服务
文章信息
- 黄金海, 陈振, 孙燕, 刘德华
- Huang Jinhai, Chen Zhen, Sun Yan, Liu Dehua
- 克雷伯氏肺炎杆菌LDH526产1,3-丙二醇的甘油自动流加策略
- Automatically feeding strategy for 1,3-propanediol fermentation of Klebsiella pneumoniae LDH526
- 生物工程学报, 2015, 31(10): 1520-1527
- Chin J Biotech, 2015, 31(10): 1520-1527
- 10.13345/j.cjb.140550
-
文章历史
- Received: November 16, 2014
- Accepted: February 26, 2015
1,3-丙二醇 (1,3-Propanediol,简称PDO) 是一种重要的平台化合物,广泛应用于聚酯、食品、医药、化妆品、溶剂等行业[1, 2]。1,3-丙二醇最重要的用途是作为单体用于合成聚对苯二甲酸丙二醇酯 (PTT),PTT是一种新型的聚酯化学纤维,在工程塑料、纺织、家具和地毯等领域应用广泛,发展前景广阔[3, 4, 5]。1,3-丙二醇的合成方法有化学合成法和微生物发酵法[6]。微生物发酵法利用可再生资源生产1,3-丙二醇具有许多优点,如反应条件温和、操作简单、原料可再生且价格低廉等,受到国内外的广泛关注[4, 5, 6, 7]。
在天然的PDO生产菌株中,克雷伯氏肺炎杆菌是最具生产潜力的菌株之一[8, 9]。本研究组自主筛选的克雷伯氏肺炎杆菌HR526[10]是目前文献报道的PDO高产菌株之一,PDO最终发酵浓度可超过90 g/L。在利用克雷伯氏肺炎杆菌发酵甘油生产1,3-丙二醇的过程中,甘油浓度的精确调控是影响PDO合成的重要因素之一[11]。甘油浓度过高会引起中间代谢产物3-羟基丙醛 (3-HPA) 的高浓度积累,3-HPA具有细胞毒性,能抑制菌体的生长和甘油的代谢,导致发酵过程的异常终止[12, 13, 14]。降低甘油浓度可以降低3-HPA的积累,但较低的甘油浓度同时会降低PDO的合成速率和最终产量。以3-HPA的浓度为指导,可以控制甘油浓度在合适的范围内,防止3-HPA的积累,保证发酵过程的安全性并提高PDO的产量[11]。由于甘油浓度不能在线检测,人工反馈流加补料工作量大,因此,建立合适的甘油自动流加策略对于PDO的工业化生产具有重要意义。在补料分批发酵过程中,常见的底物浓度控制策略有恒速流加、脉冲流加、指数流加[15, 16]等。相比于开环控制,存在反馈作用的闭环模型可以精确控制底物浓度,如pH反馈模型[17, 18]、生物量反馈模型[17]、溶氧 (DO) 反馈模型[18]、底物直接反馈模型[19]及pH和生物量二元函数模型[20]等。本文采用的菌株为克雷伯氏肺炎杆菌HR526乳酸缺陷菌株LDH526[21],由于不同菌株发酵特性不同,采用上述流加方式在LDH526的流加发酵过程中都不能很精确地控制甘油浓度,满足发酵过程的要求。针对克雷伯氏肺炎杆菌LDH526的发酵特性,本研究根据发酵动力学模型,将甘油流加速率与碱液流加速率和发酵时间相偶联,提出了甘油的自动流加策略并搭建了自动流加装置,实现了甘油流加的自启动和甘油浓度的精确控制。
1 模型建立 1.1 底物流加自启动模型的建立在补料分批发酵中,底物流加通常是在初始底物接近消耗完全时人工开启。由于甘油浓度不能快速在线检测,人工操作难以合适地把握甘油的流加时机。通过观察底物不足时的现象,本文建立了在特定甘油浓度下开启甘油流加的自启动模型。当甘油不足时,细胞生长代谢减缓,产酸速率降低,在pH恒定的发酵过程中,对应的碱液流加速率下降。通过在线检测碱泵开度值,当碱泵开度下降并且达到某个数值时开启甘油流加,实现在合适的甘油浓度范围内开启甘油流加。
1.2 底物流加速率模型的建立 根据微生物基质消耗动力学[22],基质消耗分别用于细胞生长、产物生成和维持代谢:
\[\frac{{{\text{d}}S}}{{{\text{d}}t}} = \frac{1}{{{y_{x/s}}}} \cdot \frac{{{\text{d}}X}}{{{\text{d}}t}} + {m_x} \cdot X + \frac{1}{{{y_{p/s}}}} \cdot \frac{{{\text{d}}P}}{{{\text{d}}t}}\]
(1)
其中S、t、${y_{x/s}}$、X、${m_x}$、${y_{p/s}}$和P分别为底物消耗量(g/L)、发酵时间 (h)、菌体对基质的得率系数、总生物量 (g/L)、维持常数 (/h)、产物对基质的得率系数 (g/g) 和总产物浓度 (g/L)。
根据宋志远等[20]的推导和简化,底物流加速率F1 (g/h) 与碱液流加速率F2 (g/h) 和生物量的关系为:
${F_1} = a{F_2} + bX + c\frac{{{\text{d}}X}}{{{\text{d}}t}}$
(2)
其中a、b、c为常数,通过发酵数据拟合得到。
在克雷伯氏杆菌发酵产1,3-丙二醇的发酵过程中,98%以上的甘油用于维持细胞的生命活动和生成代谢产物,细胞生长所占比例很小[20],即$c{\text{d}}X/{\text{d}}t = 0$,式 (2) 简化为:
${F_1} = a{F_2} + bX$
(3)
在菌体对数生长期,生物量X可采用指数生长模型表示:
$X = k \cdot \exp (d \cdot t)$
(4)
在稳定期,X为常数,令bX=m,得到对数生长期和稳定期的底物流加模型:
$\left\{ {\begin{array}{*{20}{l}}
{{F_1} = a{F_2} + bk \cdot \exp \left( {d \cdot t} \right)\;({\text{对数期}})} \\
{{F_1} = a{F_2} + m\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;({\text{稳定期}})}
\end{array}} \right.$
(5)
实验所用菌种为实验室自主筛选和改造的克雷伯氏肺炎杆菌乳酸缺陷株LDH526。种子培养基和发酵培养基参照文献[11],发酵培养基初始甘油浓度为20 g/L,使用前均在121 ℃下灭菌20 min。
2.1.1 种子培养在LB斜面30 ℃活化种子12 h,再接种于含100 mL种子培养液的250 mL锥形瓶中,在37 ℃、150 r/min摇床中培养12 h。
2.1.2 发酵培养发酵在5 L自控pH发酵罐中进行,装液量为4 L,接种量1% (V/V),温度37 ℃,搅拌速度250 r/min,采用质量分数为30%的NaOH溶液维持pH为6.5,通气量0.5 vvm。在人工反馈补料发酵实验中,每隔一段时间检测甘油浓度,根据甘油浓度和甘油消耗量调整甘油流加速率,控制甘油浓度 在合适的范围内。
甘油自动流加发酵实验采用甘油流加与碱液流加和发酵时间相偶联的变速流加方式。流加装置简易图见图1。发酵罐通过pH电极2在线检测pH值,碱液流加泵4自动流加碱液维持pH的恒定。计算机记录并存储碱泵开度值,通过流加模型自动控制底物流加泵5,从而实现甘油流加的自动化。

|
| 图1 甘油自动流加发酵装置 Fig.1 The device of automatically feeding fed-batch fermentation. 1: fermenter; 2: pH sensor; 3: electric control unit; 4: alkali liquor feeding pump; 5: glycerol feeding pump; 6: computer; 7: glycerol tank; 8: alkali liquor tank. |
菌体浓度以OD650表示,底物甘油及代谢产物1,3-丙二醇、2,3-丁二醇、丁二酸、乳酸、乙酸和乙醇浓度采用高效液相色谱测定,测定方法参考文献[23]。
发酵生产PDO的中间代谢产物3-羟基丙醛采用比色法测定,测定方法参考文献[24]。
3 结果与讨论在克雷伯氏肺炎杆菌LDH526产1,3-丙二醇的过程中,发酵的顺利进行及PDO的最终浓度与甘油的流加速率和3-HPA的积累密切相关。以3-HPA的浓度为指导,前期的人工补料发酵实验对发酵过程中合适的甘油浓度进行了探索,结果表明,甘油流加存在3个关键阶段:在发酵前期 (6−10 h),初始甘油接近消耗完成,3-HPA逐渐积累。菌体在该阶段对甘油浓度非常敏感,稍高的甘油浓度即导致3-HPA的高浓度积累,因此,必须在合适的时间节点以合适的速度开启甘油流加,保证甘油浓度在1−3 g/L之间;在发酵的第二阶段 (10−14 h),3-HPA积累接近峰值,甘油浓度需要控制在较低的浓度 (6 g/L以下);在发酵的第三阶段 (14−24 h),3-HPA的积累减弱,需要逐渐提高甘油浓度以促进PDO的合成。由于人工反馈控制存在延迟性,无法保证每批次发酵的顺利进行,并且存在重复性差、工作量大等问题,本文针对甘油流加时机和流加速率进行深入的研究。
3.1 甘油流加的自启动在甘油流加开启时 (6−7 h),初始甘油接近消耗完成 (甘油浓度在1 g/L左右),流加过早开启会导致甘油浓度维持在较高水平,3-HPA迅速积累。流加开启滞后,较低浓度的甘油在极短时间内即消耗完成,出现底物不足现象,直接影响菌体的发酵性能和PDO的最终产量。在人工补料反馈调节中,通过不断检测甘油浓度,推断甘油消耗速率来开启甘油流加,该方法不仅工作量大,而且由于检测的延迟性以及不同批次发酵条件的不平行性,不能实现甘油流加在合适的时机开启。
在发酵过程中发现,当底物不足时,菌体生长和代谢变缓,产酸速率变慢,碱液流加速率下降。当底物浓度为零时,菌体停止产酸,碱液流加泵停止加碱。碱液流加速率间接反映了发酵液中甘油浓度的变化。通过采集碱泵开度,得到碱泵开度平均值随时间的变化曲线 (图2)。从图中可以看出,在批式发酵中,随着产酸量的增大,碱泵的开度随之增大,在6 h (360 min) 左右达到最大值;当底物不足时,碱泵的开度迅速下降;随着甘油流加的开启,碱泵的开度又迅速上升。
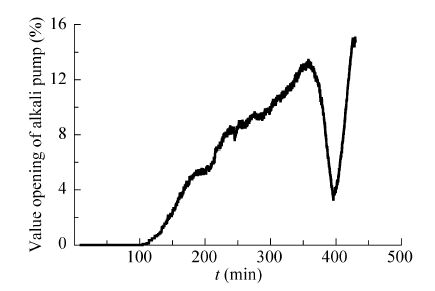
|
| 图2 碱泵开度随时间变化曲线 Fig.2 Time courses of valve opening of alkali liquor feeding pump. |
通过在流加开启时机 (6−7 h) 附近密集取样并检测甘油浓度,发现甘油浓度在1 g/L左右时,碱泵开度值下降到最大值的80%−85%。因此,研究中设定当碱泵开度下降到最大值的85%时,通过计算机控制,自动开启甘油流加。实验结果见图3。多次重复实验显示,当发酵进行到6.5−6.8 h,甘油流加自动开启,相应时刻的甘油浓度维持在0.53−1.22 g/L之间,从而保证了发酵的顺利进行。

|
| 图3 流加时机附近甘油浓度变化曲线 Fig.3 Time courses of glycerol concentration nearby the launch point. |
根据多批次人工反馈补料发酵数据,利用0−14 h的OD值,得到菌体指数增长的拟合公式为:
${\text{X}} = 2.462\exp \left( {0.132{\text{t}}} \right)$
(6)
不同时期的甘油消耗速率拟合公式为:
${F_1} = 4.869{F_2} + 6.356\exp \left( {0.132{\text{t}}} \right)({\text{对数期}})$
(7)
${F_1} = 18.95{F_2} + 4.20\left( {\text{稳定期}} \right)$
(8)
在发酵的稳定期,通过调整公式 (8) 中常数项的大小,可以实现甘油浓度以不同的速率增加。
3.3 对数生长期流加模型的验证在对数生长期,3-HPA极易积累,必须控制甘油的流加速率,使甘油维持在较低浓度 (6 g/L以下)。甘油流加自动开启后,采用公式 (7) 流加甘油。在不同批次实验中,对数生长期甘油流加自动控制结果如图4所示。由图4A可知,甘油浓度在批式发酵的终点 (第7 h左右) 达到较低水平 (1 g/L左右),通过开启甘油流加,甘油浓度逐渐上升,7−12 h维持在1−3 g/L,14 h上升至5−6 g/L。对比人工反馈调节结果,自动流加控制的甘油浓度变化更加平稳,3-HPA的浓度 (数据未列出) 维持在较低水平,保证了发酵过程的安全性。由图4B可以看出,在对数生长期PDO以较快的速率增长,实验结果超过人工反馈调节的最佳结果,说明甘油浓度在对数生长期得到合理控制。
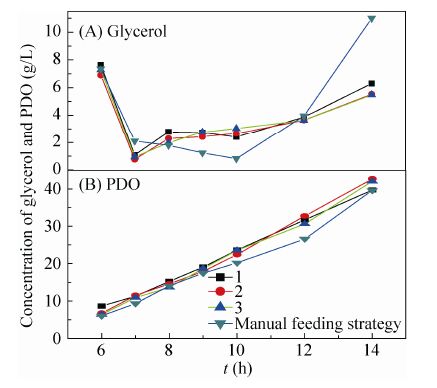
|
| 图4 6−14 h甘油浓度 (A) 和PDO浓度 (B) 随时间的变化 Fig.4 Time courses of glycerol concentration (A) and PDO concentration (B) during 6−14 h. 1−3 represent different fermentation batches. |
在发酵稳定期,3-HPA的积累下降,甘油浓度的变化不会造成菌体的死亡,但甘油浓度影响PDO的生成速率,逐渐提高甘油浓度有利于促进PDO的合成。人工补料发酵实验表明,发酵进行到14−16 h,OD650达到最大值 (OD650为12−14),此后细胞即进入稳定期。为了研究发酵稳定期甘油流加的合适速率,调整式 (8) 中常数项的大小,改变发酵液中的甘油浓度。以OD650达到最大值的时间点为对数期和稳定期的分界点,分别考察甘油以3种不同速率提高时PDO合成的变化。如图5A所示,1、2、3批次分别对应以下3种甘油流加速率:1) 甘油浓度以恒定速率1 g/(L·h) 提高,即m=8.20时;2) 不断改变m值,使甘油浓度以较快速率增长,而又不至于出现3-HPA的积累;3) 甘油浓度以恒定速率2 g/(L·h) 提高,即m=12.20。图5B中PDO浓度的变化表明稳定期时逐渐提高甘油浓度有利于PDO的生成,过低和过高的甘油浓度都不利于PDO的快速积累。当甘油浓度以恒定速率2 g/(L·h) 提高,稳定期甘油浓度维持在20−40 g/L时,PDO增长速率较快,72 h时PDO的浓度达95.25 g/L。以上实验结果表明,通过合理地选择时间节点并调整式 (8) 中的常数项,可以实现甘油浓度以合适的速率增加,保证稳定期甘油浓度在合适的范围内。
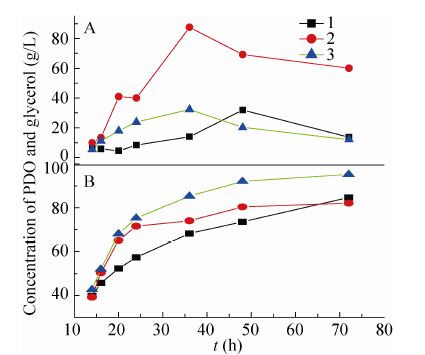
|
| 图5 甘油 (A) 及对应的PDO (B) 浓度随时间的变化 Fig.5 Time courses of glycerol concentration (A) and corresponding PDO concentration (B). 1−3 represent different feeding rate of glycerol. |
整个发酵过程中,采用自动控制装置分两阶段流加甘油,在对数生长期 (7−14 h) 使甘油浓度保持在较低水平 (6 g/L以下)。从对数生长期过渡到稳定期时,甘油浓度稳步上升 (至20 g/L左右),稳定期甘油浓度维持在20−40 g/L,最终PDO产量在95 g/L以上,甘油的摩尔转化率达到0.51−0.54,与Homann等[8]报道的值相当。整个发酵过程中,各种主要产物 (PDO、2,3-BDO、乙酸、丁二酸、乙醇) 的合成如图6所示。结果显示,副产物2,3-BDO的浓度在33 g/L左右,丁二酸浓度和乙酸的浓度分别在18 g/L和8 g/L左右,乙醇在5 g/L左右。前期发酵实验还表明,稳定期控制甘油浓度在较低水平(10−15 g/L),乙醇的生成量增加,最高可达17 g/L左右,相应的甘油摩尔转化率降低为0.47。因此,在对数生长期后期至稳定期提高甘油浓度,不仅有利于PDO的快速生成,也有利于减少副产物的积累,提高甘油转化率。而在对数生长期,必须防止3-HPA的积累,故控制甘油浓度在较低水平。由于该时间段非常短 (7 h左右),因此对整个过程副产物的分布影响很小。在对数生长期,以3-HPA和PDO的浓度来指导甘油浓度的控制,在稳定期,以副产物和PDO生成速率来确定甘油的浓度范围,既可以保证发酵过程的顺利进行,又可以进一步降低副产物的产量,提高甘油的转化率。

|
| 图6 自动控制甘油流加发酵过程中PDO、2,3-BDO、乙酸、丁二酸和乙醇浓度随时间的变化 Fig.6 Time courses of PDO,2,3-BDO,acetate,succinate and ethanol concentration during fed-batch fermentation under automatic feeding strategy. |
本文基于对克雷伯氏肺炎杆菌LDH526发酵特性的研究,提出了批式发酵过程中的甘油自动流加策略。根据碱液流加速率的变化,设定碱泵开度下降到最大值的80%−85%时,开启甘油流加,实现了甘油流加的自启动。由于菌体在对数生长期和稳定期对甘油浓度要求不同,采用两段流加模型自动控制甘油浓度在合适的范围内,实现了整个发酵过程中甘油流加的全自动,最终PDO的产量在95 g/L以上。与国内报道的甘油流加策略[19, 20]相比,本文基于克雷伯氏肺炎杆菌LDH526的发酵特性,甘油流加分两段控制:对数生长期要求较低的甘油浓度,允许波动范围小 (1−3 g/L),而其他文献报道的甘油浓度控制在较大范围 (10−20 g/L);发酵稳定期通过提高甘油的流加速率,PDO的终产量超过95 g/L,这一产量远高于其他文献报道值,该实验结果将有望从实验室规模扩大到生产规模。
| [1] | Huang H, Gong CS, Tsao GT. Production of 1,3-propanediol by Klebsiella pneumoniae. Appl Biochem Biotechnol, 2002, 98?100: 687-698. |
| [2] | Saxena RK, Anand P, Saran S, et al. Microbial production of 1,3-propanediol: recent developments and emerging opportunities. Biotechnol Adv, 2009, 27(6): 895-913. |
| [3] | Zeng AP, Bieb H. Bulk chemicals from biotechnology: the case of 1,3-propanediol production and the new trends. Adv Biochem Eng Biotechnol, 2002, 74: 239-259. |
| [4] |
Feng JW, Zhang HL, Jiang LS, et al. The study on the synthesis of 1,3-propanediol. Sci Technol Chem, 2002, 10(6): 43-47 (in Chinese). 冯婧微, 张洪林, 蒋林时, 等. 1,3-丙二醇合成方法研究. 化工科技, 2002, 10(6): 43-47. |
| [5] |
Feng KK, Lü ZG, Li Q. Research progress in synthesis technology of 1,3-propanediol. Chin Synth Fiber Ind, 2007, 30(4): 46-49 (in Chinese). 冯看卡, 吕志果, 李强. 1,3-丙二醇制备工艺技术研究进展. 合成纤维工业, 2007, 30(4): 46-49. |
| [6] | Summerfield FW, Tappel AL. Cross-linking of DNA in liver and testes of rats fed 1,3-propanediol. ChemBiol Inter, 1984, 50(1): 87-96. |
| [7] | Kurian JV. A new polymer platform for the future-Sorona? from corn derived 1,3-propanediol. J Polym Environ, 2005, 13(2): 159-167. |
| [8] | Homann T, Tag C, Biebl H, et al. Fermentation of glycerol to 1,3-propanediol by Klebsiella and Citrobacter strains. Appl Microbiol Biotechnol, 1990, 33 (2): 121-126. |
| [9] | Celińska E. Klebsiella spp. as a 1,3-propanediol producer-the metabolic engineering approach. Cri Rev Biotechnol, 2012, 32(3): 274-288. |
| [10] |
Chen Z, Zheng ZM, Sun Y, et al. Fermentation characteristics of the fast conversion of glycerol to 1,3-propanediol by Klebsiella pneumoniae HR526. Microbiol China, 2009, 36(6): 799-803 (in Chinese). 陈珍, 郑宗明, 孙燕, 等. 克雷伯氏肺炎杆菌HR526快速合成1,3-丙二醇发酵特性研究. 微生物学通报, 2009, 36(6): 799-803. |
| [11] | Hao J, Lin RH, Zheng ZM, et al. 3-Hydroxypropionaldehyde guided glycerol feeding strategy in aerobic 1,3-propanediol production by Klebsiella pneumoniae. J Ind Microbiol Biotechnol, 2008, 35(12): 1615-1624. |
| [12] | Barbirato F, Grivet JP, Soucaille P, et al. 3-Hydroxypropionaldehyde, an inhibitory metabolite of glycerol fermentation to 1,3-propanediol by Enterobacterial species. Appl Environ Microbiol, 1996, 62(4): 1448-1451. |
| [13] | Chen Z, Liu HJ, Liu DH. Regulation of 3-hydroxypropionaldehyde accumulation in Klebsiella pneumoniae by overexpression of dhaT and dhaD genes. Enzyme Microb Technol, 2009, 45(4): 305-309. |
| [14] | Chen Z, Liu HJ, Liu DH. Metabolic pathway analysis of 1,3-propanediol production with a genetically modified Klebsiella pneumoniae by overexpressing an endogenous NADPH-dependent alcohol dehydrogenase. Biochem Eng J, 2011, 54(3): 151-157. |
| [15] |
Cheng KK, Sun Y, Liu WB, et al. Effect of feeding strategy on 1,3-propandediol fermentation with Klebsiella pneumoniae. Food Ferm Ind, 2004, 30(4): 1-5 (in Chinese). 程可可, 孙燕, 刘卫斌, 等. 底物流加策略对发酵法生产1,3-丙二醇的影响. 食品与发酵工业, 2004, 30(4): 1-5. |
| [16] | Aulicino J, Hermida M, Medina R, et al. Developing an automatically controlled feeding process in an E. coli fermentation process for recombinant protein production. Biopharm Int, 2010, 6: 2-7. |
| [17] | Lee SY. High cell-density culture of Escherichia coli. Trends Biotechnol, 1996, 14(3): 98-105. |
| [18] | Duan SB, Shi ZP, Feng HJ, et al. An on-line adaptive control based on DO/pH measurements and ANN pattern recognition model for fed-batch cultivation. Biochem Eng J, 2006, 30(1): 88-96. |
| [19] |
Tan TW, Wu JX, Li Z, et al. An intermediate metabolite feedback strategy to control the substrate concentration in the production of 1,3-propanediol: CN, 101153292B. 2008-04-02 (in Chinese). 谭天伟, 吴家鑫, 李政, 等. 一种中间代谢物反馈控制底物浓度生产1,3-丙二醇的方法: 中国, 101153292B. 2008-04-02. |
| [20] |
Song ZY, Teng H, Xiu ZL. Coupled-feeding strategy based on the cell growth and metabolism during 1,3-propanediol fermentation. Chin J Process Eng, 2012, 12(6): 996-1001 (in Chinese). 宋志远, 滕虎, 修志龙. 基于生长代谢耦联的1,3-丙二醇发酵过程底物流加控制策略. 过程工程学报, 2012, 12(6): 996-1001. |
| [21] | Xu YZ, Guo NN, Zheng ZM, et al. Metabolism in 1,3-propanediol fed-batch fermentation by a D-lactate deficient mutant of Klebsiella pneumoniae. Biotechnol Bioeng, 2009, 104(5): 965-972. |
| [22] |
Yu JT, Gu QF, Ye Q. Biochemical Engineering. Beijing: Chemical Industry Press, 1991: 58-65 (in Chinese). 俞俊棠, 顾其丰, 叶勤. 生物化学工程. 北京: 化学工业出版社, 1991: 58-65. |
| [23] |
He L, Zhao XB, Sun Y, et al. Optimization of continuous fermentative production of 1,3-propanediol by Klebsiella pneumoniae. Food Ferm Ind, 2012, 38(8): 23-28 (in Chinese). 贺璐, 赵雪冰, 孙燕, 等. Klebsiella pneumoniae连续发酵生产1,3-丙二醇的工艺优化. 食品与发酵工业, 2012, 38(8): 23-28. |
| [24] | Circle SJ, Stone L, Boruff CS. Acrolein determination by means of tryptophane: a colorimetric micro method. Ind Eng Chem Anal Ed, 1945, 17(4): 259-262. |
 2015, Vol. 31
2015, Vol. 31




