服务
文章信息
- 牛坤, 胡逸博, 毛健, 邹树平, 郑裕国
- Niu Kun, Hu Yibo, Mao Jian, Zou Shuping, Zheng Yuguo
- 微粒添加对棘白菌素B 发酵过程的影响
- Effect of microparticles on echinocandin B production by Aspergillus nidulans
- 生物工程学报, 2015, 31(7): 1082-1088
- Chin J Biotech, 2015, 31(7): 1082-1088
- 10.13345/j.cjb.140578
-
文章历史
- Received: Novemeber 24, 2014
- Accepted: January 4, 2015
棘白菌素类抗生素是20世纪70年代发现的一组天然产物,具有类似的环状多肽核心和不同的脂肪酸侧链,能够非竞争性地抑制真菌细胞壁β-1,3-葡聚糖合成酶的活性,从而达到抗真菌的目的[1, 2, 3]。FDA已批准上市的这类药物包括卡泊芬净 (Caspofungin)、米卡芬净 (Micafungin) 和阿尼芬净 (Anidulafungin),其中前两者已在国内上市,阿尼芬净已在国内临床中[4, 5, 6]。
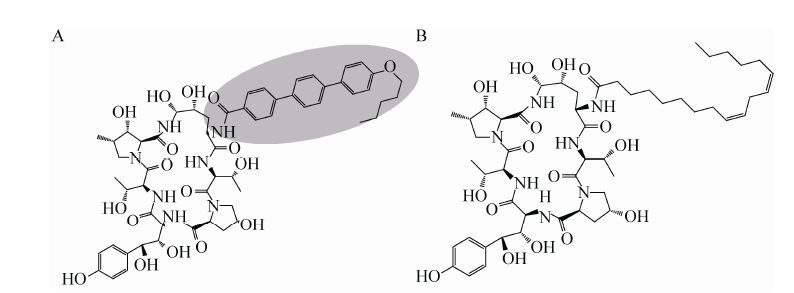
阿尼芬净是由前体化合物棘白菌素B (Echinocandin B,ECB) 经犹他游动放线菌产生的酰化酶作用脱去侧链亚油酰基,然后在DMF中与活性中间体4"-戊氧基-[1,1',4',1"]三苯基-4-甲酸-2,4,5-三氯-苯基酯反应制得,其化学结构如图1A所示[7]。目前,ECB的化学结构已经确定,它的六肽支架是由6个氨基酸组成,包括:4R,5R-二羟基-L-鸟氨酸、L-苏氨酸、4R-羟基-L-脯氨酸、3S,4S-二羟基-L-高酪氨酸、L-苏氨酸和3S-羟基-4S-甲基-L-脯氨酸 (图1B) [8]。
ECB是合成阿尼芬净的关键前体化合物,其发酵单位的高低将直接影响阿尼芬净的市场前景。根据文献和专利报道,目前国内外ECB均是利用微生物发酵法进行制备,其中主要是以构巢曲霉Aspergillus nidulans进行发酵[9, 10, 11, 12]。但是在该类微生物发酵过程中会碰到一些难以克服的技术问题,如发酵液粘度高、供氧不足以及传质受阻等,这些问题都会导致菌种代谢合成产物的能力下降,因此ECB的发酵仍然处于实验室研究阶段。要解决上述问题,常用的方法有菌种诱变、培养基优化、气升式发酵罐培养、细胞固定化以及工艺操作条件调控 等[13, 14, 15]。近年来,研究学者提出了通过添加无机微粒来改变丝状微生物菌体形态的新技术,发现无机微粒的应用可以显著影响丝状微生物
生长过程中的菌体形态,并进一步影响产物产量及酶的活性,目前应用比较广泛的无机微粒包括硅酸盐、钛酸盐、滑石粉、Al2O3等[16, 17, 18, 19, 20]。
本文以构巢曲霉发酵合成ECB,希望通过添加不同种类及不同浓度的微粒来改善菌体生长形态,调控培养过程中的传质过程,最终提高ECB的发酵产量。
1 材料与方法 1.1 菌种构巢曲霉Aspergillus nidulans ZJB09223,由本实验室保藏。
1.2 培养基斜面培养基:PDA培养基。
种子培养基 (g/L):葡萄糖10,甘油10,棉籽粉25,pH 6.8−7.0,121 ℃灭菌20 min。
初始发酵培养基 (g/L):花生油20,甘油10,蛋白胨10,L-脯氨酸1,甘露醇90,豆粕粉40,K2HPO4·3H2O 8,MgSO4·7H2O 0.5,MnSO4·H2O 0.1,FeSO4·7H2O 0.05,CaCl2 0.3,pH 7.0,121 ℃灭菌20 min。
1.3 主要仪器与设备恒温调速摇床 (上海杜科自动化设备有限公司 DKY-1);高效液相色谱 (日本SHIMADZU);高压蒸汽灭菌锅 (日本SANYO,MLS-3780);电子分析天平 (上海精密仪器仪表有限公司FA2004);高速冷冻离心机 (美国Bechman Coulter,X-22);光学显微镜 (美国leica,DM3000)。
1.4 培养方法 1.4.1 斜面培养将传好种的斜面置于25 ℃培养箱中培养8−16 d,菌落表面呈现墨绿色后取出置于15−20 ℃继续培养,一般5−20 d都可接种用于种子培养。
1.4.2 种子液培养接种后的种子培养基在220 r/min、25 ℃条件下培养2 d。
1.4.3 发酵培养按照10%接种量进行接种,然后将接种后发酵培养基在220 r/min、25 ℃条件下培养12 d,第6天起定时取样测定ECB产量。每个条件做3个平行样,最终结果取平均值。
1.5 分析方法生物量 (g/L) 的测定:采用称重法,取1 mL发酵液12 000 r/min离心10 min,弃上清,放入90 ℃烘箱烘干至恒重,计算得到生物量。
待测样品预处理:取1 mL发酵液 12 000 r/mim离心8 min,弃上清;所得菌体加入1 mL甲醇,25 ℃振荡萃取30 min,12 000 r/min离心8 min,留上清液备用;残留菌体中再加入1 mL甲醇进行二次萃取,25 ℃振荡摇匀30 min,12 000 r/min离心8 min,所得上清液与前一步上清液合并,12 000 r/min离心2 min,上清液用0.45 μm水膜过滤,进行检测。
产物的测定:产物ECB采用高效液相色谱(HPLC) 进行检测,色谱柱为ODS-C18柱 (大连伊力特4.6 mm×250 mm,5 μm),流动相为乙腈:甲醇:水 = 2:7:1,流速为1.0 mL/min,紫外检测波长为222 nm,进样量20 μL,柱温40 ℃。
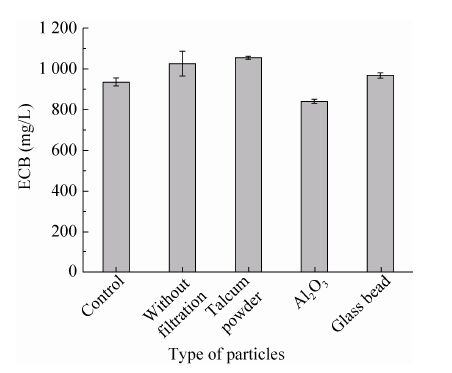
2 结果与分析 2.1 微粒种类对ECB发酵过程的影响本实验选用了文献报道较多的滑石粉、Al2O3以及玻璃珠作为无机微粒,考察了其对ECB发酵过程的影响。在发酵过程中,由于培养基中含有可作为微粒的豆粕粉 (d50 = 8.8 μm),为了消除其对结果的影响,本实验首先比较了采用蒸煮过滤后的豆粕粉滤液作为有机氮源与未过滤的豆粕粉培养基进行发酵的结果 (图2),发现采用蒸煮过后的豆粕粉滤液作为氮源发酵时,其产量由原来的1 025.6 mg/L降为935.9 mg/L,下降了近10%,而下降的原因可能是由于氮源的损失造成的,也可能是由于作为微粒的豆粕粉颗粒被过滤除去造成的。
|
| 图2 微粒种类对棘白菌素B发酵产量的影响 Fig.2 Effect of microparticles types on the production of ECB |
在后续实验中,以蒸煮过滤后的豆粕粉培养基作为对照,考察了在其中加入不同微粒后对发酵过程的影响。发现对照组菌体在发酵过程中会自我缠绕,呈较大直径的球状生长,而添加滑石粉及玻璃珠后均可以改善发酵过程中微生物的菌丝形态,使ECB的发酵单位有所提高。当添加20 g/L 600目 (d50 = 5.7 μm) 滑石粉时,ECB产量由935.9 mg/L提高到1 054.4 mg/L;当加入3颗直径为4 mm玻璃珠后,ECB产量提高到967.6 mg/L。而加入Al2O3后对ECB的产量反而有所抑制,推测可能是由于Al2O3粒径过小 (d50 = 4.7 μm) 引起的。
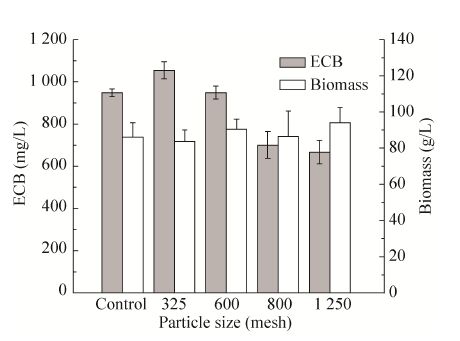
2.2 滑石粉粒径及浓度对ECB发酵单位的影响在上述实验的基础上,进一步考察了滑石粉的粒径及其添加浓度对ECB发酵单位的影响。图3为添加10 g/L不同粒径滑石粉的结果,表明当滑石粉粒径小于600目 (d50 > 5.7 μm) 时,添加微粒可以提高ECB产量,而当其粒径大于800目 (d50 < 4.6 μm) 时,ECB产量反而会下降,并且微粒的添加对菌体浓度影响较小。而当添加粒径大于800目的滑石粉时,虽然菌体浓度基本未受影响,但由于添加的粒径较小,使得发酵过程中菌丝体包裹微粒后会在发酵液中形成致密的菌丝小球并充满整个摇瓶,导致发酵液黏度增大,营养物质和氧气的传递效果下降,从而使产物ECB发酵产量降低,这与上述实验中添加Al2O3的结果是一致的。
|
| 图3 滑石粉粒径对ECB发酵产量的影响 Fig.3 Effect of particle size of talcum powder on the production of ECB |
表1为不同浓度的滑石粉 (325目,d50 = 14.2 μm) 对ECB发酵过程的影响,发现ECB的产量随滑石粉添加浓度的增加呈现先升高后降低的趋势,添加20 g/L滑石粉可以使ECB的产量提高33.2%至1 262.9 mg/L;而添加30 g/L 600目滑石粉 (d50 = 5.7 μm) 时可以使ECB产量达到最高值1 144.7 mg/L (结果未列出)。由结果可知,在添加粒径较小的微粒时,其添加浓度应适度增加,才能达到最佳的优化效果,而这与文献中的报道是相反的,推测可能是由于发酵菌种的不同引起的[20]。
| Concentration of talcum powder (g/L) | ECB production (mg/L) | Biomass (g/L) |
| Control | 948.5±18.3 | 86.3±7.8 |
| 10 | 1 054.9±39.9 | 83.8±6.3 |
| 20 | 1 262.9±74.1 | 85.1±4.3 |
| 30 | 1 229.2±23.5 | 91.6±4.2 |
| 40 | 1 202.5±36.8 | 89.3±0.9 |
同时在培养过程中发现,当添加滑石粉时可以显著改善发酵过程中菌丝体的状态,使菌体形成以微粒为核心的菌丝团,且培养基中菌丝球的直径与对照相比明显减小 (图4),从而提高了发酵液的传质效果和溶氧量,使ECB产量明显增加。而当添加的滑石粉浓度过高时,发酵液内微粒与菌丝球之间相互碰撞、摩擦的几率大大提高,因此可能会切断菌丝体,使菌体以分散状菌丝的形态生长,增加了发酵液粘度,最终导致ECB发酵产量降低 (图4,40 g/L)。
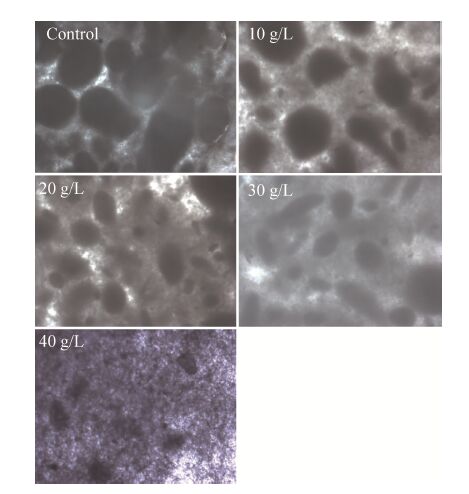
|
| 图4 滑石粉浓度对微生物菌丝体形态的影响 Fig.4 Effect of talcum powder on the morphology of Aspergillus nidulans |
表2为添加不同数量的玻璃珠对ECB发酵产量的影响,由结果可以看出添加玻璃珠也可以促使ECB发酵单位提高。当玻璃珠直径为 4 mm、添加个数为5颗和7颗时,发酵液中ECB含量分别为1 117.4 mg/L和1 160.9 mg/L,分别比对照组分别提高了17.7%和22.4%。当玻璃珠直径为6 mm、添加个数为5颗和7颗时,ECB产量会大幅提高,最高产量达到1 344.1 mg/L,比对照提高了41.7%。
| Numbers of glass beads | ECB production (mg/L) | |
| Diameter of 4 mm | Diameter of 6 mm | |
| Control | 948.5±18.3 | 948.5±18.3 |
| 5 | 1 117.4±23.5 | 1 037.6±24.8 |
| 7 | 1 160.9±42.5 | 1 344.1±29.9 |
| 9 | 882±6.3 | 1 249.1±24.9 |
观察发酵液状态可以看出,当培养基中添加适当浓度的玻璃珠时,玻璃珠产生的剪切力会切断菌丝,使菌丝球直径减小 (图5B、图5C),氧气分子和营养物质传递效果增强,ECB发酵产量提高,而当过量添加玻璃珠时 (9颗),玻璃珠与菌丝体之间的碰撞和摩擦作用占主导地位,过高的剪切力会使培养基发生剪切稀化现象,从而导致了菌丝体的断裂,培养基粘度降低,ECB产量下降 (图5D)。
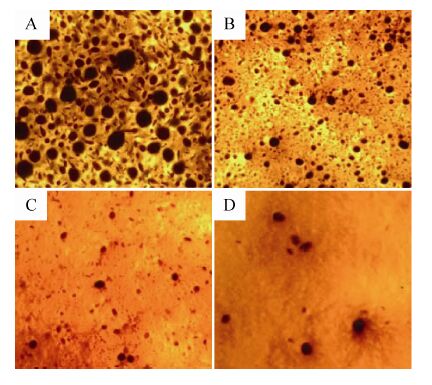
|
| 图5 玻璃珠 (d = 4 mm) 数量对微生物菌丝体形态的影响 Fig.5 Effect of glass bead (d = 4 mm) numbers on the morphology of Aspergillus nidulans. (A) Control. (B) 5. (C) 7. (D) 9 |
目前,ECB主要通过曲霉菌属发酵法制备,但由于丝状微生物发酵过程中会以菌丝球或分散状菌丝的形态生长,从而导致发酵液粘度增加,溶氧量急剧下降,发酵水平降低。而通过添加无机微粒来改善菌体生长形态,调控培养过程中的传质过程是近几年来发展的新技术,该技术的应用可以优化丝状微生物的发酵过程,进而提高关键酶活性及发酵产物的产量。
本文初步考察了滑石粉、Al2O3以及玻璃珠对构巢曲霉发酵过程中ECB产量的影响,研究表明在摇瓶发酵生产ECB的培养基中,微粒的添加可以改善发酵过程中菌丝的生长形态,提高氧气和营养物质的传递效率,增加ECB的发酵产量。微粒的浓度和粒径是影响该过程的主要因素,随着微粒浓度的提高,其对菌丝体产生的剪切力也不断提高,使菌丝球直径减小,氧气和营养物质的传递效果得以改善;而当剪切力过高时,会使菌丝体大量断裂,微生物的生长形态由菌丝球状变为分散状菌丝,同时ECB产量降低。研究表明微粒的粒径对ECB的发酵产量也有较大影响,添加适当粒径的微粒可以使菌体包裹微粒形成粒径较小的菌丝球,提高传质效果;而粒径过小则无法产生此作用。因此,在实际发酵过程中应根据不同的发酵菌株选择不同的微粒浓度及粒径,以提高发酵效果。该技术的应用为丝状微生物发酵过程的优化提供了一定的思路与借鉴,为解决丝状微生物发酵过程遇到的高粘度、低溶氧等问题提供了重要的方法,然而现今主要研究工作多集中于国外,国内对此研究尚无报道,后续还需要在新型微粒发掘、影响机制考察等方面开展进一步的研究工作。
| [1] | Vazquez JA. Anidulafungin: A new echinocandin with a novel profile. Clin Ther, 2005, 27(6): 657-673. |
| [2] | Ghannoum M, D'Angelo M. Anidulafungin: a potent antifungal that targets Candida and Aspergillus. Infect Dis Clin Practice, 2005, 13(4): 165-178. |
| [3] | Denning DW. Echinocandins: a new class of antifungal. J Antimicrob Chemother, 2002, 49(6): 889-891. |
| [4] | Chen SCA, Slavin MA, Sorrell TC. Echinocandin antifungal drugs in fungal infections a comparison. Drugs, 2011, 71(1): 11-41. |
| [5] | Perlin DS. Current perspectives on echinocandin class drugs. Future Microbiol, 2011, 6(4): 441-457. |
| [6] | Chandrasekar PH, Sobel JD. Micafungin: a new echinocandin. Clin Infect Dis, 2006, 42(8): 1171-1178. |
| [7] | Nyfeler R, Keller SW. Metabolites of microorganisms. 143: echinocandin B, a novel polypeptide antibiotic from Aspergillus nidulans var. echinulatus: isolation and structural components. Helv Chim Acta, 1974, 57(8): 2459-2477. |
| [8] | Emri T, Majoros L, Tóth V, et al. Echinocandins: production and applications. Appl Microbiol Biotechnol, 2013, 97(8): 3267-3284. |
| [9] | Cockshott A, Sullivan GR. Improving the fermentation medium for Echinocandin B production. Part I: sequential statistical experimental design. Process Biochem, 2001, 36(7): 647-660. |
| [10] | Cockshott A, Hartman B. Improving the fermentation medium for Echinocandin B production part II: particle swarm optimization. Process Biochem, 2001, 36(7): 661-669. |
| [11] | Toth V, Nagy CT, Pocsi I, et al. The echinocandin B producer fungus Aspergillus nidulans var. roseus ATCC 58397 does not possess innate resistance against its lipopeptide antimycotic. Appl Microbiol Biotechnol, 2012, 95(1): 113-122. |
| [12] | Toth V, Nagy CT, Miskei M, et al. Polyphasic characterization of "Aspergillus nidulans var. roseus" ATCC 58397. Folia Microbiol, 2011, 56(5): 381-388. |
| [13] | Gibbs PA, Seviour RJ, Schmid F. Growth of filamentous fungi in submerged culture: problems and possible solutions. Crit Rev Biotechnol, 2000, 20(1): 17-48. |
| [14] | Xia JY, Wang YH, Zhang SL, et al. Fluid dynamics investigation of variant impeller combinations by simulation and fermentation experiment. Biochem Eng J, 2009, 43(3): 252-260. |
| [15] | Rainer K, Thomas W, Manely EE, et al. Characterization and control of fungal morphology for improved production performance in biotechnology. J Biotechnol, 2013, 163(2): 112-123. |
| [16] | Kaup BA, Ehrich K, Pescheck M, et al. Microparticle-enhanced cultivation of filamentous microorganisms: increased chloroperoxidase formation by Caldariomyces fumago as an example. Biotechnol Bioeng, 2008, 99(3): 491-498. |
| [17] | Driouch H, Hansch R, Thomas W, et al. Improved enzyme production by bio-pellets of Aspergillus niger: targeted morphology engineering using titanate microparticles. Biotechnol Bioeng, 2012, 109(2): 462-471. |
| [18] | Driouch H, Roth A, Dersch P, et al. Filamentous fungi in good shape: microparticles for tailor-made fungal morphology and enhanced enzyme production. Bioeng Bugs, 2011, 2(2): 100-104. |
| [19] | Walisko R, Krull R, Schrader J, et al. Microparticle based morphology engineering of filamentous microorganisms for industrial bio-production. Biotech Lett, 2012, 34(11): 1975-1982. |
| [20] | Driouch H, Sommer B, Wittmann C. Morphology engineering of Aspergillus niger for improved enzyme production. Biotechnol Bioeng, 2009, 105(6): 1058-1068. |
 2015, Vol. 31
2015, Vol. 31