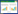服务
文章信息
- 陆海荣, 张宜涛, 黄青山
- Hairong Lu, Yitao Zhang, Qingshan Huang
- 重组溶葡萄球菌酶的PEG 定点修饰
- Site-specific PEGylation of recombinant lysostaphin
- 生物工程学报, 2016, 32(1): 127-134
- Chin J Biotech, 2016, 32(1): 127-134
- 10.13345/j.cjb.150106
-
文章历史
- Received: March 11, 2015
- Accepted: May 21, 2015
2. 复旦大学生命科学院 遗传学研究所 遗传工程国家重点实验室,上海 200433
2. State Key Laboratory of Genetic Engineering, Institute of Genetics, School of Life Sciences, Fudan University, Shanghai 200433, China
金黄色葡萄球菌是临床主要病原菌,它能引起肺炎、骨髓炎、心内膜炎及败血症等多种感染性疾病[1, 2]。随着抗生素的广泛使用,金葡菌耐药性问题日益突出,尤其是耐甲氧西林金葡菌 (MRSA)[3, 4]。MRSA已经造成临床治疗上的困难及病死率增高,严重威胁人类健康[5, 6]。
溶葡萄球菌酶 (Lysostaphin,Lysn) 是1964年Schindler和Schuhar[7]首次从模仿葡萄球菌培养上清中发现并分离的一种细菌素。它是一种含锌的金属蛋白酶,由特异性靶向细菌细胞壁的结合结构域和高效水解葡萄球菌细胞壁肽聚糖中甘氨酸肽键的催化结构域组成 (图1)。Lysn通过溶解细菌细胞壁,从而达到杀菌目的,其对葡萄球菌 (包括MRSA) 具有很强的杀菌作用 (MICs在0.003-0.125 μg/mL之间)[8],并且不容易诱导产生耐药菌株。但由于Lysn的体内半衰期非常短 (<1 h)[9],它的临床应用还停留在局部外用阶段,主要用于治疗创面金葡菌感染和清除鼻部定殖的金葡菌[10, 11, 12, 13]。
|
| 图1 溶葡萄球菌酶中8个Cys突变位点 Fig.1 Eight selected sites in lysostaphin for cysteine substitutions. |
如何改善Lysn的体内稳定性,是扩大其临床应用所面临的关键问题。近年来,国内外开展了Lysn的PEG修饰方面的工作。Walsh等[14]报道通过偶联PEG到Lysn的赖氨酸,PEG化Lysn的体内半衰期从原来的不到1 h提高至24 h以上;同时,ELISA检测显示,PEG化Lysn抗体的产生水平比PEG化前降低了10倍以上,说明Lysn经PEG化后,不但延长了其体内半衰期,而且显著降低了抗体产生。然而由于是非定点修饰 (Lysn有16个赖氨酸可被修饰),修饰后产物的异构体多,其中大部分位点的修饰会降低Lysn与细菌细胞壁 (大的网状结构) 的亲和力,导致生物活性急剧下降。最近,王永等[15]同样也进行了Lysn的PEG非定点修饰工作,获得的PEG-Lysn的生物活性只有原来的25%。吴宏等[16]在Lysn两个结构域之间的连接区引入半胱氨酸,再进行PEG定点修饰 (偶联PEG至半胱氨酸的巯基),虽然产物单一,但抗菌活性只有修饰前的20%左右。
之前PEG修饰Lysn研究的一个重要限制因素是该酶的空间结构尚不明确,因此只有充分了解Lysn的作用机制以及两个结构域之间的相互关系,才能更好地进行该酶的PEG修饰。最近我们[17]和Sabala等[18]对Lysn高级结构的研究,阐明了该酶高效裂解细菌细胞壁的作用依赖于两个结构域之间一定范围内的相对运动。为获得高抗菌活性PEG定点修饰的Lysn,本文根据Lysn高级结构,优选8个位点,将其分别突变成半胱氨酸,再进行PEG定点修饰,并进一步用比浊法和最小抑菌浓度 (MIC) 法评价了PEG化Lysn的体外抗菌活性。
1 材料与方法 1.1 材料表达载体pET28a(+)、大肠杆菌表达菌株BL21(DE3) 购自Novagen公司;金黄色葡萄球菌Staphylococcus aureus ATCC 6538购自中国生物制品检定所;限制性内切酶、T4 DNA连接酶购自NEB公司;DNA marker、低分子量标准蛋白质购自TaKaRa公司;质粒抽提试剂盒、胶回收试剂盒、BCA蛋白浓度测定试剂盒购自天根生化科技有限公司;定点突变引物由上海生工生物工程有限服务公司合成;QuikChange lightningsite-directed mutagenesis kit购自Stratagene公司;mPEG-MAL (单甲氧基聚乙二醇马来酰亚胺) 购自北京键凯科技有限公司;
1.2 Lysn 的表达和纯化为在大肠杆菌中表达Lysn,在编码成熟Lysn基因的5ʹ端引入NcoⅠ位点和编码OmpA信号肽的基因序列;在其3ʹ端引入Hind Ⅲ位点。OmpA-Lysn基因片段经NcoⅠ和Hind Ⅲ双酶切,割胶回收OmpA-Lysn基因片段,克隆到pET28a(+) 载体的NcoⅠ和Hind Ⅲ位点之间,构建重组表达质粒pET28a-OmpA-Lysn,阳性克隆送上海英骏生物公司测序。将测序正确的表达质粒转化BL21 (DE3) 感受态细胞,获得表达Lysn的工程菌。
挑单克隆接种于LB培养液 (含30 mg/L卡那霉素),37 ℃振荡培养过夜,按1%接种到相同的LB培养液中,37 ℃振荡培养至光密度值 (波长600 nm) 约为0.6时,加入终浓度为0.05 mmol/L的IPTG诱导蛋白表达,继续37 ℃振荡培养,诱导4 h左右,离心收集发酵上清,保存于4 ℃。
将离心后发酵上清进样至预先用50 mmol/L Tris-HCl缓冲液 (pH 9.0)平衡的Capto MMC阳离子交换层析柱 (26 mm×60 mm),用含1.0 mol/L NaCl的Tris-HCl缓冲液洗脱,收集目的峰。收集峰经超滤浓缩后,进样至Sephadex G50凝胶过滤层析柱进行精纯,用含150 mmol/L NaCl的PBS缓冲液 (pH 7.0) 进行洗脱,收集目的峰。纯化后的样品经超滤浓缩后置于-20 ℃冷冻保存备用。
用12% SDS-PAGE测定重组蛋白样品的大小和纯度。以牛血清白蛋白为标准蛋白,用BCA (Bicinchoninic acid,二喹啉甲酸) 法测定蛋白浓度。
1.3 Lysn 半胱氨酸(Cysteine,Cys) 突变体的表达和纯化Lysn不含Cys,通过定点突变技术在拟PEG修饰的位置引入一个Cys,利用Cys的巯基和mPEG-MAL的特异性反应实现定点修饰。为减少PEG修饰对Lysn生物活性的影响,我们根据Lysn的高级结构优选8个位点进行Cys突变,如图1所示。拟突变的位点需要满足3个条件:必须在分子表面;不在结构域的活性中心一侧;不在两个结构域的相互作用界面上。
为表达Lysn突变体,设计合成系列引物,以pET28a-OmpA-Lysn为模板,按照QuikChange® lightning site-directed mutagenesis试剂盒的标准操作进行扩增,产物用DpnⅠ消化模板,然后转化DH5α。挑克隆测序分析,将测序正确的表达质粒转化BL21 (DE3) 感受态细胞,获得表达Lysn突变体的工程菌。蛋白的诱导表达和纯化方法同上。
1.4 比浊法测定重组蛋白抗菌活性采用比浊法[19],在特定条件下细菌悬液浊度下降值代表Lysn的酶活。将过夜培养的金葡菌 (ATCC 6538) 转接后生长到对数中期 (OD600 大约0.5),离心 (5 000 ×g,5 min) 收集菌体。菌体用PBS (pH 7.2) 清洗2次,然后重悬于含150 mmol/L NaCl的PBS缓冲液中 (OD600约为1.0)。在比色皿中加入20 μL样品 (0.5 mg/mL)和2 mL的菌悬液,室温 (25 ℃) 下在分光光度计600 nm波长下读数 (间隔1 min,共15 min)。
将纯化获得的Lysn突变体用20 mmol/L的DTT处理 (室温15 min),DTT处理的样品经SP-650M阳离子柱纯化去除DTT。将洗脱峰与分子量20 kDa的mPEG-MAL修饰剂按1∶5摩尔比混合,再加入10%的DMSO,于4 ℃反应2-3 h,RP-HPLC分析PEG修饰率。反应混合物与纯水1∶5稀释后,进样至预先用50 mmol/L NaAc缓冲液 (pH 4.5) 平衡的MacroCap SP阳离子交换层析柱 (16 mm×30 mm),用含1.0 mol/L NaCl 的Tris-HCl缓冲液 (pH 9.0) 梯度洗脱,收集目的峰。纯化后的样品置于-20 ℃冷冻保存备用。用12% SDS-PAGE测定PEG修饰样品的大小和纯度。以牛血清白蛋白为标准蛋白,用BCA法测定PEG修饰样品的蛋白浓度。
1.6 最小抑菌浓度 (MIC) 检测采用二倍稀释法测定MIC。将金黄色葡萄球菌ATCC6538复苏,细菌在营养琼脂平板上培养过夜,经过MH液体培养基逐级稀释至细菌浓度为104-105 CFU/mL,备用。待检样品用MH培养基二倍稀释成各种所需浓度,分别加100 μL到96孔板中,再加入100 μL含受试菌液的MH培养基到96孔板中与待检样品混匀,置35 ℃培养18-24 h后观察结果。肉眼未见细菌生长的样品孔中所含药物最小的浓度即为MIC值。
2 结果根据Lysn的高级结构,优选8个位点进行Cys突变。通过QuikChange® lightning site-directed mutagenesis点突变试剂盒构建8个Lysn突变体的表达载体,DNA测序结果显示突变体的DNA序列均正确。
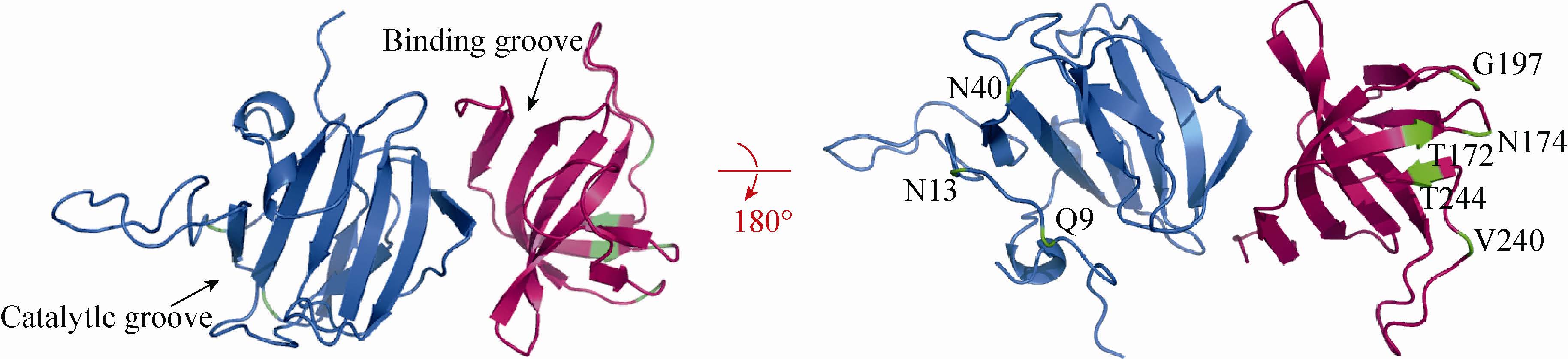
将表达Lysn和Lysn突变体的重组质粒转化BL21 (DE3) 感受态,经IPTG诱导表达。Lysn在信号肽的作用下分泌至发酵上清中。经Capto MMC阳离子交换和Sephadex G50凝胶排阻纯化,SDS-PAGE显示重组蛋白位于27 kDa处,与理论分子量 (26 941 Da) 相符,且纯度大于95% (图2)。
|
| 图2 溶葡萄球菌酶半胱氨酸突变体的SDS-PAGE分析 Fig.2 SDS-PAGE analysis of single cysteine substitutions in lysosatphin. |
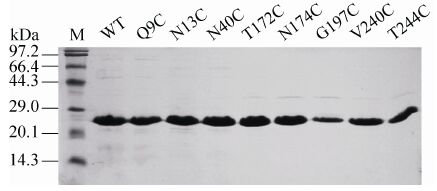
采用比浊法[19]测定重组Lysn及其Cys突变体的生物活性。结果显示,与Lysn的溶菌活性相比,突变体N40C、V240C和T244C的活性基本没有下降,分别为Lysn酶活性的95%、100%和98%;突变体Q9C和G197C的活性有轻微下降,分别为Lysn酶活性的88%和91%;而突变体N13C、T172C和N174C的活性下降了近20%,为Lysn酶活性的82%、81%和83% (图3)。说明这些位点的突变对Lysn的结构和功能影响并不明显,纯化获得的突变体可进一步用于PEG修饰。
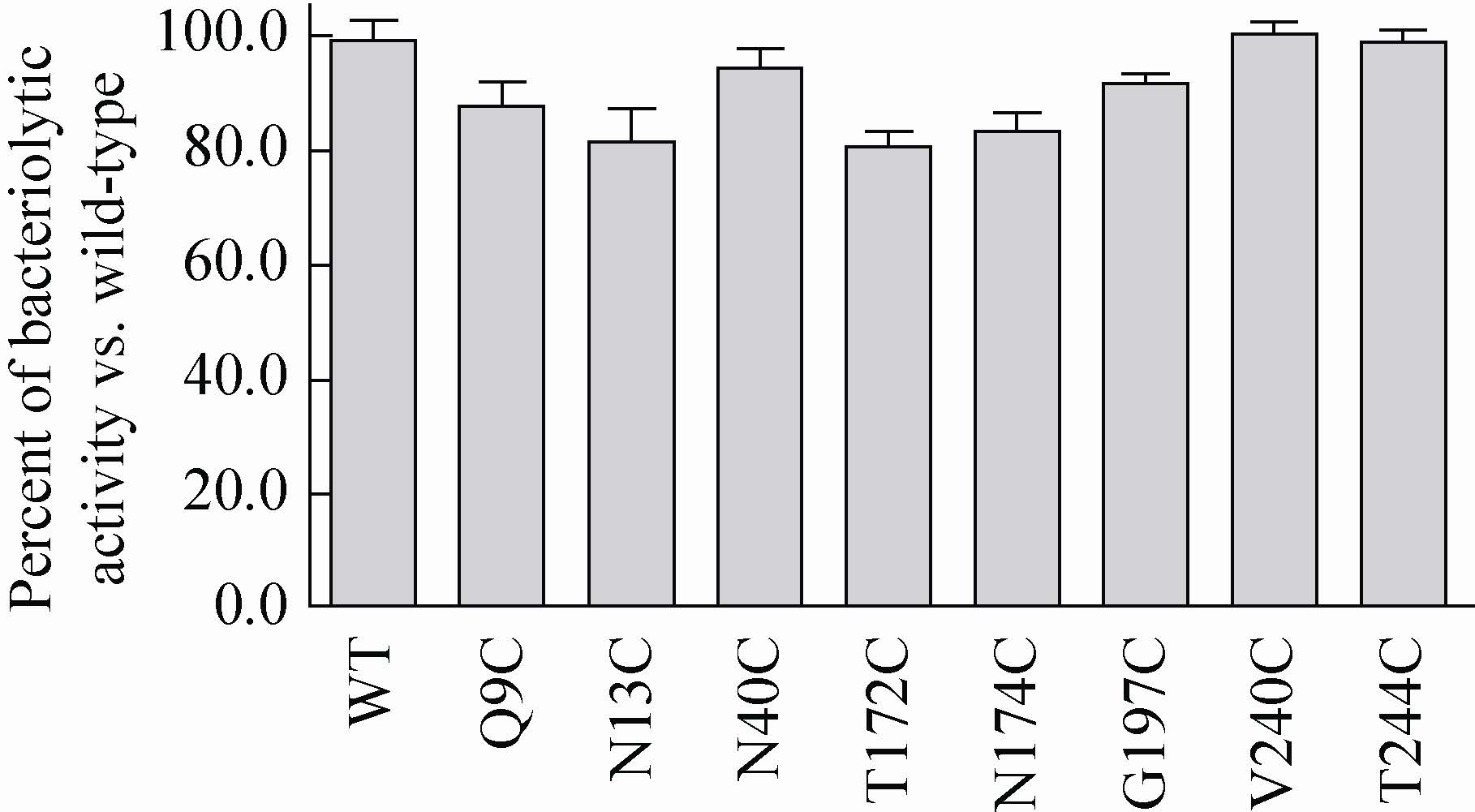
|
| 图3 溶葡萄球菌酶Cys 突变体的生物活性分析 Fig.3 The bacteriolytic activities of single cysteine substitutions in lysosatphin. |
将Lysn突变体与mPEG-MAL (分子量20 kDa) 按1:5摩尔比4 ℃反应2-3 h后,RP-HPLC分析结果显示Lysn突变体的PEG修饰率大于70% (数据未显示)。将mPEG-MAL与Lysn的反应液经MacroCap SP柱纯化。通过梯度洗脱,PEG-Lysn最先被洗脱下来。Lysn被PEG修饰后,蛋白分子表面的带电基团被PEG覆盖,导致PEG-Lysn带电荷比Lysn少,因此与MacroCap SP阳离子纯化介质的结合能力减弱。SDS-PAGE显示经纯化后的PEG-Lysn的纯度达到了95%以上 (图4)。电泳显示PEG-Lysn位于70 kDa处,比理论分子量 (47 kDa) 大,可能是由于线性PEG分子在SDS-PAGE中的泳动速度比橄榄型蛋白分子慢所致。
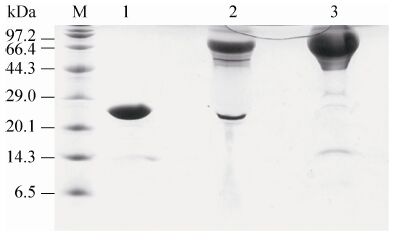
|
| 图4 PEG 修饰溶葡萄球菌酶的SDS-PAGE 分析 Fig.4 SDS-PAGE analysis of PEGylated lysostaphin. M: protein marker; 1: single-cysteine mutant (LysnQ9C); 2: PEGylation reaction mixture; 3: purified 20K-PEG-LysnQ9C. |
采用比浊法和MIC法测定PEG-Lysn的生物活性。结果显示,与Lysn的溶菌活性相比,突变体V240C和T244C经PEG修饰后的生物活性保留较高,分别为Lysn酶活性的45%和51%;突变体N174C和G197C经PEG修饰后的生物活性有明显下降,分别为Lysn酶活性的29%和36%;而突变体Q9C、N13C、N40C和T174C经PEG修饰后活性急剧下降,分别只有Lysn酶活性的9%、11%、20%和23% (图5)。
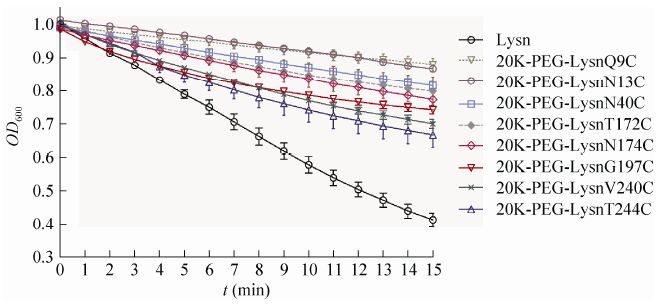
|
| 图5 PEG化溶葡萄球菌酶的生物活性分析 Fig.5 The bacteriolytic activities of PEGylated lysostaphin. |
MIC实验结果显示,20K-PEG-LysnT244C和20K-PEG-LysnV240C对金黄色葡萄球菌ATCC 6538的MIC均为0.25 μg/mL,MIC值是Lysn的2倍。其他PEG-Lysn的MIC值在0.5-1.0 μg/mL之间,抗菌活性明显低于Lysn (表1)。
| Sample | MIC (μg/mL) |
| Lysn | 0.125 |
| 20K-PEG-LysnQ9C | 1.000 |
| 20K-PEG-LysnN13C | 1.000 |
| 20K-PEG-LysnN40C | 0.500 |
| 20K-PEG-LysnT172C | 0.500 |
| 20K-PEG-LysnN174C | 0.500 |
| 20K-PEG-LysnG197C | 0.500 |
| 20K-PEG-LysnV240C | 0.250 |
| 20K-PEG-LysnT244C | 0.250 |
病原菌耐药性问题日趋严重,尤其是MRSA,因此迫切需要研发具有新型作用模式的抗菌药物。近年来,抗菌蛋白 (包括细菌素、噬菌体裂解酶、细菌自溶素等) 因其能高效裂解细菌细胞壁而具有很好的应用前景[20, 21, 22, 23]。其中Lysn的研究最为广泛[24],它作为治疗创面金葡菌感染的新药,目前处于临床III期研究阶段。但由于Lysn的体内半衰期问题,它只能局部外用。PEG修饰已被广泛应用于蛋白类药物,它能显著延长药物体内半衰期并减少免疫原性,增强药物的生物利用度[25, 26]。目前有多个PEG修饰药物已经上市销售,还有大量PEG 修饰药物处于临床研究阶段,然而前期PEG修饰Lysn的研究进展并不顺利[14, 15, 16]。
为获得高生物活性的PEG-Lysn,本研究基于Lysn最新研究的高级结构,在其分子表面优选8个位点,通过定点突变技术分别引入Cys,完成8个突变体的构建、表达和生物活性分析。进一步建立了简便可控、适合放大的PEG修饰和纯化工艺。由于是定点修饰,因此不存在多PEG修饰产物或者同分异构体,降低了PEG-Lysn质量控制的难度。研究过程中发现,在PEG修饰前通过DTT处理,能显著提高PEG的修饰率,这可能是由于在表达和纯化过程中部分巯基已经被氧化,导致无法被mPEG-MAL修饰,经过快速DTT处理,还原Cys上的巯基。PEG修饰可以延长Lysn的体内半衰期,从而延长体内作用时间,但由于引入的PEG会对Lysn与细菌细胞壁的结合产生空间位阻,使其溶菌活性急剧下降。之前,王永等[15]和吴宏等[16]的研究结果表明,Ly sn分子中赖氨酸的随机PEG修饰产物和Lysn两个结构域之间linker处的定点PEG修饰产物的溶菌活性都显著下降。与这些报道相似,我们在研究过程中也发现催化域上的一些位点 (LysnQ9C和LysnN13C) 经PEG修饰后,其溶菌活性只有修饰前的10%左右 (图5),提示这些位点的PEG修饰严重影响了Lysn催化域与细菌细胞壁的结合。
当我们在位于Lysn结合域的LysnT244C和LysnV240C进行PEG定点修饰后发现,修饰产物的生物活性能维持在原来的50%左右,可能是由于这些位点的修饰对Lysn结合域与细菌细胞壁结合的影响相对较小;同时,这些位点远离Lysn催化域和结合域的相互作用界面,因此也不会影响两个结构域之间的协作。由于本研究中选择PEG修饰的位点数量有限,不排除有更好的位点可被用来PEG修饰,从而进一步提高PEG-Lysn的生物活性。在下一步工作中,将通过金葡菌感染动物模型来验证高活性PEG-Lysn的体内生物学活性。
| [1] | Lowy FD. Medical progress: Staphylococcus aureus infections. New Engl J Med, 1998, 339(8): 520-532. |
| [2] | Whitby M, McLaws ML, Berry G. Risk of death from methicillin-resistant Staphylococcus aureus bacteraemia: a meta-analysis. Med J Aust, 2001, 175(5): 264-267. |
| [3] | Chambers HF, Deleo FR. Waves of resistance: Staphylococcus aureus in the antibiotic era. Nat Rev Microbiol, 2009, 7(9): 629-641. |
| [4] |
Hu FP, Zhu DM, Wang F, et al. CHINET 2013 surveillance of bacterial resistance in China. Chin J Infect Chemother, 2014, 14(5): 369-378 (in Chinese). 胡付品, 朱德妹, 汪复, 等. 2013年中国CHINET细菌耐药性监测. 中国感染与化疗杂志, 2014, 14(5): 369-378. |
| [5] | Dombrowski JC, Winston LG. Clinical failures of appropriately-treated methicillin-resistant Staphylococcus aureus infections. J Infect, 2008, 57(2): 110-115. |
| [6] | Schindler CA, Schuhardt VT. Lysostaphin: a new bacteriolytic agent for the Staphylococcus. Proc Natl Acad Sci USA, 1964, 51(3): 414-421. |
| [7] | Lodise TP, Graves J, Evans A, et al. Relationship between vancomycin MIC and failure among patients with methicillin-resistant Staphylococcus aureus bacteremia treated with vancomycin. Antimicrob Agents Chemother, 2008, 52(9): 3315-3320. |
| [8] | Yang XY, Li CR, Lou RH, et al. In vitro activity of recombinant lysostaphin against Staphylococcus aureus isolates from hospitals in Beijing, China. J Med Microbiol, 2007, 56(1): 71-76. |
| [9] |
Tang ZM, Liu XW, Song HF. Pharmacokinetics of Bio-technology Derived Drugs. Beijing: Chemical Industry Press, 2004: 300-302 (in Chinese). 汤仲民, 刘秀文, 宋海峰. 生物技术药物药代动力学. 北京:化学工业出版社, 2004: 300-302. |
| [10] | Quickel Jr KE, Selden R, Caldwell JR, et al. Efficacy and safety of topical lysostaphin treatment of persistent nasal carriage of Staphylococcus aureus. Appl Microbiol, 1971, 22(3): 446-450. |
| [11] |
Chen L, Guo L, Xiong AB. Antibiotic effect of lysostaphin on granulation wound. Acta Acad Med Milit Tert, 2006, 28(14): 1517-1519 (in Chinese). 陈莉, 郭力, 熊爱兵. 溶葡萄球菌酶对创面肉芽组织抗菌效果的临床研究. 第三军医大学学报, 2006, 28(14): 1517-1519. |
| [12] | Miao JJ, Pangule RC, Paskaleva EE, et al. Lysostaphin-functionalized cellulose fibers with antistaphylococcal activity for wound healing applications. Biomaterials, 2011, 32(36): 9557-9567. |
| [13] | Belyansky I, Tsirline VB, Martin TR, et al. The addition of lysostaphin dramatically improves survival, protects porcine biomesh from infection, and improves graft tensile shear strength. J Surg Res, 2011, 171(2): 409-415. |
| [14] | Walsh S, Shah A, Mond J. Improved pharmacokinetics and reduced antibody reactivity of lysostaphin conjugated to polyethylene glycol. Antimicrob Agents Chemother, 2003, 47(2): 554-558. |
| [15] |
Wang Y, Liu MR, Wan HT, et al. Chemical modification of lysostaphin with activated polyethylene glycol. China Biotechnol, 2013, 33(6): 12-17 (in Chinese). 王永, 刘沐荣, 万海同, 等. 聚乙二醇修饰重组溶葡球菌酶的初步研究. 中国生物工程杂志, 2013, 33(6): 12-17. |
| [16] |
Wu H, Fang W, Yuan J, et al. Site-directed mutagenesis and sulfhydryl PEGylation of lysostaphin. Chin J Biotech, 2011, 27(11): 1623-1630 (in Chinese). 吴宏, 房伟, 袁璟, 等. 溶葡球菌酶的定点突变与 PEG巯基定点修饰. 生物工程学报, 2011, 27(11): 1623-1630. |
| [17] | Lu HR, Gu MG, Huang Q, et al. Hydrogen/ Deuterium exchange mass spectrometry and site-directed disulfide cross-linking suggest an important dynamic interface between the two lysostaphin domains. Antimicrob Agents Chemother, 2013, 57(4): 1872-1881. |
| [18] | Sabala I, Jagielska E, Bardelang PT, et al. Crystal structure of the antimicrobial peptidase lysostaphin from Staphylococcus simulans. FEBS J, 2014, 281(18): 4112-4122. |
| [19] | Kusuma CM, Kokai-Kun JF. Comparison of four methods for determining lysostaphin susceptibility of various strains of Staphylococcus aureus. Antimicrob Agents Chemother, 2005, 49(8): 3256-3263. |
| [20] | Villa TG, Crespo PV. Enzybiotics: Antibiotic Enzymes as Drugs and Therapeutics. Hoboken: John Wiley & Sons, 2010. |
| [21] | Szweda P, Schielmann M, Kotlowski R, et al. Peptidoglycan hydrolases-potential weapons against Staphylococcus aureus. Appl Microbiol Biotechnol, 2012, 96(5): 1157-1174. |
| [22] | Pastagia M, Schuch R, Fischetti VA, et al. Lysins: the arrival of pathogen-directed anti-infectives. J Med Microbiol, 2013, 62(10): 1506-1516. |
| [23] | Rodríguez-Rubio L, Martínez B, Donovan DM, et al. Bacteriophage virion-associated peptidoglycan hydrolases: potential new enzybiotics. Crit Rev Microbiol, 2013, 39(4): 427-434. |
| [24] | Kumar JK. Lysostaphin: an antistaphylococcal agent. Appl Microbiol Biotechnol, 2008, 80(4): 555-561. |
| [25] | Harris JM. Chess RB. Effect of PEGylation on pharmaceuticals. Nat Rev Drug Discov, 2003, 2(3): 214-221. |
| [26] | Pasut G. Veronese FM. State of the art in PEGylation: the great versatility achieved after forty years of research. J Control Release, 2012, 161(2): 461-472. |
 2016, Vol. 32
2016, Vol. 32