中国科学院微生物研究所、中国微生物学会主办
文章信息
- 孟丽, 陶洁, 李本强, 马玉飞, 程靖华, 张春玲, 刘惠莉
- Meng Li, Tao Jie, Li Benqiang, Ma Yufei, Cheng Jinghua, Zhang Chunling, Liu Huili
- 猪7种腹泻相关病毒的临床检测及猪嵴病毒的遗传进化分析
- Clinical detection of seven porcine diarrhea-associated viruses and evolution analysis of porcine kobuvirus
- 生物工程学报, 2017, 33(8): 1292-1303
- Chinese Journal of Biotechnology, 2017, 33(8): 1292-1303
- 10.13345/j.cjb.170113
-
文章历史
- Received: March 24, 2017
- Accepted: May 10, 2017
2 上海海洋大学 水产与生命学院,上海 201306
2 College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China
近年来,猪腹泻病的流行越来越广,且疾病的复杂程度日益增加,给我国畜牧业造成了严重的经济损失。猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV)和猪轮状病毒(Porcine rotavirus, PoRV)是引起猪腹泻的三种重要的病毒性病原[1]。但近年来不断报道有新的腹泻病原出现,导致猪腹泻病原复杂化,疾病防控难度增加。兰道亮等[2]报道华东地区猪群中猪萨佩罗病毒(Porcine sapelovirus, PSV)平均阳性率达17.2%。蔡雨涵等[3]报道湖北、湖南、河南省各大猪场中猪博卡病毒(Porcine bocavirus, PBoV)的阳性率达73.95%。刘玲玲等[4]利用RT-PCR方法对江西省地区腹泻粪便检测,结果显示腹泻样本中猪丁型冠状病毒(Porcine deltacoronavirus, PDCoV)的检出率为31.33%。Xiao等[5]检测湖南猪场中猪星状病毒(Porcine astrovirus, PAstV)感染率达11.5%。猪嵴病毒(Porcine kobuvirus, PKV)也广泛存在于猪群中,其主要临床症状表现为胃肠炎,因此容易与TGEV相混淆,从而导致所谓的“疫苗使用效果不佳”[6]。所以,开展猪病毒性腹泻病原调查十分必要,有助于对猪腹泻病的针对性治疗。
猪嵴病毒是小RNA病毒科嵴病毒属成员,该病毒于2007年首次在匈牙利健康猪腹泻粪便样品中发现。PKV主要危害3周龄以下的仔猪,可引起仔猪胃肠炎,出现严重腹泻,甚至死亡[7]。PKV呈地方性流行,中国、泰国、韩国、日本、新西兰及巴西等[8-13]均有PKV感染的相关报道。PKV与其他病毒混合感染现象也较普遍[14],不仅会促进仔猪腹泻疾病的发生,同时还会加重病情,其感染也不仅仅局限于肠道,还可以侵入血液并造成病毒血症。国内从2009年开始PKV阳性检出率呈逐年递增的趋势。很多学者推断PKV和目前的猪腹泻有着很大的关系,但也有报道指出PKV在无腹泻症状猪群中的阳性率比腹泻症状猪群还要高[15]。因此,对猪群中PKV监测并进一步了解其致病特性和遗传规律具有重要意义。
本研究首先建立了针对7种报道较少的猪病毒性腹泻相关病原的多重RT-PCR检测方法,通过对临床样品的检测,明确了上海地区PKV的感染率及其混合感染情况;进一步测定了不同猪场来源的PKV毒株的全基因组序列,并分析其遗传进化规律,为后续深入研究PKV的致病性奠定基础。
1 材料与方法 1.1 材料 1.1.1 病毒及病料样品采集PEDV、TGEV、猪瘟病毒(Classical swine fever virus, CSFV)、猪源牛病毒性腹泻病毒(Bovine viral diarrhea virus, BVDV)、猪流感病毒(Swine influenza virus, SIV)均由上海市农业科学院畜牧兽医研究所分离保存。
419份粪便样品采自上海及周边猪场中有腹泻症状的猪。
1.1.2 主要试剂和仪器100 bp DNA ladder marker、pMD-18 T载体、rTaq DNA聚合酶、TRIzol、M-MLV (RNase H-)、dNTPs均购自TaKaRa公司;普通琼脂糖凝胶DNA回收试剂盒和质粒提取试剂盒购自Tiangen公司;DH5α菌株由本实验室保存,其他常规试剂均为国产分析纯级产品。
主要仪器包括梯度PCR仪(ABI)、低温台式高速离心机(Beckman)、涡旋振荡仪(Vision)、凝胶成像分析系统(Bio-Rad)、Q5000蛋白核酸测定仪等。
1.2 方法 1.2.1 引物设计参照文献[2-6],根据GenBank中已有PKV (EU787450、KT892971、JX401523、KM977675)、PAstV (JX556692、KU764486、JX556693、JX556691)、PSaV (KT922089、FJ387164、KT922087、KF204570)、PDCoV (KJ769231、KR265865、KT021234、KX022605)、PToV (GU196786、JQ740195、FJ555569)、PTV (AF231767、AF296096、GU446660、JQ664746、AJ516011)、PSV (HQ875059、KJ821020、KJ821021) 全基因组序列,通过比较其保守区域,利用Oligo7.37软件分别针对PTV 3D基因、PKV 3D基因、PDCoV M基因、PSV 5′UTR基因、PSaV ORF1基因、PAstV ORF2基因、PToV S基因设计7对特异性检测引物(表 1)。引物由生工生物工程(上海)股份有限公司合成。
| Name | Primer sequences (5′-3′) | Product length (bp)* | Location (nt)* |
| PTV-F | ATGGGACTCTAGATCTCGT | 176 | 4 507-4 525 |
| PTV-R | ACGCCTCTGTAGTTCTCTCTT | 4 662-4 682 | |
| PAstV-F | GGATTTACAGTTGGCCCAGAT | 249 | 3 785-3 805 |
| PAstV-R | CCTGTCCATCTGCCTTTCTGT | 4 013-4 033 | |
| PKV-F | ATGCTGCTTGGTGGACTCATT | 280 | 7 065-7 064 |
| PKV-R | ACGTCTCGTTGCCAAAGACAT | 7 324-7 343 | |
| P-SaV-F | CGAGGCTAAAGGGAAAAACAAACGT | 340 | 2 808-2 832 |
| P-SaV-R | ACTGTCGTAGGTGTCTGCTTTT | 3 126-3 147 | |
| PToV-F | CTTTTACACCTTGCCATCC | 421 | 23 234-23 253 |
| PToV-R | TGCTTCACCTCTACACTGTT | 23 640-23 659 | |
| PDCoV-F | ACTTATTCTGCTTTGGCTGCT | 504 | 23 157-23 178 |
| PDCoV-R | GAAGTGGTTATGGTGTGAAGTC | 23 639-23 661 | |
| PSV-F | GATGTGGCGCATGCTCTT | 624 | 316-334 |
| PSV-R | TGCTGCCTCCTGTGTTGTTAT | 919-940 | |
| *Primer locations and lengths are listed according to the strain PTV (AF231767), PAstV (JX556692), PKV (EU787450), PSaV (KT922089), PToV (GU196786), PDCoV (KJ769231) and PSV (HQ875059), respectively. | |||
采集的粪便溶于适量PBS中,反复冻融2次,12 000 r/min离心2 min,吸取250 μL上层样品进行总RNA的提取,并反转录成cDNA。
1.2.3 多重RT-PCR的建立与优化以cDNA为模板,分别利用相对应的病原检测引物进行单一RT-PCR扩增,并克隆各目的片段,测序鉴定,制备阳性质粒模板。
进一步将7种分别含有特定病原基因片段的质粒的混合物作为模板,进行多重RT-PCR反应条件的优化,包括最佳退火温度、引物浓度、多重RT-PCR特异性和灵敏性等。
1.2.4 临床样品检测用建立的多重RT-PCR方法对临床419份腹泻样品进行检测。
1.2.5 全基因组序列的测定参照文献[16],合成8对PKV全基因组扩增引物,选取3例阳性样本分别进行基因组序列的测定,得到3株PKV全基因组。其中5′末端序列利用5′ RACE kit测定。每个片段送样3份,由生工生物工程(上海)股份有限公司测序。
1.2.6 序列分析应用Lasergene分析软件对各测定片段进行拼接,获得PKV全基因组序列并进行分析,利用MEGA6.0软件制作进化树分析其亲缘性。
2 结果与分析 2.1 阳性质粒的克隆和鉴定分别利用7种腹泻病原的检测引物,对临床采集样品进行检测,获得扩增出阳性目的片段的样品(图 1)。进一步回收各目的片段,利用pEASY-T1 Simple Cloning Kit进行“TA”连接,然后转化DH5α。通过菌液PCR方法鉴定,获得疑似阳性质粒pEASY-PTV/3D、pEASY-PKV/3D、pEASY-PDCoV/M、pEASY-PSV/5′UTR、pEASY-PSaV/ORF1、pEASY-PAstV/ ORF2、pEASY-PToV/S。测序证实,各片段均与相应的腹泻病原序列吻合,获得正确的阳性质粒。
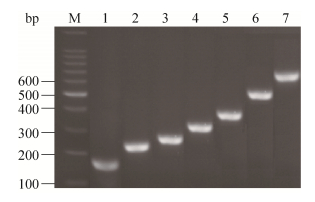
|
| 图 1 猪7种病毒性腹泻病原的目的片段扩增 Figure 1 Specific fragments amplification of the seven porcine diarrhea-associated viruses. M: 100 bp DNA marker; 1: PTV 3D fragment; 2: PAstV ORF2 fragment; 3: PKV 3D fragment; 4: PSaV ORF1 fragment; 5: PToV S fragment; 6: PDCoV M fragment; 7: PSV 5′UTR fragment. |
| |
将7种阳性质粒模板逐渐增加,依次进行多重RT-PCR扩增,最终建立了7重RT-PCR方法(图 2),7个目的片段大小依次为624 bp、504 bp、421 bp、340 bp、280 bp、249 bp和176 bp,大小正确,条带特异。进一步优化退火温度,如图 3所示,退火温度为52 ℃、55 ℃、58 ℃和61 ℃时,7重PCR均能扩增成功;其中,当退火温度为58 ℃时,PCR扩增条带最清晰。
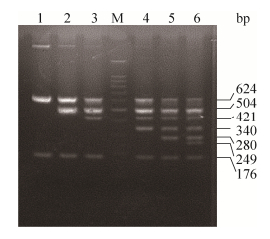
|
| 图 2 多重RT-PCR的建立 Figure 2 Development of the multiplex RT-PCR. M: 100 bp DNA marker; 1: multiplex RT-PCR for PTV and PSV; 2: multiplex PCR for PTV, PDCoV and PSV; 3: multiplex RT-PCR for PTV, PToV, PDCoV and PSV; 4: multiplex RT-PCR for PTV, PSaV, PToV, PDCoV and PSV; 5: multiplex RT-PCR for PTV, PKV, PSaV, PToV, PDCoV and PSV; 6: multiplex RT-PCR for PTV, PAstV, PKV, PSaV, PToV, PDCoV and PSV; M: marker. |
| |
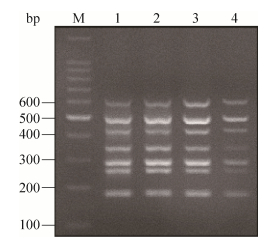
|
| 图 3 多重RT-PCR的退火温度筛选 Figure 3 Temperature screening of the multiplex RT-PCR. 1-4: Tm 52 ℃, 55 ℃, 58 ℃ and 61 ℃; M: marker. |
| |
用建立的多重RT-PCR方法检测PEDV、TGEV、CSFV、BVDV、SIV,结果如图 4所示,没有扩增出片段;而以含有PTV、PKV、PDCoV、PSV、PSaV、PAstV、PToV特异性目的片段的阳性质粒为模板进行多重RT-PCR,扩增出了7条特异的目的片段;证实该方法特异性较好(图 4)。
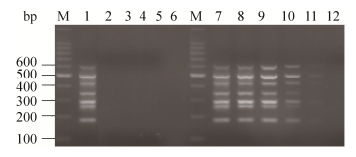
|
| 图 4 多重RT-PCR特异性和灵敏性鉴定 Figure 4 Specificity and sensitivity of the multiplex RT-PCR. M: 100 bp DNA ladder; 1: multiplex RT-PCR used PTV, PKV, PDCoV, PSV, PSaV, PAstV and PToV as the templates; 2: multiplex RT-PCR used PEDV as the template; 3: multiplex RT-PCR used TGEV as the template; 4: multiplex RT-PCR used BVDV as the template; 5: multiplex RT-PCR used CSFV as the template; 6: multiplex RT-PCR used SIV as the template; 7−12: sensitivity detection of the multiplex RT-PCR with the plasmids of 10−1−10−6. |
| |
分别以7个阳性质粒模板10倍倍比稀释后,进行多重PCR,检测其灵敏性。结果发现,当质粒稀释至10-5倍时,多重PCR条带很浅。因此,我们判定该多重PCR方法可检测PTV、PKV、PDCoV、PSV、PSaV、PAstV和PToV的质粒最低检测限量分别为5.0×104、5.5×104、6.0×104、6.0×104、3.8×104、6.1×104和6.9×104copies/μL,对应的最低核酸检测浓度分别为0.32、0.36、0.41、0.41、0.18、0.39和0.43 μg/L (图 4)。
2.3.3 重复性试验应用多重RT-PCR对同一阳性模板进行检测,5次试验检测结果均一致,表明本方法的重复性较好。
2.4 多重RT-PCR与单项RT-PCR临床检测结果的比较利用建立的多重RT-PCR方法对上海地区采集的419份临床腹泻样品进行检测,结果见表 2,其中PKV的感染率最高,2015和2016年分别为26.98%和45.79%。2种以上病原混合感染率较高,其中PKV和其他病原的混合感染率达9.52% (2015年)、18.54% (2016年)。与用单一RT-PCR检测7种腹泻相关病原结果的符合率均为100%,表明该方法能够快速准确地筛检出这7种腹泻相关病原的混合感染病例。
| Year | Total samples | Infection rate (%) | Coinfection rate of PKV and other viruses | ||||||
| PTV | PToV | PDCoV | PKV | PSaV | PAstV | PSV | |||
| 2015 | 63 | 3.17 | 6.35 | 15.87 | 26.98 | 19.05 | 17.46 | 15.87 | 9.52 |
| 2016 | 356 | 6.46 | 1.69 | 4.21 | 45.79 | 12.92 | 26.97 | 18.26 | 18.54 |
选择来源于不同猪场的PKV阳性样品3例,进行PKV全基因组序列的测定,如图 5所示,共有11个目的片段,大小正确且特异。利用Lasergene和Cluster X软件拼接,获得3株PKV全基因组序列,分别编号为PD-PKV、JS-PKV和CM-PKV。PD-PKV、JS-PKV和CM-PKV全长分别为8 054 bp、8 053 bp和8 057 bp,均包含5′UTR、3′UTR和一个大的ORF。PD-PKV和JS-PKV编码一个2 459 aa的多聚蛋白,CM-PKV编码2 460 aa的多聚蛋白。

|
| 图 5 PKV全基因组PCR扩增 Figure 5 PCR amplification of the complete genomic sequence of PKV. |
| |
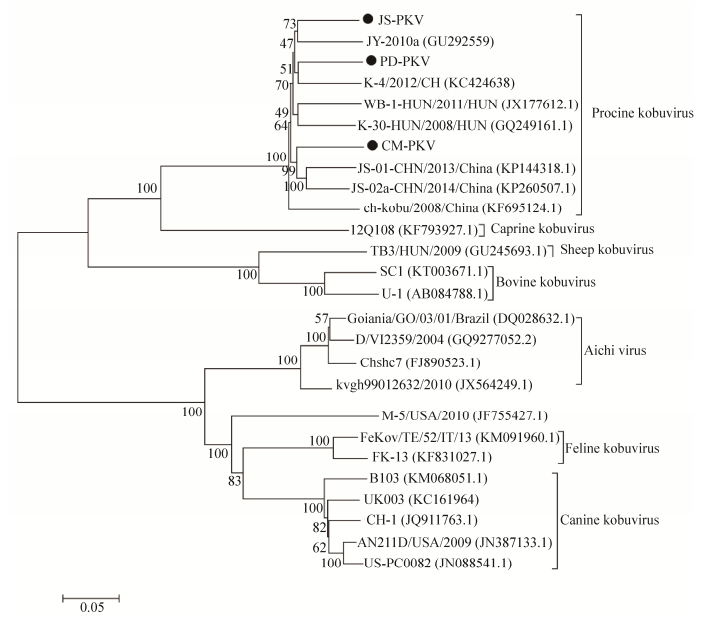
从GenBank中选取不同地区、年代、种属的嵴病毒全基因组序列,利用MEGA6.0软件构建全基因组进化树,具体参考毒株见表 3。结果发现(图 6),JS-PKV、PD-PKV和JS-PKV均归属于猪嵴病毒,分别与中国北京株JS-2010a PDPKV、中国甘肃株K-4/2012/CH、中国江苏株JS-01-CHN/2013/China的亲缘性最近,与其他动物嵴病毒遗传距离较远。
| Strains | Origins | GenBank No. |
| Aichi virus Chshc7 | China | FJ890523.1 (2008) |
| Aichi virus kvgh99012632/2010 | Taiwan, China | JX564249.1 (2010) |
| Aichi virus D/Ⅵ2359/2004 | Germany | GQ927705.2 (2004) |
| Aichi virus Goiania/GO/03/01/Brazil | Germany | DQ028632.1 (2006) |
| Bovine kobuvirus U-1 | Japan | AB084788.1 (2008) |
| Bovine kobuvirus SC1 | Scotland | KT003671.1 (2013) |
| Mouse kobuvirus M-5/USA/2010 | USA | JF755427.1 (2010) |
| Canine kobuvirus UK003 | UK | KC161964 (2008) |
| Canine kobuvirus CH-1 | Hubei, China | JQ911763.1 (2011) |
| Canine kobuvirus US-PC0082 | USA | JN088541.1 (2010) |
| Canine kobuvirus B103 | Germany | KM068051.1 (2010) |
| Canine kobuvirus AN211D/USA/2009 | USA | JN387133.1 (2009) |
| Feline kobuvirus FeKoV/TE/52/IT/13 | Italy | KM091960.1 (2013) |
| Feline kobuvirus FK-13 | Korea | KF831027.1 (2011) |
| Porcine kobuvirus JS-02a-CHN/2013 | Jiangsu, China | KP260507.1 (2013) |
| Porcine kobuvirus JS-01-CHN/2013 | Jiangsu, China | KP144318.1 (2013) |
| Porcine kobuvirus K-4/2012/CH | Gansu, China | KC424638.1 (2012) |
| Porcine kobuvirus JY-2010a | Beijing, China | GU292559.1 (2010) |
| Porcine kobuvirus ch-kobu/2008/China | Jiangsu, China | KF695124.1 (2008) |
| Porcine kobuvirus WB-1-HUN/2011/HUN | Hungary | JX177612.1 (2011) |
| Porcine kobuvirus K-30-HUN/2008/HUN | Hungary | GQ249161.1 (2008) |
| Caprine kobuvirus 12Q108 | South Korea | KF793927.1 (2012) |
| Sheep kobuvirus TB3/HUN/2009 | Hungary | GU245693.2 (2009) |
|
| 图 6 PKV全基因组进化树分析 Figure 6 Phylogenetic tree based on the complete genomic sequences of PKV. |
| |
这3株PKV的全基因组序列同源性为88.1%−89.1% (图 7),CM-PKV和中国株JS-02a-CHN/2013/China同源性最高(89.5%),而JS-PKV和PD-PKV则与匈牙利株K-30-KUN/2008/HUN的同源性最高(89.6%),说明近年来不同国家流行的猪嵴病毒之间存在着一定的相似性。

|
| 图 7 PKV全基因组序列的同源性比对 Figure 7 Identity analyzation of the complete genomic sequences of PKV. |
| |
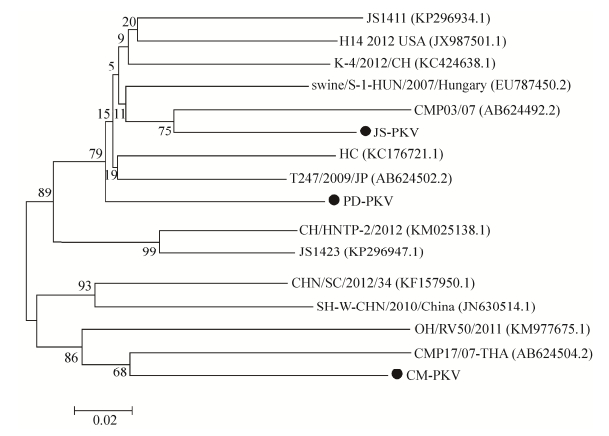
VP1是PKV的主要结构蛋白,具有较大变异性。通过构建VP1基因的进化树(图 8),我们发现虽然JS-PKV、PD-PKV和CM-PKV处于不同分支,但它们均与日本株的亲缘性最近;JS-PKV、CM-PKV分别与2007年日本报道的CMP03/07株、CMP17/07-THA株处于同一分支,而PD-PKV与2009年日本报道的T247/2009/JP株处于同一分支。说明本试验中的3株PKV很有可能是由日本株变异而来。
|
| 图 8 VP1基因的进化树分析 Figure 8 Phylogenetic tree based on the VP1 genes. |
| |
近年来,猪病毒性腹泻流行甚广,对引起腹泻病原的诊断、检测技术也有很多报道。特别是多病原检测方法研究较多。目前,关于PEDV、TGEV和PoRV等腹泻病原的多重RT-PCR方法较多[1, 17-21],且多是3重RT-PCR或4重RT-PCR。本研究首次建立了可同时检测7种猪病毒性腹泻病原的多重RT-PCR方法。该方法特异性较好,只可特异性扩增出PTV、PKV、PDCoV、PSV、PSaV、PAstV和PToV的条带,不会出现其他病毒性腹泻病原的交叉扩增现象;最低核酸检测浓度分别为0.32、0.36、0.41、0.18、0.39和0.43 μg/L,与已有多重RT-PCR方法[22-26]相比,灵敏性较高。利用该方法对临床腹泻样品进行筛检,共检出PKV阳性样品180例、PTV和PDCoV阳性各25例、PToV阳性10例、PAstV阳性108例、PSV阳性75例;PKV和其他病原混合感染72例。测序证实PCR检测正确。说明本研究建立的7重RT-PCR方法可适用于临床大批量样品的筛查。
鉴于PKV的感染率较高,研究进一步选取了3个地区的PKV毒株进行全基因组序列测定。结果表明,JS-PKV、PD-PKV和CM-PKV的基因组构成符合PKV的基因组结构,依次分为5′ UTR、一个大的ORF和3′ UTR。除polyA尾巴外,它们的全基因组长度依次为8 053 bp、8 054 bp和8 057 bp;G+C百分含量依次为52.07%、52.04%和52.09%;A+T百分含量依次为47.93%、47.96%和47.91%。它们的全基因组同源性不高,仅达88.1%-89.1%,说明上海不同地区流行的PKV毒株之间存在着一定的变异。与参考毒株相比,JS-PKV和PD-PKV与匈牙利株K-30-KUN/2008/HUN的同源性最高,达89.6%;CM-PKV和中国株JS-02a-CHN/2013/China同源性最高,达89.5%。全基因组进化树表明,这3株PKV均与中国株的亲缘性最近;但VP1基因进化树表明,它们与日本株PKV的亲缘性最近。由此推测,近年来我国流行的PKV和日本株PKV之间有着一定的相似性,很有可能是从日本株变异而来。后续我们将开展这3株PKV的致病性及其在腹泻疾病中的作用研究。
| [1] | Ogawa H, Taira O, Hirai T, et al. Multiplex PCR and multiplex RT-PCR inclusive detection of major swine DNA and RNA viruses in pigs with multiplex infections. J Virol Methods, 2009, 160(1/2): 210–214. |
| [2] |
Lan DL, Ji WH, Wang CS, et al. Molecular epidemiology investigation of porcine sapelovirus in pigs in East China.
Prog Vet Med, 2012, 33(12): 116–121.
(in Chinese). 兰道亮, 吉文汇, 王长松, 等. 华东部分地区猪群中猪萨佩罗病毒分子流行病学调查. 动物医学进展, 2012, 33(12): 116-121. DOI:10.3969/j.issn.1007-5038.2012.12.027 |
| [3] |
Cai YH, Zhu L, Zhou YC, et al. Development and application of the duplex PCR for detection of porcine bocavirus.
Chin Vet Sci, 2013, 43(8): 833–838.
(in Chinese). 蔡雨涵, 朱玲, 周远成, 等. 猪博卡病毒双重PCR检测方法的建立及其应用. 中国兽医科学, 2013, 43(8): 833-838. |
| [4] |
Liu LL, Cao BB, Zhang LW, et al. Establishment and preliminary application of duplex RT-PCR for detection of emerging porcine deltacoronavirus and porcine transmissible gastroenteritis virus.
J Agricul Biotechnol, 2016, 24(12): 1955–1963.
(in Chinese). 刘玲玲, 曹贝贝, 张利卫, 等. 新发PDCoV和TGEV双重RT-PCR检测方法的建立及初步应用. 农业生物技术学报, 2016, 24(12): 1955-1963. |
| [5] | Xiao CT, Luo Z, Lv SL, et al. Identification and characterization of multiple porcine astrovirus genotypes in Hunan province, China. Arch Virol, 2017, 162(4): 943–952. DOI: 10.1007/s00705-016-3185-0 |
| [6] | Jackova A, Sliz I, Mandelik R, et al. Porcine kobuvirus 1 in healthy and diarrheic pigs: Genetic detection and characterization of virus and co-infection with rotavirus A. Infect Genet Evol, 2017, 49: 73–77. DOI: 10.1016/j.meegid.2017.01.011 |
| [7] | Jin WJ, Yang Z, Zhao ZP, et al. Genetic characterization of porcine kobuvirus variants identified from heathy pigs in China. Infect Genet Evol, 2015, 35: 89–95. DOI: 10.1016/j.meegid.2015.07.035 |
| [8] | Yu JM, Jin M, Zhang Q, et al. Candidate porcine kobuvirus, China. Emerg Infect Dis, 2009, 15(5): 823–825. DOI: 10.3201/eid1505.081518 |
| [9] | Wang C, Lan D, Hua X. Porcine kobuvirus from pig stool specimens in Shanghai, China. Virus Genes, 2011, 43(3): 350–352. DOI: 10.1007/s11262-011-0643-3 |
| [10] | Khamrin P, Maneekarn N, Kongkaew A, et al. Porcine kobuvirus in piglets, Thailand. Emerg Infect Dis, 2009, 15(12): 2075–2076. DOI: 10.3201/eid1512.090724 |
| [11] | Park SJ, Kim HK, Moon HJ, et al. Molecular detection of porcine kobuvirus in pigs in Korea and their association with diarrhea. Arch Virol, 2010, 155(11): 1803–1811. DOI: 10.1007/s00705-010-0774-1 |
| [12] | Khamrin P, Maneekarn N, Hidaka S, et al. Molecular detection of kobuvirus sequences in stool samples collected from heathy pigs in Japan. Infect Genet Evol, 2010, 10(7): 950–954. DOI: 10.1016/j.meegid.2010.06.001 |
| [13] | Barry AF, Ribeiro J, Alfieri AF, et al. First detection of kobuvirus in farm animals in Brazil and the Netherlands. Infect Genet Evol, 2011, 11(7): 1811–1814. DOI: 10.1016/j.meegid.2011.06.020 |
| [14] | Zhao ZP, Yang Z, Lin WD, et al. The rate of co-infection for piglet diarrhea viruses in China and the genetic characterization of porcine epidemic diarrhea virus and porcine kobuvirus. Acta Virol, 2016, 60(1): 55–61. DOI: 10.4149/av_2016_01_55 |
| [15] | Phan NT, Trinh QD, Khamrin P, et al. Sequence analysis of the capsid gene of Aichi viruses detected from Japan, Bangladesh, Thailand, and Vietnam. J Medical Virol, 2008, 80(7): 1222–1227. DOI: 10.1002/(ISSN)1096-9071 |
| [16] | Peng Q, Song D, Huang D, et al. Complete genome sequence of a porcine kobuvirus variant strain from Jiangxi, China. Genome Announc, 2017, 5(5): pii: e01580–16. |
| [17] | Ben Salem AN, Chupin Sergei A, Bjadovskaya Olga P, et al. Multiplex nested RT-PCR for the detection of porcine enteric viruses. J Virol Methods, 2010, 165(2): 283–293. DOI: 10.1016/j.jviromet.2010.02.010 |
| [18] | Zhao J, Shi BJ, Huang XG, et al. A multiplex RT-PCR assay for rapid and differential diagnosis of four porcine diarrhea associated viruses in field samples from pig farms in East China from 2010 to 2012. J Virol Methods, 2013, 194(1/2): 107–112. |
| [19] | Song DS, Kang BK, Oh JS, et al. Multiplex reverse transcription-PCR for rapid differential detection of porcine epidemic diarrhea virus, transmissible gastroenteritis virus, and porcine group A rotavirus. J Vet Diagn Invest, 2006, 18(3): 278–281. DOI: 10.1177/104063870601800309 |
| [20] |
Ren YP, Zhang B, Tang C, et al. Development and application of a multiplex RT-PCR for detecting PEDV, TGEV and PDCoV.
Chin Vet Sci, 2016, 46(6): 756–762.
(in Chinese). 任玉鹏, 张斌, 汤承, 等. 同时检测PEDV和TGEV及PDCoV的多重RT-PCR方法的建立及初步应用. 中国兽医科学, 2016, 46(6): 756-762. |
| [21] |
Xiong NN, Tao J, Zhang QZ, et al. Establishment and application of the multiplex PCR for detection of four porcine viral diarrhea viruses.
Chin J Vet Sci, 2016, 46(8): 972–978.
(in Chinese). 熊年年, 陶洁, 张清真, 等. 猪四种病毒性腹泻病原多重PCR检测方法的建立及应用. 中国医科学, 2016, 46(8): 972-978. |
| [22] |
Li LM, Zhu WX, Wang XB, et al. Establishment and application of a multiplex reverse transcription-PCR for detecting porcine epidemic diarrhea virus, porcine transmissible gastroenteritis virus and porcine group A rotavirus.
Chin J Vet Sci, 2016, 36(2): 216–220.
(in Chinese). 李丽敏, 朱卫霞, 王晓波, 等. 猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪A型轮状病毒多重R-PCR方法的建立及其应用. 中国兽医学报, 2016, 36(2): 216-220. |
| [23] |
Long FX, Shi KC, Zhang Z, et al. Establishment and application of a multiplex RT-PCR assay for detection of PEDV, TGEV and PRoV.
Chin Anim Husb & Vet Med, 2016, 43(10): 2518–2526.
(in Chinese). 龙飞翔, 施开创, 张珍, 等. PEDV、TGEV和PRoV多重RT-PCR检测方法的建立及应用. 中国畜牧兽医, 2016, 43(10): 2518-2526. |
| [24] |
Yang WY, Zhou YC, Han Y, et al. Establishment and clinical application of a multiplex reverse transcription-PCR for simultaneous detection of porcine group A rotavirus, porcine group C rotavirus and porcine astrovirus.
Chin Vet Sci, 2014, 44(4): 394–400.
(in Chinese). 杨文宇, 周远成, 韩燕, 等. 猪A群轮状病毒和C群轮状病毒以及猪星状病毒多重RT-PCR同时检测方法的建立及应用. 中国兽医科学, 2014, 44(4): 394-400. |
| [25] |
Gu F, Zhou YC, Huang JB, et al. Establishment and clinical application of a multiplex RT-PCR for detection of porcine kobuvirus, porcine astrovirus and porcine torovirus.
Chin Vet Sci, 2015, 45(7): 661–667.
(in Chinese). 顾凡, 周远成, 黄剑波, 等. 猪嵴病毒和猪星状病毒及猪环曲病毒多重RT-PCR检测方法的建立及临床应用. 中国兽医科学, 2015, 45(7): 661-667. |
| [26] |
Xu YD, Zhang QX, Li JL, et al. Establishment and application of multiple RT-PCR method for diagnosis of PEDV, TGEV and RV infection.
Chin J Vet Drug, 2014, 48(11): 10–13.
(in Chinese). 徐引弟, 张青娴, 李建林, 等. PEDV、TGEV、RV多重RT-PCR检测方法的建立与应用. 中国兽药杂志, 2014, 48(11): 10-13. |
 2017, Vol. 33
2017, Vol. 33




