中国科学院微生物研究所、中国微生物学会主办
文章信息
- 彭显, 李继遥, 徐欣
- Xian Peng, Jiyao Li, Xin Xu
- c-di-AMP调控细菌生物被膜的形成
- c-di-AMP regulates bacterial biofilm formation
- 生物工程学报, 2017, 33(9): 1369-1375
- Chinese Journal of Biotechnology, 2017, 33(9): 1369-1375
- 10.13345/j.cjb.170078
-
文章历史
- Received: February 27, 2017
- Accepted: June 2, 2017
2 四川大学 华西口腔医院 华西口腔医院牙体牙髓病科,四川 成都 610041
2 Department of Operative Dentistry and Endodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan, China
细菌生物被膜是细菌持续性致病的重要机制。细菌形成生物被膜可以增强其耐药性,阻碍临床抗菌治疗以及引起宿主免疫反应[1]。近年来研究发现,c-di-GMP在调控细菌生物被膜形成过程中具有重要作用[2]。在铜绿假单胞菌中增加细胞中c-di-GMP的含量可促进生物被膜的形成[3],在大肠杆菌中c-di-GMP调控生物被膜基质中纤维素的合成[4]。上述研究结果提示核苷酸第二信使分子在细菌生物被膜形成中起到重要的作用。近期研究发现,一种与c-di-GMP相似的核苷酸第二信使分子——c-di-AMP也参与了细菌生物被膜形成的调控[5-9]。
Cyclic di-AMP (Cyclic diadenosine monophosphate,c-di-AMP)是最新发现的广泛存在于细菌中的第二信使[10-12]。c-di-AMP的发现有很大的偶然性,研究者在研究一种DNA完整性扫描蛋白(DNA integrity scanning protein A,DisA)的结构时发现c-di-AMP存在于DisA的晶体中[13]。DisA可催化c-di-AMP的合成[14],后来被命名为DAC (Di-adenylyl cyclase)。c-di-AMP是由两分子ATP或ADP经二腺苷酸环化酶(Di-adenylate cyclase,DAC)催化形成,并可被c-di-AMP磷酸二酯酶(Phosphodiesterase,PDE)分解为1分子的pApA或2分子的AMP。在枯草芽孢杆菌Bacillus subtilis、金黄色葡萄球菌Staphylococcus aureus、肺炎链球菌Streptococcus pneumoniae以及单核细胞增生李斯特菌Listeria monocytogenes等常见致病菌中均发现了c-di-AMP的存在。近年来,c-di-AMP的相关研究日渐火热,其调控细菌代谢的分子机制也逐渐明确。研究发现,c-di-AMP与枯草芽孢杆菌DNA完整性[15]、金黄色葡萄球菌细胞壁合成[16]、耻垢分枝杆菌的脂肪酸代谢[16]、肺炎链球菌的钾离子摄取[17]、变异链球菌和枯草芽孢杆菌的生物被膜形成以及细菌致病毒力密切相关[7, 18-20]。
1 细菌中的c-di-AMP 1.1 c-di-AMP的代谢c-di-AMP在研究海栖热袍菌DisA蛋白晶体结构时被发现[16]。随着研究的深入,发现2分子的ATP在DAC催化下合成1分子的c-di-AMP[5, 21]。最初,人们一直认为c-di-AMP只能由2分子ATP经DAC催化合成。随后,研究者们在研究结核分枝杆菌c-di-AMP合成酶时发现,结核分枝杆菌的c-di-AMP合成酶也可利用ADP合成c-di-AMP[13, 18]。目前发现的c-di-AMP合成酶有7种,除了最初发现的DisA外,还根据其蛋白结构的不同将后来发现的c-di-AMP合成酶分别命名为DacA、DacB、DacC、DacD、DacE和DacF,它们具有不同的蛋白结构,但都含有保守的RHR和GDA结构域[22]。DacA是细菌中最为普遍存在的c-di-AMP合成酶。DacA除了含有具有RHR和GDA结构域的保守结构外,在其蛋白结构的C端还有3个跨膜区域,可能与调控c-di-AMP的合成有关[23]。我们在对一种口腔致龋菌——变异链球菌的研究中发现其c-di-AMP合成酶属于DacA类[7]。
c-di-AMP在细菌胞内可被c-di-AMP磷酸二酯酶分解为pApA。最早发现的具有c-di-AMP磷酸二酯酶活性的蛋白是YybT,后被命名为GdpP (GGDEF domain protein containing phosphodiesterase),是既含有GGDEF结构又具有磷酸二酯酶活性的蛋白[24-25]。GdpP蛋白含有2个跨膜结构域、1个PAS信号感受结构域、1个GGDEF结构域和1个DHH-DHHA1[26-27]。GdpP的磷酸二酯酶活性主要依赖其含有的DHH-DHHA1结构域,可以将c-di-AMP水解成pApA[28]。变异链球菌的c-di-AMP磷酸二酯酶具有GdpP蛋白相似的结构[7]。c-di-AMP的磷酸二酯酶缺失使合成的c-di-AMP无法分解而在细菌细胞内积累。同一个细菌体内可能含有多个具有c-di-AMP磷酸二酯酶活性的蛋白质[29]。目前发现的c-di-AMP磷酸二酯酶活性的蛋白质除了GdpP之外还有只含有DHH-DHHA1的蛋白质,进一步证明了DHH-DHHA1是c-di-AMP磷酸二酯酶的活性结构域。此外,也有个别c-di-AMP磷酸二酯酶只含有1个信号感受结构域和1个DHH-DHHA1结构域[6]。近期研究者在单核细胞增生李斯特菌中发现了一种新的c-di-AMP水解酶,其含有1个新的活性结构域——PgpH[30]。PgpH可与c-di-AMP结合并将c-di-AMP水解,PgpH水解c-di-AMP的活性可以被另外一种核苷酸信号分子抑制——ppGpp。细菌c-di-AMP磷酸二酯酶可将c-di-AMP的含量维持在一个平衡状态,c-di-AMP磷酸二酯酶缺失可造成c-di-AMP在细菌细胞内积累,影响细菌生物被膜的形成。除此之外,研究发现结核分枝杆菌的Rv2837c能够降解c-di-AMP、c-di-GMP、3′3′-cGAMP与2′3′-cGAMP的磷酸二酯酶,并且与结核分枝杆菌的致病性密切相关[31],此种可以降解多种环状核苷酸信号分子的磷酸二酯酶尚属首次发现。
1.2 c-di-AMP的受体蛋白与其他核苷酸信号分子一样,c-di-AMP的调控需要其受体蛋白的参与。当细菌感受到周围环境变化所带来的刺激时,可通过调控其c-di-AMP合成酶和水解酶来控制细胞内的c-di-AMP水平。不同的胞内c-di-AMP可被c-di-AMP的受体蛋白感知而引起下游分子活动的变化,从而实现c-di-AMP的信号传导。因此,研究c-di-AMP的受体蛋白对了解c-di-AMP调控细菌生理活动的作用机制至关重要。第一个被发现的c-di-AMP受体蛋白是耻垢分枝杆菌Mycobacterium smegmatis中一个属于TetR家族的转录因子DarR[32]。在耻垢分枝杆菌中c-di-AMP可与DarR结合,不仅可调控其自身的转录,还可与中链脂肪酰基辅酶A合成酶基因的启动子结合,抑制中链脂肪酰基辅酶A合成酶基因的转录,影响耻垢分枝杆菌的脂肪酸合成[32]。目前发现最多的c-di-AMP受体蛋白是与钾离子转运密切相关的KtrA蛋白。KtrA是枯草芽孢杆菌中钾离子转运系统的重要组成蛋白,由RCK_N和RCK_C两个结构域组成,其RCK_C结构域可与c-di-AMP特异性结合[33]。
近期研究发现,在肺炎链球菌中Trk家族钾离子转运蛋白CabP (SPD_0077) 可与另一个Trk家族钾离子转运蛋白SPD_0076结合,促进钾离子的细胞内转运。细胞中的c-di-AMP又可与CabP结合,阻碍CabP与SPD_0077的结合,从而影响细菌对钾离子的摄取[18],提示c-di-AMP可能在肺炎链球菌摄取钾离子的过程中存在一定的调节作用。离子转运对细菌的生存极为重要,可帮助细菌适应环境中渗透压变化,调控细胞内酶活性和酸碱平衡,保持一个适当的细胞膜位势。c-di-AMP信号通路与离子平衡间的关系提示该分子对细菌生存至关重要。PstA是在金黄色葡萄球菌中发现的一种c-di-AMP受体蛋白,它是一种PII样信号转导蛋白,是参与碳和氮代谢的重要因子[34]。因此,揭示了c-di-AMP可能参与细菌生命活动极为重要的碳氮代谢活动的调节。
1.3 c-di-AMP与核糖开关核糖开关是一类能够应答配体浓度变化,从而调控基因表达的mRNA元件。ydaO核糖开关通常与细菌细胞壁代谢、渗透压适应性以及细菌芽胞形成有关[35]。Nelson等发现c-di-AMP可与ydaO mRNA紧密结合,ydaO mRNA结构中M1、M2、M3、M4和M5位点上的核苷酸是影响ydaO mRNA与c-di-AMP结合的关键位点[36-37]。c-di-AMP与ydaO核糖开关的结合可调控基因的表达,进而参与调控细菌的多种生物活动,如放线细菌的细胞壁代谢、蓝藻细菌渗透保护剂的合成以及芽孢杆菌芽孢的形成等[36]。c-di-AMP核糖开关受体的发现,进一步丰富了c-di-AMP调控细菌基因表达的分子机制。
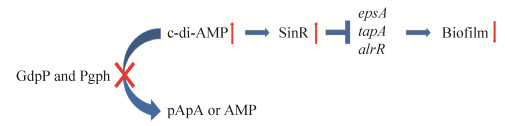
2 c-di-AMP与细菌生物被膜c-di-AMP与细菌生物被膜的关系最早发现于对金黄色葡萄球菌耐药性的研究。研究者发现c-di-AMP降解酶突变可引起金黄色葡萄球菌细胞壁肽聚糖的合成受阻,造成细菌耐药性降低,并显著促进了金黄色葡萄球菌的生物被膜形成[5-6]。Gundlach等研究发现,c-di-AMP在细菌中的积累可促进枯草芽孢杆菌中SinR基因的表达,抑制生物被膜形成相关基因epsA、tapA和slrR,从而抑制其生物被膜的形成(图 1)[8]。
|
| 图 1 c-di-AMP调控枯草芽孢杆菌生物被膜的形成 Figure 1 c-di-AMP regulates biofilm formation in Bacillus subtilis. |
| |
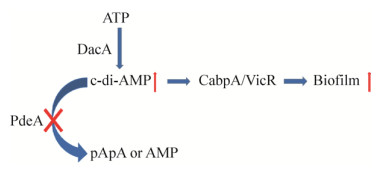
笔者近期研究发现,变异链球菌c-di-AMP合成酶缺陷可降低细胞内c-di-AMP水平,c-di-AMP磷酸二酯酶PdeA缺陷可导致c-di-AMP在细胞内积累。变异链球菌细胞内c-di-AMP水平参与调控细菌细胞外多糖合成酶主要编码基因gtfB的表达,进而影响其生物被膜形成。CabPA (Cyclic di-AMP binding protein A,CabPA)和CabPB (Cyclic di-AMP binding protein B,CabPB)是变异链球菌的c-di-AMP结合蛋白,都属于Trk家族钾离子转运蛋白。c-di-AMP/CabPA与VicR复合体相互作用,特异性调控变异链球菌葡糖基转移酶GtfB的表达,影响其细胞外多糖的合成以及生物被膜的形成。变异链球菌在果蝇中定殖依赖于其生物被膜的形成,c-di-AMP促进变异链球菌的生物被膜形成有利于变异链球菌在果蝇体内定殖。细胞内c-di-AMP含量减少可以抑制变异链球菌的生物被膜形成能力从而降低其对大鼠的致龋毒力(图 2)[7, 20]。
|
| 图 2 c-di-AMP调控变异链球菌生物被膜的形成 Figure 2 c-di-AMP regulates biofilm formation of Streptococcus mutans. |
| |
综上所述,研究发现在枯草芽孢杆菌中c-di-AMP通过强调控性蛋白SinR的表达而抑制下游基因的表达,从而抑制枯草芽孢杆菌的生物被膜的形成(图 1)。在变异链球菌中,c-di-AMP通过参与下游受体蛋白CabpA与调控蛋白VicR的结合,可能影响VicR与葡糖基转移酶gtfB启动子区域的结合能力而影响变异链球菌生物被膜形成,进而影响细菌的致病毒力(图 2)。值得注意的是,有研究指出c-di-AMP在金黄色葡萄球菌中的积累能促进其生物被膜的形成[5],但具体机制仍有待研究。因此,尽管通过调节c-di-AMP在细胞内的含量可影响细菌生物被膜的形成,但其对生物被膜调控的结果有可能截然相反。c-di-AMP对细菌调控作用的多样性有待进一步深入研究。
3 展望近年来关于c-di-AMP对生物被膜的调控作用受到了学者们的广泛重视,其作用分子机制也正被逐渐揭示。c-di-AMP作为多数革兰氏阳性细菌的必需信号分子,调控细菌生理功能及其毒力因子的研究正如火如荼。c-di-AMP参与了核糖开关的调控,有望成为c-di-AMP调控生物被膜形成的新机制[38]。c-di-AMP及其相关分子有望成为抗生物被膜药物研发的潜在靶点[39],为抗细菌生物被膜感染提供新的思路和有效策略。
| [1] | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science, 1999, 284(5418): 1318–1322. DOI: 10.1126/science.284.5418.1318 |
| [2] | Jenal U, Reinders A, Lori C. Cyclic di-GMP: second messenger extraordinaire. Nat Rev Microbiol, 2017, 15(5): 271–284. DOI: 10.1038/nrmicro.2016.190 |
| [3] | Hickman JW, Tifrea DF, Harwood CS. A chemosensory system that regulates biofilm formation through modulation of cyclic diguanylate levels. Proc Natl Acad Sci USA, 2005, 102(40): 14422–14427. DOI: 10.1073/pnas.0507170102 |
| [4] | Serra DO, Richter AM, Klauck G, et al. Microanatomy at cellular resolution and spatial order of physiological differentiation in a bacterial biofilm. mBio, 2013, 4(2): e00103–13. |
| [5] | Corrigan RM, Abbott JC, Burhenne H, et al. c-di-AMP is a new second messenger in Staphylococcus aureus with a role in controlling cell size and envelope stress. PLoS Pathog, 2011, 7(9): e1002217. DOI: 10.1371/journal.ppat.1002217 |
| [6] | Corrigan RM, Gründling A. Cyclic di-AMP: another second messenger enters the fray. Nat Rev Microbiol, 2013, 11(8): 513–524. DOI: 10.1038/nrmicro3069 |
| [7] | Peng X, Zhang Y, Bai GC, et al. Cyclic di-AMP mediates biofilm formation. Mol Microbiol, 2016, 99(5): 945–959. DOI: 10.1111/mmi.13277 |
| [8] | Gundlach J, Rath H, Herzberg C, et al. Second messenger signaling in Bacillus subtilis: accumulation of cyclic di-AMP inhibits biofilm formation. Front Microbiol, 2016, 7: 804. |
| [9] | Gries CM, Bruger EL, Moormeier DE, et al. Cyclic di-AMP released from Staphylococcus aureus biofilm induces a macrophage type Ⅰ interferon response. Infect Immun, 2016, 84(12): 3564–3574. DOI: 10.1128/IAI.00447-16 |
| [10] | R mling U. Great times for small molecules: c-di-AMP, a second messenger candidate in bacteria and archaea. Sci Signal, 2008, 1(33): pe39. |
| [11] | Antunes LCM, Ferreira RBR, Buckner MMC, et al. Quorum sensing in bacterial virulence. Microbiology, 2010, 156(8): 2271–2282. DOI: 10.1099/mic.0.038794-0 |
| [12] | Kalia D, Merey G, Nakayama S, et al. Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis. Chem Soc Rev, 2013, 42(1): 305–341. DOI: 10.1039/C2CS35206K |
| [13] | Bai YL, Yang J, Zhou X, et al. Mycobacterium tuberculosis Rv3586 (DacA) is a diadenylate cyclase that converts ATP or ADP into c-di-AMP. PLoS ONE, 2012, 7(4)–e35206. |
| [14] | Chukkapalli SS, Rivera MF, Velsko IM, et al. Invasion of oral and aortic tissues by Oral Spirochete Treponema denticola in ApoE-/- mice causally links periodontal disease and Atherosclerosis. Infect Immun, 2014, 82(5): 1959–1967. DOI: 10.1128/IAI.01511-14 |
| [15] | Abdul-Sater AA, Tattoli I, Jin L, et al. Cyclic-di-GMP and cyclic-di-AMP activate the NLRP3 inflammasome. EMBO Rep, 2013, 14(10): 900–906. DOI: 10.1038/embor.2013.132 |
| [16] | Ammann TW, Belibasakis GN, Thurnheer T. Impact of early colonizers on in vitro subgingival biofilm formation. PLoS ONE, 2013, 8(12)–e83090. |
| [17] | Bai YL, Yang J, Eisele LE, et al. Two DHH subfamily 1 proteins in Streptococcus pneumoniae possess cyclic di-AMP phosphodiesterase activity and affect bacterial growth and virulence. J Bacteriol, 2013, 195(22): 5123–5132. DOI: 10.1128/JB.00769-13 |
| [18] | Bai YL, Yang J, Zarrella TM, et al. Cyclic di-AMP impairs potassium uptake mediated by a c-di-AMP binding protein in Streptococcus pneumoniae. J Bacteriol, 2014, 196(3): 614–623. DOI: 10.1128/JB.01041-13 |
| [19] | Cheng XQ, Zheng X, Zhou XD, et al. Regulation of oxidative response and extracellular polysaccharide synthesis by a diadenylate cyclase in Streptococcus mutans. Environ Microbiol, 2016, 18(3): 904–922. DOI: 10.1111/1462-2920.13123 |
| [20] | Peng X, Michalek S, Wu H. Effects of diadenylate cyclase deficiency on synthesis of extracellular polysaccharide matrix of Streptococcus mutans revisit. Environ Microbiol, 2016, 18(11): 3612–3619. DOI: 10.1111/1462-2920.13440 |
| [21] | Commichau FM, Dickmanns A, Gundlach J, et al. A jack of all trades: the multiple roles of the unique essential second messenger cyclic di-AMP. Mol Microbiol, 2015, 97(2): 189–204. DOI: 10.1111/mmi.2015.97.issue-2 |
| [22] | Pham TH, Liang ZX, MarcellinE, et al. Replenishing the cyclic-di-AMP pool: regulation of diadenylate cyclase activity in bacteria. Curr Genet, 2016, 62(4): 731–738. DOI: 10.1007/s00294-016-0600-8 |
| [23] | Du B, Ji WH, An HT, et al. Functional analysis of c-di-AMP phosphodiesterase, GdpP, in Streptococcus suis serotype 2. Microbiol Res, 2014, 169(9/10): 749–758. |
| [24] | Ebensen T, Libanova R, Schulze K, et al. Bis-(3′, 5′)-cyclic dimeric adenosine monophosphate: strong Th1/Th2/Th17 promoting mucosal adjuvant. Vaccine, 2011, 29(32): 5210–5220. DOI: 10.1016/j.vaccine.2011.05.026 |
| [25] | Tan E, Rao F, Pasunooti S, et al. Solution structure of the PAS domain of a thermophilic YybT protein homolog reveals a potential ligand-binding site. J Biol Chem, 2013, 288(17): 11949–11959. DOI: 10.1074/jbc.M112.437764 |
| [26] | Haririan H, Andrukhov O, Bertl K, et al. Microbial analysis of subgingival plaque samples compared to that of whole saliva in patients with periodontitis. J Periodontol, 2014, 85(6): 819–828. DOI: 10.1902/jop.2013.130306 |
| [27] | Zhou J, Sayre DA, Zheng Y, et al. Unexpected complex formation between coralyne and cyclic diadenosine monophosphate providing a simple fluorescent turn-on assay to detect this bacterial second messenger. Anal Chem, 2014, 86(5): 2412–2420. DOI: 10.1021/ac403203x |
| [28] | Hengge R. Principles of c-di-GMP signalling in bacteria. Nat Rev Microbiol, 2009, 7(4): 263–273. DOI: 10.1038/nrmicro2109 |
| [29] | Huynh TA, Woodward NJJ. Too much of a good thing: regulated depletion of c-di-AMP in the bacterial cytoplasm. Curr Opin Microbiol, 2016, 30: 22–29. DOI: 10.1016/j.mib.2015.12.007 |
| [30] | Huynh TN, Luo SK, Pensinger D, et al. An HD-domain phosphodiesterase mediates cooperative hydrolysis of c-di-AMP to affect bacterial growth and virulence. Proc Natl Acad Sci USA, 2015, 112(7): E747–E756. DOI: 10.1073/pnas.1416485112 |
| [31] | He Q, Wang F, Liu SH, et al. Structural and biochemical insight into the mechanism of Rv2837c from Mycobacterium tuberculosis as a c-di-NMP Phosphodiesterase. J Biol Chem, 2016, 291(7): 3668–3681. DOI: 10.1074/jbc.M115.699801 |
| [32] | Zhang L, Li WH, He ZG. DarR, a TetR-like transcriptional factor, is a cyclic-di-AMP responsive repressor in Mycobacterium smegmatis. J Biol Chem, 2013, 288(5): 3085–3096. DOI: 10.1074/jbc.M112.428110 |
| [33] | Corrigan RM, Campeotto I, Jeganathan T, et al. Systematic identification of conserved bacterial c-di-AMP receptor proteins. Proc Natl Acad Sci USA, 2013, 110(22): 9084–9089. DOI: 10.1073/pnas.1300595110 |
| [34] | Campeotto I, Zhang Y, Mladenov MG, et al. Complex structure and biochemical characterization of the Staphylococcus aureus cyclic diadenylate monophosphate (c-di-AMP)-binding protein PstA, the founding member of a new signal transduction protein family. J Biol Chem, 2015, 290(5): 2888–2901. DOI: 10.1074/jbc.M114.621789 |
| [35] | Ren AM, Patel DJ. c-di-AMP binds the ydaO riboswitch in two pseudo-symmetry-related pockets. Nat Chem Biol, 2014, 10(9): 780–786. DOI: 10.1038/nchembio.1606 |
| [36] | Nelson JW, Sudarsan N, Furukawa K, et al. Riboswitches in eubacteria sense the second messenger c-di-AMP. Nat Chem Biol, 2013, 9(12): 834–839. DOI: 10.1038/nchembio.1363 |
| [37] | Gao A, Serganov A. Structural insights into recognition of c-di-AMP by the ydaO riboswitch. Nat Chem Biol, 2014, 10(9): 787–792. DOI: 10.1038/nchembio.1607 |
| [38] | Meehan RE, Torgerson CD, Gaffney BL, et al. Nuclease-resistant c-di-AMP derivatives that differentially recognize RNA and protein receptors. Biochemistry, 2016, 55(6): 837–849. DOI: 10.1021/acs.biochem.5b00965 |
| [39] | Zheng Y, Zhou J, Cooper Jr SM, et al. Structure-activity relationship studies of c-di-AMP synthase inhibitor, bromophenol-thiohydantoin. Tetrahedron, 2016, 72(25): 3554–3558. DOI: 10.1016/j.tet.2015.10.073 |
 2017, Vol. 33
2017, Vol. 33