中国科学院微生物研究所、中国微生物学会主办
文章信息
- 于珊, 张妙坤, 马旅雁
- Shan Yu, Miaokun Zhang, Luyan Ma
- 乳酸锌和氟化亚锡对铜绿假单胞菌、鲍曼不动杆菌和变异链球菌生物被膜的抑制作用
- Anti-biofilm effects of Zn lactate·3H2O and SnF2 on Pseudomonas aeruginosa, Acinetobacter baumannii and Streptococcus mutans
- 生物工程学报, 2017, 33(9): 1478-1488
- Chinese Journal of Biotechnology, 2017, 33(9): 1478-1488
- 10.13345/j.cjb.170141
-
文章历史
- Received: April 5, 2017
- Accepted: June 12, 2017
2 中国科学院大学, 北京 100049
2 University of Chinese Academy of Sciences, Beijing 100049, China
生物被膜(Biofilm)是指单细胞微生物通过粘附于介质表面,分泌胞外多聚基质(胞外多糖、蛋白、DNA等),将其自身包绕其中而成的膜样微生物细胞聚集物[1]。铜绿假单胞菌和鲍曼不动杆菌都是易形成生物被膜的条件致病菌[2-3],其造成的感染通常与形成生物被膜后大幅升高的抗生素抗性相关[4-5],因而被作为研究生物被膜的模式菌株。牙菌斑是生物被膜的一种,是一个以细菌为主定殖于牙面的微生态坏境,是细菌在牙面上生存、代谢、致病的具体环境[6]。在一定条件下,细菌及其产物会对牙体和牙周组织产生破坏,导致口腔感染性疾病[7]。牙齿硬组织长期暴露在如链球菌属、乳酸菌属或放线菌属等致龋细菌产生的酸性产物下就会造成龋齿的发生[7-9]。变异链球菌既产酸又耐酸,定殖在牙齿上后会引起珐琅质的去矿化作用[10]。尤其是,变异链球菌还具有较强的生物被膜的形成能力,因此,被认为是造成龋齿的主要病因之一[11]。有效地抑制这些病原菌的生长及生物被膜的产生是防治和治疗龋齿的关键手段[12]。
锌盐可以置换磷酸钙中的钙,抑制牙垢的生成,对口腔粘膜和牙周组织具有收敛作用[13],锌离子还具有出色的抗菌能力,不仅可以抑制牙菌斑细菌的产酸,还可以预防口臭的产生[13-14];亚锡可通过降低牙釉质在酸中的溶解度和增强釉质再矿化预防龋齿发生[15-18]。有关的原位研究表明,锌离子与氟联用,可以增加矿物质在牙齿的沉淀,显著降低牙齿的去矿化作用,而这种效果在仅仅应用氟的实验组中并未观察到[19]。因而锌离子、亚锡离子与氟经常作为活性物质加入到牙膏中。由于锌离子、亚锡离子与氟这些活性物质对生物被膜的影响及其相应作用机理尚不明确,本研究检测了乳酸锌(Zn lactate·3H2O)和氟化亚锡(SnF2)对最常用于生物被膜研究的模式菌株铜绿假单胞菌、条件致病菌鲍曼不动杆菌和引起龋齿的主要细菌变异链球菌生物被膜形成能力的影响,发现两种化合物对生物被膜的形成均具有明显的抑制作用,且两种化合物联用可以使生物被膜几乎不能形成。该研究结果揭示了乳酸锌和氟化亚锡的作用机理,并暗示了这些化合物用于抑制生物被膜形成的可能应用前景。
1 材料与方法 1.1 菌株、培养基及培养条件本研究所选用的菌株为铜绿假单胞菌Pseudomonas aeruginosa的模式菌株PAO1、鲍曼不动杆菌杆菌Acinetobacter baumannii ATCC 19606和变异链球菌Streptococcus mutans UA159;实验所用培养基配方如下:
LB培养基(1 L):胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g;
Jensen’s培养基(1 L):NaCl 5 g,K2HPO4 3.286 g,谷氨酸15.56 g,缬氨酸2.81 g,苯丙氨酸1.32 g;葡萄糖277.4 g,MgSO4·7H2O 0.33 g,CaCl2 0.021 g,FeSO4 0.001 1 g,ZnSO4 0.002 4 g;
LBNS培养基(1 L):胰蛋白胨10 g,酵母提取物5 g;
BHI培养基(1 L):脑心浸液37 g,蔗糖10 g。
铜绿假单胞菌的菌液于37 ℃培养于LB培养基中,生物被膜于30 ℃静置培养于LB或Jensen’s培养基;鲍曼不动杆菌于37 ℃培养于LB培养基;变异链球菌于37 ℃培养于BHI培养基。
1.2 主要试剂Zn lactate·3H2O与SnF2由宝洁公司提供;菌细胞用DNA染料SYTO9购自Invitrogen公司,Psl多糖染料TRITC-HHA购自EY LABORATORIES公司。
1.3 96孔板中生物被膜的形成能力检测本实验参照Ma等的方法[20]进行,具体实验步骤简述如下:将菌株的过夜培养液以1%体积接种于96孔微量滴定板中(Falcon 3911),于30 ℃或37 ℃静置培养24 h,用生理盐水将游离及松散吸附的菌细胞洗脱,随即用0.1%的结晶紫对小孔内牢固吸附的菌细胞染色30 min,最后30%乙酸溶解并用分光光度计读取A560值。
1.4 生物被膜的抑制及瓦解实验在生物被膜抑制实验中,Zn lactate·3H2O与SnF2在接种时即添加入培养基中;在生物被膜瓦解实验中,生物被膜于培养基中长成后,将培养基更换为含有Zn lactate·3H2O与SnF2的新鲜培养基再处理一段时间,Zn lactate·3H2O与SnF2的工作浓度分别为2 mmol/L和2.5 mmol/L。生物被膜在96孔板、24孔板及4孔玻璃小室中的培养时间均为24 h。
1.5 铜绿假单胞菌气液交界面形成菌膜的图像获取与分析气液交界面形成的菌膜参照Wang等的方法[21]于24孔板及1 cm×1 cm×4 cm大小的4孔玻璃小室(Chambered #1.5 German Coverglass System, Nunc Inc.)中经24 h静置培养而成。24孔板中形成的菌膜分别由相机Nikon COOLPIX P500及体视显微镜Nikon MODEL C-DSS230观察拍摄。
进行激光共聚焦显微镜观察前,生物被膜中的菌细胞用DNA染料SYTO9标记;Psl多糖用100 μg/mL荧光标记凝集素TRITC-HHA染色[22],荧光图片由激光共聚焦显微镜FV1000 (Olympus, Japan)摄取,并应用COMSTAT软件对生物被膜的生物量和厚度进行定量计算。
2 结果与分析 2.1 乳酸锌(Zn lactate·3H2O)和氟化亚锡(SnF2)对铜绿假单胞菌96孔板中生物被膜形成的抑制本研究将Zn lactate·3H2O和SnF2两种化合物分别或共同加入到LBNS培养基中,以未添加化合物的培养基为对照,检测其对铜绿假单胞菌PAO1在96孔板中于4 h、8 h及24 h时所形成生物被膜生物量的影响。结果如图 1所示,两种化合物在实验所测时间均对PAO1的生物被膜形成具有明显的抑制作用,单一添加入培养基中时两种化合物的抑制能力相当。同时添加两种化合物的实验组对PAO1生物被膜的抑制最强,几乎不随时间的延长而增加,24 h的生物量与对照组和单一化合物实验组相比呈现出明显的抑制作用。
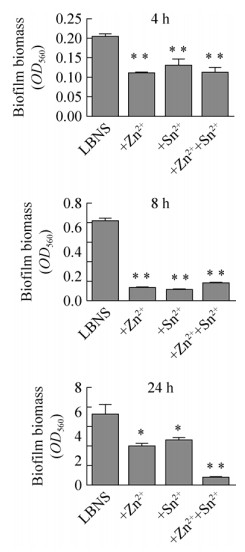
|
| 图 1 Zn lactate·3H2O与SnF2对铜绿假单胞菌PAO1在96孔板中4 h、8 h及24 h形成生物被膜的抑制(*P < 0.05; **P < 0.01) Figure 1 Zn lactate·3H2O and SnF2 reduced 4 h, 8 h and 24 h biofilm formation of PAO1 in 96-well Micro-titer Dish (*P < 0.05; **P < 0.01). |
| |
铜绿假单胞菌在静置培养时,在气液交界面形成的一种生物被膜称为“菌膜(Pellicle)”。本研究进一步检测了两种化合物对铜绿假单胞菌PAO1在24孔板中形成的菌膜的抑制效果,肉眼直接观察及体视显微镜的观察结果如图 2所示。单独添加Zn lactate·3H2O或SnF2即可明显抑制气液交界面生物被膜的形成,呈现为具有更高透光性的更薄的菌膜,且易在处理时破碎。而加入两种化合物的LBNS培养基中几乎不能形成菌膜,提示Zn lactate·3H2O与SnF2的联用可以清除PAO1菌膜的形成。

|
| 图 2 Zn lactate·3H2O与SnF2对PAO1在24孔板中形成的菌膜的抑制 Figure 2 Zn lactate·3H2O and SnF2 reduced pellicle formation of PAO1 in 24-well plate. Left: camera image of pellicles; right: stereomicroscope image of pellicles. |
| |
通过绿色荧光标记铜绿假单胞菌菌细胞的方法,研究进一步利用激光共聚焦显微镜观察了Zn lactate·3H2O与SnF2对PAO1形成的24 h菌膜生物量的影响,实验结果如图 3所示。培养基中添加2.5 mmol/L的Zn lactate·3H2O所形成的菌膜结构松散,荧光强度较弱,但对荧光信号的计算结果并未显示出菌膜生物量的下降;而添加了2 mmol/L SnF2的LBNS培养基中的菌膜生物量显著降低,仅为对照组的1/4左右;在添加了两种化合物的实验组中则几乎不能观察到菌膜细胞,与之前的结果相一致——Zn lactate·3H2O与SnF2联用可完全抑制PAO1的生物被膜的形成。

|
| 图 3 激光共聚焦显微镜观察Zn lactate·3H2O与SnF2对PAO1生物被膜形成的影响(绿色荧光信号为DNA染料SYTO9标记的铜绿假单胞菌细胞) Figure 3 Zn lactate·3H2O and SnF2biofilm inhibition effect of PAO1 observed by CLSM. Green fluorescent signal: Pseudomonas aeruginosa cells stained by DNA dye SYTO9. |
| |
为进一步阐释Zn lactate·3H2O与SnF2两种化合物对铜绿假单胞菌PAO1生物被膜的抑制机理,本研究用绿色荧光标记菌细胞,红色荧光标记胞外多糖Psl,在激光共聚焦显微镜下观察两种化合物对胞外多糖基质网结构的影响,结果如图 4所示。乳酸锌的添加使PAO1的Psl多糖基质网更为疏松,且显示为较弱的红色荧光信号,虽然乳酸锌的添加并不能减少生物被膜的生物量(图 3),但通过对图 4荧光信号的统计学分析发现,在Zn lactate·3H2O的作用下,每细胞所产生的Psl多糖的产量减少至对照组的1/15;氟化亚锡除了能明显抑制生物被膜的形成外(图 3),还明显改变了Psl多糖基质网的空间结构。与对照组相比,菌株丧失了形成典型3D蜘蛛网状Psl多糖网的能力,结构松散且不规则(图 4);而两种化合物联用则在镜下完全观察不到Psl多糖信号和菌细胞的存在。

|
| 图 4 激光共聚焦显微镜观察Zn lactate·3H2O与SnF2对PAO1菌膜中Psl多糖基质网的影响(绿色荧光信号为DNA染料SYTO9标记的铜绿假单胞菌细胞;红色荧光信号为荧光标记凝集素TRITC-HHA染色Psl多糖基质网) Figure 4 Zn lactate·3H2O and SnF2 effect on Psl matrix observed by CLSM. Green fluorescent signal: Pseudomonas aeruginosa cells stained by DNA dye SYTO9. Red fluorescent signal: Psl matrix stained by TRITC-HHA. |
| |
Zn lactate·3H2O与SnF2两种化合物都对铜绿假单胞菌PAO1的生物被膜形成有明显的抑制作用,那么其是否对已经形成的生物被膜具有瓦解作用呢?本研究于96孔板Jensen’s培养基中长成的生物被膜中,将培养基更换为添加了两种化合物的新鲜培养基并继续作用一段时间后,观察其对生物被膜生物量的影响。结果如图 5所示,除了开始0.5 h内,2 mmol/L的SnF2可使已形成的生物被膜的生物量稍稍降低一点以外,在长达24 h的作用期间,未观察到两种化合物对PAO1的生物被膜具有瓦解作用。

|
| 图 5 Zn lactate·3H2O与SnF2对PAO1生物被膜的瓦解作用(*P < 0.05) Figure 5 Zn lactate·3H2O and SnF2biofilm dispersion effect of PAO1 (*P < 0.05). |
| |
为了解乳酸锌和氟化亚锡是可形成生被膜的革兰氏阴性细菌鲍曼不动杆菌和革兰氏阳性细菌变异链球菌生物被膜的作用,分别在96孔板中进行了对这两种细菌24 h生物被膜的抑制与降解实验,结果图 6所示,两种化合物对其生物被膜的形成均有明显的抑制作用(图 6),而不具瓦解其生物被膜能力。

|
| 图 6 Zn lactate·3H2O与SnF2对96孔板中鲍曼不动杆菌(A)和变异链球菌(B)形成生物被膜的抑制与瓦解作用(Zn lactate·3H2O与SnF2对96孔板中鲍曼不动杆菌(A)和变异链球菌形(B)成生物被膜的抑制作用;Zn lactate·3H2O与SnF2对96孔板中鲍曼不动杆菌(C)和变异链球菌(D)形成生物被膜0.5 h和24 h的瓦解作用(*P < 0.05; **P < 0.01)) Figure 6 Zn lactate·3H2O and SnF2 biofilm inhibition and dispersal effect on Acinetobacter baumannii and Streptococcusmutans. Zn lactate·3H2O and SnF2 biofilm inhibition effect on Acinetobacter baumannii (A) and Streptococcus mutans (B); Zn lactate·3H2O and SnF2 biofilm dispersal effect on Acinetobacter baumannii (C) and Streptococcus mutans (D) at 0.5 h or 24 h (*P < 0.05; **P < 0.01). |
| |
为进一步探求工作浓度的乳酸锌和氟化亚锡对铜绿假单胞菌、鲍曼不动杆菌和变异链球菌生物被膜形成的抑制作用是否是因为同时抑制了细菌生长所造成的,研究检测了在培养时间为24 h时3种细菌的OD600值。结果如图 7所示,实验所采取的两种化合物的工作浓度添加入培养基后,对3种细菌的生长均起到了明显的抑制作用,其中两种物质联用对生长的抑制作用最强。实验结果提示,对细菌生长的影响是其抑制生物被膜形成的主要因素。

|
| 图 7 Zn lactate·3H2O与SnF2对液体振荡培养的铜绿假单胞菌(A)鲍曼不动杆菌(B)和变异链球菌形(C) 24 h时的生长抑制作用(**P < 0.01) Figure 7 24 h growth inhibition effect on Pseudomonas aeruginosa (A), Acinetobacter baumannii (B) and Streptococcus mutans (C) by Zn lactate·3H2O and SnF2 (**P < 0.01). |
| |
通过近年来对牙菌斑生物被膜的大量深入研究,人们逐渐认识到牙菌斑生物被膜是存在于牙面或牙周袋内的一个细菌生态环境,是造成人类两大口腔疾病龋齿和牙周病的始动因子[23]。氟化物与牙齿接触后,可使牙齿组织中易被酸溶解的氢氧磷灰石形成不易溶的氟磷灰石,从而提高了牙齿的抗腐蚀能力,除了预防龋齿的功效外,还有较好的控制牙龈炎、减轻牙本质敏感的功能。此外,锌离子可以置换磷酸钙里的钙,抑制牙垢晶体的生长,从而防治牙垢的产生,因此常常在抗龋防敏牙膏中添加锌盐和亚锡离子。
本研究过对两种化合物Zn lactate·3H2O与SnF2对铜绿假单胞菌、鲍曼不动杆菌和变异链球菌生物被膜形成能力的影响检测发现,单一添加2.5 mmol/L的Zn lactate·3H2O或2 mmol/L的SnF2即对生物被膜的形成具有明显的抑制作用,而同时添加两种化合物即可完全消除生物被膜的产生,提示这两种化合物具有较大的清除生物被膜的应用潜力。
Psl多糖对于铜绿假单胞菌菌体的初始吸附、生物被膜结构的维持以及提供细胞与细胞间、细胞与介质表面的相互作用至关重要[20, 24-25],研究通过分别对生物被膜中的菌细胞和胞外多糖Psl进行荧光标记并用激光共聚焦显微镜观察,发现两种化合物可能存在对铜绿假单胞菌生物被膜的不同抑制机理:单一Zn lactate·3H2O作用的菌膜其胞外基质网中观测到单个细胞的Psl多糖合成量大大降低,几乎降至未处理组的1/45,提示Zn lactate·3H2O可能通过抑制胞外多糖合成或基质网的形成干扰生物被膜的发生;而SnF2作用的菌膜的生物量大幅降低为对照组的1/5,且胞外Psl多糖基质网的结构发生了明显的松散型改变。以上结果解释了两种化合物联用即可达到完全清除PAO1生物被膜形成的机制——SnF2明显减少生物被膜的生物量且形成形态疏松的Psl网络,而Zn lactate·3H2O大大减少了每个菌细胞的Psl的合成量,因此两者共用可起到双重作用,因而产生显著的清除效果。进一步的检测显示,这两种化合物对铜绿假单胞菌的生长也有抑制作用,且两种化合物联用时的抑制作用最为显著。因此,Zn lactate·3H2O与SnF2对铜绿假单胞菌生物被膜的影响可能是通过改变多糖基质网的结构及对菌体生长的抑制作用的共同结果。
变异链球菌是口腔主要的致龋齿菌之一,常见于牙菌斑中,可通过代谢产生的酸性物质导致龋齿的发生。鲍曼不动杆菌是医院感染的重要病原菌。近年来的感染在增多,且其耐药性日益严重,已引起临床和微生物学者的严重关注。本研究发现添加Zn lactate·3H2O与SnF2对这两种细菌形成的生物被膜也有明显的抑制作用。但同铜绿假单胞菌一样,两种化合物对其已经形成的生物被膜的瓦解作用并不显著,可能由于外源添加较高浓度的乳酸锌和氟化亚锡的不利环境使菌细胞更倾向于停留在生物被膜内受到保护,而并非游离出来。只有0.5 h内2 mmol/L的SnF2作用下可使铜绿假单胞菌PAO1已形成的生物被膜的生物量略有下降,而牙膏在口腔内的作用时间通常较短,并伴以剧烈的物理刷洗过程,因此SnF2也可能具备一定的清除口腔生物被膜的潜质。锌离子和锡离子均有报道认为其有潜在的抗菌活性[26],而氟离子则是通过使牙齿矿化坚硬而起到抗敏和预防龋齿的作用[27],因此实验中两种化合物对细菌生长和生物被膜的抑制应是锌锡两种离子的应用效果。本研究认为,在牙膏中外源添加Zn lactate·3H2O与SnF2具有对抗牙菌斑生物被膜造成的口腔疾病的潜在应用价值,且工作浓度的乳酸锌和氟化亚锡的应用亦可在临床生物被膜防治中发挥作用。
| [1] | Karatan E, Watnick P. Signals, regulatory networks, and materials that build and break bacterial biofilms. Microbiol Mol Biol Rev, 2009, 73(2): 310–347. DOI: 10.1128/MMBR.00041-08 |
| [2] | Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis, 2002, 8(9): 881–890. DOI: 10.3201/eid0809.020063 |
| [3] | Gurung J, Khyriem AB, Banik A, et al. Association of biofilm production with multidrug resistance among clinical isolates of Acinetobacter baumannii and Pseudomonas aeruginosa from intensive care unit. Indian J Crit Care Med, 2013, 17(4): 214–218. DOI: 10.4103/0972-5229.118416 |
| [4] | Hota S, Hirji Z, Stockton K, et al. Outbreak of multidrug-resistant Pseudomonas aeruginosa colonization and infection secondary to imperfect intensive care unit room design. Infect Control Hosp Epidemiol, 2009, 30(1): 25–33. DOI: 10.1086/592700 |
| [5] | La Forgia C, Franke J, Hacek DM, et al. Management of a multidrug-resistant Acinetobacter baumannii outbreak in an intensive care unit using novel environmental disinfection: a 38-month report. Am J Infect Control, 2010, 38(4): 259–263. DOI: 10.1016/j.ajic.2009.07.012 |
| [6] | Kensche A, Holder C, Basche S, et al. Efficacy of a mouthrinse based on hydroxyapatite to reduce initial bacterial colonisation in situ. Arch Oral Biol, 2017, 80: 18–26. DOI: 10.1016/j.archoralbio.2017.03.013 |
| [7] | Selwitz RH, Ismail AI, Pitts NB. Dental caries. Lancet, 2007, 369(9555): 51–59. DOI: 10.1016/S0140-6736(07)60031-2 |
| [8] | Bowden GH, Ekstrand J, McNaughton B, et al. The association of selected bacteria with the lesions of root surface caries. Oral Microbiol Immunol, 1990, 5(6): 346–351. DOI: 10.1111/omi.1990.5.issue-6 |
| [9] | Gross EL, Beall CJ, Kutsch SR, et al. Beyond Streptococcus mutans: dental caries onset linked to multiple species by, 16S rRNA community analysis. PLoS ONE, 2012, 7(10): e47722. DOI: 10.1371/journal.pone.0047722 |
| [10] | Marsh PD. Dental plaque as a biofilm and a microbial community-implications for health and disease. BMC Oral Health, 2006, 6(Suppl 1): S14. DOI: 10.1186/1472-6831-6-S1-S14 |
| [11] | Ho CSF, Ming Y, Foong KWC, et al. Streptococcus mutans forms xylitol-resistant biofilm on excess adhesive flash in novel ex-vivoorthodontic bracket model. Am J Orthod Dentofacial Orthop, 2017, 151(4): 669–677. DOI: 10.1016/j.ajodo.2016.09.017 |
| [12] | Wang YF, Fan YY, Zhou ZL, et al. De novo synthetic short antimicrobial peptides against cariogenic bacteria. Arch Oral Biol, 2017, 80: 41–50. DOI: 10.1016/j.archoralbio.2017.03.017 |
| [13] | Navada R, Kumari H, Le S, et al. Oral malodor reduction from a zinc-containing toothpaste. J Clin Dent, 2008, 19(2): 69–73. |
| [14] | Fatima T, Rahim ZBHA, Lin CW, et al. Zinc: a precious trace element for oral health care?. J Pak Med Assoc, 2016, 66(8): 1019–1023. |
| [15] | Ganss C, Lussi A, Grunau O, et al. Conventional and anti-erosion fluoride toothpastes: effect on enamel erosion and erosion-abrasion. Caries Res, 2011, 45(6): 581–589. DOI: 10.1159/000334318 |
| [16] | Huysmans MCDNJM, Jager DHJ, Ruben JL, et al. Reduction of erosive wear in situ by stannous fluoride-containing toothpaste. Caries Res, 2011, 45(6): 518–523. DOI: 10.1159/000331391 |
| [17] | Young A, Thrane PS, Saxegaard E, et al. Effect of stannous fluoride toothpaste on erosion-like lesions: an in vivo study. Eur J Oral Sci, 2006, 114(3): 180–183. DOI: 10.1111/eos.2006.114.issue-3 |
| [18] | Faller RV, Eversole SL, Tzeghai GE. Enamel protection: a comparison of marketed dentifrice performance against dental erosion. Am J Dent, 2011, 24(4): 205–210. |
| [19] | ten Cate JM. The caries preventive effect of a fluoride dentifrice containing Triclosan and zinc citrate, a compilation of in vitro and in situ studies. Int Dent J, 1993, 43(4 Suppl 1): 407–413. |
| [20] | Ma LY, Jackson KD, Landry RM, et al. Analysis of Pseudomonas aeruginosa conditional psl variants reveals roles for the psl polysaccharide in adhesion and maintaining biofilm structure postattachment. J Bacteriol, 2006, 188(23): 8213–8221. DOI: 10.1128/JB.01202-06 |
| [21] | Wang SW, Parsek MR, Wozniak DJ, et al. A spider web strategy of type Ⅳ pili-mediated migration to build a fibre-like Psl polysaccharide matrix in Pseudomonas aeruginosa biofilms. Environ Microbiol, 2013, 15(8): 2238–2253. DOI: 10.1111/emi.2013.15.issue-8 |
| [22] | Ma LY, Conover M, Lu HP, et al. Assembly and development of the Pseudomonas aeruginosa biofilm matrix. PLoS Pathog, 2009, 5(3): e1000354. DOI: 10.1371/journal.ppat.1000354 |
| [23] | Takahashi N, Washio J, Mayanagi G. Metabolomics of supragingival plaque and oral bacteria. J Dent Res, 2010, 89(12): 1383–1388. DOI: 10.1177/0022034510377792 |
| [24] | Yang L, Hu YF, Liu Y, et al. Distinct roles of extracellular polymeric substances in Pseudomonas aeruginosa biofilm development. Environ Microbiol, 2011, 13(7): 1705–1717. DOI: 10.1111/j.1462-2920.2011.02503.x |
| [25] | Ruer S, Stender S, Filloux A, et al. Assembly of fimbrial structures in Pseudomonas aeruginosa: functionality and specificity of chaperone-usher machineries. J Bacteriol, 2007, 189(9): 3547–3555. DOI: 10.1128/JB.00093-07 |
| [26] | Soares LG, Jonski G, Tinoco EMB, et al. Short-term effect of strontium-and zinc-containing toothpastes and mouthrinses on volatile sulphur compounds in morning breath: a randomized, double-blind, cross-over clinical study. Eur J Oral Sci, 2015, 123(2): 72–79. DOI: 10.1111/eos.2015.123.issue-2 |
| [27] | Orsini G, Procaccini M, Manzoli L, et al. A double-blind randomized-controlled trial comparing the desensitizing efficacy of a new dentifrice containing carbonate/hydroxyapatite nanocrystals and a sodium fluoride/potassium nitrate dentifrice. J Clin Periodontol, 2010, 37(6): 510–517. DOI: 10.1111/cpe.2010.37.issue-6 |
 2017, Vol. 33
2017, Vol. 33