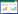中国科学院微生物研究所、中国微生物学会主办
文章信息
- 徐嫄, 邹兴启, 李翠, 朱元源, 何天慈, 杨延丽, 林旋, 宋艳民, 郑金来, 张松平, 赵启祖
- Xu Yuan, Zou Xingqi, Li Cui, Zhu Yuanyuan, He Tianci, Yang Yanli, Lin Xuan, Song Yanmin, Zheng Jinlai, Zhang Songping, Zhao Qizu
- 应用体积排阻色谱法测定口蹄疫灭活疫苗中的146S抗原含量
- Using size-exclusion chromatography to quantify the 146S antigen in inactivated foot-and-mouth disease vaccine
- 生物工程学报, 2018, 34(5): 676-684
- Chinese Journal of Biotechnology, 2018, 34(5): 676-684
- 10.13345/j.cjb.170392
-
文章历史
- Received: October 9, 2017
- Accepted: March 26, 2018
2 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190;
3 北京标驰泽惠生物科技有限公司,北京 102600
2 National Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
3 Beijing Biaochizehui Biological Technology Co. Ltd., Beijing 102600, China
口蹄疫(Foot-and-mouth disease,FMD)是传染性最强的家畜疫病之一。目前,我国对口蹄疫采取以灭活疫苗免疫为主的防控策略,使用的灭活疫苗以双相油乳剂疫苗为主,疫苗的质量对于口蹄疫的防控至关重要[1-2]。疫苗对动物的保护效果主要取决于两个方面,一是疫苗毒株与流行毒株的相似程度,二是疫苗中抗原的含量[3]。《中国兽药典》规定[2],口蹄疫灭活疫苗质量的最终评估标准是本动物免疫攻毒试验,该项检验必须使用抗体阴性的本动物,不仅试验费用昂贵,还涉及动物实验伦理问题[4]。而疫苗中有效抗原,即完整的病毒粒子(146S)的含量测定,是大型疫苗生产厂家和国际口蹄疫疫苗储备库控制疫苗中间生产过程的重要环节。国际上通用的测定146S抗原含量的方法是利用蔗糖或氯化铯密度梯度离心法,通过测定各个级份在259 nm的OD值,最终计算出抗原的浓度。该方法操作复杂,耗时较长,每次检测样品数量有限,且在操作过程中极易导致146S抗原的损失,结果的稳定性和重复性受较多因素影响,因此尚未标准化[5-7]。酶联免疫吸附试验(ELISA)因其灵敏度高、特异性强等优点,在146S抗原的测定中被广泛关注,但因该方法不具有通用性而受到局限[8-10]。因此,亟待应用更高效、经济的方法测定疫苗中146S的含量。体积排阻色谱技术是根据待测组分的分子大小进行分离的一种液相色谱技术,分离原理为凝胶色谱柱的分子筛机制。样品进入色谱柱后,不同组分按其分子大小进入相应孔内,大分子因不能进入颗粒内部,在色谱柱中滞留时间短,先于小分子被流动相洗脱至柱外,通过这种分子筛效应,各组分从大到小依次被洗脱。体积排阻色谱技术常用于生物大分子的分离和纯化。Spitteler等[6]和杨延丽等[10]均使用体积排阻色谱法对灭活的口蹄疫病毒液中的146S抗原进行检测,认为该技术在疫苗生产工艺研究和质量控制中均具有应用前景。Vajda等[11]应用该技术分离了3株流感病毒,并通过红细胞凝聚活性测定进行了验证。本研究首次将高效液相体积排阻色谱技术应用于口蹄疫灭活疫苗中146S抗原含量的测定,通过方法学考察,证明了该方法具有准确、高效等优势,初步建立了一种新的口蹄疫灭活疫苗中146S抗原含量的高效液相色谱检测方法,为口蹄疫灭活疫苗质量评价提供了一种更加快速、高效的新技术。
1 材料与方法 1.1 主要仪器L-2000型高效液相色谱仪(Hitachi公司),L203型电子天平(梅特勒-托利多)。
1.2 主要试剂50 mmol/L磷酸盐缓冲液(pH 8.0,含0.15 mol/L NaCl) (PBS),聚乙二醇(PEG) 6000 (国药集团优级纯),ISA206油佐剂,DMEM培养液,胎牛血清FBS,口蹄疫O型抗原Mya98株测试卡、口蹄疫A型抗原测试卡(北京标驰泽惠生物技术有限公司)。
1.3 测试样品口蹄疫病毒(O型) 146S抗原纯化样品(67.42 μg/mL),由中农威特生物科技股份有限公司提供灭活抗原液(O/Mya98),经中国科学院过程工程研究所生化工程国家重点实验室制备。口蹄疫病毒灭活抗原液(O/Mya98)、口蹄疫病毒灭活抗原液(AF72),分别由金宇保灵生物药品有限公司和中农威特生物科技股份有限公司提供。供试疫苗样品16批,由国内4家口蹄疫灭活疫苗生产企业提供。未接毒BHK-21细胞,由金宇保灵生物药品有限公司提供。猪圆环病毒2型灭活疫苗(YZ株),猪繁殖与呼吸综合征灭活疫苗(CH-1a株),为中国兽医药品监察所疫苗检品留样。
1.4 色谱条件色谱柱:TSKgel G4000SWXL (7.8 mm×30 cm)色谱柱(TOSOH)、TSKgel guard column SWXL (6.0 mm×4 cm)保护柱(TOSOH);流动相:pH 7.2的50 mmol/L磷酸缓冲液,含0.1 mol/L Na2SO4;紫外检测器检测波长:259 nm;流速:0.6 mL/min。
1.5 标准曲线制备用灭菌磷酸盐缓冲液对146S纯化样品进行系列稀释,至最低浓度为0.56 μg/mL。按上述色谱条件,进样100 μL检测。以仪器积分得到峰面积为纵坐标,以相应146S浓度为横坐标,绘制标准曲线并进行线性回归。
1.6 抗原液PEG浓缩与疫苗配制向灭活抗原液中加入40% PEG 6000磷酸盐溶液,使PEG 6000终浓度为8%,充分混匀,置4 ℃过夜,8 000 r/min、4 ℃离心30 min,弃去液体,将沉淀重悬于适量PBS中,吹打使充分溶解,8 000 r/min、4 ℃离心10 min,保留上清液,为抗原浓缩液。用PBS对抗原浓缩液进行适当稀释后,与ISA206油佐剂等体积混合,剧烈振摇使之乳化,即得口蹄疫灭活疫苗。
1.7 疫苗前处理分别使用正丁醇、正戊醇、正己醇、正庚醇、正己烷、三氯甲烷作为破乳试剂对疫苗进行破乳。分别按疫苗体积与破乳试剂9:1 (体积比)充分振摇混合,4 ℃静置30 min分层后,3 000 r/min、4 ℃离心5 min,比较破乳分层情况。
1.8 抗原鉴别应用口蹄疫O型抗原Mya98株测试卡和口蹄疫A型抗原测试卡检测3份自制疫苗,参照操作说明,向测试卡样品孔中缓慢滴加70 μL破乳水相,水平放置20 min后观察结果。
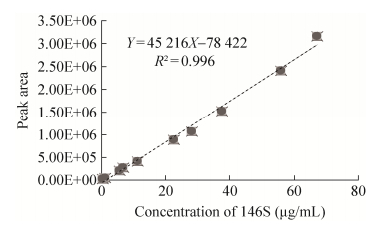
2 结果 2.1 线性范围将146S纯化样品色谱检测结果作图(图 1),经线性回归处理,得到146S的回归方程为:Y=45 216X-78 422 (R2=0.996,n=10),结果表明,146S在0.56-67.42 μg/mL范围内呈良好的线性关系,当浓度为0.56 μg/mL时,S/N=14.62,满足定量限要求。146S抗原保留时间在13-14 min (图 2)。
|
| 图 1 口蹄疫灭活病毒(O型) 146S抗原定量分析标准曲线 Figure 1 Calibration curve for qualification of inactivated FMDV 146S antigen (O/Mya98). |
| |
|
| 图 2 口蹄疫灭活病毒(O型) 146S抗原纯化样品色谱图 Figure 2 Chromatograms of pure inactivated FMDV 146S antigen (O/Mya98). |
| |
抗原浓缩液经体积排阻色谱法测定,代入标准曲线计算146S浓度,得抗原浓缩液(O/Mya98)为45.49 μg/mL,抗原浓缩液(AF72)为44.08 μg/mL。利用以上抗原浓缩液配制3份疫苗,分别为口蹄疫O型灭活疫苗,抗原含量33.3 μg/mL,口蹄疫A型灭活疫苗,抗原含量22.7 μg/mL,口蹄疫O型、A型二价灭活疫苗,抗原总含量29.1 μg/mL。另用PBS与ISA206油佐剂等体积混合,配制空白对照样。利用以上自制疫苗进行方法学验证。
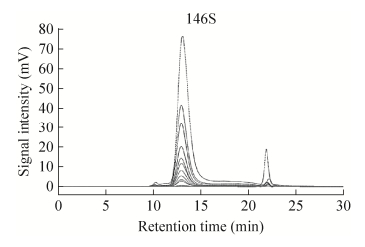
2.3 破乳试剂的确定比较了6种试剂对疫苗的破乳效果,结果显示,使用正己烷、三氯甲烷,4 ℃静置30 min后不能有效分离油相和水相,其余4种破乳试剂静置离心后,以正丁醇、正戊醇破乳水相体积高且澄清,正己醇、正庚醇破乳得到水相体积偏低(图 3)。色谱检测正丁醇、正戊醇破乳后水相中的146S抗原,结果基本一致。本实验选用正戊醇作为破乳试剂。

|
| 图 3 不同试剂对疫苗的破乳结果 Figure 3 Results of demulsification of vaccines by different reagents. (A) n-butyl alcohol. (B) n-pentanol. (C) n-hexyl alcohol. (D) n-heptanol. (E) n-hexane. (F) Chloroform. |
| |
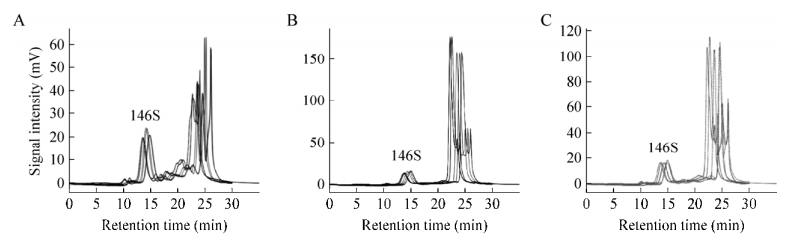
取口蹄疫A型灭活疫苗破乳水相,连续进样6次,将数据代入标准曲线计算,结果重复性良好(RSD=0.5%,n=6) (表 1)。取3份实验室配制的疫苗分别破乳测定3次,每次平行进样2针,每次测定间隔1周,将数据代入标准曲线计算含量和回收率。结果表明,3份疫苗的回收率分别为93.6% (RSD=2.7%,n=3)、102.3% (RSD=2.6%,n=3)、95.5% (RSD=5.1%,n=3) (表 2),该方法的重复性、精密度均良好,色谱结果见图 4。
| No. of injection | Retention time (min) | Peak rea (mV·min) | Concentration (μg/mL) | Average concentration (μg/mL) | RSD (n=6) (%) |
| 1 | 13.61 | 1 063 447 | 25.3 | 25.2 | 0.5 |
| 2 | 13.61 | 1 063 149 | 25.2 | ||
| 3 | 13.61 | 1 060 502 | 25.2 | ||
| 4 | 13.61 | 1 062 882 | 25.2 | ||
| 5 | 13.61 | 1 052 052 | 25.0 | ||
| 6 | 13.61 | 1 052 090 | 25.0 |
| No. of samples | Time point (d) | Concentration (μg/mL) | Recovery (%) | Average recovery (%) | RSD (n=3) (%) |
| 1 | 7 | 32.2 | 96.7 | 93.6 | 2.7 |
| 32.0 | 96.1 | ||||
| 14 | 31.0 | 93.1 | |||
| 30.9 | 92.7 | ||||
| 21 | 30.3 | 91.0 | |||
| 30.6 | 91.9 | ||||
| 2 | 7 | 23.3 | 102.6 | 102.3 | 2.6 |
| 23.3 | 102.6 | ||||
| 14 | 24.1 | 106.2 | |||
| 23.5 | 103.5 | ||||
| 21 | 22.6 | 99.6 | |||
| 22.6 | 99.6 | ||||
| 3 | 7 | 29.4 | 101.0 | 95.5 | 5.1 |
| 29.6 | 101.7 | ||||
| 14 | 27.6 | 94.8 | |||
| 27.4 | 94.2 | ||||
| 21 | 26.5 | 91.1 | |||
| 26.3 | 90.4 |
|
| 图 4 实验室自制疫苗色谱图 Figure 4 Chromatograms of vaccines formulated in our lab. (A) Vaccine (Type O). (B) Vaccine (Type A). (C) Vaccine (Type O, Type A). |
| |
对空白对照苗、24 h培养的BHK-21细胞、猪圆环病毒2型灭活疫苗(YZ株)和猪繁殖与呼吸综合征灭活疫苗(CH-1a株)进行色谱检测,结果显示,在146S保留时间13-14 min均未见吸收峰(图 5),因此不会对146S峰面积造成干扰,方法的特异性良好。
|
| 图 5 对照色谱图 Figure 5 Chromatograms of control samples. |
| |
通过改变流动相pH值和环境温度,考察方法耐受性。TSKgel G4000SWXL色谱柱pH适用范围在2.5-7.5,且应置于4-30 ℃。维持146S抗原稳定性的最适pH值为7.8。调节流动相pH值范围在6.9-7.5,146S抗原色谱峰保留时间和峰形一致,考虑到色谱柱耐受性,选用该流动相未经调节的pH值7.2-7.4。为防止146S降解,需注意实验室温度不应过高,且仪器样品盘应设定低温进样。
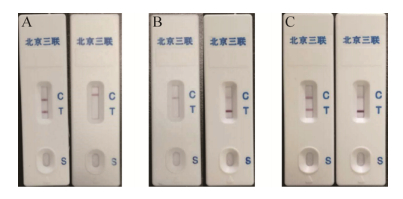
2.7 抗原鉴别对3份疫苗破乳水相的检测结果显示,口蹄疫O型灭活疫苗在O型抗原Mya98株测试卡为阳性结果,口蹄疫A型灭活疫苗在A型抗原测试卡为阳性结果,口蹄疫O型、A型二价灭活疫苗在两种测试卡均为阳性结果(图 6)。该抗原测试卡可对口蹄疫灭活疫苗中的O型和A型抗原进行鉴定。
|
| 图 6 抗原测试卡检测实验室自制疫苗 Figure 6 Antigen test results of vaccines formulated in lab. (A) Vaccine (Type O). (B) Vaccine (Type A). (C) Vaccine (Type O, Type A). Note: C means control lines; T means test lines; S means sample well. |
| |
测定了4家企业各4个批次共16批疫苗样品破乳水相中的抗原含量,结果显示,16批疫苗均能检出146S抗原(图 7)。16批样品的色谱结果存在差异,原因与各企业生产工艺不同有关,不同产品因生产工艺的差别,疫苗中146S的降解产物和杂蛋白含量不同,会对146S色谱峰产生不同程度的影响。将仪器自动积分得到的峰面积代入标准曲线计算,即得抗原含量,效力检验结果(PD50)由企业提供,见表 3。
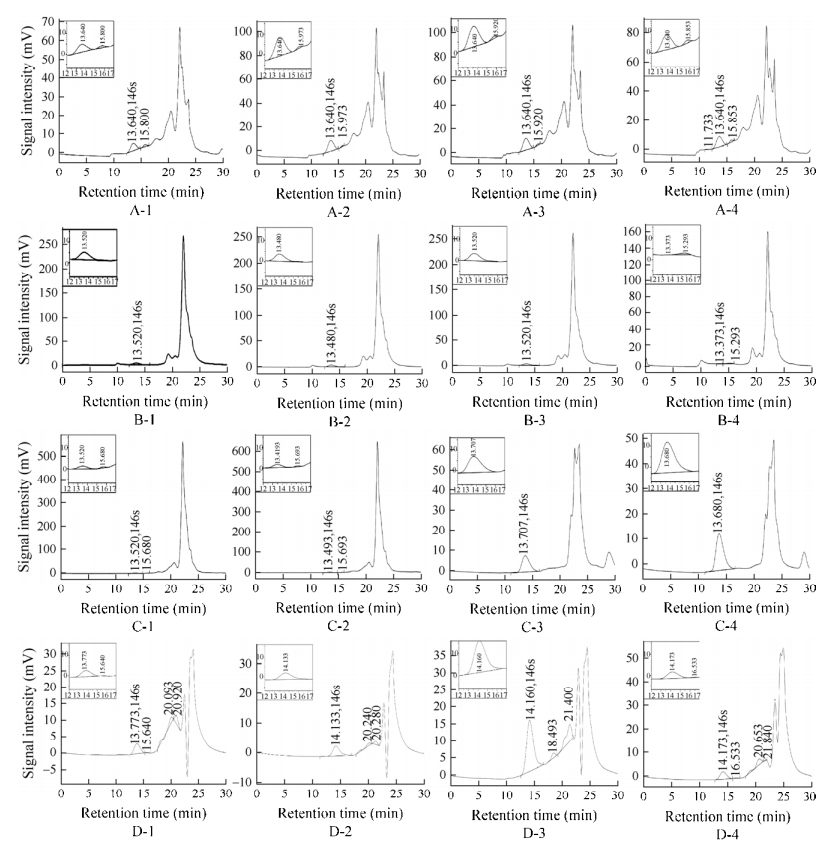
|
| 图 7 疫苗样品色谱图 Figure 7 Chromatograms of vaccine samples. (A-D) Manufacturer code. (1-4) Different batches of vaccine. |
| |
| Manufacturer code | No. of vaccine | Concentrations (μg/mL) | PD50 (The fifty percent of protective dose) |
| A | 1 | 11.9 | 13.59 |
| 2 | 13.6 | 13.59 | |
| 3 | 14.5 | 13.97 | |
| 4 | 10.8 | 13.97 | |
| B | 1 | 8.1 | 15.59 |
| 2 | 7.7 | 15.59 | |
| 3 | 7.9 | 13.59 | |
| 4 | 8.0 | 13.59 | |
| C | 1 | 3.7 | 9.00 |
| 2 | 3.9 | 10.81 | |
| 3 | 6.6 | 10.81 | |
| 4 | 14.7 | 13.59 | |
| D | 1 | 6.5 | 15.59 |
| 2 | 8.3 | 15.59 | |
| 3 | 18.4 | 15.59 | |
| 4 | 7.0 | 10.81 |
纯度高且稳定的口蹄疫抗原标准品是该方法得以应用的前提,口蹄疫病毒粒子的二十面体结构非常不稳定,在温度高于56 ℃或pH低于6的条件下会裂解[12-14],因此对146S抗原的纯化制备工艺要求很高。本实验使用的纯化样品由中国科学院过程工程研究所杨延丽等制备,制得后立即用于检测。色谱条件的确定不仅依赖病毒粒子的特性,还需要考虑色谱柱的耐用范围,本研究使用的TOSOH TSKgel色谱柱是目前较为常用的凝胶色谱柱,在后续耐用性研究中,可对同类型其他色谱柱进行考察。在疫苗前处理中,通过比较不同试剂对疫苗的破乳效果,确定了正戊醇为破乳试剂。在部分口蹄疫灭活疫苗的检测中发现,杂质会对146S抗原色谱峰产生影响,该问题有望通过改进生产工艺,降低杂蛋白含量、提高抗原稳定性,以及进一步优化样品前处理过程来解决。
本研究初步建立了一种口蹄疫灭活疫苗中146S抗原含量检测的液相色谱分析方法。应用该方法能够快速、准确地测定疫苗中有效抗原的含量。通过结合抗原测试卡,可进一步对疫苗中抗原的血清型加以鉴别,以便全面地评价其质量。与传统的蔗糖或氯化铯密度梯度离心法相比,省去了过夜制备密度梯度离心管和长时间的高速离心等复杂的操作过程,能够显著降低时间和人力成本。并且,疫苗破乳后可立即对水相进行检测,有效避免了146S抗原的损失,保证了检测结果的准确性和重复性。以上优势使该方法对疫苗生产过程中的质量控制和工艺改进具有重要应用价值,并且对于口蹄疫灭活疫苗的质量评价具有重要意义。相信随着疫苗生产工艺的进步、146S标准品的成功研制以及检测方法的优化和深入研究,该技术将有望替代本动物免疫攻毒保护试验,成为控制口蹄疫疫苗质量的有效技术手段,在降低生物安全风险、提高动物福利、节约成本和提高环保效益等方面具有重要意义。
| [1] |
Cui C, Huang LG, Li J, et al. Establishment of chemiluminescent enzyme immunoassay for detecting antibodies against foot-and-mouth disease virus serotype O in swine.
Chin J Biotech, 2016, 32(11): 1519–1530.
(in Chinese). 崔辰, 黄立纲, 李晶, 等. 猪O型口蹄疫病毒抗体化学发光酶联免疫检测方法的建立. 生物工程学报, 2016, 32(11): 1519-1530. |
| [2] |
Commission of Chinese Veterinary Pharmacopeia.
Veterinary Pharmacopoeia of the People's Republic of China.2015(3). Beijing: China Agriculture Press, 2016(in Chinese).
中国兽药典委员会. 中华人民共和国兽药典.2015年版(三部). 北京: 中国农业出版社, 2016. |
| [3] | Rweyemamu MM, Umehara O, Giorgi W, et al. Effect of formaldehyde and binary ethyleneimine (BEI) on the integrity of foot and mouth disease virus capsid. Rev Sci Technol, 1989, 8(3): 747–764. DOI: 10.20506/rst.issue.8.3.2465 |
| [4] |
Zhao QZ, Xie QG. Introduction of foot-and-mouth disease vaccine.
Chin J Vet Technol, 2000, 30(6): 43–44.
(in Chinese). 赵启祖, 谢庆阁. 家畜口蹄疫疫苗简介. 中国兽医科技, 2000, 30(6): 43-44. |
| [5] | Rodriguez LL, Grubman MJ. Foot and mouth disease virus vaccines. Vaccine, 2009, 27(S4): D90–D94. |
| [6] | Spitteler MA, Fernández I, Schabes E, et al. Foot and mouth disease (FMD) virus: quantification of whole virus particles during the vaccine manufacturing process by size exclusion chromatography. Vaccine, 2011, 29(41): 7182–7187. DOI: 10.1016/j.vaccine.2011.05.078 |
| [7] |
Shi LG, Zou XQ, Zhu YY, et al. Factors affecting the efficacy of foot-and-mouth disease vaccine.
Chin J Vet Med, 2013, 49(11): 89–91.
(in Chinese). 史兰广, 邹兴启, 朱元源, 等. 影响口蹄疫疫苗效力的因素. 中国兽医杂志, 2013, 49(11): 89-91. DOI:10.3969/j.issn.0529-6005.2013.11.035 |
| [8] | Le CT, Grambsch PM, Giebink GS. Quality control and the identification of vaccine responders using ELISA-derived antibody data. Stat Med, 2003, 22(18): 2935–2942. DOI: 10.1002/(ISSN)1097-0258 |
| [9] |
Li L, Miao HS, Xin AG, et al. Rapid quantification of FMDV 146S antigen by ELISA method.
Chin J Pre Vet Med, 2008, 30(4): 314–317.
(in Chinese). 李乐, 苗海生, 信爱国, 等. ELISA用于口蹄疫病毒146S抗原快速定量的研究. 中国预防兽医学报, 2008, 30(4): 314-317. |
| [10] | Yang YL, Li H, Li ZJ, et al. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens. Vaccine, 2015, 33(9): 1143–1150. DOI: 10.1016/j.vaccine.2015.01.031 |
| [11] | Vajda J, Weber D, Brekel D, et al. Size distribution analysis of influenza virus particles using size exclusion chromatography. J Chromatogr A, 2016, 1465: 117–125. DOI: 10.1016/j.chroma.2016.08.056 |
| [12] | Doel TR, Baccarini PJ. Thermal stability of foot-and-mouth disease virus. Arch Virol, 1981, 70(1): 21–32. DOI: 10.1007/BF01320790 |
| [13] | Brown F, Cartwright B. Dissociation of foot-and-mouth disease virus into its nucleic acid and protein components. Nature, 1961, 192(4808): 1163–1164. DOI: 10.1038/1921163a0 |
| [14] | Doel TR, Chong WKT. Comparative immunogenicity of 146S, 75S and 12S particles of foot-and-mouth disease virus. Arch Virol, 1982, 73(2): 185–191. DOI: 10.1007/BF01314726 |
 2018, Vol. 34
2018, Vol. 34