中国科学院微生物研究所、中国微生物学会主办
文章信息
- 姜淑喆, 李净净, 曹春静, 申玉龙, 倪金凤
- Jiang Shuzhe, Li Jingjing, Cao Chunjing, Shen Yulong, Ni Jinfeng
- 黄翅大白蚁来源β-葡萄糖苷酶的分子改造
- Molecular modification of β-glucosidase from the midgut of Macrotermes barneyi
- 生物工程学报, 2018, 34(7): 1081-1090
- Chinese Journal of Biotechnology, 2018, 34(7): 1081-1090
- 10.13345/j.cjb.170511
-
文章历史
- Received: December 25, 2017
- Accepted: February 5, 2018
纤维素是植物细胞壁的主要成分,是自然界中最丰富的多糖之一,也是生物能源取之不尽用之不竭的来源。纤维素水解成为葡萄糖,需要一系列纤维素酶的作用,根据纤维素酶的作用方式和底物特异性的不同,主要分为三大类:内切β-1, 4-葡聚糖酶(EGs,EC 3.2.1.4)、外切葡聚糖酶(CBHs,EC 3.2.1.91)和β-葡萄糖苷酶(BGs,EC 3.2.1.21)[1]。其中β-葡萄糖苷酶的作用是降解纤维寡糖产生葡萄糖,因此β-葡萄糖苷酶可以缓解内切β-1, 4-葡聚糖酶和外切葡聚糖酶的产物抑制,所以β-葡萄糖苷酶起着至关重要的作用,被认为是限速酶,是酶法降解天然纤维素材料的瓶颈。因此,很多人都在致力于寻找酶学性质较好的β-葡萄糖苷酶来应用于工业生产[2]。
虽然在碳水化合物活性酶数据库和蛋白质数据库中可以找到许多β-葡萄糖苷酶,但是酶活高、热稳定性好、葡萄糖耐受性高的却很少。例如,Novozym 188已经作为一种商业酶供工业生产使用,但是它的葡萄糖耐受能力很低(Ki为0.1 mol/L);另外来源于高山象白蚁Nasutitermes takasagoensis前肠唾液腺的β-葡萄糖苷酶(G1mgNtBG1),拥有较好的热稳定性,但低的酶活力和葡萄糖耐受性(Ki为0.6 mol/L)却限制了它的工业化应用[3]。在前期研究中,我们实验室从高等培菌白蚁黄翅大白蚁Macrotermes barneyi中肠克隆了一个具有较高葡萄糖耐受性的β-葡萄糖苷酶基因。该β-葡萄糖苷酶分子量56 kDa[4],属于糖苷水解酶GH1家族。其葡萄糖耐受性高,但酶活力和热稳定性不理想。我们试图对其改造以获得更好特性的β-葡萄糖苷酶。
碳水化合物活性酶(CAZy)数据库[5]显示出有17 108个(截至于2017年12月01日) GH1家族的酶,其中有336个酶进行了生物学分析。53个酶的结构已经被解析(40个属于GH1家族的β-葡萄糖苷酶),这些数据为分析改造MbmgBG1奠定了理论基础[6]。近年来,很多学者成功进行了β-葡萄糖苷酶的改造[7-8]。例如,从吐鲁番盆地土壤的宏基因组中得到的β-葡萄糖苷酶(Bgl6)[2],具有较高的葡萄糖耐受性和酶活力,但是热稳定性差,通过定点突变获得优质突变体M3,在葡萄糖耐受性几乎不受影响的情况下其热稳定性得到了提高[2, 9],为我们改造MbmgBG1奠定了实践基础。文中我们通过分析同源建模得到的MbmgBG1的三维结构,选择保守氨基酸附近的非保守氨基酸进行定点突变,研究这些氨基酸对MbmgBG1酶学特性的影响。
1 材料与方法 1.1 材料 1.1.1 主要试剂及仪器CelLytic B Cell Lysis Reagent、对硝基苯基- β-D-吡喃葡萄糖苷(pNPG)购自Sigma公司;MagExtract His-tag fusion protein purification kit购自日本Toyobo公司;DNA Ladder、限制性内切酶、Eazy Pfu酶、DNA Ligation Kit均购自TaKaRa公司;Cycle Pure Kit、Gel Extraction Kit、Plasmid Mini Kit购自OMEGA公司;Ni-NTA琼脂糖树脂、氨苄青霉素购自Invitrogen公司;异丙基- β-D-硫代半乳糖苷(IPTG)购买自生工生物工程(上海)股份有限公司;纤维二糖(Cellobiose)购自国药公司;蛋白胨和酵母粉购自OXOID公司;其他均购买自国药公司。
PCR仪(TaKaRa);酶标仪(TECAN SUNRISE M200CHB-202);凝胶成像仪(UV Itec公司);2802H UV/VIS分光光度计(UNICO);PHS-3C精密pH计(上海精密科学仪器有限公司)。
1.1.2 培养基LB培养基:10.0 g蛋白胨,5.0 g酵母粉,10.0 g NaCl,20.0 g的琼脂粉溶于1 000 mL蒸馏水。121 ℃条件下灭菌20 min。冷却至55 ℃左右,加入氨苄青霉素(终浓度100 μg/mL),成为LA培养基。
鉴定培养基:10.0 g蛋白胨,5.0 g酵母粉,10.0 g NaCl,2.0 g七叶苷,20.0 g琼脂。溶于1 000 mL蒸馏水。121 ℃条件下灭菌20 min。冷却至55 ℃,加入氨苄青霉素(终浓度100 μg/mL)、柠檬酸铁铵(0.5%)和IPTG (1 mmol/L)[2]。
1.1.3 菌株及质粒大肠杆菌JM109、表达载体pQE-30、黄翅大白蚁中肠来源的β-葡萄糖苷酶基因MbmgBG1为实验室保存,pQE-30通用引物以及实验过程中所有引物由华大基因测序公司合成。
1.2 构建突变体表达载体以MbmgBG1为模板,MbmgBG1-forward/ MbmgBG1-reverse和D53K-forward/D53K-reverse为引物(表 1),利用重叠延伸PCR扩增出突变位点为D53K的片段。利用Sal Ⅰ和Sph Ⅰ双酶切后连接,构建表达载体,转入大肠杆菌JM109感受态细胞。挑取单克隆进行测序鉴定,并命名为pQE30-MbmgBG1D53K。按照上述突变体D53K的构建方法,构建点突变体F167L、T176C、E347I、R354K、N393G和V425M。
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| MbmgBG1-forward | CAATAGGCATGCGCTGATGTAGACAACGA | 29 |
| MbmgBG1-reverse | CTTGGGTCGACATCTAGGAAGCGGT | 25 |
| D53K-forward | TCCACAATTGGTGGTTAAGCATTCAAGCG | 29 |
| D53K-reverse | CTTAACCACCAATTGTGGACGCTCATGTG | 29 |
| F167L-forward | GGAGACAGAGTTAAACTTTGGATCACTTTCAAC | 33 |
| F167L-reverse | GTTGAAAGTGATCCAAAGTTTAACTCTGTCTCC | 33 |
| T176C-forward | CAACGAGCCTCTGTGTTTCATGGATGCAT | 29 |
| T176C-reverse | ATGCATCCATGAAACACAGAGGCTCGTTG | 29 |
| E347I-forward | GATCCGTCTTGGCCCATTTCTGCTTCTTCATGG | 33 |
| E347I-reverse | CCATGAAGAAGCAGAAATGGGCCAAGACGGATC | 33 |
| R354K-forward | GCTTCTTCATGGCTCAAAGTTGTACCATGGGG | 32 |
| R354K-reverse | CCCCATGGTACAACTTTGAGCCATGAAGAAGC | 32 |
| N393G-forward | CTCAATGACACAGGCAGGGTTCTTTACTAC | 30 |
| N393G-reverse | GTAGTAAAGAACCCTGCCTGTGTCATTGAGTCC | 33 |
| V425M-forward | ACAGCTTGGAGCCTCATGGATAACTTCGAATGG | 33 |
| V425M-reverse | CCATTCGAAGTTATCCATGAGGCTCCAAGCTGT | 33 |
| Underlines indicate restriction enzyme sites. | ||
在平板上分别挑取突变体和野生型的单克隆,接种于5 mL LA培养基,37 ℃、180 r/min培养过夜。按1%的接种量接种于20 mL LA培养基,37 ℃培养至OD600为0.6−0.8时,加入终浓度为1 mmol/L的IPTG,16 ℃、180 r/min进行诱导表达16 h[10]。4 ℃、10 000 r/min离心5 min收集菌体,利用破壁缓冲液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl)洗涤菌体2次,将菌体−20 ℃冻存或立即破壁。向菌体中加入1 mL破壁缓冲液重悬菌体,超声波破壁(功率400 W,超声时间5 s,间隔时间5 s,超声次数100 cycles)。高速离心收集上清(12 000 r/min,4 ℃,10 min),即为粗酶液[11]。
1.4 纯化利用亲和层析原理纯化含有组氨酸标签的蛋白,具体步骤参照文献[4],纯化后的蛋白在4 ℃下浸没在透析液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl,0.1 mmol/L EDTA)中过夜,去除酶液中的咪唑,用于酶活分析。
1.5 酶活力测定方法 1.5.1 以pNPG为底物活性的测定以0.1 mol/L的醋酸钠缓冲液配制5 mmol/L的对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)作为底物,取200 μL底物与50 μL适当稀释的酶液,充分混合后,37 ℃恒温条件下反应30 min。结束后加入1 mL 0.6 mol/L的Na2CO3终止反应。OD410测定吸光值,做3个平行[12]。每分钟产生1 μmol对硝基苯酚所需要的酶量定义为一个酶活力单位U。
1.5.2 以纤维二糖为底物活性的测定[13]以0.1 mol/L的醋酸钠缓冲液配制2%的纤维二糖(Cellobiose)作为底物,取200 μL底物与50 μL适当稀释的酶液,充分混合后,37 ℃恒温条件下反应30 min。结束后沸水浴5 min,立即冰水中冷却2–3 min后加入1 mL POD-GOD (葡萄糖氧化酶),37 ℃恒温条件下反应10 min,冰上终止反应。OD505测定吸光值,做3个平行。每分钟产生1 μmol葡萄糖所需要的酶量定义为一个酶活力单位U。
1.5.3 反应温度和pH影响的测定[12]最适温度:以5 mmol/L的pNPG为底物,按照1.5.1酶活力测定步骤,以5 ℃为间隔,在30–70 ℃范围内测定β-葡萄糖苷酶的酶活。
最适pH:用0.1 mol/L醋酸缓冲液配制pH 3.0– 6.5的2%的纤维二糖,用0.1 mol/L磷酸缓冲液配制pH 6.5–7.0的2%的纤维二糖,用0.1 mol/L Tris-HCl配制pH 7.5–9.0的2%的纤维二糖。不同pH间隔0.5,按照1.5.2酶活力测定方法,在37 ℃、不同pH值下的酶活。
温度稳定性:以5 mmol/L的pNPG为底物,在30–70 ℃范围内,以5 ℃为间隔,将酶液在不同温度下处理30 min,按照1.5.1酶活力测定步骤测定β-葡萄糖苷酶的剩余酶活力。
pH稳定性:测定pH 3.0–8.0 (Mcilavine buffer)[12]范围内,以0.5为间隔,将酶液在25 ℃、不同pH下处理30 min,按照1.5.2酶活力测定步骤测定β-葡萄糖苷酶的剩余酶活力。
1.5.4 葡萄糖耐受性的测定利用0.1 mol/L醋酸缓冲液配制含有不同葡萄糖浓度的(0–4.0 mol/L范围内) 5 mmol/L的pNPG作为底物,测定β-葡萄糖苷酶的酶活力,测定方法同1.5.1[11]。
1.5.5 动力学常数的测定利用0.1 mol/L的醋酸钠缓冲液配置一系列不同浓度(0.4–20 mmol/L)的pNPG为底物,测定β-葡萄糖苷酶的酶活。利用底物浓度和对应酶活力,采用Lineweaver-Burk双倒数作图法得到Km和Vmax值[14]。
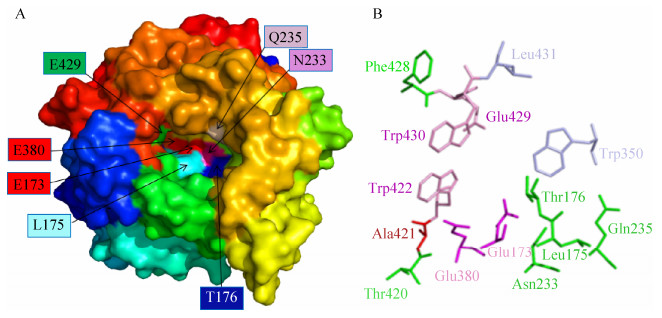
2 结果与分析 2.1 同源建模和突变体的选择已有文献报道出很多已知三维结构的GH1家族的β-葡萄糖苷酶,其典型结构是由8个(α/β)结构围成的桶状结构,也被称为4/7超家族[14-15]。将白蚁的β-葡萄糖苷酶MbmgBG1进行Blast氨基酸序列比对,同源性最高的是恒春新白蚁Neotermes koshunensis来源的β-葡萄糖苷酶(NkBG,PBD数据库,3vif,ID:BAB91145.1)[16],以它的三维结构为模板,由SWISS-MODEL同源建模,得到MbmgBG1的三维结构图(图 1A)[17]。在PyMOL中打开MbmgBG1的三维结构图,用不同的颜色展示出典型结构中的8个(α/β)结构,用红色标注出酶的催化残基,其他颜色标注出酶活中心表面的保守氨基酸残基(图 1A)。
|
| 图 1 同源建模(SWISS-MODEL) MbmgBG1的三维结构 Figure 1 Structure of the MbmgBG1 by homology modeling (SWISS-MODEL). (A) Surface of the structure of the Macrotermes barneyi β-glucosidase and showing the catalytic residues E173 and E308 (red). Different colors and the color transitions in α-helices and β-strands trace the polypeptide backbone in the barrel-shaped three-dimensional structure from the N terminus (dark blue) to the C terminus (dark red) direction. (B) Stick of the structure of the M. barneyi β-glucosidase and showing the catalytic residues E173 and E308 (hot pink), four residues (W350 and L431) forming the aglycone-binding pocket (blue), and A421 are probably important for aglycone recognition (red). Three residues (W422, W430 and E429) are probably glucose binding (pink). In this view, only the aglycone moiety is visible in its binding site as glucose is hidden below aglycone. |
| |
通过同源建模得到MbmgBG1的三维结构,分析它的结构特点,以及保守氨基酸的催化功能和非保守氨基酸对酶活中心的影响[15]。据文献报道,改变距离酶活力中心较近的点,能较大影响酶活力[18]。Young曾提出突变距离酶活位点5 Å之内的氨基酸容易造成酶的完全失活;一般改变距离活性位点5–10 Å范围内的氨基酸残基,能得到较理想的突变体。通过与已报道的酶活力较高、热稳定性较好的GH1家族的β-葡萄糖苷酶的多序列比对[2-3, 19],确定突变原则为,寻找保守区内的非保守序列,突变酶活中心附近的非保守氨基酸[18, 20]。
2.2 突变体酶活分析选择保守氨基酸附近的非保守氨基酸进行定点突变,得到D53K、F167L、T176C、E347I、R354K、N393G以及V425M共7个突变体(图 2)。其中突变体F167L、R354K的酶活与野生型相比有明显提高,突变体F167L的酶活提高约2倍,突变体R354K的酶活提高约4倍。突变体D53K、N393G和V425M的酶活力基本没有改变。突变体T176C、E347I比野生型的酶活降低。热稳定性都没有得到改善。

|
| 图 2 野生型与突变体的酶活力 Figure 2 Enzyme activity of MbmgBG1 and mutants. |
| |
7株突变体中,只有突变体F167L和R354K的比活力有明显提高,对这两个突变体的酶学动力学常数进行测定。结果发现F167L和R354K的Km值都有不同程度的减小(表 2),预示突变体F167L和R354K拥有比野生型MbmgBG1较好的底物亲和力。Kcat/Km比值变大,突变体F167L和R354K比野生型分别增加了5.79倍和3.48倍,这反映了突变体对底物的亲和力和催化能力比MbmgBG1要好,降解底物的能力增强[21]。
| Vmax (U/mg) | Km (mmol/L) | Kcat (s–1) | Kcat/Km (mmol/L·s) | |
| Wild-type | 29.24 | 1.07 | 6.21 | 5.80 |
| F167L | 25.32 | 0.98 | 32.91 | 33.58 |
| R354K | 38.91 | 0.82 | 16.53 | 20.16 |
| The Kcat and Km values were determined on the basis of the Michaelis-Menten equation. | ||||
测定温度对突变体活性的影响。野生型的最适温度在50 ℃左右,突变体R354K并没有发生改变,突变体F167L发生了改变,最适温度在45 ℃左右,而且最适温度范围也变窄了,在35–50 ℃范围内能保留80%以上的酶活力(图 3A)。突变体的热稳定性几乎和野生型保持一致,野生型和突变体在低温时(< 35 ℃)的稳定性较好,酶活损失较少,剩余酶活都在90%以上。35 ℃以上,随着温度的升高,酶活急剧下降,55 ℃时剩余酶活在20%左右(图 3B)。突变体的热稳定性没有得到改善。

|
| 图 3 温度和pH对野生型和突变体酶活性与稳定性的影响 Figure 3 Effects of temperature and pH on the activity and stability of MbmgBG1 and mutants. (A) Optimum temperature of MbmgBG1 and mutants. (B) Effects of temperature on enzyme stability. (C) Optimum pH of MbmgBG1 and mutants. (D) Effects of pH on enzyme stability. Data points are the average of triplicate measurements, and error bars represent standard deviation. |
| |
pH对突变体活性的影响。突变体的最适pH发生了不同程度的变化,野生型在pH为5.5时,酶活最高。突变体F167L和R354K分别在pH为4.5和5.0时,酶活最高。而且突变体R354K的最适反应pH的范围变宽,在pH为4.0−6.0时剩余酶活约在80%以上(图 3C)。突变体和野生型的pH稳定性几乎保持一致。在pH为4.5−6.5时具有较高的酶活,酶的稳定性比较好,pH为5.0保存时,酶的稳定性最好(图 3D)。
2.4 葡萄糖耐受性葡萄糖耐受性的结果如图 4所示,突变体F167L和R354K的葡萄糖耐受性都比野生型的高。在反应液中含有浓度为2.0 mol/L葡萄糖时,野生型的剩余酶活约在40%,突变体F167L的剩余酶活约在60%,而R354K的酶活还能维持在100%左右。还有一点值得注意的是,低浓度的葡萄糖对野生型和突变体的酶活都存在一定的促进作用[2, 9]。这种低葡萄糖浓度促进、高葡萄糖浓度抑制的特点是糖苷水解酶1家族的β-葡萄糖苷酶所特有的,而糖苷水解酶3家族中的β-葡萄糖苷酶至今没有发现此特点[22]。

|
| 图 4 野生型和突变体的葡萄糖耐受性 Figure 4 Effect of glucose on the activity of MbmgBG1 and mutants. pNPG were used as substrate. The IC50 values are 1.5 mol/L (MbmgBG1), 2.0 mol/L (F167L) and 3.0 mol/L (R354K). Data points are the average of triplicate measurements, and error bars represent standard deviation. |
| |
分析MbmgBG1三维结构的结构特点,及保守氨基酸的催化功能和非保守氨基酸对酶活中心的影响,选择7个氨基酸残基进行点突变,获得了点突变体。
β-葡萄糖苷酶MbmgBG1的Blast氨基酸序列比对结果表明,在高度保守的区域里是Phe167,与恒春新白蚁的β-葡萄糖苷酶(Leu)不同[19-20, 23],而恒春新白蚁的β-葡萄糖苷酶具有较高的酶活力,所以将167位点的苯丙氨酸突变为亮氨酸。在作用原理上来讲,亮氨酸的疏水性较苯丙氨酸弱,增强了活性中心附近的亲水性,可能更容易与底物结合,促进产物释放[16, 24]。从结构上来看(图 5A),Phe167处在β折叠与loop区的交界处,距离活性中心较近[18],突变为亮氨酸,导致催化残基(Glu173和Glu380)与葡萄糖结合位点(Trp422)的距离增加,而且构象上发生一定的变化,使酶活力中心的空间变大,可以更好地释放葡萄糖,从而导致酶活性增加。

|
| 图 5 MbmgBG1和突变体的活性位点和配体结构 Figure 5 Structure of the ligands and the active site of MbmgBG1 and mutants by PyMOL. (A, B) The difference between the MbmgBG1 (blue) and the F167L (green) or R354K (red). Overall molecular architecture highlighting the two acidic catalytic residues and the active-site pocket. (C, D) MbmgBG1 structure. Overall molecular architecture highlighting the two acidic catalytic residues (yellow) and the mutated amino acid residues. |
| |
对于突变体R354K,是因为Arg354位于酶活性中心的入口处(图 5B),还处于文献报道的葡萄糖第二结合位点附近[9],所以将R基较大的精氨酸突变为R基较小的赖氨酸,这样可能更利于底物的进入和产物的释放[17],从而提高其酶活和葡萄糖耐受性。由精氨酸突变为赖氨酸,降低了酶的pI值,可能是突变体R354K的最适pH变小的原因。另外,从结构上来看,Arg354这一位点的突变并没有引起酶活中心保守氨基酸残基的改变。要完全解释突变体R354K不同于野生型的原因,可能还需要更加深入的研究。
突变体D53K (图 5C),因为Asp53位于loop区,灵活性较大,导致β-葡萄糖苷酶的热稳定性较差,希望突变为赖氨酸,能减小其灵活性从而增强其热稳定性,但其酶活力和热稳定性都几乎没变,可能是因为Asp53位于酶表面的loop区对酶活中心的影响较小。突变体N393G (图 5C)[24],可能是因为天冬酰胺和丙氨酸都是亲水性氨基酸,虽然亲水能力不同,但是Asn393位点距离酶活中心较远,对酶活中心的影响不大。突变体V425M (图 5C),突变原因同F167L[19-20],但可能Val425位于距离酶活中心较近的loop区位置(图 5C),疏水性的缬氨酸突变为疏水性的甲硫氨酸对酶活中心的影响不大。所以D53K、N393G和V425M的酶活力几乎不变。
对于突变体T176C[2] (图 5D)酶活降低的原因,可能是因为突变点Thr176位于酶活中心,距离催化残基较近,对催化作用影响较大。也可能由苏氨酸突变为半胱氨酸引入了硫元素,与其他含有硫元素的半胱氨酸或甲硫氨酸形成异常的二硫键,影响蛋白正常结构的形成,导致酶活力大大降低,当然,这一点还需要结构上的进一步验证。对于突变体E347I (图 5D)[15],由亲水性的谷氨酸突变为疏水性的异亮氨酸,增强β-葡萄糖苷酶表面的疏水性,希望得到热稳定性较好的β-葡萄糖苷酶,但是可能太大程度地影响了酶分子,使酶活降低。
Young曾提出突变距离酶活中心位点5 Å之内的氨基酸容易造成酶的完全失活,对于距离催化残基较近且位于酶活中心表面的Leu175和Asn233这两个位点[25],还有待于进一步确认其酶活力是否完全丧失[26]。距离酶活中心较近的氨基酸残基都很大程度上影响酶活力,如底物入口处有糖苷配基的识别和结合位点及其附近的一些间接影响酶活力的氨基酸残基(图 1)。
通过定点突变,我们获得了两个酶活较高、葡萄糖耐受性较强的突变体,为黄翅大白蚁中肠来源的β-葡萄糖苷酶进一步研究奠定了基础。但是,突变体的热稳定性并没有提高,接下来可以采用其他策略提高突变体的热稳定性。例如,利用SpyTag/SpyCatcher环化策略[27]提高酶的稳定性,即根据各种酶的特定结构进行N-端和C-端的连接使其环化;或者通过酶剩余电荷的优化(优化电荷相互作用)进行合理的设计突变[28],从而使酶的电势(Eij)降低,热稳定性增强。
| [1] | Woodward J, Wiseman A. Fungal and other β-D-glucosidases their properties and applications. Enzyme Microb Technol, 1982, 4(2): 73–79. DOI: 10.1016/0141-0229(82)90084-9 |
| [2] | Cao LC, Wang ZJ, Ren GH, et al. Engineering a novel glucose-tolerant β-glucosidase as supplementation to enhance the hydrolysis of sugarcane bagasse at high glucose concentration. Biotechnol Biofuels, 2015, 8: 202–213. DOI: 10.1186/s13068-015-0383-z |
| [3] | Uchima CA, Tokuda G, Watanabe H, et al. Heterologous expression in Pichia pastoris and characterization of an endogenous thermostable and high-glucose-tolerant β-glucosidase from the termite Nasutitermes takasagoensis. Appl Environ Microb, 2012, 78(12): 4288–4293. DOI: 10.1128/AEM.07718-11 |
| [4] | Wu Y, Chi S, Yun C, et al. Molecular cloning and characterization of an endogenous digestive β-glucosidase from the midgut of the fungus-growing termite Macrotermes barneyi. Insect Mol Biol, 2012, 21(6): 604–614. DOI: 10.1111/imb.2012.21.issue-6 |
| [5] | Cantarel BL, Coutinho PM, Rancurel C, et al. The Carbohydrate-Active EnZymes database (CAZy):an expert resource for glycogenomics. Nucleic Acids Res, 2009, 37(S1): D233–D238. |
| [6] | Singh G, Verma AK, Kumar V. Catalytic properties, functional attributes and industrial applications of β-glucosidases. 3 Biotech, 2015, 6: 3–16. |
| [7] | Biot-Pelletier D, Martin VJJ. Evolutionary engineering by genome shuffling. Appl Microbiol Biotechnol, 2014, 98(9): 3877–3887. DOI: 10.1007/s00253-014-5616-8 |
| [8] | Singhania RR, Patel AK, Pandey A, et al. Genetic modification:A tool for enhancing β-glucosidase production for biofuel application. Bioresource Technol, 2017, 245: 1352–1361. DOI: 10.1016/j.biortech.2017.05.126 |
| [9] | Pang PJ, Cao LC, Liu YH, et al. Structures of a glucose-tolerant β-glucosidase provide insights into its mechanism. J Struct Biol, 2017, 198(3): 154–162. DOI: 10.1016/j.jsb.2017.02.001 |
| [10] | Dong WL, Xue ML, Zhang Y, et al. Characterization of a β-glucosidase from Paenibacillus species and its application for succinic acid production from sugarcane bagasse hydrolysate. Bioresource Technol, 2017, 241: 309–316. DOI: 10.1016/j.biortech.2017.05.141 |
| [11] | Li YD, Liu N, Yang H, et al. Cloning and characterization of a new β-glucosidase from a metagenomic library of Rumen of cattle feeding with Miscanthus sinensis. BMC Biotechnol, 2014, 14: 85–93. DOI: 10.1186/1472-6750-14-85 |
| [12] | Riou C, Salmon JM, Vallier MJ, et al. Purification, characterization, and substrate specificity of a novel highly glucose-tolerant β-glucosidase from Aspergillus oryzae. Appl Environ Microb, 1998, 64(10): 3607–3614. |
| [13] | Yang F, Yang XF, Li Z, et al. Overexpression and characterization of a glucose-tolerant β-glucosidase from T. aotearoense with high specific activity for cellobiose. aotearoense with high specific activity for cellobiose. Appl Microbiol Biotechnol, 2015, 99(21): 8903–8915. |
| [14] | Santos CA, Zanphorlin LM, Crucello A, et al. Crystal structure and biochemical characterization of the recombinant ThBgl, a GH1 β-glucosidase overexpressed in Trichoderma harzianum under biomass degradation conditions. Biotechnol Biofuels, 2016, 9(1): 71–81. DOI: 10.1186/s13068-016-0487-0 |
| [15] | Czjzek M, Cicek M, Zamboni V, et al. The mechanism of substrate (aglycone) specificity in β-glucosidases is revealed by crystal structures of mutant maize β-glucosidase-DIMBOA, -DIMBOAGlc, and -dhurrin complexes. Proc Natl Acad Sci USA, 2000, 97(25): 13555–13560. DOI: 10.1073/pnas.97.25.13555 |
| [16] | Jeng WY, Wang NC, Lin CT, et al. High resolution structures of Neotermes koshunensis β-glucosidase mutants provide insights into the catalytic mechanism and the synthesis of glucoconjugates. Acta Crystallogr D, 2012, 68(7): 829–838. DOI: 10.1107/S0907444912013224 |
| [17] | Sathe SS, Soni S, Ranvir VP, et al. Heterologous expression and biochemical studies of a thermostable glucose tolerant β-glucosidase from Methylococcus capsulatus (bath strain). Int J Biol Macromol, 2017, 102: 805–812. DOI: 10.1016/j.ijbiomac.2017.04.078 |
| [18] | Xie Y, An J, Yang GY, et al. Enhanced enzyme kinetic stability by increasing rigidity within the active site. J Biol Chem, 2014, 289(11): 7994–8006. DOI: 10.1074/jbc.M113.536045 |
| [19] | Ni JF, Tokuda G, Takehara M, et al. Heterologous expression and enzymatic characterization of β-glucosidase from the drywood-eating termite, Neotermes koshunensis. Appl Entomol Zool, 2007, 42(3): 457–463. DOI: 10.1303/aez.2007.457 |
| [20] | Tiwari R, Kumar K, Singh S, et al. Molecular detection and environment-specific diversity of glycosyl hydrolase family 1 β-glucosidase in different habitats. Front Microbiol, 2016, 7: 1597. |
| [21] | Miao LL, Fan HX, Qu J, et al. Specific amino acids responsible for the cold adaptedness of Micrococcus antarcticus β-glucosidase BglU. Appl Microbiol Biotechnol, 2017, 101(5): 2033–2041. DOI: 10.1007/s00253-016-7990-x |
| [22] | de Giuseppe PO, Souza TDCB, Souza FHM, et al. Structural basis for glucose tolerance in GH1 β-glucosidases. Acta Crystallogr D, 2014, 70(6): 1631–1639. DOI: 10.1107/S1399004714006920 |
| [23] | Chandrasekharaiah M, Thulasi A, Bagath M, et al. Molecular cloning, expression and characterization of a novel feruloyl esterase enzyme from the symbionts of termite (Coptotermes formosanus) gut. BMB Rep, 2011, 44(1): 52–57. DOI: 10.5483/BMBRep.2011.44.1.52 |
| [24] | Kulkarni TS, Khan S, Villagomez R, et al. Crystal structure of β-glucosidase 1A from Thermotoga neapolitana and comparison of active site mutants for hydrolysis of flavonoid glucosides. Proteins, 2017, 85(5): 872–884. DOI: 10.1002/prot.v85.5 |
| [25] | Hassan N, Nguyen TH, Intanon M, et al. Biochemical and structural characterization of a thermostable β-glucosidase from Halothermothrix orenii for galacto-oligosaccharide synthesis. Appl Microbiol Biotechnol, 2015, 99(4): 1731–1744. DOI: 10.1007/s00253-014-6015-x |
| [26] | Hassan N, Geiger B, Gandini R, et al. Engineering a thermostable Halothermothrix orenii β-glucosidase for improved galacto-oligosaccharide synthesis. Appl Microbiol Biotechnol, 2016, 100(8): 3533–3543. DOI: 10.1007/s00253-015-7118-8 |
| [27] | Wang JD, Wang YL, Wang XZ, et al. Enhanced thermal stability of lichenase from Bacillus subtilis 168 by SpyTag/SpyCatcher-mediated spontaneous cyclization. Biotechnol Biofuels, 2016, 9: 79–87. DOI: 10.1186/s13068-016-0490-5 |
| [28] | You S, Tu T, Zhang LJ, et al. Improvement of the thermostability and catalytic efficiency of a highly active β-glucanase from Talaromyces leycettanus JCM12802 by optimizing residual charge-charge interactions. Biotechnol Biofuels, 2016, 9: 124–135. DOI: 10.1186/s13068-016-0544-8 |
 2018, Vol. 34
2018, Vol. 34