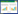中国科学院微生物研究所、中国微生物学会主办
文章信息
- 沈思, 王晓瑜, 王海霞, 任浩, 吕镇梅
- Shen Si, Wang Xiaoyu, Wang Haixia, Ren Hao, Lü Zhenmei
- 细菌降解邻苯二甲酸酯的研究进展
- Advances in biodegradation of phthalates esters
- 生物工程学报, 2019, 35(11): 2104-2120
- Chinese Journal of Biotechnology, 2019, 35(11): 2104-2120
- 10.13345/j.cjb.190177
-
文章历史
- Received: May 8, 2019
- Accepted: June 19, 2019
邻苯二甲酸酯(Phthalates esters, PAEs),俗称酞酸酯,是一类由邻苯二甲酸酐与相应醇类在酸催化剂作用下通过酯化反应生成的有机化合物[1] (图 1)。通常为无色透明油状黏稠液体,难溶于水,易溶于甲醇、乙醚等有机溶剂[2]。PAEs也是一种典型的环境内分泌干扰物,在环境中性质稳定,难降解,存留时间长。环境介质中残留的PAEs不仅对生态系统造成危害,而且直接影响动植物生长,同时在动植物体内富集积累,通过食物链传递,危害人类健康[1, 3]。大量研究表明,PAEs对人体具有肝肾毒性、生殖毒性和“三致”毒性,长时间暴露于PAEs,会增加妊娠风险,出现癌症、畸形以及内分泌系统紊乱等现象[4-6]。目前PAEs己成为全球性最普遍的一类有机污染物之一,因在环境中被普遍检出而被称为第二个全球性“多氯联苯(Polychlorinated biphenyl, PCB)污染物”[7]。目前,我国PAEs使用量大且范围广,由此带来的环境和健康问题日趋突出。
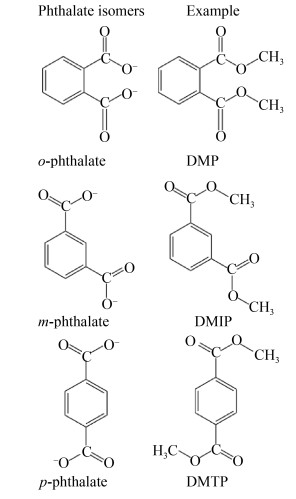
PAEs是1, 2-苯二羧酸的酯类(图 1),根据侧链的数量和与碱性苯基基团连接的烷基或芳基的不同而形成多种结构(表 1)。1, 2-苯二甲酸酯类的3种异构形式(邻位、对位和间位)构成增塑剂的主要类别(图 2)。其中邻苯二甲酸酯类占主要份额,根据其碳链的长度又可分为碳链具有7–13个碳原子的高分子量(High molecular weight, HMW) PAEs和具有3–6个碳原子的低分子量(Low molecular weight, LMW) PAEs[5]。常见的HMW PAEs有邻苯二甲酸二异癸酯(DIDP)、邻苯二甲酸二异壬酯(DINP)、邻苯二甲酸二丙基庚酯(DPHP)和邻苯二甲酸二异癸酯(DTDP)等,在工业上广泛用作能增加产品柔软度、伸长率的增塑剂和耐久性的刚性聚合物(如聚氯乙烯(PVC))[8]。LMW PAEs包括邻苯二甲酸二正丁酯(DBP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸丁基苄酯(BBP)和邻苯二甲酸二(2-乙基己)酯(DEHP)等,用于PVC产品、医疗器械、粘合剂、油漆、油墨和肠溶片等。邻苯二甲酸二甲酯(DMP)和邻苯二甲酸二乙酯(DEP)在其烃链上分别具有1个和2个碳原子,因而不属于这两组,不能用作增塑剂,但广泛用作香料、化妆品添加剂和个人护理产品中的溶剂和固定剂[9-14]。对苯二甲酸酯类和间苯二甲酸酯类主要用于制造工业中合成各种聚酯的单体。例如,对苯二甲酸二甲酯(DMTP)和间苯二甲酸二甲酯(DMIP)主要用于工业生产纤维、电容器和薄膜等[15]。
| Name of compound | Abbreviation | Molecular formulae | Molecular weight (g/mol) |
| Dimethyl phthalate | DMP | C10H10O4 | 194.2 |
| Diethyl phthalate | DEP | C12H14O4 | 222.2 |
| Di-n-propyl phthalate | DPrP | C14H18O4 | 250.3 |
| Dibutyl phthalate | DBP | C16H22O4 | 278.4 |
| Di-isobutyl phthalate | DIBP | C16H22O4 | 278.3 |
| Di-n-pentyl phthalate | DNPP | C18H26O4 | 306.4 |
| Benzyl butyl phthalate | BBP | C19H20O4 | 312.4 |
| Di (2-ethylhexyl) phthalate | DEHP | C24H38O4 | 390.6 |
| Di-n-octyl phthalate | DOP | C24H38O4 | 390.6 |
| Di-n-hexyl phthalate | DHP | C20H30O4 | 334.5 |
| Di-isoheptyl phthalate | DIHP | C22H34O4 | 363.0 |
| Di-isononyl phthalate | DINP | C26H42O4 | 418.6 |
| Di-isodecyl phthalate | DIDP | C28H46O4 | 446.7 |
| Di (2-propylheptyl) phthalate | DPHP | C28H46O4 | 446.7 |
| Diisoundecyl phthalate | DIUP | C30H50O4 | 447.7 |
| Diisotridecyl phthalate | DTDP | C34H58O4 | 530.8 |
|
| 图 2 邻苯二甲酸盐的邻位、间位和对位异构体 Fig. 2 Ortho, meta and para isoforms of phthalates. |
| |
随着PAEs被广泛使用和在机体中不断蓄积,其负效应也日渐凸显。研究显示,PAEs对土壤生态系统各类生物体具有生态毒性。例如,对土壤微生物的群落结构、种群数量和活性均产生影响,从而影响土壤的正常功能;对土壤生态系统的主要动物类群——蚯蚓具有一定毒性,但急性毒性较低,主要体现在生殖系统;对植物具有遗传毒性,并对其一些生理生化指标产生相应的毒性效应[16]。另外,PAEs作为一种环境内分泌干扰物,对人体内分泌系统具有影响,还具有生殖毒性、免疫毒性和致癌毒性[17]。Xu等[18]将雌性大鼠持续60 d暴露于B[a]P (5、10 mg/kg)、DEHP (300、600 mg/kg)、B[a]P+DEHP (5 mg/kg+300 mg/kg和10 mg/kg+ 600 mg/kg)三种条件下,发现B[a]P和DEHP会抑制雌鼠卵巢激素分泌,降低卵巢滤泡内环境稳态,并导致粒层细胞凋亡。长期暴露于DEHP会引发大小鼠的肝癌,增加雄性小鼠睾丸Leydig细胞肿瘤和腺泡细胞腺瘤发生率以及增加雌性大鼠患乳腺癌、卵巢癌的风险[17, 9-20]。
目前有关PAEs毒性效应的研究主要是动物实验结果,人体资料非常有限,并且对其毒性分子机制的研究还不够深入,大都停留在传统的毒理学研究方法,缺乏相关基因调控、信号转导、蛋白质组学等方面的深入研究。总之,PAEs对生态环境和人体健康构成了极大的威胁,因此,如何有效去除环境中残留的PAEs将是本文重点综述的内容。
3 PAEs在环境中的污染状况PAEs在各类塑料制品中主要通过氢键和范德华力结合在母体上,呈游离态,因而在生产、使用和处置过程中不可避免地从塑料产品迁移并不断释放到周边环境中[21]。物理化学因素如温度、压力、pH值、溶剂、有机化合物和辐射等都可能影响迁移速度(图 3)[4, 15]。近年来,已有大量研究发现在大气、水体、河流沉积物、土壤等中存在不同程度PAEs污染。
由于PAEs挥发性低,在大气中存在量有限,大气PAEs污染相对于水体和土壤污染较轻。但在空气和雨水中都检测到PAEs,其主要通过工厂排放、塑料垃圾焚烧、汽车尾气、农膜和涂料的挥发进入大气中[22]。这些PAEs以气态分子的形式沉积并被直接吸附在大气悬浮颗粒上,且挥发受温度影响[23]。对天津市7个不同功能区春、夏、冬三季大气中6种PAEs进行调查,发现DEHP和DBP是主要污染物,工业区PAEs值最高为(135.9±202.8) ng/m3,除DOP外其余5种PAEs浓度冬季高于夏季。在兰州市西固区和南京市也发现类似的污染情况[24-27]。由此可见,PAEs在大气中的浓度受温度影响较大,且与环境温度成负相关。
3.2 我国水体及沉积物中PAEs的污染状况PAEs已成为威胁我国水质资源安全的重要污染物之一。目前,在我国许多地表水和饮用水中检测出了PAEs,例如在哈尔滨市饮用水源磨盘山水库和南京饮用水源的部分长江河段均检测出0–6.6 μg/L PAEs[28]。我国长江、黄河和松花江等主要河流多处采样点PAEs浓度超出了国家规定的饮用水标准限值,其中长江中主要污染物DBP和DEHP浓度高达35.65 μg/L和54.73 μg/L[29]。太湖流域地表水和沉积物中6种PAEs总浓度范围分别为0.740–13.0 μg/L和5.15–20.9 mg/kg。其中DBP和DEHP是地表水中主要污染物,平均浓度分别为1.59 μg/L和1.29 μg/L。DOP是沉积物中主要污染物,平均浓度为7.41 mg/kg。在重庆市典型岩溶区地下水中检出19种PAEs类污染物,DBP和DEHP为主要污染物,检出浓度分别为5.92–1083.27 μg/L和4.57–935.44 μg/L,远高出太湖水的PAEs污染程度,可见重庆市典型岩溶区地下水PAEs污染更为严峻[30]。调查沈阳市城市河流细河和蒲河中DEHP污染状况,发现位于仙女河污水处理厂(接收了含PAEs污染物的工业废水)下游100 m处采样点的DEHP浓度最高,在河流沉积物中DEHP浓度高达355 mg/kg (干重)。此外,孟雪征等[31]调查上海市25个污水处理厂的活性污泥,其中DEHP平均含量达到97.4 mg/kg。
含PAEs废水的排放是水体PAEs的主要来源,研究表明农膜、化肥及塑料中的PAEs经雨水冲洗和土壤浸润作用下最终也进入水体。此外,大气干、湿沉降带来的PAEs也会进入水体[22]。另一方面,由于PAEs水溶性差,对固体颗粒、有机质具有较强的吸附性与亲和性,因而逐渐迁移到水体沉积物中稳定存在并富集,所以沉积物PAEs含量往往高于水体中PAEs浓度[32]。
3.3 我国土壤中PAEs的污染状况当PAEs释放到环境中时易被土壤颗粒吸附,此外,大气迁移和沉积也显著促进PAEs在土壤中聚集,因此土壤成了PAEs最终的“汇”[21]。世界上大部分地区的土壤都存在PAEs污染[23]。城市土壤中PAEs主要源于增塑剂或添加剂的应用、化妆品和个人护理产品的使用及建筑材料和家庭装饰的排放等。农业土壤中PAEs污染主要源于农业塑料薄膜、城市生物固体、化肥农药和废水灌溉的应用[3]。近年来农用地膜栽培技术广泛推广,使得PAEs对农业土壤的污染问题更为严峻。
我国不同地区土壤中DBP、DEHP及总PAEs的污染水平如表 2所示。多数土壤PAEs含量高于欧美等国家,其中福建省、广东省、新疆生产建设兵团土壤中PAEs污染水平最高。Niu等[33]对我国各地区农田土壤和设施农业土壤的123个样本检测发现这些土壤均受到不同程度的PAEs污染,检测到的15种PAEs总浓度范围为75.0– 6 369 μg/kg,平均值为1 088 μg/kg,以DBP和DEHP污染为主,DMP、DEP、DOP和BBP检测率则较低。“中国蔬菜之乡”山东省寿光镇是我国最大的蔬菜种植地区,抽检该地区长期使用农膜栽培技术的5个蔬菜基地土壤样品,发现PAEs含量高达33.39 mg/kg,显著高于我国其他地区设施菜地土壤PAEs浓度[34]。另外,耕地土壤PAEs水平要远高于荒地,并且邯郸潮土中PAEs浓度高于哈尔滨黑土[35]。考察中国东北三江平原3种不同栽培方式下6种PAEs总浓度,发现稻田(532.1±198.1 μg/kg) > 菜地(308.2±87.5 μg/kg) > 豆田(268.2±48.3 μg/kg)[36]。因此不同的耕作方式和剧烈的人类活动也影响着农业土壤PAEs的分布格局。
| Location | Soil type (number of samples) | DBP | DEHP | ∑PAEs(a) | ||||||
| Min | Max | Mean | Min | Max | Mean | Min | Max | Mean | ||
| Beijing | Urban (30) | 0.28 | 3.80 | 0.79 | 0.17 | 6.50 | 1.90 | 0.51 | 8.00 | 2.80 |
| Shenyang | Agricultural (41) | 0.18 | 0.88 | 0.44 | 0.19 | 0.58 | 0.27 | 0.52 | 1.73 | 0.94 |
| Hebei | Agricultural (39) | 0.35 | 0.054 | 0.045 | 0.066 | 0.26 | 0.14 | 0.19 | 0.46 | 0.29 |
| Handan | Agricultural (4) | 3.18 | 29.40 | 14.10 | 1.15 | 7.99 | 4.86 | - | - | - |
| Harbin | Agricultural (4) | 2.75 | 14.60 | 7.60 | 0.49 | 4.20 | 2.40 | - | - | - |
| Xi’an | Urban (62) | 0.08 | 1.71 | 0.52 | 0.04 | 17.2 | 0.76 | 0.19 | 19.10 | 1.37 |
| South Xinjiang | Cotton (3) | 11.2 | 57.70 | 28.30 | 104 | 149 | 129 | 124 | 1 233 | - |
| Yangtze River Delta | Agricultural (241) | ND | 1.50 | 0.095 | ND | 9.19 | 0.55 | 0.17b | 9.37b | 0.78b |
| Shandong Peninsula | Vegetable (111) | 0.016 | 15.70 | 1.47 | 0.073 | 5.32 | 1.46 | 1.94c | 35.4c | 6.75c |
| Wuhan | Surface (4) | ND | 0.12 | 0.06 | 0.20 | 0.46 | 0.32 | 0.29 | 1.23 | 0.68 |
| Huzhou | Agricultural (74) | ND | 0.34 | 0.02 | ND | 0.84 | 0.11 | ND | 1.10 | 0.16 |
| Nanjing | Vegetable (127) | ND | 1.83 | 0.21 | 0.021 | 9.03 | 1.82 | 0.15 | 9.68 | 2.26 |
| Hangzhou | Vegetable (10) | 0.14 | 0.35 | 0.21 | 0.81 | 2.20 | 1.48 | 1.90 | 4.36 | 2.75 |
| Guangzhou | Agricultural (40) | 0.009 | 2.74 | 0.34 | 0.11 | 29.40 | 1.76 | 0.20c | 33.6c | 2.57c |
| Guilin | Agricultural (16) | ND | 0.41 | 0.13 | ND | 0.58 | 0.25 | 0.001 | 1.17 | - |
| a: sum concentration of six USEPA priority PAEs, i.e., DMP, DEP, DBP, BBP, DOP and DEHP; b: sum concentration of 15 PAE compounds, including six US EPA priority PAEs; c: sum concentration of 16 PAE compounds, including six US EPA priority PAEs. | ||||||||||
城市土壤中PAEs的污染问题也逐渐引起关注。研究发现西安市城市土壤中6种PAEs总浓度在193.0–19 146.4 μg/kg范围内变化,平均值为1 369.3 μg/kg,根据污染特征发现磁化率(材料中产生的磁化强度与产生磁化的磁场强度之比)、土壤质地和不同功能区是影响城市土壤中PAEs浓度的重要因素[37]。与国内其他城市土壤相比,杭州市西湖景区土壤总PAEs浓度低于广州省和北京市,高于重庆市和西安市,因此高密度人为活动和城市化进程也是PAEs污染的原因[38]。另外还有降雨和季节性变化也会影响土壤中PAEs的分布,因此,有必要对影响土壤中PAEs分布的因素进行全面研究,以便为PAEs污染土壤提供合适的修复途径[39]。
4 细菌降解PAEs的研究进展PAEs降解包括水解、光降解和微生物降解等过程[21]。自然环境中水解和光降解微弱且速率缓慢,微生物降解被认为是PAEs在环境中消减的主要途径。长期受PAEs污染的土壤逐渐驯化出PAEs降解微生物,其中细菌因具有良好的PAEs耐受性和降解能力,可以单独或作为菌群来参与PAEs的降解过程,成为PAEs生物降解研究的重要对象。目前国内外就PAEs细菌降解主要开展了以下3个方面的工作:1) PAE高效降解菌/菌群的筛选与鉴定;2)细菌降解PAEs途径的研究;3)细菌降解PAEs的降解机制。
4.1 单菌对PAEs的降解过去40年中,研究人员和笔者从农田、垃圾填埋场、红树林湿地等土壤、各种水体及其沉积物、污水处理厂活性污泥等样品中筛选获得大量PAEs降解菌并进行了种属鉴定,有超过80个降解菌株(涵盖36个属)得到了详细的研究与报道,主要有鞘氨醇单胞菌Sphingomonas、节杆菌Arthrobacter、假单胞菌Pseudomonas、红球菌Rhodococcus和丛毛单胞菌Comamonas等菌属[41]。已报道的从环境中分离出的典型好氧PAEs降解菌如表 3所示。
| Strains | Substrate (substrate profile) | Degradation efficiency (degradation rate, time, PAEs concentration) | References |
| Delftia sp. TBKNP-05 | DMP | 100%, 5 d, 10 mmol/L | [42] |
| Sphingobium sp. TJ | DBP | 100%, 32 h, 100 mg/L | [43] |
| Acinetobacter sp. SN13 | DEHP | 90%, 5 d, 400 mg/L | [44] |
| Providencia sp. 2D | DBP | 100%, 3 d, 200 mg/L | [45] |
| Camelimonas sp. M11 | DBP (DEP, DPrP, DnPP) | 44%, 72 h, 0.1 mmol/L | [46] |
| Methylobacillus sp. V29b | DBP (DEP, BBP, DOP, DIDP) | 70.5%, 8 d, 2 000 mg/L | [47] |
| Pseudomonas sp. V21b | DBP (DEP, DOP, DIDP) | 57%, 8 d, 1 994 mg/L | [48] |
| Bacillus subtilis 3C3 | DEP (DMP, DPrP, DBPP, BBP) | 98%, 10 h, 100 mg/L | [49] |
| Agromyces sp. MT-O | DEHP (DMP, DEP, DBP, DOP) | 90%, 4 d, 200 mg/L | [50] |
| Gordonia alkanivorans sp. YC-RL2 | DEHP (DCP, DEP, DMP, DBP) | 99.4%, 7 d, 100 mg/L | [51] |
| Mycobacterium sp. YC-RL4 | DEHP (DCHP, DBP, DEP, DMP) | 100%, 5 d, 50 mg/L | [52] |
| Rhodococcus sp. WJ4 | DEHP (DBP, DOP) | 96.4%, 7 d, 200 mg/L | [53] |
| Gordonia sp. QH-11 | DBP (DMP, DEP, DOP, DIOP, DEHP) | 100%, 45 h, 750 mg/L | [54] |
| Gordonia sp. Dop5 | DOP (DMP, DEP, DBP, DEHP, BBP, DPP) | 100%, 40 h, 750 mg/L | [55] |
| Pseudomonas fluoresences FS1 | PAEs (DMP, DEP, DBP, DIBP, DOP, DEHP) | > 99%, 3 d, 100 mg/L | [56] |
| Burkholderia pyrrocinia B1213 | DEHP | 98.05%, 144 h, 500 mg/L | [57] |
| Sphingomonas yanoikuyae DOS01 | DMP | 100%, 35 h, 1 000 mg/L | [58] |
| Pseudomonas sp. DNE-S1 | DEP | 97.8%, 24 h, 500 mg/L | [59] |
总体来看,不同菌株的PAEs降解能力不同,且降解效率受自身基因编码蛋白和多种环境因素影响。大多数降解菌具有高效降解能力和环境适应性,可以耐受500–2 000 mg/L甚至更高浓度的PAEs (表 3)。然而,实际环境中污染物浓度往往较低(大多低于mg/L),导致无法诱导菌株功能性酶的表达;而且较低浓度的污染物进一步导致其生物利用率太低而不能维持细菌细胞正常生长,两者都使得细菌降解PAEs困难[60-61]。目前关于菌株对低浓度PAEs降解能力的研究较少,后期针对该问题的研究将有助于PAEs污染土壤的生物修复。
由于自然环境中往往同时存在多种PAEs的污染[62],在长期演变过程中细菌进化出对多种PAEs的降解能力。例如菌株甲基芽孢杆菌属Methylobacillus sp. V29b、枯草芽孢杆菌Bacillus subtilis 3C3、壤霉菌属Agromyces sp. MT-O、烷源戈登氏菌Gordonia alkanivorans YC-RL2、分枝杆菌属Mycobacterium sp. YC-RL4、戈登氏菌Gordonia sp. QH-11、Gordonia sp. Dop5和荧光假单胞菌Pseudomonas fluorescens FS1等都可高效降解4种及以上的PAEs (表 3)。此外,对PAEs混合物的细菌降解也进行了研究。梭菌属Camelimonas sp. M11可同时降解浓度为100 mg/L的DBP、DEP、DPP和DNPP共4种PAEs的混合物,72 h内降解效率分别为56%、72%、87%和28%[46]。Mycobacterium sp. YC-RL4可在5 d内高效降解含DEHP、DBP、DEP、DMP和DCHP的混合物,且降解率均在90%以上[52]。漠海威芽孢杆菌Bacillus mojavensis B1811可对7种PAEs混合物进行有效生物降解,且由于酯酶的特异性,4 d内完全降解DEHP、DBP、BBP、DNOP、DPP,而DMP、DEP的降解率分别为94.1%和57.1%[63]。同时,研究发现有些菌株在逆境条件下也能很好发挥降解能力,一种耐有机溶剂的菌株Bacillus subtilis 3C3能在Tween-80 (作为增溶剂)存在下快速降解一系列高浓度的短链PAEs[49]。从石油污染土壤中分离获得的Gordonia alkanivorans YC-RL2能在0–5% (W/V)盐度范围内生长和降解DEHP[51]。但是,这些具备多底物降解、抵御逆境胁迫能力的高效降解菌株仅仅是少数,研究人员仍需从自然环境中分离筛选或人工改造获得更多性能优良的新降解菌,以丰富菌株资源和提高生物修复PAEs污染土壤的潜能。
4.2 混合菌群对PAEs的降解PAEs完全矿化需要不同的代谢基因和酶,个别细菌能够单独完成这一过程不需要其他菌株的协作。但是,在自然环境中细菌往往以菌群形式存在,通过协同作用来完全降解PAEs为自身提供能量。目前研究的PAEs降解菌群主要分为两种,一是以PAEs为底物从环境样品中富集得到的菌群。例如,He等[64]从污水处理厂活性污泥中富集到一个降解DBP的天然菌群HD-1,能耐受高浓度DBP,在48 h内降解90%的1 200 mg/L DBP,降解效果高于已报道的纯菌和组合菌群。二是人工构建菌群,根据菌株来源不同,又可分为从同一个自然菌群中分离出单个降解菌组合成特定菌群和来自不同菌群的单个降解菌组合成的菌群。类芽孢杆菌属Paenibacillus sp. S-3和Paenibacillus sp. H-2是分离自同一菌群的单菌,能在48 h内将100 mg/L DBP分别降解45.5%和71.7%。其中菌株S-3缺乏3, 4-邻苯二甲酸酯双加氧酶,只能将DBP转化为中间代谢产物邻苯二甲酸(PA),而菌株H-2能完全矿化DBP。当两者共培养时,在60 h内能将100 mg/L DBP完全降解。最重要的是,共代谢增加了3, 4-邻苯二甲酸酯双加氧酶的活性,加速DBP的降解[65]。Wu等[66]从活性污泥中分离出Gordonia sp. JDC-2和Arthrobacter sp. JDC-32,菌株JDC-2能迅速将DOP降解为PA,因无法进一步降解使得PA在培养基中积累,而菌株JDC-32能降解PA但不降解DOP,两者共培养克服了单菌的降解限制而能完全降解DOP。Chatterjee和Dutta[67]发现不同来源的菌株Gordonia sp. MTCC 4818和Arthrobacter sp. WY都能单独利用BBP为唯一碳源生长,但无法完全矿化BBP,菌株MTCC 4818仅能利用BBP水解产生的醇,导致中间产物邻苯二甲酸单丁酯(MBuP)、邻苯二甲酸单苄酯(MBzP)和PA的积累,而菌株WY降解BBP十分缓慢,它的生长主要是利用PA。通过共培养克服了单个菌株在代谢BBP中的局限性,72 h内完全降解了BBP。笔者也从同一菌群中发现一株降解菌Arthrobacter sp. ZMO5和一株非降解菌不动杆菌属Acinetobacter sp. ZMO6,在重金属胁迫的逆境条件下两者共培养缩短了延滞期,比降解菌单独降解DPrP的效率提高了大约一倍。
虽然人工组合菌群在一定程度上能克服部分单菌的代谢限制,提高降解效率,但是发现良好的组合菌群较为困难,一般是在明确不同来源单菌的降解缺陷后进行取长补短。明确成功的组合菌群中单个菌株间如何发挥协同作用也将是研究者们需要探索的问题。此外,人工组合菌群往往是在实验室培养条件下开发的,菌株间可能缺乏其他方面的协作,真正应用到自然环境中也很难维持稳定,甚至因与土著微生物竞争处于劣势而被淘汰。而天然菌群已经适应了自然环境,长久以来也已建立了良好的协作关系,更适合自然环境中的土壤修复。
4.3 PAEs好氧降解途径PAEs代谢途径主要是在中间产物鉴定的基础上提出的,可分为两个主要步骤(图 4),PAEs转化为PA (Ⅰ)和PA的进一步利用(Ⅱ)。PAEs转化为PA是代谢的关键步骤,涉及两种反应:1)通过β-氧化、转酯化作用和脱酯化(去甲基化)作用减少侧链长度。其中,侧链的减少将显著降低长侧链的空间效应。β-氧化作用是通过依次脱去1个乙基,将侧链双酯基碳原子数大于2 (侧链长于DEP)的PAEs转化为较短链PAEs,相关研究较少且并未在纯菌体系中得到验证[68];转酯化和脱酯化作用都发生在单侧酯基,例如DEP→EMP (邻苯二甲酸二乙基甲酯)→DMP,这种单侧链酯基发生变化的代谢方式就是转酯化作用。脱酯化作用是将PAEs单侧或双侧酯基水解,产生邻苯二甲酸单酯(MAPs)或直接代谢为PA,与侧链烷基变化无关,这种代谢方式相较其他两种最常见且研究最透彻;2)酯键的水解是PAEs厌氧和好氧降解最常见的步骤,最终产生PA。脱酯化作用也涉及酯键的水解。由于长侧链对酶促反应的空间效应,导致短链的水解比长链更容易[69]。此外,多个酯键水解时没有特定的水解顺序。
PA是PAEs生物降解过程的关键代谢产物,可通过环裂解进一步降解,并且在有无氧气条件下其代谢途径不同。在好氧条件下,PA首先转化为另一种“中转站”——原儿茶酸(Protocatechuate, PCA)。其中,革兰氏阴性菌利用4, 5-邻苯二甲酸双加氧酶作用于PA,生成顺-4, 5-二羟-4, 5-二氢邻苯二甲酸酯(cis-4, 5-dihydroxy-4, 5-dihydrophthalate),再生成4, 5-双羟基邻苯二甲酸酯(4, 5-dihydroxyphthalate),最后转化为PCA (如图 4中a途径)。而在革兰氏阳性菌中,3, 4-邻苯二甲酸双加氧酶作用于PA,依次生成顺-3, 4-二羟-3, 4-二氢邻苯二甲酸酯(cis-3, 4-dihydroxy-3, 4-dihydrophthalate)和3, 4-双羟基邻苯二甲酸酯(3, 4-dihydroxyphthalate),再形成PCA (图 4中b途径)。原儿茶酸的环裂解由内二醇环裂解双加氧酶或外二醇环裂解双加氧酶介导,分别产生3-羧基粘康酸或4-羧基-2-羟基粘康酸半醛,再将3-羧基粘康酸转化为β-酮己二酸并进入β-酮己二酸途径(图 4中c途径);或将4-羧基-2-羟基粘康酸半醛分解成草酰乙酸和丙酮酸,最终进入三羧酸循环(图 4中d途径)[41, 69-70]。
PAEs的单菌好氧降解一般遵循以下规律:1)侧链长度越长、越复杂(含支链),PAEs的微生物降解效率越低;2) PAEs降解遵循一级动力学方程[71];3)生长曲线遵循Gompertz模型[57];4)降解过程受菌株、PAEs浓度、温度、pH、微量重金属离子等多种因素影响[49, 59];5)外源添加碳源或能源作为共代谢底物可显著提高PAEs降解效率[72]。
4.4 厌氧降解途径自然环境中绝大部分PAEs降解是由好氧细菌完成的,厌氧降解相对缓慢,因此对PAEs细菌厌氧降解途径的研究相对较少。值得关注的是厌氧降解途径与好氧对PA的代谢方式是不同的。在厌氧代谢中,PA首先通过脱羧作用转化为苯甲酸(BA),再经β-氧化转化为己二酸,最终由己二酸生成乙酸盐、CO2和H2[1, 70]。
5 PAEs降解基因/酶的研究进展目前关于PAEs细菌降解遗传机制的研究主要集中在PAEs酯基水解过程中酯酶的研究和PA转化为PCA过程中降解基因的克隆和功能鉴定方面。对其他降解途径,如β-氧化、转酯化降解基因和酶研究较少,且尚无研究阐明完整的PAEs细菌降解途径的分子机理。
5.1 PAEs酯酶的研究进展通过基因组文库构建及筛选、基因组或转录组测序及注释分析等方法对PAEs酯酶基因进行克隆分析,发现了仅水解PAEs的(参与图 4水解步骤Ⅰ)、仅水解MAPs的(参与图 4水解步骤Ⅱ)和两者都能水解的三类酯酶。
目前研究发现较为典型的参与PAEs水解第一步的酯酶。例如,Acinetobacter sp. M673中非诱导型PAEs水解酶能将大部分二烷基PAEs (包括DMP、DEP、DPrP、DBP、DPP和DHP)水解成相应的MAPs,且对中等长度侧链的DBP、DPP和DPrP的降解效率比对短侧链和长侧链的DMP、DEP和DHP降解效率高,但无法继续降解MAPs[73]。从嗜酸硫化叶菌Sulfobacillus acidophilus DSM10332中克隆获得新的PAEs酯酶EstS1,能降解PAEs至相应的单烷基PAEs。EstS1具有很高的热稳定性,在60 ℃时,对DBP、DPrP、DHP、DPeP、DEP和BBP的降解活性约是37 ℃的两倍。EstS1只能降解侧链是直链烷基的PAEs,对包含苄基或环己基的大体积烷基侧链的PAEs,如DEHP、DCHP无降解能力[74]。从构建的PAEs废水生物膜宏基因组文库中克隆到酯酶基因DphB,编码一种能耐受低温的二烷基水解酶,催化生成相应的单烷基PAEs,且在10 ℃、pH 7.5时有最大活性,对中链的DPrP、DBP和DNPP具有特定活性,不能降解较短和较长侧链的PAEs[75]。从冰川鞘氨醇单胞菌Sphingomonas glacialis PAMC 26605基因组中克隆获得一种编码嗜冷PAEs酯酶的基因EstSP1,不仅偏好具有较短酯链(C2–C6)的PAEs底物,而且对极性有机溶剂(包括有机醇和DMSO)具有耐受性[76]。Chen等[46]从塑料工业排污口分离获得Camelimonas sp. M11,并在其基因组文库中克隆了一个DBP酯酶基因,该酶具有较广的温度适应性,且在50 ℃最佳。能水解DEP、DPrP、DBP和DNPP生成相应的MAPs,不能降解DMP,降解速率依次为DPrP>DBP>DNPP>DEP>DMP。上述发现的5种酯酶都只能在PAEs转化为MAPs上发挥催化作用,并对MAPs没有活性,氨基酸序列比对后属于酯酶家族Ⅳ,具有保守的五肽基序GXSAG,其中X是Asp或Glu,它们都是酸性氨基酸,在底物特异性中起重要作用[69]。
第二类是参与单烷基酯水解成PA的酯酶。从Gordonia alkanivorans YC-RL2中克隆获得水解酶基因mehpH,该酶可催化各种MAPs转化为PA,包括单甲酯、单乙酯、单正丁酯[51]。此外,在Rhodococcus sp. EG-5和Gordonia sp. P8219菌株中分别获得邻苯二甲酸单-2-乙基己酯(MEHP)水解酶EG-5 MehpH和P8219 MehpH,两种酶都具有广泛的MAPs催化活性[77]。上述3种酶是MAPs水解酶同时也是MEHP水解酶,属于酯酶家族Ⅴ,具有催化三联体的典型α/β-水解酶折叠,且仅在Gordonia和Rhodococcus属中有报道,比对后的保守五肽基序是GX1SX2G,其中X1是N或H (N是主要的,H是次要的),X2通常是C-C水解酶和一些丝氨酸水解酶中的疏水残基(F、M或L),而来自菌株P8219的MEHP水解酶的X2是精氨酸[78]。从约什特氏红球菌Rhodococcus jostii RHA1中克隆得到PAEs水解酶基因(patE),异源表达产物只能将MAPs水解成PA,无法转化PAEs或其他芳族酯,但不属于常见的丝氨酸酯酶家族,而属于半胱氨酸酯酶家族[79]。
第三类酯酶能参与两步水解反应,既具有二烷基酯酶水解活性又具有单烷基水解酶活性。鞘氨醇单胞菌Sphingobium sp. SM42能以DBP作为唯一碳源和能源生长,构建其基因组文库筛选得到2个酯酶基因EstB和EstG。EstG和EstB不仅能降解DBP,还具有部分MBP酯酶活性[80]。1 mg/L EstG能在1 h内将500 µmol/L DBP完全水解成大量的邻苯二甲酸单丁酯(MBP)和微量的PA,而EstB也能降解DBP和MBP,但降解效率远差于EstG。CarEW是从芽孢杆菌属Bacillus sp. K91基因组测序数据中分析并筛选得到的一个酯酶,属于丝氨酸酯酶家族,能降解具有分支侧链的DiBP和邻苯二甲酸单异丁基酯(MiBP),能连续降解DiBP的两个酯键且无先后顺序,最后生成PA[81]。
已报道PAEs降解酯酶的研究大多还停留在发现新酶和鉴定降解功能的水平上,对于催化机制和实际应用的研究较少。
5.2 PA降解基因的研究进展从PA到PCA的降解途径有较为系统的研究,其中对阳性菌Arthrobacter keyseri 12B和阴性菌洋蔥伯克氏菌Burkholderia cepacia DBO1这两株降解菌相关基因簇功能研究最为透彻。在A. keyseri 12B中,克隆出了一个编码能完全代谢PA的130 kb质粒,对该质粒进行功能验证,确定了pht操纵子(负责PA到PCA转化)、pcm操纵子(负责从PCA到丙酮酸和草酰乙酸的代谢)、pehA基因(编码PAEs水解酶)、tnpR基因(编码转座子解离酶)、ptr操纵子(可能编码PA或PCA或PAEs的转运蛋白) 5个遗传单位[82]。据报道,最早发现的PA降解基因簇是pht操纵子(phtBAaAbAcAdCR)存在于革兰氏阳性菌中[82]。其后,研究者们在地杆菌属Terrabacter sp. DBF63和范巴伦氏分枝杆菌Mycobacterium vanbaalenii PYR-1中分别克隆到pht操纵子(phtA1A2BA3A4CR)[83]和(phtRAaAbBAcAd)[84]。Li等报道了Gordonia sp. HS-NH1中pht操纵子的特征(phtBAabcdCR),其中phtAabcd编码3, 4-邻苯二甲酸酯双加氧酶,由异寡聚加氧酶、[3Fe-4S]型铁氧还蛋白和GR型还原酶组成[85]。随后,Fan等通过全基因组测序分析发现菌株Gordonia sp. YC-JH1中pht基因簇与Gordonia sp. HS-NH1和Arthrobacter keyseri 12B分别具有69.2%–90.8%和71.1%–90.8%的相似性[86]。
革兰氏阳性菌与阴性菌因其降解途径不同,PA代谢的分子机制也完全不同(图 5)。研究革兰氏阴性菌Burkholderia cepacia DBO1中的PA降解相关基因,发现了3个分散且不同方向的相对独立的转录单元,分别是邻苯二甲酸加氧酶还原酶(ophA1)、4, 5-二羟基邻苯二甲酸脱羧酶(ophDC)、邻苯二甲酸加氧酶和顺式-二氢邻苯二甲酸脱氢酶(ophA2B)[1]。此外,阴性菌恶臭假单胞菌Pseudomonas putida NMH102-2的PA降解基因(pht12345)与菌株DBO1也存在差异,组成一个转录方向相同的基因簇[87]。
随着基因测序技术的蓬勃发展,越来越多PAEs降解菌的全基因组被测序与分析注释,为后续筛选鉴定功能基因提供了数据库,同时为研究代谢过程中的关键酶提供支持。此外,通过分子技术和生物信息学深入挖掘功能酶的结构和功能将有助于更好地解析PAEs代谢遗传机制,为生物修复PAEs的环境污染提供新思路。
6 结论与展望PAEs主要是人类长期大量生产和使用塑料制品过程中所产生的一种环境有机污染物,分布广泛且消除困难。一方面,寻求塑料替代品和开发使PAEs与塑料中聚合物骨架紧密结合的新技术是解决PAEs污染问题的手段之一。另一方面,环境中已有的PAEs污染有望通过微生物降解来去除。针对目前研究中仍存在的问题和限制,提出一些展望:1)虽然已从不同环境介质中分离并表征了大量PAEs降解菌株,但只有少数表现出良好的环境适应性和应用潜力。因此,仍需分离筛选新的PAEs降解菌,特别是能在胁迫条件下(高盐度、有机溶剂、低营养、低温和高温等)行使降解功能的菌株,以丰富菌株资源。2)现阶段对微生物降解PAEs的研究大多是在实验室培养体系下,对修复实际污染土壤的应用还极为有限。考虑到实际环境条件与室内差异较大,且高降解率往往是在菌株最适条件下达到的,降解菌进入污染土壤后的耐受性和有效性还需进一步证明。因此,如何将实验室所取得的研究成果应用于自然环境下PAEs污染的土壤修复,解决实际问题是研究者们需要进一步思考的问题。3)降解酶在生物修复中具有广阔的应用前景,后续应对PAEs降解菌的降解基因/酶进行更深入、系统的研究,包括新酶鉴定、催化机制探索、酶的修饰和改性等。阐明其降解的分子调控机制,拓宽其底物广谱性和催化酯键类型,并进一步提高酶的环境适应性、稳定性和降解效率。4)混合菌群是微生物降解PAEs的研究热点之一。高通量测序、稳定同位素示踪、环境宏基因组学、宏转录组学等现代分子生物学技术的应用为获得更多天然菌群和人工构建的高效菌群以及明确菌株间协同互作的机制提供了有利的方法和工具,对于PAEs污染的高效修复具有重要意义。
| [1] |
Hu RW. Cloning and functional analysis of a dibutyl phthalate hydrolase gene from Rhodococcus sp. 2G. Guangzhou: Jinan University, 2018 (in Chinese). 胡瑞文. 邻苯二甲酸二丁酯(DBP)水解酶基因的克隆与功能分析. 广州: 暨南大学, 2018. |
| [2] |
Lorz PM, Towae FK, Enke W, et al. Phthalic acid and derivatives//Fritz Ullmann, Ed. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, New York, 1990: 35-154.
|
| [3] |
He LZ, Gielen G, Bolan NS, et al. Contamination and remediation of phthalic acid esters in agricultural soils in China: a review. Agron Sustain Dev, 2015, 35(2): 519-534. DOI:10.1007/s13593-014-0270-1 |
| [4] |
Benjamin S, Masai E, Kamimura N, et al. Phthalates impact human health: epidemiological evidences and plausible mechanism of action. J Hazard Mater, 2017, 340: 360-383. DOI:10.1016/j.jhazmat.2017.06.036 |
| [5] |
Katsikantami I, Sifakis S, Tzatzarakis MN, et al. A global assessment of phthalates burden and related links to health effects. Environ Int, 2016, 97: 212-236. DOI:10.1016/j.envint.2016.09.013 |
| [6] |
Mariana M, Feiteiro J, Verde I, et al. The effects of phthalates in the cardiovascular and reproductive systems: a review. Environ Int, 2016, 94: 758-776. DOI:10.1016/j.envint.2016.07.004 |
| [7] |
Liu Q, Yang HJ, Shi YX, et al. Research progress on phthalate esters(PAEs) organic pollutants in the environmemt. Chin J Eco-Agric, 2012, 20(8): 968-975 (in Chinese). 刘庆, 杨红军, 史衍玺, 等. 环境中邻苯二甲酸酯类(PAEs)污染物研究进展. 中国生态农业学报, 2012, 20(8): 968-975. |
| [8] |
Cao XL. Phthalate esters in foods: sources, occurrence, and analytical methods. Compr Rev Food Sci Food Saf, 2010, 9(1): 21-43. DOI:10.1111/j.1541-4337.2009.00093.x |
| [9] |
Frederiksen H, Nielsen JKS, Mørck TA, et al. Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother-child pairs. Int J Hyg Environ Health, 2013, 216(6): 772-783. DOI:10.1016/j.ijheh.2013.02.006 |
| [10] |
Green R, Hauser R, Calafat AM, et al. Use of di (2-ethylhexyl) phthalate-containing medical products and urinary levels of mono (2-ethylhexyl) phthalate in neonatal intensive care unit infants. Environ Health Perspect, 2005, 113(9): 1222-1225. DOI:10.1289/ehp.7932 |
| [11] |
Koo HJ, Lee BM. Estimated exposure to phthalates in cosmetics and risk assessment. J Toxicol Environ Health A, 2004, 67(23/24): 1901-1914. |
| [12] |
Philippat C, Mortamais M, Chevrier C, et al. Exposure to phthalates and phenols during pregnancy and offspring size at birth. Environ Health Perspect, 2012, 120(3): 464-470. DOI:10.1289/ehp.1103634 |
| [13] |
Schettler T. Human exposure to phthalates via consumer products. Int J Androl, 2006, 29(1): 134-139. DOI:10.1111/j.1365-2605.2005.00567.x |
| [14] |
Schlumpf M, Kypke K, Wittassek M, et al. Exposure patterns of UV filters, fragrances, parabens, phthalates, organochlor pesticides, PBDEs, and PCBs in human milk: correlation of UV filters with use of cosmetics. Chemosphere, 2010, 81(10): 1171-1183. DOI:10.1016/j.chemosphere.2010.09.079 |
| [15] |
Benjamin S, Pradeep S, Josh MS, et al. A monograph on the remediation of hazardous phthalates. J Hazard Mater, 2015, 298: 58-72. DOI:10.1016/j.jhazmat.2015.05.004 |
| [16] |
Song XY, Cui XW, Li JK, et al. Research advances in soil ecotoxicology of phthalic acid esters (PAEs) exposure. Ecology Environ Sci, 2016, 25(11): 1885-1890 (in Chinese). 宋雪英, 崔小维, 李嘉康, 等. 邻苯二甲酸酯类塑化剂的土壤生态毒理学研究进展. 生态环境学报, 2016, 25(11): 1885-1890. |
| [17] |
Li L, Song NN, Li HS, et al. Advances of toxicology and toxicologic mechanism of phthalate esters. Chin J Pharmacol Toxicol, 2014, 28(3): 468-474 (in Chinese). 李蕾, 宋乃宁, 李海山, 等. 邻苯二甲酸酯类毒理学效应及其机制研究进展. 中国药理学与毒理学杂志, 2014, 28(3): 468-474. DOI:10.3867/j.issn.1000-3002.2014.03.027 |
| [18] |
Xu C, Chen JA, Qiu Z, et al. Ovotoxicity and PPAR-mediated aromatase downregulation in female Sprague-Dawley rats following combined oral exposure to benzo[a]pyrene and di-(2-ethylhexyl) phthalate. Toxicol Lett, 2010, 199(3): 0-332. |
| [19] |
David RM, Moore MR, Finney DC, et al. Chronic toxicity of di (2-ethylhexyl) phthalate in mice. Toxicol Sci, 2000, 58(2): 377-385. DOI:10.1093/toxsci/58.2.377 |
| [20] |
Voss C, Zerban H, Bannasch P, Berger MR. Life-long exposure to di-(2-ethylhexyl)-phthalate induces tumors in liver and testes of Sprague-Dawley rats. Toxicol, 2005, 206(3): 359-371. DOI:10.1016/j.tox.2004.07.016 |
| [21] |
Gu CG, Xiang LL, Ren WJ, et al. Multi-interfacial migration/transformation and effects of phthalic acid esters in soils: a review. J Zhejiang Univ Sci: Agric Life Sci, 2017, 43(6): 700-712 (in Chinese). 谷成刚, 相雷雷, 任文杰, 等. 土壤中酞酸酯多界面迁移转化与效应研究进展. 浙江大学学报:农业与生命科学版, 2017, 43(6): 700-712. |
| [22] |
Li J. Preliminary study on the degrading charicteristics and mechanisms of phthalic acid esters-degrading bacteria. Chongqing, Southwest University, 2018 (in Chinese). 李静. 邻苯二甲酸酯降解菌的降解特征与降解机制的初步研究. 重庆, 西南大学, 2018. |
| [23] |
Gao DW, Wen ZD. Phthalate esters in the environment: a critical review of their occurrence, biodegradation, and removal during wastewater treatment processes. Sci Total Environ, 2016, 541: 986-1001. DOI:10.1016/j.scitotenv.2015.09.148 |
| [24] |
Wang XD, Yang J, Yan H, et al. Distribution characteristics and source analysis of Phthalic acid esters in bust fall at the Xigu District of Lanzhou City. Earth Environ, 2012, 40(3): 336-341 (in Chinese). 王晓丹, 杨杰, 严浩, 等. 兰州市西固区大气降尘中邻苯二甲酸酯分布特征及来源分析. 地球与环境, 2012, 40(3): 336-341. |
| [25] |
Zhu ZY, Ji YQ, Zhao JB, et al. Pollution characteristics and correlation analysis of PAEs in atmospheric PM10 and dust in Tianjin. Environ Pollut Prevent, 2015, 37(12): 24-28 (in Chinese). 朱振宇, 姬亚芹, 赵静波, 等. 天津市大气PM10与降尘中邻苯二甲酸酯的污染特征及相关性分析. 环境污染与防治, 2015, 37(12): 24-28. |
| [26] |
Kong SF, Ji YQ, Liu LL, et al. Spatial and temporal variation of phthalic acid esters (PAEs) in atmospheric PM10 and PM2.5 and the influence of ambient temperature in Tianjin. China. Atmos Environ, 2013, 74: 199-208. DOI:10.1016/j.atmosenv.2013.02.053 |
| [27] |
Wang P, Wang SL, Fan CQ. Atmospheric distribution of particulate- and gas-phase phthalic esters (PAEs) in a metropolitan city, Nanjing, East China. Chemosphere, 2008, 72(10): 1567-1572. DOI:10.1016/j.chemosphere.2008.04.032 |
| [28] |
Wu B, Zhang XX, Zhang XL, et al. Semi-volatile organic compounds and trace elements in the Yangtze River source of drinking water. Ecotoxicology, 2009, 18(6): 707-714. DOI:10.1007/s10646-009-0331-4 |
| [29] |
Wang F, Xia XH, Sha YJ. Distribution of phthalic acid esters in Wuhan section of the Yangtze River, China. J Hazard Mater, 2008, 154(1/3): 317-324. |
| [30] |
Yang M, Hu ZY, Pu JB, et al. Distribution characteristics of phthalic acid esters in underground rivers of Chongqing typical karst areas. Environ Monit China, 2009, 25(6): 62-66 (in Chinese). 杨梅, 扈志勇, 蒲俊兵, 等. 重庆典型岩溶区地下河水体PAEs分布特征研究. 中国环境监测, 2009, 25(6): 62-66. DOI:10.3969/j.issn.1002-6002.2009.06.018 |
| [31] |
Meng XZ, Niu GL, Zeng M, et al. Occurrence, hazard and biodegradation of di-(2-ethylhexyl) phthalate in environment. Ecol Environ Sci, 2014, 23(8): 1384-1389 (in Chinese). 孟雪征, 牛贵龙, 曾明, 等. 增塑剂邻苯二甲酸二(2-乙基己基)酯的危害、分布及生物降解. 生态环境学报, 2014, 23(8): 1384-1389. DOI:10.3969/j.issn.1674-5906.2014.08.021 |
| [32] |
Li HT, Huang SL. Distribution and transformation of phthalate esters in aqueous environment. Environ Pollut Control, 2006, 28(11): 853-858 (in Chinese). 李海涛, 黄岁樑. 水环境中邻苯二甲酸酯的迁移转化研究. 环境污染与防治, 2006, 28(11): 853-858. DOI:10.3969/j.issn.1001-3865.2006.11.015 |
| [33] |
Niu LL, Xu Y, Xu C, et al. Status of phthalate esters contamination in agricultural soils across China and associated health risks. Environ Pollut, 2014, 195: 16-23. |
| [34] |
Zheng SA, Xue YH, Li XH, et al. Phthalate acid esters (PAEs) pollution in soils and agricultural products of vegetable greenhouses in Shouguang city, Shandong province. J Agro-Environ Sci, 2016, 35(3): 492-499 (in Chinese). 郑顺安, 薛颖昊, 李晓华, 等. 山东寿光设施菜地土壤-农产品邻苯二甲酸酯(PAEs)污染特征调查. 农业环境科学学报, 2016, 35(3): 492-499. |
| [35] |
Xu G, Li FH, Wang QH. Occurrence and degradation characteristics of dibutyl phthalate (DBP) and di-(2-ethylhexyl) phthalate (DEHP) in typical agricultural soils of China. Sci Total Environ, 2008, 393(2/3): 333-340. |
| [36] |
Wang H, Liang H, Gao DW. Occurrence and risk assessment of phthalate esters (PAEs) in agricultural soils of the Sanjiang Plain, northeast China. Environ Sci Pollut Res, 2017, 24(24): 19723-19732. DOI:10.1007/s11356-017-9646-5 |
| [37] |
Wang LJ, Liu MM, Tao WD, et al. Pollution characteristics and health risk assessment of phthalate esters in urban soil in the typical semi-arid city of Xi'an, Northwest China. Chemosphere, 2018, 191: 467-476. DOI:10.1016/j.chemosphere.2017.10.066 |
| [38] |
Liao J, Deng C, Chen Y, et al. Pollution level, sources and spatial distribution of phthalate esters in soils of the West Lake scenic area. Environ Sci, 2019, 40(7) (in Chinese). 廖健, 邓超, 陈怡, 等. 西湖景区土壤中邻苯二甲酸酯污染水平、来源分析和空间分布特征. 环境科学, 2019, 40(7). DOI:10.13227/j.hjkx.201812207 |
| [39] |
Liu WL, Shen CF, Zhang Z, et al. Distribution of phthalate esters in soil of E-Waste recycling sites from Taizhou city in China. Bull Environ Contam Toxicol, 2009, 82(6): 665-667. DOI:10.1007/s00128-009-9699-3 |
| [40] |
Lü HX, Mo CH, Zhao HM, et al. Soil contamination and sources of phthalates and its health risk in China: a review. Environ Res, 2018, 164: 417-429. DOI:10.1016/j.envres.2018.03.013 |
| [41] |
Han YH, He RW, Li C, et al. Phthalic acid esters-degrading bacteria: Biodiversity, degradation mechanisms and environmental applications. Asian J Ecotoxicol, 2016, 11(2): 37-49 (in Chinese). 韩永和, 何睿文, 李超, 等. 邻苯二甲酸酯降解细菌的多样性、降解机理及环境应用. 生态毒理学报, 2016, 11(2): 37-49. |
| [42] |
Patil NK, Kundapur R, Shouche YS, et al. Degradation of plasticizer di-n-butylphthalate by Delftia sp. TBKNP-05. Curr Microbiol, 2006, 52(5): 369-374. DOI:10.1007/s00284-005-5258-2 |
| [43] |
Jin DC, Kong X, Cui BJ, et al. Biodegradation of di-n-butyl phthalate by a newly isolated halotolerant Sphingobium sp. Int J Mol Sci, 2013, 14(12): 24046-24054. DOI:10.3390/ijms141224046 |
| [44] |
Xu JM, Lu QH, de Toledo RA, et al. Degradation of di-2-ethylhexyl phthalate (DEHP) by an indigenous isolate Acinetobacter sp. SN13. Int Biodeter Biodegr, 2017, 117: 205-214. DOI:10.1016/j.ibiod.2017.01.004 |
| [45] |
Zhao HM, Du H, Feng NX, et al. Biodegradation of di-n-butylphthalate and phthalic acid by a novel Providencia sp. 2D and its stimulation in a compost-amended soil. Biol Fert Soils, 2016, 52(1): 65-76. DOI:10.1007/s00374-015-1054-8 |
| [46] |
Chen X, Zhang XL, Yang Y, et al. Biodegradation of an endocrine-disrupting chemical di-n-butyl phthalate by newly isolated Camelimonas sp. and enzymatic properties of its hydrolase. Biodegradation, 2015, 26(2): 171-182. DOI:10.1007/s10532-015-9725-6 |
| [47] |
Kumar V, Maitra SS, J B. Biodegradation of endocrine disruptor dibutyl phthalate (DBP) by a newly isolated Methylobacillus sp. V29b and the DBP degradation pathway. 3 Biotech, 2016, 6(2): 200. DOI:10.1007/s13205-016-0524-5 |
| [48] |
Kumar V, Sharma N, Maitra SS. Comparative study on the degradation of dibutyl phthalate by two newly isolated Pseudomonas sp. V21b and Comamonas sp. 51F. Biotechnol Rep (Amst), 2017, 15: 1-10. |
| [49] |
Navacharoen A, Vangnai AS. Biodegradation of diethyl phthalate by an organic-solvent-tolerant Bacillus subtilis strain 3C3 and effect of phthalate ester coexistence. Int Biodeter Biodegr, 2011, 65(6): 818-826. DOI:10.1016/j.ibiod.2011.05.005 |
| [50] |
Zhao HM, Du H, Lin J, et al. Complete degradation of the endocrine disruptor di-(2-ethylhexyl) phthalate by a novel Agromyces sp. MT-O strain and its application to bioremediation of contaminated soil. Sci Total Environ, 2016, 562: 170-178. DOI:10.1016/j.scitotenv.2016.03.171 |
| [51] |
Nahurira R, Ren L, Song JL, et al. Degradation of di(2-Ethylhexyl) phthalate by a novel Gordonia alkanivorans strain YC-RL2. Curr Microbiol, 2017, 74(3): 309-319. DOI:10.1007/s00284-016-1159-9 |
| [52] |
Ren L, Jia Y, Ruth N, et al. Biodegradation of phthalic acid esters by a newly isolated Mycobacterium sp. YC-RL4 and the bioprocess with environmental samples. Environ Sci Pollut Res, 2016, 23(16): 16609-16619. DOI:10.1007/s11356-016-6829-4 |
| [53] |
Wang J, Zhang MY, Chen T, et al. Isolation and identification of a di-(2-Ethylhexyl) phthalate- degrading bacterium and its role in the bioremediation of a contaminated soil. Pedosphere, 2015, 25(2): 202-211. DOI:10.1016/S1002-0160(15)60005-4 |
| [54] |
Jin DC, Bai ZH, Chang DD, et al. Biodegradation of di-n-butyl phthalate by an isolated Gordonia sp. strain QH-11: genetic identification and degradation kinetics. J Hazard Mater, 2012, 221-222: 80-85. DOI:10.1016/j.jhazmat.2012.04.010 |
| [55] |
Sarkar J, Chowdhury PP, Dutta TK. Complete degradation of di-n-octyl phthalate by Gordonia sp. strain Dop5. Chemosphere, 2013, 90(10): 2571-2577. DOI:10.1016/j.chemosphere.2012.10.101 |
| [56] |
Zeng F, Cui KY, Li XD, et al. Biodegradation kinetics of phthalate esters by Pseudomonas fluoresences FS1. Process Biochem, 2004, 39(9): 1125-1129. DOI:10.1016/S0032-9592(03)00226-7 |
| [57] |
Li JL, Zhang JF, Yadav MP, et al. Biodegradability and biodegradation pathway of di-(2-ethylhexyl) phthalate by Burkholderia pyrrocinia B1213. Chemosphere, 2019, 225: 443-450. DOI:10.1016/j.chemosphere.2019.02.194 |
| [58] |
Gu JG, Han BP, Duan SS, et al. Degradation of the endocrine-disrupting dimethyl phthalate carboxylic ester by Sphingomonas yanoikuyae DOS01 isolated from the South China Sea and the biochemical pathway. Int Biodeter Biodegr, 2009, 63(4): 450-455. DOI:10.1016/j.ibiod.2008.12.004 |
| [59] |
Tao Y, Li HX, Gu JD, et al. Metabolism of diethyl phthalate (DEP) and identification of degradation intermediates by Pseudomonas sp. DNE-S1. Ecotoxicol Environ Saf, 2019, 173: 411-418. DOI:10.1016/j.ecoenv.2019.02.055 |
| [60] |
Chen XP, Xu SS, Tan TF, et al. Toxicity and estrogenic endocrine disrupting activity of phthalates and their mixtures. Int J Environ Res Public Health, 2014, 11(3): 3156-3168. DOI:10.3390/ijerph110303156 |
| [61] |
Hsu PC, Kuo YT, Guo YL, et al. The adverse effects of low-dose exposure to di(2-ethylhexyl) phthalate during adolescence on sperm function in adult rats. Environ Toxicol, 2016, 31(6): 706-712. DOI:10.1002/tox.22083 |
| [62] |
Wang J, Luo YM, Teng Y, et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film. Environ Pollut, 2013, 180: 265-273. DOI:10.1016/j.envpol.2013.05.036 |
| [63] |
Zhang JF, Zhang CN, Zhu YP, et al. Biodegradation of seven phthalate esters by Bacillus mojavensis B1811. Int Biodeter Biodegr, 2018, 132: 200-207. DOI:10.1016/j.ibiod.2018.04.006 |
| [64] |
He ZX, Xiao HL, Tang L, et al. Biodegradation of di-n-butyl phthalate by a stable bacterial consortium, HD-1, enriched from activated sludge. Bioresour Technol, 2013, 128: 526-532. DOI:10.1016/j.biortech.2012.10.107 |
| [65] |
Jin L, Sun XM, Zhang XJ, et al. Co-metabolic biodegradation of DBP by Paenibacillus sp. S-3 and H-2. Curr Microbiol, 2014, 68(6): 708-716. DOI:10.1007/s00284-014-0533-8 |
| [66] |
Wu XL, Liang RX, Dai QY, et al. Complete degradation of di-n-octyl phthalate by biochemical cooperation between Gordonia sp. strain JDC-32 isolated from activated sludge. J Hazard Mater, 2010, 176(1/3): 262-268. |
| [67] |
Chatterjee S, Dutta TK. . strain MTCC 4818 and Arthrobacter sp. strain WY in the utilization of butyl benzyl phthalate: effect of a novel co-culture in the degradation of a mixture of phthalates. Microbiology, 2008, 154(11): 3338-3346. DOI:10.1099/mic.0.2008/021881-0 |
| [68] |
Okamoto Y, Toda C, Ueda K, et al. Transesterification in the microbial degradation of phthalate esters. J Health Sci, 2011, 57(3): 293-299. DOI:10.1248/jhs.57.293 |
| [69] |
Ren L, Lin Z, Liu HM, et al. Bacteria-mediated phthalic acid esters degradation and related molecular mechanisms. Appl Microbiol Biotechnol, 2018, 102(3): 1085-1096. DOI:10.1007/s00253-017-8687-5 |
| [70] |
Luo ZH, Huang XL, Ye DZ, et al. Advances in research of biodegradation of environmental endocrine disruptors-phthalate esters. Chin J Appl Environ Biol, 2008, 14(6): 890-897 (in Chinese). 骆祝华, 黄翔玲, 叶德赞. 环境内分泌干扰物——邻苯二甲酸酯的生物降解研究进展. 应用与环境生物学报, 2008, 14(6): 890-897. |
| [71] |
de Moura Carrara SMC, Morita DM, Boscov MEG. Biodegradation of di(2-ethylhexyl) phthalate in a typical tropical soil. J Hazard Mater, 2011, 197: 40-48. DOI:10.1016/j.jhazmat.2011.09.058 |
| [72] |
Yuan SY, Huang IC, Chang BV. Biodegradation of dibutyl phthalate and di-(2-ethylhexyl) phthalate and microbial community changes in mangrove sediment. J Hazard Mater, 2010, 184(1/3): 826-831. |
| [73] |
Wu J, Liao XW, Yu FB, et al. Cloning of a dibutyl phthalate hydrolase gene from Acinetobacter sp. strain M673 and functional analysis of its expression product in Escherichia coli. Appl Microbiol Biotechnol, 2013, 97(6): 2483-2491. DOI:10.1007/s00253-012-4232-8 |
| [74] |
Zhang XY, Fan X, Qiu YJ, et al. Newly identified thermostable esterase from Sulfobacillus acidophilus: properties and performance in phthalate ester degradation. Appl Environ Microbiol, 2014, 80(22): 6870-6878. DOI:10.1128/AEM.02072-14 |
| [75] |
Jiao YY, Chen X, Wang X, et al. Identification and characterization of a cold-active phthalate esters hydrolase by screening a metagenomic library derived from biofilms of a wastewater treatment plant. PLoS ONE, 2013, 8(10): e75977. DOI:10.1371/journal.pone.0075977 |
| [76] |
Hong DK, Jang SH, Lee C. Gene cloning and characterization of a psychrophilic phthalate esterase with organic solvent tolerance from an Arctic bacterium Sphingomonas glacialis PAMC 26605. J Mol Catal B: Enzym, 2016, 133(S1): S337-S345. |
| [77] |
Nishioka T, Iwata M, Imaoka T, et al. A mono-2-ethylhexyl phthalate hydrolase from a Gordonia sp. that is able to dissimilate di-2-ethylhexyl phthalate. Appl Environ Microbiol, 2006, 72(4): 2394-2399. DOI:10.1128/AEM.72.4.2394-2399.2006 |
| [78] |
Iwata M, Imaoka T, Nishiyama T, et al. Re-characterization of mono-2-ethylhexyl phthalate hydrolase belonging to the serine hydrolase family. J Biosci Bioeng, 2016, 122(2): 140-145. DOI:10.1016/j.jbiosc.2016.01.008 |
| [79] |
Hara H, Stewart GR, Mohn WW. Involvement of a novel ABC transporter and monoalkyl phthalate ester hydrolase in phthalate ester catabolism by Rhodococcus jostii RHA1. Appl Environ Microbiol, 2010, 76(5): 1516-1523. DOI:10.1128/AEM.02621-09 |
| [80] |
Whangsuk W, Sungkeeree P, Nakasiri M, et al. Two endocrine disrupting dibutyl phthalate degrading esterases and their compensatory gene expression in Sphingobium sp. SM42. Int Biodeter Biodegr, 2015, 99: 45-54. DOI:10.1016/j.ibiod.2014.12.006 |
| [81] |
Ding JM, Wang CF, Xie ZR, et al. Properties of a newly identified esterase from Bacillus sp. K91 and its novel function in diisobutyl phthalate degradation. PLoS ONE, 2015, 10(3): e0119216. DOI:10.1371/journal.pone.0119216 |
| [82] |
Eaton RW. Plasmid-encoded phthalate catabolic pathway in Arthrobacter keyseri 12B. J Bacteriol, 2001, 183(12): 3689-3703. DOI:10.1128/JB.183.12.3689-3703.2001 |
| [83] |
Habe H, Miyakoshi M, Chung J, et al. Phthalate catabolic gene cluster is linked to the angular dioxygenase gene in Terrabacter sp. strain DBF63. Appl Microbiol Biotechnol, 2003, 61(1): 44-54. |
| [84] |
Stingley RL, Khan AA, Cerniglia CE. Molecular characterization of a phenanthrene degradation pathway in Mycobacterium vanbaalenii PYR-1. Biochem Biophys Res Commun, 2004, 322(1): 133-146. DOI:10.1016/j.bbrc.2004.07.089 |
| [85] |
Li DD, Yan JL, Wang L, et al. Characterization of the phthalate acid catabolic gene cluster in phthalate acid esters transforming bacterium-Gordonia sp. strain HS-NH1. Int Biodeter Biodegr, 2016, 106: 34-40. DOI:10.1016/j.ibiod.2015.09.019 |
| [86] |
Fan SH, Wang JH, Li K, et al. Complete genome sequence of Gordonia sp. YC-JH1, a bacterium efficiently degrading a wide range of phthalic acid esters. J Biotechnol, 2018, 279: 55-60. DOI:10.1016/j.jbiotec.2018.05.009 |
| [87] |
Nomura Y, Nakagawa M, Ogawa N, et al. Genes in PHT plasmid encoding the initial degradation pathway of phthalate in Pseudomonas Putida. J Ferment Bioeng, 1992, 74(6): 333-344. DOI:10.1016/0922-338X(92)90028-S |
 2019, Vol. 35
2019, Vol. 35