肝细胞癌(Hepatocellular carinoma,HCC)是严重威胁全球人类健康的恶性肿瘤之一,占所有原发性肝癌的90%以上。世界卫生组织2018年癌症统计结果显示,全球约有84.1万肝癌新增病例和78.1万肝癌死亡病例。肝癌死亡率高达8.2%,仅次于肺癌位居世界第二[1]。在我国,每年约有46.6万肝癌新增病例,约38.3万人死于肝癌,占全球肝癌死亡病例数的51%[2]。对我国肝癌患者病例研究发现,肝癌发生的主要因素有病毒性肝炎感染和长期饮酒、吸烟等不健康的生活方式[3]。
临床上,肝癌的主要治疗手段是手术切除、肝移植和局部消融,但是绝大多数肝癌患者发病隐匿,早期诊断困难,大多数患者在确诊时已是晚期或者发生了转移,失去了根治性治疗的机会,并且病情发展迅速,预后极差,死亡率高,即使采取一些放疗或者化疗手段,疗效依旧不理想,易造成耐药和复发[4],存活率仍然较低。
肿瘤微环境是肿瘤发生、发展和转移过程中所处的内环境,大体上可分为免疫细胞为主的免疫微环境和成纤维细胞为主的非免疫微环境。免疫细胞在肿瘤微环境中成分复杂多样,包括T淋巴细胞(70%-80%)、B淋巴细胞(10%-20%)、巨噬细胞(5%-10%)、自然杀伤细胞(< 5%)和发挥抗原呈递作用的树突状细胞[5]。肿瘤微环境中免疫细胞的组成和比例的改变,对肝癌的发生和发展发挥关键作用。苗同国等[6]对40位均有乙型肝炎(HBV)病史的原发性肝癌患者和40位健康人的外周血进行检测,发现肝癌患者中的CD3+、CD4+、CD4+/CD8+ T细胞亚群的数量显著低于健康对照组,但CD8+、Treg细胞数量明显高于健康对照组。不仅如此,肝癌患者血清中IL-2、IFN-γ和TNF-α的表达量也显著低于健康对照组。上述研究结果表明,肝癌患者的细胞免疫系统紊乱,免疫功能受到明显抑制。细胞的免疫功能低下和免疫抑制正是肝癌难治愈、易转移、易复发的重要因素。另一方面,肝癌细胞能对自身表面抗原进行修饰使得肿瘤细胞逃脱免疫系统的识别和清除,或是通过某些机制下调机体的抗肿瘤免疫应答,抑制免疫细胞的功能并诱导免疫细胞的凋亡,逃避宿主免疫系统攻击[7]。此外,调节性T细胞(Regulatory T cells,Tregs)和肿瘤细胞相关的巨噬细胞(Tumor-associated macrophages,TAMs)通过参与免疫抑制反应,为肿瘤免疫逃逸发生和发展提供条件。Tan等[8]发现Tregs能有效削弱自身抗原引起的抗肿瘤免疫,促进肿瘤细胞的增殖和转移。在免疫缺陷的小鼠体内,回输人源CD3+CD25- T细胞可阻止卵巢癌细胞生长,但同时回输人源Tregs则会促进卵巢癌细胞的生长。肿瘤相关巨噬细胞是肿瘤浸润免疫细胞的主要成分,肿瘤微环境中多种刺激因子可招募巨噬细胞在肿瘤处聚集,巨噬细胞通过诱发炎症反应或改变肿瘤细胞对药物敏感性,促进肿瘤的发生和发展[9]。Zhu等[10]发现低密度TAMs的原发性肝癌患者5年后的总生存率为61%,无进展生存率为61%,而高密度TAMs的HCC患者则分别为20%和15%,结果表明肿瘤周围TAMs的密度与HCC术后预后密切相关,即肝癌患者的TAMs密度越高,预后越差。
肿瘤相关成纤维细胞(Cancer-associated fibroblasts,CAFs)是实体肿瘤微环境中最丰富的宿主细胞,是构成非免疫微环境的主要细胞亚群,在肿瘤发生、发展、转移和复发过程中发挥重要作用。Olumi等[11]在体内实验中证实,前列腺癌细胞单独或者与正常成纤维细胞共接种均不具备致瘤性,而与CAFs联合接种则能形成巨大的实体瘤,揭示了CAFs主导的肿瘤微环境对肿瘤生长具有促进作用。此外,Liu等[12]发现肿瘤相关的成纤维细胞相比于正常纤维细胞分泌更多的趋化因子CCL2、CCL5、CCL7和CXCL16。四种趋化因子通过诱导HCC细胞hedgehog (Hh)途径和transforming growth factor-β (TGF-β)途径来促进肝癌细胞的转移。
肝脏中免疫微环境和非免疫微环境共同参与HCC的免疫耐受及应答,影响肝癌的发展与患者预后。传统的HCC治疗方案由于未对免疫耐受环境产生影响,免疫系统对药物的敏感性不足,疗效常不理想。因此,临床医师应充分了解HCC免疫微环境,完善治疗策略提高HCC的治疗效果。
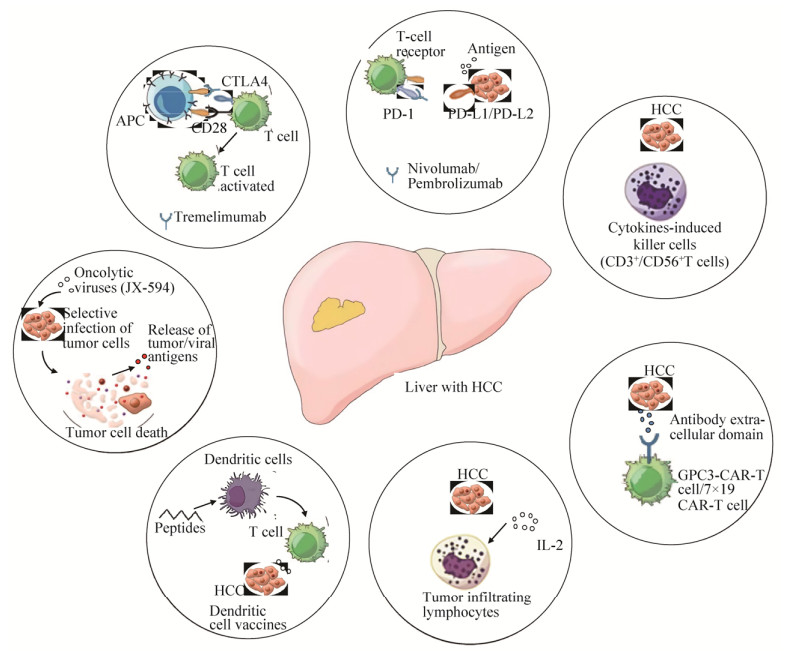
肿瘤免疫治疗是通过激发机体的免疫功能,增强肿瘤微环境抗肿瘤免疫力,从而控制和杀伤肿瘤细胞的治疗手段。与传统肝癌治疗手段相比,免疫治疗发生严重毒性反应的概率更低,患者耐受性更好,可有效增强机体的免疫反应,延缓肿瘤的进展,一定程度上延长患者的生存时间。近年来,肝癌免疫治疗逐渐成为目前研究的热点,并在临床上取得了积极的效果,部分病人在接受免疫治疗后生存周期延长,复发率降低。常用的免疫治疗的方法有免疫检查点抑制剂治疗(CTLA-4单抗、PD-1/PD-L1单抗等)、过继免疫治疗(细胞因子诱导的杀伤细胞、嵌合抗原受体T细胞免疫、肿瘤浸润淋巴细胞等)和肿瘤疫苗治疗(树突状细胞疫苗、溶瘤病毒疫苗等) (图 1),本文对近年来肝癌免疫治疗的研究进展作一综述。
1 免疫检查点抑制剂治疗 参与抗肿瘤免疫反应的T细胞在活化后,其表面多种抑制性受体表达上调,与肿瘤细胞表面相应配体结合产生免疫抑制作用,促使肿瘤相关免疫反应的强度下调。这些在免疫反应过程中具有抑制性免疫调节作用的位点,被称为免疫检查点。目前许多研究都致力于揭示免疫机制以及肿瘤相关的免疫调节通路并取得了突破性进展。2018年诺贝尔生理学或医学奖分别授予了美国德州大学安德森癌症中心詹姆斯·P·艾利森(James P. Allison)和日本免疫学家本庶佑(Tasuku Honjo),以表彰他们发现了CTLA-4和PD-1/PD-L1免疫负调控癌症疗法。
1.1 CTLA-4单抗 细胞毒性T淋巴细胞相关抗原4 (Cytotoxic T lymphocyte-associated antigen-4,CTLA-4)是一种白细胞分化抗原,属于T细胞上的一种跨膜受体,它的表达与T细胞活化存在密切联系。T细胞表面分子CD28通过与抗原呈递细胞表面配体CD80/CD86结合激活免疫细胞完成免疫反应,但由于CTLA-4与CD28分子存在相互竞争关系,而CTLA-4与CD80/CD86具有更好的亲和性使得CTLA-4更易结合两个配体,抑制T细胞的活性(图 2)[13]。
阻断CTLA-4与其配体的结合可刺激免疫细胞的活化、增殖从而诱导或增强免疫反应。Hodi等[14]对Ⅲ/Ⅳ期黑色素瘤患者分别进行抗CTLA-4单克隆抗体Ipilimumab (IgG 1κ)或糖蛋白100 (Glycoprotein 100,gp100)治疗。结果表明,接受gp100治疗的患者中位总生存期为6.4个月,而接受Ipilimumab治疗的患者中位总生存期为10.1个月,即Ipilimumab显著提高了黑色素瘤患者的术后生存期。因此,Ipilimumab成为第一个获得FDA批准用于临床的免疫检查点抑制剂[15]。肾细胞癌、非小细胞肺癌、前列腺癌等利用Ipilimumab进行治疗时发现其疗效并没有黑色素瘤明显,还需更多试验结果确定能否利用Ipilimumab有效治疗其他癌症类型。
Tremelimumab作为另一个阻断CTLA-4的单克隆抗体已用于肝癌、结直肠癌和转移性黑色素瘤的治疗。目前已应用于肝癌临床治疗的药物有Sorafenib[16]、Everolimus[17]和Brivanib[18],3种药物对肝癌的疾病控制率为44%-53%,肿瘤进展时间中位数为2.7-5.5个月。Sangro等[19]对HCC和HCV患者共17例进行Tremelimumab治疗后,患者的客观反应率和疾病控制率分别是17.6%和76.4%,肿瘤进展时间的中位数是6.48个月。Tremelimumab与Sorafenib、Everolimus和Brivanib相比,表现出更好的治疗效果,但其安全性和抗肿瘤活性还需更多临床试验和数据分析来进一步评估。
1.2 PD-1/PD-L1单抗 程序性死亡受体1 (Programmed cell death protein 1,PD-1)属于CD28超家族成员,其配体程序性死亡配体1 (Programmed cell death-Ligand 1,PD-L1)和程序性死亡配体2 (Programmed cell death-Ligand 2,PD-L2)都具有抑制T细胞活性功能。肿瘤细胞表面PD-L1分子表达上调后与T细胞和B细胞的PD-1结合,使PD-1分子位于胞质区的ITSM (Immunoreceptor tyrosine-based switch motif)磷酸化,细胞内的葡萄糖代谢受到抑制,T细胞增殖能力和细胞因子分泌能力大大降低,肿瘤细胞周围T细胞耗竭,最终导致肿瘤细胞逃过免疫监控和清除[20]。
以PD-1/PD-L1作为靶点阻断PD-L1蛋白与PD-1受体的结合使T细胞发挥正常功效对抗肿瘤具有重要意义。2014年FDA批准了人源IgG 4κ单克隆抗体Nivolumab作为第一个PD-1靶向黑色素瘤治疗药物。在一项三期临床实验中,患者分别接受Nivolumab和达卡巴嗪治疗,其客观反应率分别为40.0%和13.9%,无进展生存期分别为5.1个月和2.2个月,一年总生存率分别为72.9%和42.1%。可见,Nivolumab对于黑色素瘤的治疗效果均优于达卡巴嗪[21]。2016年,El-Khoueiry等[22]公布了Nivolumab治疗晚期原发性肝癌Ⅰ/Ⅱ期非随机临床研究结果,214名患者接受Nivolumab静脉注射,有35例患者出现应答(16.3%),其中33例部分应答(94%),2例完全应答(6%);111例患者(52%)在整个治疗过程中病情稳定。患者客观反应率为16%,疾病控制率达68%,6个月生存率82.5%,9个月生存率70.8%。因此,Nivolumab对晚期HCC患者表现出良好的安全性,具备治疗晚期HCC患者的潜力。
另外一个靶向抑制PD-1通路的单克隆抗体是Pembrolizumab,并且已被FDA批准用于一线PD-1过表达的非小细胞肺癌和转移性黑色素瘤的治疗。一项多中心Ⅱ期临床试验KEYNOTE-224研究Pembrolizumab在晚期HCC患者中的安全性和有效性。该研究招募了104名患者每3周对其进行200 mg的Pembrolizumab静脉注射,104名参与者中有84名(81%)死亡或疾病进展,疾病进展中位时间为4.9个月,无进展生存期中位时间4.9个月。104名参与者中有60名(58%)死亡,中位总生存期为12.9个月。研究进行到12个月时,29名患者存活且无进展,12个月无进展生存率为28%,56名患者仍然存活,12个月总生存率为54%[23]。另外两项关键临床Ⅲ期试验KEYNOTE-240和KEYNOTE-394评估Keytruda单药二线治疗HCC的疗效和安全性仍在进行中。
PD-1/PD-L1除了运用于肿瘤治疗还可作为术后的预测因子。Gao等[24]通过蛋白质印迹实验测试125名HCC患者PD-L1表达量以研究PD-L1与病人预后相关性,发现PD-L1阴性患者(低表达)中位总生存期为59.4个月而PD-L1阳性患者(高表达)是29.6个月,此外,PD-L1阳性患者复发率是阴性患者1.71倍,PD-L1阳性患者的预后明显差于低表达患者。因此,PD-L1可作为HCC免疫疗法的靶标和表征患者预后的潜在标志物。
1.3 PD-1/PD-L1联合CTLA-4 单一的免疫检查点抑制剂在HCC治疗中表现出较好疗效,但对晚期实体瘤疗效有限,免疫检查点抑制剂的联合运用有望产生协同作用获得更好疗效。Stein等[25]将PD-L1单抗Atezolizumab联合Bevacizumab治疗晚期HCC患者(NCT02715531)。在43位接受治疗的患者中有14名晚期HCC患者瘤体缩小30%,5名晚期患者疾病稳定控制率达到83%。联合方案优于单药治疗有效率达到65%。Hellmann等[26]针对不同非小细胞肺癌患者评估Nivolumab治疗方案(CHECKMATE 227)。试验以1︰1︰1的比例分别对患者进行Nivolumab和Ipilimumab联合用药治疗、Nivolumab单一药物治疗和化疗。Nivolumab和Ipilimumab联合用药的一年无进展生存率为42.6%,化疗的为13.2%,中位无进展生存期分别为7.2个月和5.5个月。Nivolumab加Ipilimumab的客观反应率为45.3%,化疗的为26.9%。结果表明Nivolumab加Ipilimumab的无进展生存率、无进展生存期和客观反应率均优于化疗。对比Nivolumab和化疗发现Nivolumab的中位无进展生存期为4.2个月,化疗为5.6个月,两个治疗组无进展存活率没有显著差异。这些结果表明Nivolumab加Ipilimumab联合用药在非小细胞肺癌患者治疗中优于化疗,Nivolumab加Ipilimumab联合用药可以作为非小细胞肺癌的有效一线治疗药物。联合治疗方案相比单药治疗也引起相对较多的副作用。除了免疫治疗出现的副作用发烧、咳嗽、皮疹和乏力等之外也有其他症状出现,所以还需根据病人临床数据指标对治疗策略作进一步优化。
尽管关于免疫检查点抑制剂报道结果表现出很好的疗效,但免疫检查点抑制剂仍存在潜在的严重不良反应。例如,PD-1抑制剂在阻断PD-1与PD-L1相互作用的同时存在抑制T细胞与抗原呈递细胞的作用[27]。PD-1/PD-L1单抗仅能解除位于肿瘤细胞边缘T细胞的束缚,不能够促使T细胞攻击肿瘤细胞,因而仅对部分患者有效,部分患者在接受治疗后病情反而恶化,因此还需要针对晚期肝细胞癌的治疗策略进行优化[28]。对新型免疫检查点的鉴定和治疗效果的探究,是未来免疫治疗领域的研究重点。
2 过继免疫治疗 目前过继免疫治疗有两个治疗方向:一是给患者回输能在体内激发患者的特异性抗肿瘤免疫反应的细胞如树突状细胞,属于主动细胞免疫治疗。二是通过对自身的细胞在体外进行刺激后产生大量的特异性细胞,再将特异性细胞回输到人体内调动和激活人体内的细胞因子和具有细胞毒性的免疫细胞,调整免疫杀伤性反应,实现杀伤肿瘤效果,属于被动细胞免疫治疗。肝癌的过继免疫治疗对抑制肝癌的复发、延长生存期都具有重要的作用,特别是作为术后辅助治疗手段取得了较好疗效,这也推动了许多与该疗法相关Ⅲ期临床试验的进行。
2.1 细胞因子诱导的杀伤细胞(Cytokinesinduced killer, CIK) 细胞因子诱导的杀伤细胞是一种非MHC限制性的新型免疫活性细胞,其增殖能力强、抗肿瘤活性高、副作用小,优于淋巴因子激活的杀伤细胞(Lymphokine activated killer cells,LAK),对提高患者自身抗肿瘤免疫能力有重要作用[29]。CIK是T淋巴细胞的细胞群,主要包括CD3+/CD56-细胞、CD3-/CD56+NK细胞、CD3+/CD56+T细胞等。CD3+/CD56+T细胞是主要的效应细胞,它们具有很强的增殖能力,对肿瘤细胞具有特异性,并且具备T细胞和NK细胞双重抗肿瘤能力且对正常细胞毒性较小。早期临床研究显示CIK细胞对各种肿瘤均具有抗癌活性。
临床前试验表明,CIK细胞在体外具有较高的抗肝癌细胞活性,在荷瘤裸鼠模型中对肝癌细胞生长的抑制作用均强于LAK和PBMC[30]。Pan等[31]对肝切除后HCC患者进行CIK细胞免疫辅助治疗,研究辅助治疗对患者的总生存期和无复发生存期的影响。单独肝切除患者的中位总生存率和无复发生存期分别为28个月和12个月,肝切除后接受CIK细胞免疫治疗的患者中位总生存率和无复发生存期分别为41个月和16个月。因此,CIK免疫辅助治疗可显著提高总生存期和无复发生存期。
在另一项研究CIK细胞免疫治疗功效和安全性的Ⅲ期临床试验中,17%的患者出现与CIK细胞因子相关的不良反应,如发热、寒战、肌痛和疲劳,但它们的严重程度尚在可控范围内[29]。因此,CIK细胞免疫治疗的安全性仍需更多临床试验作进一步研究。
为了达到更好的治疗效果,将树突状细胞(Dendritic cell,DC)与CIK细胞联合运用作为新的治疗策略。树突状细胞主要分布在淋巴系和髄系,是已发现的最强的抗原呈递细胞,能有效激活T细胞诱导机体发生抗肿瘤免疫反应。DC-CIK细胞免疫已在多种实体瘤临床研究中取得了令人可喜的结果。肝癌手术后配合DC-CIK辅助治疗可以提高机体免疫功能,为患者提供了一种安全有效的治疗策略。已有研究证实DC-CIK细胞疗法能用于增强术后经导管动脉化疗栓塞(POTACE)的HCC癌患者的抗肿瘤免疫能力。Zhang等[32]研究分析DC-CIK细胞治疗对接受POTACE的HBV感染的HCC患者的临床疗效。对照组(仅POTACE)与实验组(POTACE加DC-CIK细胞疗法) HCC患者的中位总生存时间分别为26.7个月和38.7个月,实验组明显长于对照组。除此之外,试验还对患者的血清甲胎蛋白(AFP)表达水平进行测试,AFP是用于诊断原发性癌症和HCC肿瘤复发的特异性标记物,在健康人血清中AFP维持在较低水平,而在恶性肿瘤中因受到相应刺激使得AFP表达水平上升。在接受POTACE加DC-CIK细胞疗法之前,对照组和实验组AFP表达量分别为(332.4±668.5) ng/mL和(236.1±389) ng/mL,AFP水平无显著性差异。治疗之后对照组与实验组分别为(50.3±105.7) ng/mL和(603±1161.7) ng/mL,实验组AFP水平与对照组相比明显降低。研究结果表明,DC-CIK细胞疗法在延长患者中位总生存时间、降低HCC患者外周血中的AFP水平、改善HCC患者预后都起到了重要的作用。
尽管关于CIK疗法已经开展了很多工作,但是由于存在免疫逃逸机制和缺乏特定肿瘤抗原,只有一部分T细胞可以发挥完整的抗肿瘤功能。如何进一步提高CIK疗法的有效性有待进一步研究。
2.2 嵌合抗原受体T细胞免疫(Chimeric antigen receptor T-cell immunotherapy, CAR-T) 嵌合抗原受体修饰T细胞是近年来迅速发展的肿瘤过继免疫新疗法,其原理是利用经嵌合抗原受体修饰的T细胞特异性地识别肿瘤相关抗原,提高效应T细胞的靶向性、杀伤活性和持久性,克服抑制性肿瘤局部免疫微环境并打破宿主免疫耐受性。
CAR-T细胞到目前为止已经开发到了第4代,基于前3代的基础上T细胞的持续增殖、细胞因子的分泌和杀伤肿瘤的能力都得到了较大的提高。目前被广泛应用的CAR结构由单链抗体、细胞外铰链区(Extracellular hinge region)、跨膜结构域和细胞内结构域组成[33]。CAR-T免疫治疗在白血病[34]、淋巴瘤[35]中取得了较好的疗效。2017年FDA批准Kymriah和Yescarta两种CAR-T治疗产品用于淋巴细胞白血病和淋巴瘤的治疗。
CAR-T细胞免疫虽然在实体瘤的应用上已经成为了研究的热点,但是关于HCC在临床上的研究还没有报道,更多仍处于基础研究阶段[36],其技术关键点在于肿瘤特异性抗原的选择。磷脂酰肌醇蛋白聚糖3 (Glypican-3,GPC3)是硫酸乙酰肝素糖蛋白家族中的一员,属于一种跨膜糖蛋白,在细胞的增殖、分化和转移中具有重要的作用。Gao等[37]发现GPC3+肿瘤细胞能有效地被GPC3靶向的T细胞裂解,并且裂解的肿瘤细胞数量和肿瘤中GPC3表达量呈正比。体内实验结果表明,GPC3-CAR-T细胞可有效杀伤肝癌细胞抑制HCC肿瘤形成。
除了对CAR-T细胞修饰抗原受体以外,还能将CAR-T定向改造表达所需的细胞因子辅助免疫治疗。Adachi等[38]将IL-7和CCL19基因转染到CAR-T细胞以表达IL-7和CCL19 (7×19 CAR-T细胞)。IL-7是一种细胞因子可促进T细胞增殖提高存活率,CCL19作为引诱因子可吸引T细胞和树突状细胞到达肿瘤部位。传统的CAR-T细胞存活率仅有30%,而接受7×19 CAR-T细胞治疗的DBA/2小鼠的存活率达到100%。利用免疫荧光技术发现7×19 CAR-T细胞可以有效促进浸润性T细胞和树突状细胞向肿瘤组织的转移。IL-7和CCL19两者的结合既增强免疫细胞增殖能力又促进免疫细胞向肿瘤细胞转移,类似上述具备两种或多种功能的CAR-T细胞将会为今后免疫治疗提供一种新的治疗策略。
随着CAR-T细胞在临床的不断应用,CAR-T细胞存在的安全性问题开始受到了人们的关注,在输注大量的CAR-T细胞后机体会分泌大量的细胞因子导致细胞因子风暴引发多器官功能衰竭,同时CAR-T细胞的免疫排斥反应和脱靶效应等其他安全性问题也亟待解决,未来还需要对CAR-T细胞结构逐渐优化来克服上述安全性问题。
2.3 肿瘤浸润淋巴细胞(Tumor infiltrating lymphocytes,TIL) 肿瘤浸润淋巴细胞本身也作为一种免疫疗法。手术切除的肿瘤组织大部分是肿瘤细胞但仍有少部分淋巴细胞。TIL治疗原理是从肿瘤组织中分离淋巴细胞在体外进行扩增,经IL-2培养得到足够多肿瘤浸润淋巴细胞回输到患者体内发挥抗癌作用。先前的研究表明在HCC中TIL数量稀少,但对肿瘤病人的复发有重要的影响[39]。经过TIL治疗的肝癌患者与对照组相比复发率减少38.6%,5年生存率提高了34.9%。在另外一项随机临床试验中,76例HCC患者(HBV感染患者占20%,HCV感染患者占66%)在肝切除后利用IL-2体外激活淋巴细胞进行过继免疫治疗后相比于对照组其复发率降低18%[40]。虽然TIL有明显的治疗效果,但是目前存在的困难是TIL难以从HCC患者中分离并进行体外扩大培养,并且仅有少部分TIL细胞对肿瘤抗原敏感[33]。Rosenberg等[41]发现在CD8+ TIL细胞中只有少量对肿瘤抗原敏感,其他大量TIL对肿瘤细胞不敏感,其原因是在CD8+ TIL细胞中存在CD39表达差异。CD39是一种与慢性免疫细胞刺激有关的分子,在多种恶性实体瘤中存在高表达的情况。研究发现CD8+CD39+的TIL具有潜在的抗肿瘤能力但其活性受到抑制,PD-1/PD-L1抑制剂可以解除该类抑制。所以能对PD-1/PD-L1与CD39之间作用机制作进一步研究,便于今后临床上将CD39表达量作为指标确定PD-1/PD-L1治疗策略。
2.4 淋巴因子激活杀伤细胞(Lymphokineactivated killer, LAK) 淋巴因子激活杀伤细胞是用高浓度IL-2激活肿瘤患者自体或正常捐赠者的外周血单核细胞,激活之后体外有广谱抗肿瘤的活性,可直接溶解、杀伤肿瘤细胞。Takeda等[42]报道了LAK细胞治疗多发HCC的有效性和实用性,但是这种方法存在肿瘤细胞自体回输风险,所以临床报道不多。
3 肿瘤疫苗治疗 肿瘤疫苗治疗具有高效性和低毒性,其目的就是启动机体产生持续的抗肿瘤免疫反应,避免损伤自体组织细胞。肝癌疫苗就是利用肝癌细胞或者抗原诱导机体特异性免疫应答达到消灭肿瘤的目的。肿瘤疫苗主要包括多肽疫苗、树突状细胞疫苗和溶瘤病毒疫苗等。
3.1 多肽疫苗 目前报道较多的多肽疫苗是甲胎蛋白(AFP)多肽疫苗。甲胎蛋白(AFP)是一种糖蛋白,属于白蛋白家族。甲胎蛋白在胎儿血液中含量丰富,出生后含量逐渐降低,在健康成年人血清中维持较低水平。在肝脏、胃和胰腺等恶性肿瘤中因受到相应的刺激,重新获得合成AFP的能力出现了甲胎蛋白含量升高的情况。检查血清中的甲胎蛋白含量结合一些影像学检查能方便快捷地对肝癌进行临床诊断。
甲胎蛋白因在胚胎时期就已经出现,机体对其已产生免疫耐受性,甲胎蛋白再次在肝脏中合成时难以产生有效的免疫应答,无法对肝癌细胞进行杀伤,所以甲胎蛋白也可作为肝癌免疫治疗的潜在靶点。基于甲胎蛋白作为靶点的临床试验已经开展。利用AFP抗原决定簇肽制备肝癌疫苗进行小鼠实验,测定小鼠肿瘤大小和细胞因子(IL-2、IL-10、IFN-γ)发现对照组肿瘤直径为(12.28±3.49) mm,经AFP肝癌疫苗治疗的小鼠其肿瘤直径为(8.87±3.49) mm,实验结果说明AFP肝癌疫苗能有效抑制肿瘤的生长;实验组小鼠血清中细胞因子相比于对照组存在不同程度的上调,而淋巴细胞活化负调控因子IL-10表现出显著的抑制作用[43]。
AFP特异性多肽疫苗表现出来的显著抗癌活性能为今后肝癌的临床治疗提供实验依据,但是AFP多肽疫苗也存在一定的局限性,它只针对AFP特异性的免疫反应,而肝癌细胞AFP抗原的表达存在一定的异质性,临床上存在1/3的肝癌患者的甲胎蛋白水平并未明显升高的情况,这会影响患者的临床诊断延误疾病的治疗。
3.2 树突状细胞疫苗 树突状细胞(DC)是人体内抗原递呈能力最强的细胞,通常情况下人体内的DC细胞数量很少,只有抗原递呈细胞发挥正常呈递功能时身体才能有效识别病原,激活免疫系统产生免疫反应。肿瘤疫苗通常是利用肿瘤抗原物质诱导机体产生特异性免疫反应达到治疗肿瘤的目的。树突状细胞疫苗是体外培养病人单核细胞诱导生成DC细胞,负载相应的肿瘤抗原制成含肿瘤抗原的树突状细胞,再将细胞回输到病人体内激活毒性T淋巴细胞增殖实现杀伤肿瘤的作用。2010年4月FDA批准了第一个抗肿瘤树突状细胞疫苗Provenge用于治疗前列腺癌,但是疗效并不理想。为提高抗肿瘤树突状细胞疫苗疗效需要对其进行改进,有研究团队将疫苗与免疫检查点抑制剂相结合以提高药物疗效。Wilgenhof等[44]将特异性疫苗和免疫检查点CTLA-4抑制剂两者相结合用于晚期黑色素瘤Ⅱ期临床研究。39名黑色素瘤病人在接受树突状细胞疫苗和Ipilimumab联合治疗之后,6个月疾病控制率为51%,整体肿瘤反应率为38%,其中完全反应8例,部分反应7例。1年和2年生存率分别为59%和38%。O’Day等[45]利用Ipilimumab单药治疗晚期黑色素瘤患者其1年和2年的生存率分别为47.2%和32.8%。实验结果表明肿瘤疫苗与免疫检查点联用与单一药物治疗相比具有显著优势。上述临床结果为肿瘤疫苗与免疫检查点联合使用提供临床数据支持,两者相结合的治疗策略具有很好的发展前景。
200项临床试验已经表明DC疫苗安全可靠能高效激活病人产生抗肿瘤免疫反应。未来DC疫苗还将运用到肝癌、肺癌等其他癌症疾病。基于DC疫苗与免疫检查点抑制剂联用等新的治疗策略会被开发并运用到更多临床试验中[46]。
3.3 溶瘤病毒疫苗 溶瘤病毒通过感染癌细胞引起病毒性细胞病变并诱发宿主抗肿瘤免疫反应,从而选择性杀死癌细胞。2015年美国FDA和欧洲药物管理局(EMA)批准了经基因工程改造的单纯疱疹病毒Ⅰ型(HSV-1)命名为lmlygic用于治疗黑色素瘤。lmlygic直接注射到肿瘤组织能高效感染肿瘤细胞引起肿瘤细胞裂解,裂解的肿瘤细胞释放出肿瘤相关的抗原,在人粒细胞-巨噬细胞集落刺激因子(GM-CSF)作用下,激发机体抗肿瘤的免疫反应[47]。除了HSV-1外,尚有许多不同类型的病毒已经进入临床试验以评估其生物安全性和抗肿瘤疗效,主要包括腺病毒、痘病毒、麻疹病毒和呼肠孤病毒等。Heo等利用JX-594痘苗病毒以确定晚期肝癌患者的最佳JX-594剂量。随机对处在Ⅱ期的30名患者进行试验,受试者中有16名患者(HBV感染患者占37%,HCV感染患者占19%)注射高剂量JX-594,而14名患者(HBV感染患者占43%,HCV感染患者占21%,酒精相关肝癌患者占14%)则注射低剂量,两种剂量中位生存期分别为14.1个月和6.7个月,高剂量组的生存期明显高于低剂量组,结果表明受试者生存期和剂量存在一定的相关性[48]。
采用溶瘤病毒与免疫检查点抑制剂相结合治疗策略能实现更好的治疗效果。在一项1b期临床试验中,Ribas等[49]将溶瘤病毒与抗PD-1抗体Pembrolizumab联用评估其安全性。使用Pembrolizumab单药进行PD-1阻断治疗可使转移性黑色素瘤患者客观反应率达33%[50],病人在接受溶瘤病毒与Pembrolizumab联合用药后其客观反应率达62%,完全缓解的占33%。患者体内CD8+ T细胞数增加,IFN-γ基因出现过度表达。试验结果表明溶瘤病毒与Pembrolizumab联用疗效优于PD-1单一抗体,但是由于研究人数有限,还需要更多的临床试验进一步证明溶瘤病毒与免疫检查点抑制剂联用优于单药治疗。目前,治疗晚期肝癌的瘤苗病毒项目(临床试验登记号NCT02562755)尚在临床Ⅲ期,预期2019年10月完成研究,但是截止至12月相关研究机构还未公布临床结果。
溶瘤病毒作为肿瘤免疫治疗方法虽然许多仍处于临床研究早期阶段,但是因其具有杀伤肿瘤和激活肿瘤免疫的双重功效使得它一直备受关注,其抗肿瘤活性和疫苗自身稳定性都将会是未来研究的热点。
4 展望 免疫治疗是目前肝癌治疗方法中的重要研究方向,并且在肝癌的治疗中取得了令人可喜的结果,越来越多的医疗机构将免疫治疗作为一种常规的手段运用到临床,但是仍然存在着研发难度大、临床试验缺乏等不足,在未来可从以下4个方向进一步挖掘。一是新的肿瘤细胞表面免疫治疗标志物的发现。医生可以根据患者的各项标志物指标选取最优的治疗方案,做到早期发现、早期诊断、早期根治。二是各种治疗方法的联合运用。对比不同治疗方案的优缺点取长补短,治疗方案相互协调,提高免疫治疗的效能和特异性。三是对肝癌免疫病理和分子病理进行更加系统全面的研究。由慢性病毒感染(乙肝、丙肝)引发的肝癌和酒精肝、药物/诱变剂引发的肝癌在分子病理、免疫应答方面均有所不同,对不同肝癌致病因素的研究有助于阐述肝癌发生病因和发病机理,为新型肝癌免疫治疗方法的开发奠定理论基础。四是新型治疗策略的开发。将免疫治疗药物与高分子纳米材料或者生物载体相结合以提高药物的载药量和靶向性。
随着对分子生物学和分子免疫学研究的深入,肿瘤微环境中T细胞对肿瘤免疫具有重要的影响,不同T细胞亚群发挥不同的功能,对肿瘤微环境中免疫细胞亚群的鉴定及其变化可作为肿瘤预后的检测指标之一。作用于免疫检查点PD-1/PD-L1和CTLA-4的部分药物在多种肿瘤中均有优异的表现,但是获益人群有限,临床上仍无法获得满意的结果,新型免疫检查点的鉴定及其与免疫细胞亚群所介导的新型免疫疗法将会为肝癌的免疫治疗提供更多新的思路,改进目前免疫治疗存在的不足,对改善肝癌患者的生存质量、延长生存期、降低复发率都有着重要的作用。
 2019, Vol. 35
2019, Vol. 35