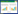中国科学院微生物研究所、中国微生物学会主办
文章信息
- 寻东民, 蒋晓宇, 孔令玺, 李宗浩, 钟超
- Xun Dongmin, Jiang Xiaoyu, Kong Lingxi, Li Zonghao, Zhong Chao
- 粘合材料及其在生物医学中的应用:进展与展望
- Application of adhesive materials in biomedicine: progress and prospects
- 生物工程学报, 2019, 35(12): 2386-2400
- Chinese Journal of Biotechnology, 2019, 35(12): 2386-2400
- 10.13345/j.cjb.190366
-
文章历史
- Received: August 13, 2019
- Accepted: November 9, 2019
2. 上海科技大学 生命科学与技术学院,上海 201210
2. School of Life Science and Technology, Shanghai Tech University, Shanghai 201210, China
粘合材料,是一种可以通过粘合作用,将两个分离的物质连接在一起,并阻止其分离的材料[1]。作为最重要的辅助材料之一,传统粘合材料广泛应用于多种工业生产或制造中,包括但不限于包装作业、汽车制造以及工业涂层或填料等领域[2]。
在粘合材料的诸多应用场景中,生物医药领域是一个十分重要的应用场景[3]。因其较强的界面和内在粘合作用,粘合材料在生物医药领域特别是在物理性损伤治疗和修复方面已经得到广泛的关注[3-4]。相较于传统的缝合线和手术螺钉,粘合材料在生物医药领域具有很多独特的优势,主要体现在以下几方面:1)手术操作简单、能够有效地缩短手术时间[5];2)治疗损伤最小化,减轻患者痛苦[5-7];3)防止体液渗漏,并减少二次损伤[8-9]。
现阶段90%的医用粘合剂都是以伤口敷料等形式应用于外部伤口的局部(如皮肤、牙齿等)[10]。这可能是因为同一般行业对粘合剂功能的需求类似,传统医用粘合剂具有的功能也较为有限,通常只能部分满足相关机械性能(例如粘合强度)方面的要求;而在特殊的生物医药场景下,粘合剂通常还需要具有各种特殊性质才能满足复杂的医疗需求[11]。随着合成化学和生物工程技术的不断发展,特别是从仿生角度出发制备的一些粘合材料表现出较好的生物相容性、生物可降解等特征,拓展了其在生物医学方面的应用潜力。近几十年来,虽然粘合剂的材料与形式发生了很大的改变,但其本质以及最基础的应用需求在生物医药领域里并未发生很大的变化,主要包括以下方面[12-13]:1)物理保护伤口;2)加速伤口愈合;3)提供物理支撑力;4)防止感染;5)填充空腔等。
本文针对粘合材料在生物医学中的发展和应用作简要概述,并对新一代粘合剂的可能发展方向与前景进行了展望。
1 医用粘合材料发展现状人类社会的发展与人类活动密不可分,人类涉猎的很多活动易引发机体功能障碍。最为常见的便是物理性损伤,例如皮肤创伤、组织挫伤、骨折骨裂等。在生物医学领域,针对物理性损伤的治疗主要有止血、闭合伤口、手术修复以及重建受损或退化的软组织。对于止血以及伤口愈合的治疗最早可以追溯到远古时代,那时的人类便知道使用天然植物的叶片作为敷料来处理伤口[14]。除此之外,历史上记载公元前1100年,缝合针线已被用于缝合伤口[15]。随着人类文明的进步和科技的发展,手术螺钉等通过物理作用提供物理支撑来满足医疗需求的材料应运而生。尽管诸如缝线和螺钉这类材料能够实现伤口闭合以及固定植入物,但是这些方法的弊端也很明显:手术过程中会产生额外的创伤和渗漏[8-9];人体组织对固定装置的排异使得组织整合性差;术后仍需手术拆除,造成二次损伤,加剧痛苦[5-7];新的创伤还会引发伤口感染等潜在问题。为了解决这一系列问题,人类着手于开发新型的医用材料或医疗器具以用于治疗物理性损伤,而生物医用粘合材料因其操作简便、患者痛苦小、二次损伤少的优越性逐渐进入人们的视野。
1.1 粘合材料应用于生物医药所需的特性对于粘合剂来说,最重要的属性就是粘合力。粘合力主要分为两种:内在粘合力(Cohesive force)以及界面粘合力(Adhesive force)。内在粘合力指的是粘合材料自身的内在作用力,指材料内部的粘合强度,与应用场所无关;界面粘合力指的是材料与不同界面之间产生的力的作用,以达到粘附的效果。界面粘合力主要涉及分子间力的相互作用,可能涉及的相互作用有离子键、共价键、氢键、偶极相互作用以及范德华力。一般材料的界面粘合力大小范围在0.01-6.00 MPa[16]。
对于医用粘合材料来说,除需具备传统工业对粘合材料所需要的必要粘合强度之外,最基本的性能便是生物相容性和生物可降解性。生物相容性是描述生物医用材料与人体之间相互作用产生的各种生物、物理、化学反应的性质,是指材料与宿主生命系统接触时不会产生对宿主产生不利影响的材料属性[17-18];生物可降解性指的是粘合材料通常具有被人体降解、不对人体造成持续伤害的材料属性[16]。这两者都是评价生物材料安全性与功能性的重要指标。此外,由于应用环境的不同,医用粘合剂有时还需要具有抗菌、可在湿环境等特殊环境下的适用性等其他方面的性能,为此,科研工作者也在努力构建各种具有多功能特性的粘合材料。
1.2 医用粘合材料发展概述最早的医用粘合材料都源自于天然产物,如植物提取物[16]。之所以最早的医用粘合剂来源于植物,不仅因为其易于提取的特点(例如使用乙醇即可提取),还因为许多植物提取物通常具有抗菌等特点[19]。此外,早在1754年,人类从鱼中提取出蛋白粘合材料,这是有记载报道的第一次从动物体内提取粘合材料[20]。随后,越来越多的天然粘合材料被提取出来,逐渐在医疗中取代针线在某些特定场景下使用。
随着化学合成技术的进步,以有机溶剂为原料制备的粘合材料逐渐出现在市面上,并且凭借其良好的粘合能力逐渐占据了主流[21]。但由于医疗诉求的不断提高,人们对多功能粘合剂的需求也越来越大,科研工作者以丰富粘合剂的功能为导向,开始研发具有特殊功能的新型粘合剂[11],并尝试将此类粘合剂应用于生物医疗行业。
1.3 主要的商业化医用粘合剂概述现阶段,市面上主要的商业用医用粘合剂主要分为3类:1)生物基粘合剂;2)有机合成的粘合剂;3)复合型粘合剂。表 1列举了几种常见的商用粘合剂。
| Products | Materials | Adhesiveness | Reference |
| Skin graft2* | Skin | 5-40 J/m2 | [23] |
| ALGICELL® | Alginate | 3 J/m2 | [24] |
| AAD | Alginate-PNIPAM | 200 J/m2 | [25] |
| TA | Alginate-PAAm | 1 200 J/m2 | [24] |
| Tegaderm® | Acrylate | 20-40 J/m2 | [24, 26] |
| COSEAL® | PEG | ~30 J/m2 | [27] |
| AdvaSeal® | [27] | ||
| DuraSeal® | [27] | ||
| TISSEEL® | Fibrin | 60 J/m2 | [28] |
| Hemaseel® | [28] | ||
| Dermabond® | Cyanoacrylate | 300 J/m2 | [29] |
| GRF® | Hybrid adhesives | 104-105 Pa | [30] |
| BioGlue® | [30] | ||
| TissuGlu® | [31] |
生物基粘合材料指自然界中生物体产生的天然粘合材料,这些粘合材料大多具有良好的生物相容性和低免疫原性[22],按照其组分的不同大致可分为蛋白质类粘合材料和多糖类粘合材料。
自然界中有许多无脊椎动物分泌粘性蛋白,如贻贝粘性蛋白(Mussel adhesive protein,MAP) (图 1),这些蛋白具有良好的生物可降解性以及生物相容性[32],已经实现细胞和组织之间的成功粘合,并且在皮肤、粘膜、软骨、骨骼等创口和手术切口的粘合中得以应用[33]。纤维蛋白粘合材料(Fibrin sealant,FS)是一种十分重要的蛋白粘合材料,它来源于血浆,由纤维蛋白和凝血酶类物质混合而成,纤维蛋白原裂解为纤维蛋白肽A和B,同时凝血酶激活因子Ⅷ促使A和B交联,最终形成凝块[34]。此外,胶原类粘合材料也是蛋白质类粘合材料中重要的一部分。胶原蛋白约占哺乳动物体内总蛋白含量的1/3,具有良好的生物活性、生物相容性以及生物降解性,能促进伤口愈合,广泛应用于医疗美容、止血修复、组织支架和药物缓释等方面,但将其用作组织粘合剂的报道比较少[35]。明胶是胶原的降解产物,具有良好的生物相容性和生物降解性,能形成透明、柔韧、高强度的胶,但其强亲水性使得结构不稳定,因此,常常对明胶进行交联改性以便在生理条件下使用[35]。
壳聚糖是一种常见的多糖类粘合材料,由自然界广泛存在的甲壳素经过脱乙酰作用得到。这种粘合材料具有优良的生物相容性、生物降解性以及止血、抗菌功能,已作为止血敷料广泛应用于临床,HemConTM就是一种被美国FDA批准上市的止血绷带[36]。由于壳聚糖含有大量氨基,仅在碱性条件下,通过暴露伯胺基团产生化学共轭反应发挥粘附作用,在生理条件下带正电荷,单独使用时与组织的粘附力差。而且,壳聚糖在体液环境中难以有效溶解,因而在人体内的粘附性不高。除壳聚糖外,海藻酸盐(断骨粘合剂)[37-39]和淀粉(片剂粘合剂)[40-41]等在生物医用粘合材料领域有着广泛的应用。
来源于天然成分的生物基粘合材料大多具有很好的生物相容性以及生物可降解性,但是也具有诸如产量低、价格高、粘合强度不足等缺陷[42]。现阶段对生物基粘合材料的研究大多围绕提高天然生物基粘合材料的性能展开,通过对其进行修饰改造或与其他合成材料联用(如基于溶菌酶相转变涂层的新型超疏水界面材料[43-45]),提高其作为粘合材料的可用性。
1.3.2 有机合成粘合材料科研人员最早合成的化学粘合材料大多是高分子材料,高分子材料在粘合领域扮演着十分重要的角色。聚乙二醇(Polyethylene glycol,PEG)是一种十分常用的生物相容性较好的粘合材料,市面上有很多以PEG为基础的粘合剂。由于PEG具有结构易修改的特点,人们可以通过对其结构的修改达到改变其物理性能的目的[6, 46]。PEG通常用作密封剂使用,防止手术后液体和空气的泄露。
现阶段化学合成类粘合剂的发展大多在于对已有医用高分子材料的改性,将其与不同的化学物质结合在一起,使其具有更丰富的功能。但是相较于已有的化学高分子材料,来源于生物成分的材料具有更多适用于生物医药的优良性能,将化学高分子与生物成分联合使用或将成为未来化学类粘合材料的发展主流。
1.3.3 复合型粘合材料天然生物质粘合剂个体差异性较大,普遍具有制备困难、成本较高、部分机械性能较差等问题,不利于生物医学领域的应用[47];而化学合成类粘合剂的缺陷往往是粘结部位弹性差、活体组织产生排异反应以及存在潜在的化学毒性,同样不利于生物医学领域的应用[48]。因此,使用化学或者生物工程手段将其部分功能区域修饰之后,越来越多的复合型粘合材料被制备出来,有基于粘性生物分子之间的复合、生物分子与化学修饰的复合[49]等。制备复合型粘合材料的方法有多种,大致分为以下几种:1)物理混合法:例如将淀粉与Ca2+混合得到粘性贴片GPAP (Gel-point adhesive patch)[32],而重组的贻贝粘性蛋白与蚕丝蛋白混合可以得到高粘性蚕丝蛋白纤维[50];2)模块基因法:例如受多样的海洋水下粘合材料启发,利用模块基因方法理性设计具有多蛋白模块的粘合分子,这些蛋白单体分子共混后能够进一步自组装成多功能的水下粘性蛋白纤维[51-52];3)化学接枝法:例如利用多金属氧酸盐使得碱性氨基酸组装形成胶粘剂[53],此外,通过光引发剂使得甲基丙烯酸明胶(GelMA)与氨基葡聚糖透明质酸(HA-NB)聚合形成类细胞外基质粘性水凝胶[54]。
2 前沿医用粘合材料发展概述 2.1 前沿医用粘合材料概述随着医疗技术的不断进步,仅仅具有粘附力这一单一功能的粘合剂很难满足日益增长的医疗需求。为了解决因粘合材料本身性质而产生的局限性,满足更高的医疗需求,科研工作者们灵活运用化学、化学生物学、分子生物学以及合成生物学手段,致力于研制具有更广泛适用性的、可以满足不同医疗应用场景的多功能粘合剂。需要指出的是,这些新型的粘合剂由于问世时间较短,大多数还仅停留在实验室研发或早期临床试验阶段,并未大规模应用于实际的生物医学领域。下面通过几个典型案例来简要阐述当前前沿医用粘合材料的发展状况。
2.2 基于商用粘合材料的改性研究现代前沿医用粘合材料的研究中,有很大一部分是针对已有商用粘合剂的改性研究。研究人员利用现代的化学以及合成生物学手段,针对商用粘合材料的某些缺陷对其进行改性,使其能够更好地行使粘合剂的功能。
哈佛大学医学院的Pedro Nido课题组将聚癸二酸丙三醇酯丙烯酸酯(Poly(glycerol sebacate acrylate),PGSA)与光敏引发剂结合,制作出了一种可以由紫外光光控交联的疏水光激活粘合剂(Hydrophobic light-activated adhesive,HLAA)[55]。当前临床使用的医用粘合剂大多具有一定生物毒性且粘性较弱,易在水环境中脱落[56-57];另一方面,粘性较强的粘合剂通常固化速度较快[58-61],在临床时施胶难度较大。HLAA则可以很好地调和这两者之间的矛盾。HLAA在具有较好粘性的同时可以通过紫外光的照射来实现固化,其在光照强度为0.38 W/cm2的紫外光的照射下,约5 s即可达到最大粘合强度(1.8 N/cm2,约为同类型市售粘合剂粘合强度的2.75倍)[55],大大降低了手术中粘合剂的使用难度,实现快速有效的粘合。
由于天然粘性蛋白或者是重组粘性蛋白组分单一、机械性能不理想,因此复合型粘合材料应运而生,简单共混型粘合材料便是初尝试。Lin等[41]将5%淀粉与Ca(NO3)2·4(H2O)混合在60 ℃下搅拌得到“凝胶点”粘性贴片GPAP,该粘弹性贴片有相对较低的动态模量,且“凝胶点”设计可以平衡材料的流体和固体特性。该粘性材料在治疗急性和亚急性心肌梗死中有很好的应用,可以调节心肌的循环变形,相比于现有的无细胞心外膜贴片,更有效地重塑左心室并恢复心脏功能。Yang等[50]将重组贻贝粘性蛋白(MAP-RGD)与蚕丝蛋白(SF)共混,以改善材料的亲水性、溶胀性和生物降解性,且不影响SF原有的力学性能。按浓度比7:3混合得到的SF/MAP-RGD_7:3共混粘合剂的粘合强度可达(1.06±0.19) MPa,且能够促进哺乳动物细胞的粘附、增殖和扩散,以及生物分子(包括碳水化合物和蛋白质)的有效附着,因而有潜力应用于多种生物医学工程领域。
同样受贻贝足丝蛋白粘合现象的启发,袁梅华等[62]在丝素蛋白大分子上接枝多巴胺(3, 4-dihydroxyphenylalanine, DOPA),利用能促进丝素蛋白自组装的聚乙二醇,和具有良好生物相容性的交联剂NHS/EDC,制得具有强耐水性的多巴胺/丝素蛋白粘合剂(NESFB-DOPA),在水中浸泡42 h后的粘合强度为(503.3±16.54) kPa,体外证实无细胞毒性且具有良好的降解性,有望用于创口修复领域。
2.3 基于理性设计的新型粘合材料除了基于已有商业粘合剂的研究之外,还有一类基于理性设计的新型粘合材料(表 2),这些新型粘合材料对于丰富粘合材料的内在性能、推动多功能粘合材料的发展起到了决定性的作用。
传统粘合剂一般以天然生物成分或有机溶剂为基础制备,通常只能在干燥或者低湿润度的环境中发挥粘合功能。然而在生物医疗领域中的某些应用场景下(如对体内组织的粘合),粘合剂通常需要具备有效的在水环境下的粘合能力,但是常见的商用高分子粘合剂在水环境中往往会被弱化或者破坏[61]。为解决这一问题,研究人员通过对水下天然存在的生物粘合剂进行模仿,设计出了具有水下粘合功能的粘合剂[64-66]。
在自然界中,许多海洋生物对海底岩石表现出异常牢固的粘附能力,例如贻贝、藤壶等,研究人员分析这类生物后发现DOPA是其中一种重要的粘性成分。DOPA在天然水下界面粘附中具有优秀的交联耦合能力,近年来,一些以DOPA为基础设计的多肽[67-68]、水凝胶[69]、聚合物[66, 70]等材料被研制出来,在界面粘附领域引起了很大反响。随后,麻省理工学院Timothy K. Lu课题组报告了一种利用大肠杆菌淀粉样卷曲纤维的主要亚结构CsgA蛋白与贻贝足蛋白(富含DOPA)融合获得的强力多功能水下粘合剂(图 2)[51],这种仿生混合纤维的设计,使这一粘合剂获得了较高的(20.9 mJ/m2)的水下粘合能(Underwater adhesion energy),是在此之前报道过的所有生物衍生和生物启发蛋白基水下粘合剂粘附能力最大值的1.5倍。同时该研究也提出了一种利用理性设计结合模块基因策略的方法来构建新的生物材料(包括水下粘合材料),构建的多蛋白结构域蛋白分子通过自组装最后形成能媲美甚至超越自然材料性能的分子材料[51]。近来,利用类似的模块基因策略,Cui等构建了富含低复杂蛋白结构域(Low-complexity domains)的重组蛋白,利用该蛋白具有液-液相分离(Liquidliquid phase separation)以及液态到固态相转变的逐步自组装能力,设计出了在不同表面都有极强粘附效果的水下粘合涂层材料[52]。其48.1 mJ/m2的水下粘合能使其成为目前已报道的最强水下粘合剂。尽管这两种粘合材料具有很强的粘性,但是否拥有良好的生物相容性仍需进一步实验检验。

|
| 图 2 模块基因方法构建自组装淀粉样蛋白水下粘合材料(改自Zhong et al[51]) Fig. 2 Modular genetic design for self-assembling amyloid underwater adhesives (Adapted from Zhong et al[51]). (A) Schematic of two independent natural adhesive proteins (curli from E. coli and mussel foot proteins (Mfps) from mussels. Curli are adhesive amyloid fibres composed of the major functional subunit CsgA. CsgA contains five stacked strand-loop-strand motifs mediated by conserved residues and can self-assemble into nanofibres via a rate-limiting nucleation step followed by fibril extension. Mfp3 and Mfp5, major mussel adhesive foot proteins, have unstructured coil structures in solution and are critical to the underwater interfacial adhesion of mussels. (B) The modular design of artificial adhesive materials is enabled by rationally fusing genes encoding the two natural adhesive elements shown in A. (C) Schematic of predicted cross-β-strand structures for CsgA-Mfp3 and Mfp5-CsgA in solution. (D) Because of the amyloidogenic domains, CsgA-Mfp3 and Mfp5-CsgA monomers can self-assemble into large bundles of fibrils or hierarchical networks of filaments. In vitro copolymerization of the CsgA-Mfp3 and Mfp5-CsgA monomers can lead to hierarchically co-assembled structures with two different adhesive domains displayed on amyloid scaffolds, potentially recapitulating intermolecular interactions between Mfp3 and Mfp5 molecules in natural mussel adhesion systems. |
| |
此外,吉林大学李文课题组通过碱性氨基酸单体和多金属氧酸盐共组装制作了一种可以由水触发的湿环境粘合剂[53]。Xu等[53]利用一种阴离子聚氧金属酸盐H4SiW12O40激活组氨酸(Histidine),使其在水的作用下,利用氢键、离子以及两性离子的相互作用的组合驱动共组装,生成一种超分子交联的粘合材料。这种湿粘合剂能够轻易地粘合在不同的固体表面,包括玻璃、金属和聚合物板以及自然表面,如木材、石头和海螺壳等。而在除去粘合材料中的水成分之后,生成的粉末状物质则会失去其具有的粘附性能,实现可逆的粘合状态的交替。在这一过程中,H4SiW12O40不仅作为引发组氨酸分子超分子交联的支架,而且还作为氧化还原组分,赋予了此粘合剂导电变色的特性。
这些新型的水下粘合材料虽然目前尚未真正应用到生物医药行业,但是为医用水环境粘合材料的发展奠定了重要的基础。
2.3.2 用于组织粘附的粘合剂可以与生物组织有较强结合作用的粘合剂通常拥有广阔的应用前景,如组织修复[63, 71]、药物递送[72-73]以及伤口敷料[74-75]。但是,通常来说,能与生物组织有较强结合作用的粘合剂都具有一定的生物毒性。因此,如何调和组织粘附性与生物毒性成为了组织粘附粘合剂发展历程中的一个难题。
仿生学给出了答案之一。自然界中有很多软体动物,它们在不活跃时,会利用凝胶类的物质将自己粘附在固定的地方或实现防御等功能。哈佛大学的Li等[24]受到软体动物鼻涕虫分泌的防御性粘液[76]的启发,设计出了具有较低生物毒性强力组织粘合剂(图 3)。这种粘合剂是由两层基质组成的仿生设计:粘合剂表面和耗散基质(Dissipative matrix)。前者通过静电相互作用、共价键和物理互穿作用附着在基底上;后者通过滞后(Hysteresis)放大能量耗散。两层基质相互作用使粘合剂在湿表面的粘附能力进一步提升,实现与猪的皮肤、软骨、心脏、动脉以及肝脏的紧密结合。据报道,该粘合剂已经成功实现了对猪穿孔心脏和白鼠肝脏的迅速修复,有望在未来应用于人体。

|
| 图 3 组织粘附剂用于猪心脏和小鼠肝脏修复(改自Li et al[79]) Fig. 3 Tissue adhesives (TAs) applied for repairing pig heart and mouse liver (Adapted from Li et al[79]). (A) TAs were used as tissue adhesives. A TA adhered to the liver and sustained 14 times its initial length (λ) before debonding. Scale bars, 20 mm. (B) TAs served as heart sealants. The TA sealant prevented liquid (red) leakage as the porcine heart was inflated. ΔP, change in pressure. Scale bars, 10 mm. (C) Burst pressures of the TA sealant were measured without (TA) and with plastic backing (TA-B). (D) Use of a TA as a hemostatic dressing. A deep wound was created on rat liver and then sealed with a TA to stop the blood flow (labeled with red arrows). (E) Blood loss with the treatment of TA, SURGIFLO hemostat, and control (without treatment). Error bars indicate SD; n=4. P values were determined by a Student's t test; ***P≤0.001; ns, not significant. |
| |
除此之外,陕西师范大学杨鹏教授课题组利用溶菌酶相转变蛋白实现了能粘附牙体组织的涂层材料[77]。该淀粉样蛋白涂层材料还可以原位诱导矿化羟基磷灰石,能够快速便捷地与牙本质小管结合并使其封闭,为牙齿敏感的治疗提供了一种廉价、快速、持久的治疗方式。
2.3.3 用于加速伤口愈合的粘合剂伤口护理一直是临床护理中一个主要的问题[78-79]。对于人个体来说,随着年龄的增长,伤口自然愈合的能力越来越弱,在愈合过程中遭受感染的几率也会增大。现阶段对于伤口的治疗大多是用纱布或绷带等,主要目的是保持伤口水分、控制渗出物以及提供药物来防止感染的发生。
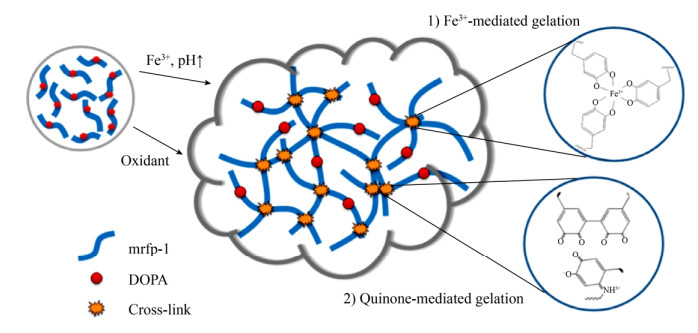
现阶段对伤口的治疗思路主要是使伤口自然修复,而当伤口面积较大或伤口愈合较慢时,这种疗法就不再适用了[80-81]。受到动物胚胎的启发,哈佛大学和麦吉尔大学的Blacklow等开发出了一种活性粘合剂敷料[25],可以通过机械作用力加速伤口的愈合。研究人员发现,在动物胚胎发育过程中愈合的伤口通常不会留下疤痕。这是因为胚胎细胞通常采取一种不同的策略来愈合伤口:通过使伤口周围的肌动蛋白纤维收缩,将其边缘拖拽收缩在一处以达到伤口愈合的效果。Blacklow等[25]仿照这一过程,设计出了一种加入了PNIPAm (Poly(N-isopropyl acrylamide),一种热响应聚合物)和银纳米颗粒的藻酸盐水凝胶(图 4)。PNIPAm是一种热敏性聚合物,具有在32 ℃的温度下收缩的特性。当粘附到人体皮肤表面时,人体的热量会加热PNIPAm,导致凝胶以及凝胶粘附的皮肤收缩,从而加快伤口的愈合。同时,由于加入了银纳米颗粒,在无需额外的抗生素加入的情况下,该凝胶粘性材料也能起到抑菌的效果。最后,研究人员通过调节凝胶中PNIPAm的含量改变凝胶收缩强度,从而发展了适用于人体不同皮肤部位的水凝胶粘性材料[25]。
|
| 图 4 生物灵感AAD材料促进伤口愈合(改自Blacklow et al[25]) Fig. 4 Bioinspired design of AAD for promoting wound contraction (Adapted from Blacklow et al[25]). (A) Skin wounds of chicken embryo. An actin cable (green) is formed in the cells at the wound edges and contacts the wound. (B) Active wound contraction enabled by AAD that adheres to and contracts the wound edges at the skin temperature. Red dashed arrows indicate the contraction. |
| |
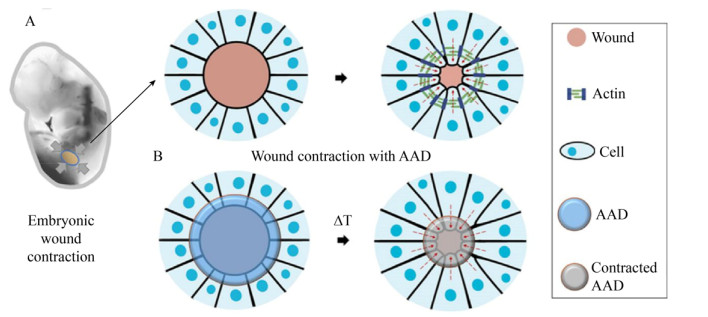
此外,抗菌特性已成为粘合剂开发中的一项重要性能加以考虑。具有抗菌能力的粘合材料在促进伤口愈合方面也有十分重要的贡献。在生理条件下,由于微生物的定植,可能会对粘合材料的性能造成一定程度的影响,并有可能导致一系列并发症,对人体产生危害[82-83],这对于伤口愈合来说是一个十分严峻的问题。西安交通大学前沿科学技术研究所的Zhao等以季铵化壳聚糖-g-聚苯胺(QCSP)和苯甲醛基功能化聚乙二醇-共-聚(癸二酸甘油酯) (PEGS-FA)作为抗菌、抗氧化、电活性敷料,研制了一系列可注射导电自愈合水凝胶(图 5)[84]。这种多功能特性的水凝胶能显著促进体内伤口愈合过程,是皮肤伤口愈合的最佳候选材料[84]。
|
| 图 5 QCSP/PEGS-FA水凝胶合成原理图(改自Zhao et al[84]) Fig. 5 Schematic representation of QCSP/PEGS-FA hydrogel synthesis (Adapted from Zhao et al[84]). (A) Synthesis of QCSP copolymer. (B) Synthesis of PEGS-FA copolymer. (C) Preparation of QCSP/PEGS-FA hydrogel. (D) Photographs of PEGS-FA solution, QCSP solution and hydrogel QCSP3/PEGS-FA1.5. (E) The bending and pressing shapes of soft and flexible hydrogel QCSP3/PEGS-FA1.5. Scar bar = 5 mm. |
| |
粘合材料是重要的辅助材料之一,广泛应用于多个领域。传统粘合剂一般来自于天然动植物提取物或由有机溶剂制备得来,对其性能的改造往往专注于在非水环境下的粘合强度和相关性能的提升或优化。然而在大多数实际应用场景中需要能在水下发挥效能的粘合材料,尤其在许多涉及到生物医药方面的场景中,例如伤口修复、骨组织粘合等,这些粘合材料除了需要在生理环境下表现出较好的组织粘合外,还需要具备生物相容、生物可降解等一种或多种新的性能或功能。
随着现代医学的发展和完善,医生面对的可以选择利用粘合材料的各种医用场景将会日渐增多,因此对于多功能医用粘合材料的诉求势必增加。然而,分析当前已经得以在生物医药中运用的粘合材料,例如已经商用的蛋白质醛和纤维蛋白粘合剂,这些粘合剂基本都是针对某一种特定的需求而设计的,无法达到可适用于多种医药领域的通用粘合剂的诉求。因此,对科研人员和企业生产来说,发展一种能同时满足不同需求的多功能粘合材料,是一件极具挑战的任务。近年来,科研人员从自然生物粘合现象中受到启发,灵活运用化学合成、合成生物学以及生物基因重组等手段,引入生物仿生的概念,以期发展出能够兼具生物相容、生物降解、环境响应、自修复可再生等优越性能的粘合材料。
本文中所提及的很多医用粘合材料正是基于特定医用需求而发展的具有多功能特性的粘合材料。此外,还有许多具有独特功能的粘合剂应运而生,如可自我修复的粘合剂[85-87]、可逆粘合剂[88-89]、活体粘合剂[90]等。这些多功能导向的粘合材料大多还处于实验阶段,尚未真正投入到产业应用中。但是当天然粘合材料的粘合机理以及新颖的设计理念被后续的科研人员逐步理解,并发展出在某些特定环境下更为实用的新一代粘合材料之时,这种多功能导向的粘合剂也就成功迈入了应用导向的大门。
未来新一代粘合剂将以多功能通用型粘合剂为发展方向,并且结合环境响应能力实现粘合剂性能按需粘合并具有动态可调节的特点。换言之,新一代粘合剂有望实现兼具生物活性特性和粘合基本性能两方面特征的活体粘合材料。例如,Zhang等[90]受自然界生物材料系统(比如骨骼、海洋粘合材料)具有环境响应、自修复和自适应性能的启发[91],基于枯草芽孢杆菌生物被膜,首次发展出了一种兼具强大粘合能力和生物活性(可自我再生、具有一定环境适应力)的多功能活体胶水(图 6)[90]。目前该活体胶水尚未能够应用于医疗领域,但是随着近年来基因编辑技术在哺乳动物细胞中的广泛应用,可以想象在不久的将来,人们可以通过基因编辑手段定向改造哺乳动物细胞使其分泌并在细胞外组装相应的粘合分子,随后作为一种具有生物活性的粘合材料,将其重新植入人体发挥功能。由于活体材料所具有的独特性质和显著优势,设计出可应用于生物医疗领域的活体粘合材料,势必成为医用粘合剂领域的下一个研究热点。

|
| 图 6 基于细菌生物被膜工程改造的活体胶水(改自Zhang et al[90]) Fig. 6 Natural underwater adhesion systems inspire biofilm-based functional cellular glues (Adapted from Zhang et al[90]). (A) Illustration of natural marine adhesive systems that employ distinct adhesion principles. Left, barnacles using cement proteins containing amyloid-like structures. Middle, mussels using adhesive foot proteins possessing Dopa, tyrosine, and lysine residues that contribute to interfacial adhesion, cation-π mediated self-coacervation and cohesion. Right, sandcastle worms using oppositely charged polyelectrolyte-induced complex coacervates. (B) Rational design for functional cellular glues based on engineered B. subtilis biofilms containing adhesive components inspired by three natural marine systems. Top, Conceptual illustration of an integrated biofilm-based functional cellular glue on a substrate, showing bacterial cells embedded inside a functionalized extracellular matrix that is rich in engineered amyloid structural proteins fused with a mussel foot protein (TasA-Mefp5), engineered biofilm surface proteins fused with an engineered mussel-derived peptide (BslA-Mfp3Sp), exopolysaccharides (EPS), and metal ions. |
| |
| [1] |
Kinloch AJ. Adhesion and Adhesives:Science and Technology. New York:Chapman & Hall, 1987. |
| [2] |
Brockmann W. Adhesive Bonding. Wiley-VCh, 2009. |
| [3] |
Park KH, Seong KY, Yang SY, et al. Advances in medical adhesives inspired by aquatic organisms' adhesion. Biomater Res, 2017, 21: 16. DOI:10.1186/s40824-017-0101-y |
| [4] |
Vernengo AJ. Adhesive Materials for Biomedical Applications. Adhesives:Applications and Properties, 2016, 99. |
| [5] |
Bouten PJM, Zonjee M, Bender J, et al. The chemistry of tissue adhesive materials. Progr Polym Sci, 2014, 39(7): 1375-1405. DOI:10.1016/j.progpolymsci.2014.02.001 |
| [6] |
Annabi N, Tamayol A, Shin SR, et al. Surgical materials:Current challenges and nano-enabled solutions. Nanotoday, 2014, 9(5): 574-589. DOI:10.1016/j.nantod.2014.09.006 |
| [7] |
Tajirian AL, Goldberg DJ. A review of sutures and other skin closure materials. J Cosmet Laser Therapy, 2010, 12(6): 296-302. DOI:10.3109/14764172.2010.538413 |
| [8] |
Bruce J, Krukowski ZH, Al-Khairy G, et al. Systematic review of the definition and measurement of anastomotic leak after gastrointestinal surgery. Br J Surg, 2001, 88(9): 1157-1168. DOI:10.1046/j.0007-1323.2001.01829.x |
| [9] |
Pickleman J, Watson W, Cunningham J, et al. The failed gastrointestinal anastomosis:an inevitable catastrophe?. J Am College Surg, 1999, 188(5): 473-482. DOI:10.1016/S1072-7515(99)00028-9 |
| [10] |
Wheat JC, Wolf JS. Advances in bioadhesives, tissue sealants, and hemostatic agents. Urol Clin, 2009, 36(2): 265-275. DOI:10.1016/j.ucl.2009.02.002 |
| [11] |
Pinnaratip R, Bhuiyan MSA, Meyers K, et al. Multifunctional biomedical adhesives. Adv Healthc Mater, 2019, 8(11): 1801568. DOI:10.1002/adhm.201801568 |
| [12] |
Mehdizadeh M, Yang J. Design strategies and applications of tissue bioadhesives. Macromol Biosci, 2013, 13(3): 271-288. DOI:10.1002/mabi.201200332 |
| [13] |
Xia YR, Xu YX, Liu WB, et al. Development and application of medical adhesive. New Chem Mater, 2003, 31(4): 9-12 (in Chinese). 夏毅然, 徐永祥, 刘文冰, 等. 医用粘合剂的研究及应用进展. 化工新型材料, 2003, 31(4): 9-12. DOI:10.3969/j.issn.1006-3536.2003.04.003 |
| [14] |
Forrest RD. Early history of wound treatment. J Roy Soc Med, 1982, 75(3): 198-205. |
| [15] |
Majno G. The Healing Hand:Man and Wound in the Ancient World. Cambridge: Harvard University Press, 1975.
|
| [16] |
Blume J, Schwotzer W. Medical products and their application range//Von Byern J, Grunwald I, Eds. Biological Adhesive Systems. Vienna: Springer, 2010: 213-24.
|
| [17] |
Vert M, Doi Y, Hellwich KH, et al. Terminology for biorelated polymers and applications (IUPAC Recommendations 2012). Pure Appl Chem, 2012, 84(2): 377-410. DOI:10.1351/PAC-REC-10-12-04 |
| [18] |
Deng LJ, Fan HH, Li WD, et al. Progress in the study on biocompatibility of absorbable hemostatic materials. Chin J Biomed Eng, 2016, 35(2): 241-246 (in Chinese). 邓乐君, 樊鸿浩, 李伟达, 等. 可吸收止血材料的生物相容性研究进展. 中国生物医学工程学报, 2016, 35(2): 241-246. DOI:10.3969/j.issn.0258-8021.2016.02.016 |
| [19] |
Essawi T, Srour M. Screening of some Palestinian medicinal plants for antibacterial activity. J Ethnopharmacol, 2000, 70(3): 343-349. DOI:10.1016/S0378-8741(99)00187-7 |
| [20] |
Schellmann NC. Animal glues:a review of their key properties relevant to conservation. Stud Conserv, 2007, 52(S1): 55-66. |
| [21] |
Kardashov DA. Synthetic adhesives. Army Foreign Science And Technology Center Charlottesville Va, 1973. |
| [22] |
Cui GL, Dan NH, Dan WH, et al. Biomass-based Tissue Adhesives and Their Application Status and Development Prospects. Leather Sci Eng, 2015, 25(5): 33-40 (in Chinese). 崔国廉, 但年华, 但卫华, 等. 基于生物质的医用粘合剂及应用现状与发展前景. 皮革科学与工程, 2015, 25(5): 33-40. |
| [23] |
Dong C, Mead E, Skalak R, et al. Development of a device for measuring adherence of skin grafts to the wound surface. Annals Biomed Eng, 1993, 21(1): 51-55. DOI:10.1007/BF02368164 |
| [24] |
Li J, Celiz AD, Yang J, et al. Tough adhesives for diverse wet surfaces. Science, 2017, 357(6349): 378-381. DOI:10.1126/science.aah6362 |
| [25] |
Blacklow SO, Li J, Freedman BR, et al. Bioinspired mechanically active adhesive dressings to accelerate wound closure. Sci Adv, 2019, 5(7): eaaw3963. DOI:10.1126/sciadv.aaw3963 |
| [26] |
Pharr G, Sun JY, Suo Z. Rupture of a highly stretchable acrylic dielectric elastomer//Aps March Meeting. American Physical Society, 2012.
|
| [27] |
Hoffman AS. Conventional and Environmentally-Sensitive Hydrogels for Medical and Industrial Uses: A Review Pape//Polymer Gels. Springer US, 1991.
|
| [28] |
Kjaergard HK, Velada JL, Pulawska T, et al. Development of a model for measurement of adhesion strength of fibrin sealant to human tissue. Eur Surg Res, 1999, 31(6): 491-496. DOI:10.1159/000008729 |
| [29] |
Li L, Tirrell M, Korba GA, et al. Surface Energy and Adhesion Studies on Acrylic Pressure Sensitive Adhesives. J Adhes, 2001. |
| [30] |
Brodie M, Vollenweider L, Murphy JL, et al. Biomechanical properties of Achilles tendon repair augmented with a bioadhesive-coated scaffold. Biomedical Materials, 2011, 6(1): 015014. DOI:10.1088/1748-6041/6/1/015014 |
| [31] |
Ye M, Jiang R, Zhao J, et al. In situ formation of adhesive hydrogels based on PL with laterally grafted catechol groups and their bonding efficacy to wet organic substrates. J Mater Sci-Mater Med, 2015. |
| [32] |
Kim BJ, Oh DX, Kim S, et al. Mussel-mimetic protein-based adhesive hydrogel. Biomacromolecules, 2014, 15(5): 1579-1585. DOI:10.1021/bm4017308 |
| [33] |
Liu JP. Research on novel bioadhesive made of marine mussel adhesive protein[D]. Xiamen: Xiamen University, 2008 (in Chinese). 刘加鹏.海洋贻贝粘附蛋白新型生物粘合剂的研究[D].厦门: 厦门大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10384-2009080230.htm |
| [34] |
Wu DY, Meure S, Solomon D. Self-healing polymeric materials:A review of recent developments. Progr Polym Sci, 2008, 33(5): 479-522. DOI:10.1016/j.progpolymsci.2008.02.001 |
| [35] |
Reece TB, Maxey TS, Kron IL. A prospectus on tissue adhesives. Am J Surg, 2001, 182(2 Suppl.1): S40-S44. |
| [36] |
Rodriguez-Merchan EC. Local fibrin glue and chitosan-based dressings in haemophilia surgery. Blood Coagulat Fibrinol, 2012, 23(6): 473-476. DOI:10.1097/MBC.0b013e3283555379 |
| [37] |
Zheng J, Chen Y, Gao YH, et al. Comparative study on adhesive strength of three colloid materials and their complexes as bone adhesives. Chin J Mar Drug, 2009, 28(1): 26-28 (in Chinese). 郑江, 陈怡, 高亚辉, 等. 三种胶体材料及其复合物作为骨粘合剂的粘合强度比较. 中国海洋药物, 2009, 28(1): 26-28. |
| [38] |
Hunt NC, Grover LM. Cell encapsulation using biopolymer gels for regenerative medicine. Biotechnol Lett, 2010, 32(6): 733-742. DOI:10.1007/s10529-010-0221-0 |
| [39] |
Ye S, Ping QN, Sun MJ. Applications and Research Advances of Alginate Sodium in Biomedical Fields. Pharm Clin Res, 2018, 26(2): 120-124, 129 (in Chinese). 叶思, 平其能, 孙敏捷. 海藻酸钠在生物医药领域的应用与研究进展. 药学与临床研究, 2018, 26(2): 120-124, 129. |
| [40] |
Zobel HF. Molecules to granules:a comprehensive starch review. Starch-Stärke, 1988, 40(2): 44-50. DOI:10.1002/star.19880400203 |
| [41] |
Lin X, Liu Y, Bai AB, et al. A viscoelastic adhesive epicardial patch for treating myocardial infarction. Nat Biomed Eng, 2019, 3(8): 632-643. DOI:10.1038/s41551-019-0380-9 |
| [42] |
Gao DY, Cao JW, Sun XB, et al. Advances in isopeptide bond-mediated molecular superglue. Chin J Biotech, 2019, 35(4): 607-615 (in Chinese). 高德英, 曹佳雯, 孙小宝, 等. 基于异肽键连接的分子粘合剂研究进展. 生物工程学报, 2019, 35(4): 607-615. |
| [43] |
Yang FC, Tao F, Li C, et al. Self-assembled membrane composed of amyloid-like proteins for efficient size-selective molecular separation and dialysis. Nat Commun, 2018, 9: 5443. DOI:10.1038/s41467-018-07888-2 |
| [44] |
Liu RR, Zhao J, Han Q, et al. One-step assembly of a biomimetic biopolymer coating for particle surface engineering. Adv Mater, 2018, 30(38): 1802851. DOI:10.1002/adma.201802851 |
| [45] |
Gao AT, Wu Q, Wang DH, et al. A superhydrophobic surface templated by protein self-assembly and emerging application toward protein crystallization. Adv Mater, 2016, 28(3): 579-587. DOI:10.1002/adma.201504769 |
| [46] |
Annabi N, Yue K, Tamayol A, et al. Elastic sealants for surgical applications. Eur J Pharmaceut Biopharmaceut, 2015, 95: 27-39. DOI:10.1016/j.ejpb.2015.05.022 |
| [47] |
Zou HJ. Observation on the healing effect of fibrin adhesive on skin wound in dogs[D]. Harbin: Northeast Forestry University, 2018 (in Chinese). 邹慧蛟.纤维蛋白粘合剂对犬皮肤切口创伤愈合作用的效果观察[D].哈尔滨: 东北农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10224-1018112471.htm |
| [48] |
Liu JK. Application status and prospects of medical adhesives in thoracic surgery[D]. Shijiazhuang: Hebei Medical University, 2017 (in Chinese). 刘佳坤.医用粘合剂在胸外科的应用现状与前景[D].石家庄: 河北医科大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10089-1017827295.htm |
| [49] |
Ryu JH, Hong S, Lee H. Bio-inspired adhesive catechol-conjugated chitosan for biomedical applications:A mini review. Acta Biomater, 2015, 27: 101-115. DOI:10.1016/j.actbio.2015.08.043 |
| [50] |
Yang YJ, Kwon Y, Choi BH, et al. Multifunctional adhesive silk fibroin with blending of RGD-bioconjugated mussel adhesive protein. Biomacromolecules, 2014, 15(4): 1390-1398. DOI:10.1021/bm500001n |
| [51] |
Zhong C, Gurry T, Cheng AA, et al. Strong underwater adhesives made by self-assembling multi-protein nanofibres. Nat Nanotechnol, 2014, 9(10): 858-866. DOI:10.1038/nnano.2014.199 |
| [52] |
Cui MK, Wang XY, An BL, et al. Exploiting mammalian low-complexity domains for liquid-liquid phase separation-driven underwater adhesive coatings. Sci Adv, 2019, 5(8): eaax3155. DOI:10.1126/sciadv.aax3155 |
| [53] |
Xu J, Li XD, Li JF, et al. Wet and functional adhesives from one-step aqueous self-assembly of natural amino acids and polyoxometalates. Angewand Chem, 2017, 129(30): 8857-8861. DOI:10.1002/ange.201703774 |
| [54] |
Hong Y, Zhou FF, Hua YJ, et al. A strongly adhesive hemostatic hydrogel for the repair of arterial and heart bleeds. Nat Commun, 2019, 10: 2060. DOI:10.1038/s41467-019-10004-7 |
| [55] |
Lang N, Pereira MJ, Lee Y, et al. A blood-resistant surgical glue for minimally invasive repair of vessels and heart defects. Sci Transl Med, 2014, 6(218): 218ra6. DOI:10.1126/scitranslmed.3006557 |
| [56] |
Spotnitz WD. Hemostats, sealants, and adhesives:a practical guide for the surgeon. Am Surg, 2012, 78(12): 1305-1321. |
| [57] |
Dolgin E. The sticking point. Nat Med, 2013, 19(2): 124-125. DOI:10.1038/nm0213-124 |
| [58] |
Strehin I, Nahas Z, Arora K, et al. A versatile pH sensitive chondroitin sulfate-PEG tissue adhesive and hydrogel. Biomaterials, 2010, 31(10): 2788-2797. DOI:10.1016/j.biomaterials.2009.12.033 |
| [59] |
Lih E, Lee JS, Park KM, et al. Rapidly curable chitosan-PEG hydrogels as tissue adhesives for hemostasis and wound healing. Acta Biomater, 2012, 8(9): 3261-3269. DOI:10.1016/j.actbio.2012.05.001 |
| [60] |
Jeong JH, Hong SW, Hong S, et al. Surface camouflage of pancreatic islets using 6-arm-PEG-catechol in combined therapy with tacrolimus and anti-CD154 monoclonal antibody for xenotransplantation. Biomaterials, 2011, 32(31): 7961-7970. DOI:10.1016/j.biomaterials.2011.06.068 |
| [61] |
Rafat M, Li FF, Fagerholm P, et al. PEG-stabilized carbodiimide crosslinked collagen-chitosan hydrogels for corneal tissue engineering. Biomaterials, 2008, 29(29): 3960-3972. DOI:10.1016/j.biomaterials.2008.06.017 |
| [62] |
Yuan MH, Liu H, Cai YR, et al. Preparation and properties of silk fibroin based bioadhesive. Journal of Zhejiang Sci-Tech University: Natural Sciences Edition), 2019, 41(4): 413-420 (in Chinese). 袁梅华, 刘涵, 蔡玉荣, 等. 丝素蛋白基生物粘结剂的制备及性能评价. 浙江理工大学学报:自然科学版, 2019, 41(4): 413-420. |
| [63] |
Duflo S, Thibeault SL, Li WH, et al. Vocal fold tissue repair in vivo using a synthetic extracellular matrix. Tissue Eng, 2006, 12(8): 2171-2180. DOI:10.1089/ten.2006.12.2171 |
| [64] |
Lee BP, Messersmith PB, Israelachvili JN, et al. Mussel-inspired adhesives and coatings. Ann Rev Mater Res, 2011, 41: 99-132. DOI:10.1146/annurev-matsci-062910-100429 |
| [65] |
Brubaker CE, Messersmith PB. The present and future of biologically inspired adhesive interfaces and materials. Langmuir, 2012, 28(4): 2200-2205. DOI:10.1021/la300044v |
| [66] |
Stewart RJ, Ransom TC, Hlady V. Natural underwater adhesives. J Polym Sci B:Polym Phys, 2011, 49(11): 757-771. DOI:10.1002/polb.22256 |
| [67] |
Stewart RJ. Protein-based underwater adhesives and the prospects for their biotechnological production. Appl Microbiol Biotechnol, 2011, 89(1): 27-33. |
| [68] |
Yin M, Yuan Y, Liu CS, et al. Development of mussel adhesive polypeptide mimics coating for in-situ inducing re-endothelialization of intravascular stent devices. Biomaterials, 2009, 30(14): 2764-2773. DOI:10.1016/j.biomaterials.2009.01.039 |
| [69] |
Brubaker CE, Kissler H, Wang LJ, et al. Biological performance of mussel-inspired adhesive in extrahepatic islet transplantation. Biomaterials, 2010, 31(3): 420-427. DOI:10.1016/j.biomaterials.2009.09.062 |
| [70] |
Matos-Pérez CR, White JD, Wilker JJ. Polymer composition and substrate influences on the adhesive bonding of a biomimetic, cross-linking polymer. J Am Chem Soc, 2012, 134(22): 9498-9505. DOI:10.1021/ja303369p |
| [71] |
Sharma B, Fermanian S, Gibson M, et al. Human cartilage repair with a photoreactive adhesive-hydrogel composite. Sci Transl Med, 2013, 5(167): 167ra6. |
| [72] |
Prausnitz MR, Langer R. Transdermal drug delivery. Nat Biotechnol, 2008, 26(11): 1261-1268. DOI:10.1038/nbt.1504 |
| [73] |
Li J, Mooney DJ. Designing hydrogels for controlled drug delivery. Nat Rev Mater, 2016, 1(12): 16071. DOI:10.1038/natrevmats.2016.71 |
| [74] |
Ghobril C, Charoen K, Rodriguez EK, et al. A dendritic thioester hydrogel based on thiol-thioester exchange as a dissolvable sealant system for wound closure. Angewand Chem Int Ed, 2013, 52(52): 14070-14074. DOI:10.1002/anie.201308007 |
| [75] |
Grinstaff MW. Designing hydrogel adhesives for corneal wound repair. Biomaterials, 2007, 28(35): 5205-5214. DOI:10.1016/j.biomaterials.2007.08.041 |
| [76] |
Pawlicki JM, Pease LB, Pierce CM, et al. The effect of molluscan glue proteins on gel mechanics. J Exp Biol, 2004, 207(7): 1127-1135. DOI:10.1242/jeb.00859 |
| [77] |
Li C, Lu DY, Deng JJ, et al. Amyloid-like rapid surface modification for antifouling and in-depth remineralization of dentine tubules to treat dental hypersensitivity. Adv Mater, 2019, 31(46): 1903973. DOI:10.1002/adma.201903973 |
| [78] |
Fong E, Tirrell DA. Collective cell migration on artificial extracellular matrix proteins containing full-length fibronectin domains. Adv Mater, 2010, 22(46): 5271-5275. DOI:10.1002/adma.201002448 |
| [79] |
Singer AJ, Clark RAF. Cutaneous wound healing. N Engl J Med, 1999, 341(10): 738-746. DOI:10.1056/NEJM199909023411006 |
| [80] |
Dyson M, Young S, Pendle CL, et al. Comparison of the effects of moist and dry conditions on dermal repair. J Investigat Dermatol, 1988, 91(5): 434-439. DOI:10.1111/1523-1747.ep12476467 |
| [81] |
Yannas IV, Burke JF, Orgill DP, et al. Wound tissue can utilize a polymeric template to synthesize a functional extension of skin. Science, 1982, 215(4529): 174-176. DOI:10.1126/science.7031899 |
| [82] |
Khardori N, Yassien M. Biofilms in device-related infections. J Indust Microbiol, 1995, 15(3): 141-147. DOI:10.1007/BF01569817 |
| [83] |
Li L, Yan B, Yang JQ, et al. Novel mussel-inspired injectable self-healing hydrogel with anti-biofouling property. Adv Mater, 2015, 27(7): 1294-1299. DOI:10.1002/adma.201405166 |
| [84] |
Zhao X, Wu H, Guo BL, et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials, 2017, 122: 34-47. DOI:10.1016/j.biomaterials.2017.01.011 |
| [85] |
Li ZW, Lu W, Ngai T, et al. Mussel-inspired multifunctional supramolecular hydrogels with self-healing, shape memory and adhesive properties. Polym Chem, 2016, 7(34): 5343-5346. DOI:10.1039/C6PY01112H |
| [86] |
Pan JZ, Jin Y, Lai SQ, et al. An antibacterial hydrogel with desirable mechanical, self-healing and recyclable properties based on triple-physical crosslinking. Chem Eng J, 2019, 370: 1228-1238. DOI:10.1016/j.cej.2019.04.001 |
| [87] |
Yin T, Rong MZ, Zhang MQ, et al. Self-healing epoxy composites-preparation and effect of the healant consisting of microencapsulated epoxy and latent curing agent. Composit Sci Technol, 2007, 67(2): 201-212. DOI:10.1016/j.compscitech.2006.07.028 |
| [88] |
Cho H, Wu G, Jolly JC, et al. Intrinsically reversible superglues via shape adaptation inspired by snail epiphragm. Proc Natl Acad Sci USA, 2019, 116(28): 13774-13779. DOI:10.1073/pnas.1818534116 |
| [89] |
Zhao YH, Wu Y, Wang L, et al. Bio-inspired reversible underwater adhesive. Nat Commun, 2017, 8: 2218. DOI:10.1038/s41467-017-02387-2 |
| [90] |
Zhang C, Huang JF, Zhang JC, et al. Engineered Bacillus subtilis biofilms as living glues. Mater Today, 2019, 28: 40-48. DOI:10.1016/j.mattod.2018.12.039 |
| [91] |
Chen AY, Zhong C, Lu TK. Engineering living functional materials. ACS Synth Biol, 2015, 4(1): 8-11. |
 2019, Vol. 35
2019, Vol. 35