
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 许雯, 陆兆新, 曹林
- Xu Wen, Lu Zhaoxin, Cao Lin
- 抗人脂蛋白相关磷脂酶A2单抗制备及应用
- Development and application of monoclonal antibodies anti-human lipoprotein-associated phospholipase A2
- 生物工程学报, 2019, 35(3): 482-491
- Chinese Journal of Biotechnology, 2019, 35(3): 482-491
- 10.13345/j.cjb.180320
-
文章历史
- Received: August 2, 2018
- Accepted: October 11, 2018
动脉粥样硬化导致的心血管疾病是我国居民首要疾病死亡原因,居民患病率逐年持续上升[1]。在社区人群中筛查和防治心血管疾病、提高基层医疗机构对心血管疾病的诊疗水平是居民健康管理的重要工作,也是改善我国心血管疾病现状的重要途径[2]。脂蛋白相关磷脂酶A2 (Lipoprotein- associated phospholipase A2, Lp-PLA2)是血管炎症特异性标志物,可以直接反映动脉粥样硬化斑块发展进程[3-4],且可有效提高传统动脉粥样硬化预测模型的预测效力[5-7]。将Lp-PLA2应用于社区人群筛查检测,可帮助表面健康人群早期发现动脉粥样硬化潜在危险、早期防治,降低心血管疾病发病率;还可帮助动脉粥样硬化患者判断病情进展、评估用药效果等。
Lp-PLA2主要由成熟的巨噬细胞、T淋巴细胞、肥大细胞等炎症细胞合成并分泌,分子量为45 kDa[8-9]。当血管中存在粥样斑块时,体内的Lp-PLA2水平上升,且在不稳定斑块中强表达[3]。目前Lp-PLA2的常见检测方法包括酶联免疫吸附法、胶乳增强免疫比浊法[10],一方面这些检测试剂依赖进口抗体原料以及贵重检测仪器,对检测环境要求高,主要集中在三级医院检验科,这使得Lp-PLA2的检测无法在社区开展;另一方面,部分检测试剂通过测定人体内Lp-PLA2的酶活力作为判断动脉粥样硬化的依据,但临床研究表明亚洲人群更适合使用免疫质量法检测作为判断依据[11-13]。
因此,本研究拟通过真核细胞表达重组Lp-PLA2蛋白免疫小鼠,制备筛选高亲和力、高特异性抗人Lp-PLA2单克隆抗体,并在此基础上结合具有便携式、检测快、结果准的即时检验(POCT)技术[14],初步建立Lp-PLA2量子点荧光免疫层析定量检测方法,为临床实现可社区化应用的Lp-PLA2免疫学检测提供新的途径。
1 材料与方法 1.1 主要材料Lp-PLA2血清样本由南京鼓楼医院提供,其中确诊为动脉粥样硬化样本32例;BALB/c小鼠购自扬州大学比较医学中心;CHO-K1细胞为本实验室保存;SP2/0小鼠骨髓瘤细胞系、CdSe/CdS/ ZnS水溶性量子点、ClonExpress®ⅡOne Step试剂盒购自南京诺唯赞生物科技有限公司;对比试剂购自美国diaDexus公司;弗氏完全佐剂、弗氏不完全佐剂、抗体亚型测定试剂盒购自Sigma公司;潮霉素B、LipofectamineTM 2000购自Thermo Fisher公司;其他各类试剂和培养液均购自南京诺唯赞生物科技有限公司。
1.2 Lp-PLA2重组蛋白制备 1.2.1 质粒构建从NCBI上获得Lp-PLA2的全长基因序列(NCBI Reference Sequence: NP_001161829.1),进行密码子优化后交苏州金唯智生物科技有限公司合成,克隆构建于pUC19载体。以合成的pUC19-Lp- PLA2为模板,扩增Lp-PLA2目的基因片段。设计引物(UCOE-F: 5′-GTCGACCTGCAGGCATGCAA GCTGG-3′; UCOE-R: 5′-GGAGTTGGTCACCAGG GCCAGGGAC-3′)线性化UCOE载体,使用ClonExpress®ⅡOne Step试剂盒构建质粒UCOE- Lp-PLA2。重组质粒转化大肠杆菌DH5α感受态细胞,随机挑选克隆交测序公司进行测序鉴定。测序结果正确的克隆进行质粒大提,去除内毒素。
1.2.2 Lp-PLA2重组蛋白表达与纯化将冻存的CHO-K1细胞用CDM4CHO培养液(含6 mmol/L Gln)进行复苏与传代,培养至细胞长满80%以上。以LipofectamineTM 2000作为转染试剂,参照转染说明书用UCOE-Lp-PLA2质粒转染CHO-K1细胞,设置UCOE空载质粒及无质粒的对照组,在37 ℃、5% CO2条件下培养48 h。转染后的细胞分别用含0.4 mg/mL潮霉素B的培养液进行加压筛选,隔天监测细胞状态及活力,每4 d换液一次,培养2周后收集存活细胞。采用有限稀释法辅以倍比稀释法进行单克隆筛选,挑选表达量大于20 μg/mL的克隆,调整初始细胞密度为3×105/mL扩大培养。培养至细胞活力下降到70%时,收集细胞上清,0.45 μm超滤膜过滤后用Ni2+亲和层析柱纯化蛋白,目的蛋白用SDS-PAGE鉴定并用diaDexus公司Lp-PLA2酶联免疫检测试剂盒检测重组蛋白反应性。
1.3 抗人Lp-PLA2单克隆抗体的制备将浓度为1 mg/mL的重组Lp-PLA2蛋白与等量的弗氏完全佐剂混合乳化,选取6-8周龄的雌性BALB/c小鼠从跗关节处注射40 μg抗原进行免疫。间隔1周,将浓度为1 mg/mL的重组Lp-PLA2蛋白与等量的弗氏不完全佐剂混合乳化,对小鼠进行再次免疫,间隔1周加强免疫。3次免疫后尾静脉采血,间接ELISA法检测血清效价,选取效价最高的小鼠用于融合实验。以PEG 1500作为融合剂,取对数生长期的小鼠骨髓瘤细胞SP2/0,以1:3的比例与免疫小鼠脾脏组织中的淋巴细胞在含有20% FBS血清的HAT-1640培养基中培养。一周后观察细胞融合状态并换液,换液3 d后取细胞培养上清。以临床确诊为动脉粥样硬化患者的血清为抗原,用间接ELISA法筛选阳性细胞株,选择阳性值与细胞数比值较高的细胞进行多次亚克隆,最终得到多株能够稳定分泌抗Lp-PLA2的单克隆抗体的杂交瘤细胞株。采用小鼠腹水诱生法大量制备单克隆抗体并先后进行饱和硫酸铵沉淀纯化法、Protein A亲和柱纯化法纯化抗体。
1.4 单克隆抗体特性鉴定 1.4.1 腹水单克隆抗体效价测定腹水单克隆抗体的效价通过间接ELISA测定。以重组Lp-PLA2蛋白作为包被抗原,将纯化的5种单克隆抗体分别按1:1 000进行倍比稀释上样,共稀释12个梯度(1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:32 000、1:64 000、1:128 000、1:256 000、1:512 000、1:1 024 000、1:2 048 000),以SP2/0培养上清为阴性对照,OD450值高于阴性对照2.1倍以上判定为阳性孔,阳性结果中的最大稀释度即为该腹水单克隆抗体的效价。
1.4.2 单克隆抗体亚型鉴定采用抗体亚型测定试剂盒鉴定纯化后单克隆抗体亚型。
1.4.3 单克隆抗体亲和力测定采用Bobrovnik等[15]的方法测定抗体亲和力解离常数(Kd),以重组Lp-PLA2蛋白为包被抗原,抗原稀释至2.048×10-7、1.024×10-7、5.12×10-8、2.56×10-8、1.28×10-8、6.4×10-9、3.2×10-9、1.6×10-9、8×10-10、4×10-10、2×10-10、1×10-10 mol/L,间接ELISA法检测不同抗原包被浓度下抗体检测的OD450值,按照公式(1)建立Ai/(A0-Ai)与l/li的线性方程,斜率即为Kd值。
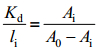
|
(1) |
Kd为亲和力解离常数;li为抗原浓度;A0为无抗原时抗体检测OD值;Ai为抗原浓度为li时的抗体检测OD值。
1.4.4 单克隆抗体特异性验证分别以Western blotting和间接ELISA法验证获得的5株单克隆抗体的特异性。取重组Lp-PLA2蛋白进行SDS-PAGE,转膜后以纯化后的5株单克隆抗体作为一抗,HRP标记的羊抗鼠IgG作为二抗,进行Western blotting检测。
选取浓度为23、125 ng/mL的Lp-PLA2阴性血清样本和浓度为230、452、667 ng/mL的Lp-PLA2阳性血清样本作为包被抗原,间接ELISA法检测单抗特异性。
1.5 抗体配对筛选免疫层析法检测Lp-PLA2通过双抗体夹心法实现,需要筛选一对可与抗原特异性结合且不受空间结构影响的抗体。取亲和力高的单抗采用双抗夹心ELISA法进行配对实验[16]。以阳性血清样本作为抗原,纯化后单抗作为捕获抗体包被至96孔板,再分别用HRP标记各抗体作为检测抗体,进行配对初步筛选,保留一孔为阴性对照,对照孔样品为等量阳性血清样本,检测各反应孔OD450值。
1.6 免疫层析检测方法建立 1.6.1 免疫层析检测试剂制备样品垫制备:将样品垫浸泡在包被缓冲液(0.02 mol/L HEPES,5%海藻糖,1%酪蛋白,pH 8.0)中5 min,室温晾干后37 ℃烘干16 h。
标记物垫制备:稀释量子点原液至固含量为1%,加入终浓度分别为5 mg/mL和7.5 mg/mL的EDC、NHS水溶液,室温孵育30 min。向体系中加入标记抗体PLA5至终浓度为0.05 mg/mL,室温孵育1 h。添加含有5% BSA的封闭液室温孵育1 h。制备好的量子点-抗体标记复合物离心后置换储存液(0.05 mol/L Tris-HCl,2%蔗糖,0.2% BSA,pH 8.0)。以3.0 μL/cm的喷量在标记物垫上喷涂量子点-抗体标记复合物,45 ℃烘干16 h。
包被膜的制备:用蛋白固定液(0.01 mol/L PBS,pH 7.4)稀释Lp-PLA2重组抗原至0.75 mg/mL作为检测试纸条的质控线(C线),稀释包被抗体PLA1至1.0 mg/mL作为检测试纸条的检测线(T线),以0.8 μL/cm喷量在硝酸纤维素膜上分别包被两种蛋白C线与T线之间间隔5 mm。37 ℃烘干16 h。
试剂卡组贴:按照试剂卡的结构,包被膜位于PVC背衬板上,在整个结构的最底层,标记物垫与吸水棉浆纸分别组贴在包被膜两侧,样品垫组贴于标记物的另一侧,组贴好试剂卡密封保存。
1.6.2 免疫层析检测试剂评价校准曲线建立:稀释重组Lp-PLA2蛋白至2 000、1 000、500、250、125、60、40、20、10 ng/mL作为校准品。用制备的试纸条检测校准品各2次,计算T线与C线荧光强度的比值(T/C值)。荧光强度检测的激发波长为365 nm,发射波长为610 nm。以T/C值为纵坐标,校准品浓度值为横坐标,绘制校准曲线并计算线性范围。
重复性评价:按照1.6.1中工艺制备3个批次的Lp-PLA2检测试剂,并分别检测Lp-PLA2浓度为175.0 ng/mL和350.5 ng/mL的临床血清样本,每个样本重复检测20次,计算批间变异系数(Coefficient of variation, CV)。
临床应用比对:应用自制试剂与diaDexus公司Lp-PLA2酶联免疫检测试剂盒同时测试100例临床血清样本,其中阴性样本68例,阳性样本32例,以自制检测系统为横坐标,diaDexus公司试剂盒检测系统为纵坐标,SPSS统计软件作相关性分析。
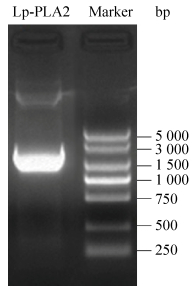
2 结果与分析 2.1 Lp-PLA2目的基因扩增及质粒鉴定目的基因经PCR扩增后,琼脂糖凝胶电泳鉴定显示在对应大小处有目的条带,且无杂带,Lp-PLA2核酸片段大小约1 300 bp,鉴定结果如图 1所示。挑取单克隆进行测序鉴定,测序结果经比对后发现序列完全正确,重组质粒构建成功。
|
| 图 1 目的基因的PCR扩增产物 Fig. 1 Electrophoresis analysis of PCR products of target gene. |
| |
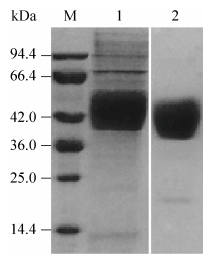
重组质粒UCOE-Lp-PLA2转染CHO-K1细胞,并用潮霉素B作为筛选条件筛选可以稳定分泌表达Lp-PLA2蛋白的细胞株。目的蛋白大小为45 kDa (图 2),SDS-PAGE显示细胞上清中杂蛋白较少,并且在目的蛋白分子量对应处有明显条带,纯化后目的蛋白纯度达到90%以上,最终目的蛋白的产量为42.3 μg/mL。
|
| 图 2 重组Lp-PLA2凝胶电泳图 Fig. 2 SDS-PAGE analysis of recombinant Lp-PLA2. M: marker; 1: cell supernatant; 2: recombinant Lp-PLA2 protein. |
| |
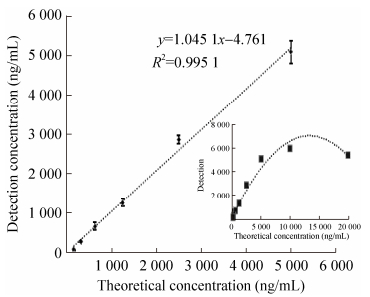
重组Lp-PLA2蛋白用于小鼠的免疫以及检测试剂校准品、质控线的制备。取纯化后的重组Lp-PLA2蛋白,用BCA试剂盒进行蛋白定量后,倍比稀释至10 μg/mL、5μg/mL、2.5 μg/mL、1 250 ng/mL、625 ng/mL、312.5 ng/mL、156.25 ng/mL,用diaDexus公司的Lp-PLA2试剂检测蛋白稀释液。结果见图 3,剔除因蛋白浓度过高而产生hook效应的浓度点10 000 ng/mL和20 000 ng/mL后,检测浓度和理论浓度间一致性好,R2=0.995 1,相关系数R=0.998 > 0.99,该重组抗原应用于后续实验。
|
| 图 3 重组Lp-PLA2反应性检测结果 Fig. 3 Reactivity test results of recombinant Lp-PLA2. |
| |
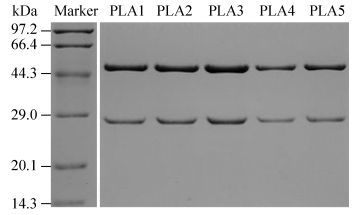
经细胞融合及筛选实验后,共获得5株能稳定分泌抗人Lp-PLA2单克隆抗体且表达量在20μg/mL的细胞株,分别命名为PLA1-PLA5。如图 4所示,纯化后抗体经还原SDS-PAGE分析,在50 kDa和25 kDa处有明显的重链条带和轻链条带,且未见明显杂带,表明抗体经纯化后结构完整并达到较高的纯度,可用于后续实验。
|
| 图 4 SDS-PAGE检测抗体纯化结果 Fig. 4 SDS-PAGE analysis of purified mAbs. |
| |
腹水单克隆抗体通过间接ELISA测定其效价。PLA1-PLA5杂交瘤细胞制备腹水单克隆抗体后,间接ELISA测定腹水单克隆效价分别为1:106、1:106、1:106、1:105、1:106。
2.5.2 单克隆抗体亚型鉴定经试剂盒鉴定,5株单克隆抗体均为IgG1型。
2.5.3 单克隆抗体亲和力测定以重组Lp-PLA2蛋白作为抗原,通过间接ELISA方法测定抗体亲和力解离常数。结果表明PLA1、PLA2、PLA3、PLA4、PLA5的亲和力解离常数分别为1.8×10-9、3.4×10-8、2.0×10-8、2.7×10-6、3.1×10-8,PLA1、PLA2、PLA3、PLA5抗体亲和力明显高于PLA4,可用于后续抗体配对筛选。
2.5.4 单克隆抗体特异性验证通过Western blotting验证单克隆抗体特异性,如图 5A所示,5株单克隆抗体均能与分子量为45 kDa的蛋白条带反应,与重组Lp-PLA2蛋白分子量相符,且反应条带单一,表明5株单克隆抗体均能特异性识别重组Lp-PLA2蛋白。

|
| 图 5 抗体特异性鉴定 Fig. 5 Identification of mAbs' specificity. |
| |
通过ELISA方法检测抗体与天然抗原反应特异性,如图 5B所示,5株单克隆抗体均与阳性血清反应,且与血清中Lp-PLA2浓度线性相关,即说明5株单克隆抗体均能特异性识别人血中的Lp-PLA2。
2.6 抗体配对筛选选择PLA1、PLA2、PLA3及PLA5进行抗体配对筛选实验,当检测OD450值越高时,表明配对的效果越好。如表 1所示,16种配对中PLA1、PLA2、PLA3间无法与抗原形成夹心配对,PLA5单克隆抗体与其他3株单抗均能形成良好配对,且PLA5作为检测抗体时测试性能更佳。综合配对及抗体鉴定结果,选择配对良好且亲和力最高的PLA1与PLA5为配对单克隆抗体进行后续免疫层析检测方法建立的实验。
| HRP labeled mAbs | Capture mAbs | |||
| PLA1 | PLA2 | PLA3 | PLA5 | |
| HRP-PLA1 | 0.024 | 0.034 | 0.019 | 0.245 |
| HRP-PLA2 | 0.026 | 0.028 | 0.033 | 0.186 |
| HRP-PLA3 | 0.033 | 0.025 | 0.041 | 0.227 |
| HRP-PLA5 | 0.314 | 0.356 | 0.349 | 0.022 |
| Negative control | 0.021 | |||
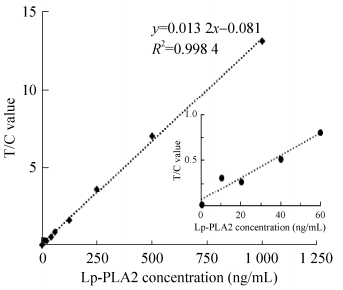
通过计算层析试纸条检测线(T)与质控线(C)检测信号值的比值(T/C)与抗原浓度建立标准曲线。如图 6所示,Lp-PLA2浓度在20-1 000 ng/mL之间时,T/C值与蛋白浓度线性相关,蛋白浓度越高,T/C值越高,线性拟合方程为y=0.013 2x+ 0.073 5,R2=0.998 3。因此本试剂的线性范围为20-1 000 ng/mL。Lp-PLA2浓度在1 000-2 000 ng/mL时,未出现hook效应,因此本试剂检测上限为2 000 ng/mL。
|
| 图 6 Lp-PLA2量子点免疫层析试剂标准曲线 Fig. 6 Standard curve of quantum dots-based Lp-PLA2 test strips. |
| |
用3个批次的Lp-PLA2免疫层析检测试剂检测浓度为175.0 ng/mL和350.5 ng/mL的临床样本各20次,计算每个样本检测结果的均值及CV。结果如表 2所示,浓度为175.0 ng/mL的样本检测批间CV为5.88%;浓度为350.5 ng/mL的样本检测批间CV为4.29%,试剂批次间的变异系数均小于6%,精密性良好。
| Sample concentration (ng/mL) |
Inter-batch variation (n=20) | |
| x±s (ng/mL) | CV (%) | |
| 175.0 | 176.9±10.4 | 5.88 |
| 350.5 | 346.6±14.9 | 4.29 |
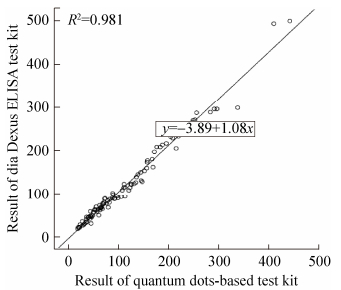
采用本实验初步建立的Lp-PLA2定量检测试剂与diaDexus公司Lp-PLA2检测试剂进行临床比对,结果如图 7所示。比对实验中采用两种试剂平行测试100例临床血清样本,检测结果经线性回归分析(R2=0.981,P < 0.001),相关系数R=0.99,两种检测系统结果具有良好的相关性,两种试剂检测结果间无差异。
|
| 图 7 两种试剂盒相关性比对 Fig. 7 Comparison between quantum dots-based test kit and diaDexus ELISA test kit. |
| |
动脉粥样硬化是冠心病、脑卒中等疾病的主要病理基础[17],通常经过斑块形成、斑块破裂、形成血栓等病理过程而最终导致急性心血管事件,提早预防可以有效降低心血管疾病发病率。Lp-PLA2是血管炎症独立预测因子,与心血管疾病发生风险呈显著正相关,可用于心血管疾病的预测、治疗和预后评估,在社区人群中进行Lp-PLA2筛查检测可以帮助居民进行心血管健康管理。近年来,我国动脉粥样硬化患病群体年龄不断下降,未来成人疾病负担将会不断加重,通过提早预防来降低动脉粥样硬化疾病的发生率势在必行。
Lp-PLA2免疫学检测方法以抗原抗体反应为基础,高特异性、高亲和力的单克隆抗体是决定检测准确与否的关键性因素。Zhang等[18-19]在大肠杆菌表达系统、昆虫细胞表达系统及酵母表达系统中成功表达Lp-PLA2重组蛋白,其中昆虫细胞表达产物具备蛋白活性且表达量最高,为6 μg/mL,纯化后目的蛋白得率仅为2.7%,表达量较低且不易纯化,在单抗制备、诊断试剂开发等多方面的应用受到限制。李苏亮等[20]选择融合表达载体pBV220构建pBV220-Lp-PLA2重组质粒表达目的蛋白,并免疫小鼠制备单克隆抗体;Huang等[21]构建pCold TF-Lp-PLA2表达载体在大肠杆菌BL21(DE3)中表达得到带有TF标签的重组Lp-PLA2蛋白,并以此作为免疫原制备得到抗Lp-PLA2兔多抗,两种方法均采用了大肠杆菌原核表达系统制备重组Lp-PLA2蛋白,但是相比较于哺乳动物表达,原核系统缺少对重组蛋白的表达后修饰,作为免疫原会对抗体特性造成影响,Huang等[21]选择TF标签增加目的蛋白可溶性,帮助重组蛋白正确翻译折叠并提高表达水平,但是多克隆抗体的批次间制备差异不可控,因此并不适用于后续检测方法的建立。沈鹤霄等[22]提出了在大肠杆菌表达系统、酵母表达系统、昆虫表达系统和哺乳动物表达系统中同时表达重组Lp-PLA2并将混合蛋白作为免疫原采用常规方法免疫小鼠制备单克隆抗体,这种方法抗原制备方法复杂,各系统制备所得重组Lp-PLA2的差异难以控制,以此作为免疫原制备得到的单克隆抗体特性受干扰因素较多,不适合应用于对准确度要求高的检测试剂中。朱建安[23]通过多肽固相合成法直接合成Lp-PLA2抗原表位肽并与载体蛋白KLH连接作为免疫原制备得到对应单克隆抗体,虽然此方法制备的抗体特异性更高,但是其与天然蛋白的亲和力也因此受限,以此作为免疫检测的关键材料会使得试剂检测灵敏度受到相应的局限。因此,本文选用CHO-K1真核表达系统[24-27]进行重组Lp-PLA2蛋白的表达,一方面哺乳动物细胞翻译后的加工修饰体系更完善,表达的外源蛋白更接近天然构象[28],可以免疫得到特异性、亲和力更高的抗体,另一方面CHO-K1细胞通过胞外分泌的形式表达目的蛋白,杂蛋白少且易于纯化,最终重组Lp-PLA2蛋白产量为42.3 μg/mL,经SDS-PAGE与市售Lp-PLA2检测试剂盒验证,蛋白纯度与反应性均较优。利用该重组蛋白免疫小鼠,筛选得到配对单克隆抗体PLA1和PLA5,两株抗体亲和力均达到1×10-8且能够特异识别人血液中的Lp-PLA2。在采用双抗夹心ELISA法进行抗体配对评价实验时发现,虽然PLA5与PLA1两株抗体能够两两配对,但是在PLA5用于检测抗体时,OD450更高,这一现象同样存在于PLA5与PLA2和PLA3配对反应时,我们推测PLA1、PLA2、PLA3的抗原结合表位易受到标记物的影响。因此在利用这一配对抗体进行免疫层析方法建立时,选用PLA5抗体与示踪物质偶联,以获得更高的检测灵敏度。
Lp-PLA2现有检测技术中部分以测定酶活性为主,特异性差且检测结果易受干扰。选用免疫质量法检测Lp-PLA2的方法学以ELISA和胶乳增强免疫比浊法为主,其中ELISA方法检测准确度高,但需经过洗板、孵育等多个步骤,单次测定时间在2 h以上;胶乳增强免疫比浊法检测快速准确,但是检测仪器对检测环境及操作要求高,因此这两种方法均不适合Lp-PLA2检测在社区医疗机构推广应用。本研究建立的Lp-PLA2荧光免疫层析检测方法,选用新型荧光材料量子点作为示踪物质,避免了以胶体金为示踪物质的第一代免疫层析方法带来的检测结果不准确的问题,并且提高了和抗体的生物相容性[29-30],性能评估结果表明检测线性范围为20-1 000 ng/mL,批次间变异系数小于6%,重复性良好,与市售的ELISA检测试剂进行临床比对,共检测了100例血清样本(32例阳性样本,68例阴性样本),两种方法的检测结果无显著差异,本方法检测结果准确。
本研究旨在通过抗体原料的开发,建立检测准确、操作简便、仪器便携、适用于社区医疗机构的Lp-PLA2定量免疫层析检测方法,为动脉粥样硬化疾病防治提供切实可行的途径。进一步研究将对更大规模的临床样本(如不同社区体检人群的血清)进行检测,并与其他检测方法进行比对,验证本方法的可靠性,以期尽早获得可以在社区医疗机构推广应用的检测试剂。
| [1] |
Chen WW, Gao RL, Liu LS, et al. Outline of China cardiovascular disease report (2015).
Chin Circul J, 2016, 31(6): 521–528.
(in Chinese). 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2015》概要. 中国循环杂志, 2016, 31(6): 521-528. DOI:10.3969/j.issn.1000-3614.2016.06.001 |
| [2] |
Guidelines for Comprehensive Prevention and Treatment of Cardiovascular Diseases in Community Population. Guidelines for comprehensive prevention and treatment of cardiovascular diseases in community population (Trial). Chin J Front Med: Elect Ver, 2017, 9(1): 20-36 (in Chinese). 社区人群心血管疾病综合防治指南(试行)编审委员会, 中国成人血脂异常健康管理服务试点项目委员会.社区人群心血管疾病综合防治指南(试行).中国医学前沿杂志: 电子版, 2017, 9(1): 20-36. |
| [3] | Jellinger PS, Smith DA, Mehta AE, et al. American association of clinical endocrinologists' guidelines for management of dyslipidemia and prevention of atherosclerosis. Endocr Pract, 2012, 18(suppl 1): 1–78. |
| [4] | Herrmann J, Mannheim D, Wohlert C, et al. Expression of lipoprotein-associated phospholipase A2 in carotid artery plaques predicts long-term cardiac outcome. Eur Heart J, 2009, 30(23): 2930–2938. DOI: 10.1093/eurheartj/ehp309 |
| [5] | Greenland P, Alpert JS, Beller GA, et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation, 2010, 122(25): 2748–2764. DOI: 10.1161/CIR.0b013e3182051bab |
| [6] | Andrus B, Lacaille D. 2013 ACC/AHA guideline on the assessment of cardiovascular risk. J Am Coll Cardiol, 2014, 63: 2886. |
| [7] | Goldstein LB, Bushnell CD, Adams RJ, et al. Guidelines for the primary prevention of stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke, 2011, 42(2): 517–584. |
| [8] | Epps KC, Wilensky RL. Lp-PLA2—a novel risk factor for high-risk coronary and carotid artery disease. J Intern Med, 2011, 269(1): 94–106. DOI: 10.1111/jim.2010.269.issue-1 |
| [9] | Yang L, Liu Y, Wang SF, et al. Association between Lp-PLA2 and coronary heart disease in Chinese patients. J Int Med Res, 2017, 45(1): 159–169. DOI: 10.1177/0300060516678145 |
| [10] |
Wang DC, Hou LA, Qiu L, et al. The performance evaluation of four Lp-PLA2 activity assays.
Chin J Lab Med, 2018, 41(3): 208–213.
(in Chinese). 王丹晨, 侯立安, 邱玲, 等. 4种脂蛋白相关磷脂酶A2活性测定试剂的性能评价. 中华检验医学杂志, 2018, 41(3): 208-213. DOI:10.3760/cma.j.issn.1009-9158.2018.03.007 |
| [11] |
Chinese Committee of Gerontology, Cardiovascular and Cerebrovascular Diseases Committee, Chinese Medical Doctor Association Expert Committee on Cardiovascular and Cerebrovascular Diseases. Expert advice on the clinical application of lipoprotein-associated phospholipase A2. Chin J Cardiol, 2015, 43(10): 843-847 (in Chinese). 中国老年学学会心脑血管病专业委员会, 中国医师协会检验医师分会心脑血管病专家委员会.脂蛋白相关磷脂酶A2临床应用专家建议.中华心血管病杂志, 2015, 43(10): 843-847 |
| [12] | Hou LP, Chen SF, Yu HL, et al. Associations of PLA2G7 gene polymorphisms with plasma lipoprotein-associated phospholipase A2 activity and coronary heart disease in a Chinese Han population: the Beijing atherosclerosis study. Hum Genet, 2009, 125(1): 11–20. |
| [13] | Millwood IY, Bennett DA, Walters RG, et al. Lipoprotein-associated phospholipase A2 loss-of-function variant and risk of vascular diseases in 90, 000 Chinese Adults. J Am Coll Cardiol, 2016, 67(2): 230–231. DOI: 10.1016/j.jacc.2015.10.056 |
| [14] |
Lu T, Qian XP. Analysis on the present situation and development prospect of Chinese POCT industry.
Biotech World, 2016(2): 293.
(in Chinese). 陆婷, 钱秀萍. 浅析我国POCT产业的现状及发展前景. 生物技术世界, 2016(2): 293. |
| [15] | Bobrovnik SA, Komisarenko SV, Ilyina LV. Novel and simple ELISA-based method for antibody affinity determination. Ukr Biokhim Zh (1999), 2005, 77(2): 169–174. |
| [16] |
Chen ZM, Zhou GL, Xu WL, et al. Development and application of CK-MB specific monoclonal antibodies.
Chin J Biotech, 2017, 33(1): 141–150.
(in Chinese). 陈自敏, 周国梁, 徐伟玲, 等. CK-MB特异性单抗的制备方法及其应用. 生物工程学报, 2017, 33(1): 141-150. |
| [17] | Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med, 2005, 352(16): 1685–1695. DOI: 10.1056/NEJMra043430 |
| [18] | Zhang FJ, Dong L, Cai MJ, et al. Heterologous expression of lipoprotein-associated phospholipase A2 in different expression systems. Protein Expr Purif, 2006, 48(2): 300–306. DOI: 10.1016/j.pep.2006.03.009 |
| [19] |
Zhang FJ, Dong L, Wang YP. Cloning, expression, purification and activity assay of a lipoprotein— associated phospholipase A2-a key enzyme of atherosclerosis.
Proceedings of the 7th National Youth Pharmacy Workers' Latest Scientific Research Achievements Exchange Conference, Hangzhou: Chinese Pharmaceutical Association, 2004: 433–437.
(in Chinese). 张福军, 董立, 王逸平. 动脉粥样硬化关键性酶——脂蛋白相关磷脂酶A2的基因克隆、表达、纯化和活性测定//第七届全国青年药学工作者最新科研成果交流会论文集. 杭州:中国药学会, 2004: 433-437. |
| [20] |
Li SL, Qi X, Wang JJ, et al. Recombination expression of Lp-PLA2 and preparation of anti-Lp-PLA2 monoclonal antibody.
Chin J Hemorh, 2013, 23(1): 20–23.
(in Chinese). 李苏亮, 齐欣, 王建军, 等. Lp-PLA2的重组表达及单克隆抗体的制备. 中国血液流变学杂志, 2013, 23(1): 20-23. |
| [21] |
Huang MR, Huang J, Wang H, et al. Prokaryotic expression of lipoprotein-associated phospholipase A2 and preparation of its polyclonal antibody.
Chin J Biol, 2011, 24(4): 460–463.
(in Chinese). 黄美容, 黄健, 王虹, 等. 脂蛋白相关磷脂酶A2的原核表达及多克隆抗体的制备. 中国生物制品学杂志, 2011, 24(4): 460-463. |
| [22] |
Shen HX, Hua QG, Zheng XS, et al. Lipoprotein-associated phospholipase A2 monoclonal antibodies, antibody pairs, preparation method and application: CN, 105542010A. 2016-05-04 (in Chinese). 沈鹤霄, 华权高, 郑雪松, 等.脂蛋白相关磷脂酶A2单克隆抗体、抗体对及制备方法、用途: CN, 105542010A. 2016-05-04. |
| [23] |
Zhu JA. Human Lp-PLA2 antigenic epitope peptide, antigen, antibody, application and kit: CN, 104231052A. 2013-06-18 (in Chinese). 朱建安.人Lp-PLA2抗原表位肽、抗原、抗体、用途及试剂盒: CN, 104231052A. 2013-06-18. |
| [24] | Horwitz AH, Carroll SF, Williams RE, et al. Inclusion of S-sepharose beads in the culture medium significantly improves recovery of secreted rBPI21 from transfected CHO-K1 cells. Protein Expr Purif, 2000, 18(1): 77–85. DOI: 10.1006/prep.1999.1163 |
| [25] | Suzuki J, Fukuda M, Kawata S, et al. A rapid protein expression and purification system using Chinese hamster ovary cells expressing retrovirus receptor. J Biotechnol, 2006, 126(4): 463–474. DOI: 10.1016/j.jbiotec.2006.04.039 |
| [26] | Kim DY, Lee JC, Chang HN, et al. Development of serum-free media for a recombinant CHO cell line producing recombinant antibody. Enzyme Microb Technol, 2006, 39(3): 426–433. DOI: 10.1016/j.enzmictec.2005.11.047 |
| [27] | Rivieccio V, Esposito A, Bellofiore P, et al. High-level expression and efficient purification of recombinant human long pentraxin PTX3 in Chinese hamster ovary cells. Protein Expr Purif, 2007, 51(1): 49–58. DOI: 10.1016/j.pep.2006.07.009 |
| [28] |
Li GK, Gao XD, Xu C. Advances on mammalian cell expression system.
Chin Biotechnol, 2014, 34(1): 95–100.
(in Chinese). 李国坤, 高向东, 徐晨. 哺乳动物细胞表达系统研究进展. 中国生物工程杂志, 2014, 34(1): 95-100. |
| [29] | Gao F, Han JX, Zhang J, et al. The synthesis of newly modified CdTe quantum dots and their application for improvement of latent fingerprint detection. Nanotechnology, 2011, 22(7): 075705. DOI: 10.1088/0957-4484/22/7/075705 |
| [30] | Rosenthal SJ, Chang JC, Kovtun O, et al. Biocompatible quantum dots for biological applications. Chem Biol, 2011, 18(1): 10–24. |
 2019, Vol. 35
2019, Vol. 35




