1. 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;
2. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;
3. 江南大学 药学院,江苏 无锡 214122;
4. 江南大学 江苏省生物活性制品加工工程技术研究中心,江苏 无锡 214122;
5. 国家固态酿造工程技术研究中心,四川 泸州 646000
收稿日期:2020-06-17;接收日期:2020-07-30
基金项目:国家自然科学基金(Nos. 31901658, 31771967),国家轻工技术与工程一流学科自主课题(No. LITE2018-11)资助
作者简介:许正宏 教授、博士生导师,现任江南大学生物工程学院院长,主要从事传统酿造食品微生物生态学研究。主持国家重点研发计划重点专项、国家自然科学基金面上项目、863重大项目课题等国家级项目,获得江苏省科学技术一等奖、中国轻工业联合会科技进步一等奖等奖励,获得中组部万人计划领军人才、科技部中青年科技创新领军人才等称号,受聘为中国生物工程学会理事、中国调味品协会感官评价专业委员会主任委员等,担任Food Microbiol、Sys Microbiol Biomanuf编委.
1. Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu, China;
4. Jiangsu Engineering Research Center for Bioactive Products Processing Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
5. National Engineering Research Center of Solid-State Brewing, Luzhou 646000, Sichuan, China
Received: June 17, 2020; Accepted: July 30, 2020
Supported by: National Natural Science Foundation of China (Nos. 31901658, 31771967), National First-class Discipline Program of Light Industry Technology and Engineering (No. LITE2018-11)
泥窖固态酿造是浓香型白酒的典型生产工艺,在经过连续多轮次的白酒酿造后,窖泥微生物形成了以细菌为主、包含古菌和真菌的独特群落结构,它们的代谢产物赋予了浓香型白酒独特的风味。基于16S rRNA基因高通量测序分析发现,窖泥中古菌大部分为产甲烷古菌,主要分布在甲烷微菌纲Methanomicrobia的甲烷八叠球菌属Methanosarcina、甲烷囊菌属Methanoculleus和甲烷鬃毛菌属Methanosaeta以及甲烷杆菌纲Methanobacteria的甲烷短杆菌属Methanobrevibacter和甲烷杆菌属Methanobacterium[1-2]。不同窖龄窖池中优势产甲烷古菌类群有差异,随着窖池年份的增长,老窖泥中产甲烷古菌数量逐渐增加[1],并且高质量窖泥中的产甲烷古菌相对丰度也显著高于退化窖泥[2]。
由于产甲烷古菌属于严格厌氧菌,其生长条件要求苛刻,生长相对缓慢,分离培养较困难,目前仅从窖泥中分离纯化出3种产甲烷古菌,其中两株分别命名为布氏甲烷杆菌Methanobacterium bryantii[3]和甲酸甲烷杆菌Methanobacterium formicicum[4]。大部分产甲烷古菌与其他微生物(如互营单胞菌属Syntrophomonas、梭菌属Clostridium)有互营代谢作用。在上世纪中后期,科研人员就发现了产甲烷古菌与梭菌存在互利共生关系,只有在两者共栖生长时梭菌才大量产生短/中链脂肪酸[5]。与克氏梭菌Clostridium kluyveri共培养时,产甲烷古菌Methanogen 166能够利用C. kluyveri H068产生H2,解除其氢抑制,从而促进己酸生成[6]。甲烷鬃毛菌属Methanosaeta和互营单细胞菌属Syntrophomonas共生能够降解长链脂肪酸,可通过种间直接电子转移产生乙酸和丁酸[7]。以上研究表明,产甲烷古菌可通过种间氢转移解除窖泥产酸菌的氢抑制效应,增强其产酸能力,从而有助于促进浓香型白酒主体风味物质的积累,改善白酒品质。
已有报道主要集中在分析不同窖龄窖泥的古菌群落结构,对白酒发酵过程酒醅和窖泥中古菌的群落组成、演替规律以及潜在功能尚缺乏系统研究。本研究选择泸州老窖连续使用的优质百年窖池,采用高通量测序技术分析了发酵过程酒醅与窖泥中古菌群落的演替规律,通过与细菌群落的共现性网络分析,对比了酒醅与窖泥中古菌群落的潜在功能差异,为揭示古菌在浓香型白酒酿造菌群中的功能地位提供理论参考。
1 材料与方法
1.1 样品采集 选取泸州老窖股份有限公司罗汉酿酒基地100年窖龄的窖池(长×宽×高=4.3 m×2.3 m×2.3 m)进行酒醅和窖泥样品采集。在发酵第0 (入窖)、1、3、5、7、9、11、16、21、26、36、46天(起窖),使用三点采样法采集窖池中层酒醅和底部窖泥,每个采样点收集约50 g样品至无菌袋内,迅速转移至实验室。用于环境因子分析的样品,于−20 ℃保存。用于DNA提取的样品,液氮研磨后于−80 ℃保存。
1.2 DNA提取及古菌生物量分析 称取液氮研磨后的样品粉末0.2 g,按照PowerSoil® DNA提取试剂盒标准操作步骤提取酒醅和窖泥样品中的DNA。采用NanoDrop 2000超微量分光光度计检测DNA的质量,要求浓度≥20 ng/μL,总量≥250 ng,A260/A280值在1.8–2.0之间。
采用Bio-Rad CFX Connect™荧光定量PCR仪分析平台,使用SYBR™ Select Master Mix试剂盒,选用引物对931F (5′-AAGAATTGGCGGGGG AGCA-3′)/m1100R (5′-BGGGTCTCGCGTCGTTR C-3′)[8],通过荧光定量PCR (qPCR)方法分析酒醅和窖泥样品中古菌生物量[9-10]。
1.3 发酵过程窖池古菌群落结构分析 采用16S rRNA基因扩增子测序分析发酵过程酒醅和窖泥中古菌的群落结构。选用古菌V3-V4区通用引物Arch349F (5′-GYGCASCAGK CGMGAAW-3′)/Arch806R (5′-GGACTACVSGGG TATCTAAT-3′)进行扩增。测序文库构建后,采用Illumina MiSeq平台进行高通量测序(2×300 bp)。
按照QIIME (V1.9.1)标准流程对测序Raw reads进行质控,获得的高质量Clean reads以97%序列相似度为标准划分操作分类单元(Operational taxonomic unit,OTU)[11]。使用SILVA (https://www.arb-silva.de/)数据库对OTU代表序列进行物种注释[12]。对各样品的数据进行均一化处理,分析古菌群落alpha多样性,包括Shannon、Chao1和ACE指数。基于R (version 3.6.3)平台的vegan (version 2.5.6)软件包进行beta多样性分析,包括聚类分析(Cluster analysis)、主坐标分析(Principal coordinate analysis, PCoA)、Mantel test分析以及相似性分析(Analysis of similarities, ANOSIM)。采用psych软件包,基于Spearman相关性分析,构建酒醅与窖泥中古菌与细菌群落的共现性网络,使用Gephi (version 0.9.2)进行可视化。
本文古菌群落测序数据已提交至中国核酸数据库GSA (https://bigd.big.ac.cn/gsub/),登录号为CRA003419。用于共现性网络分析的细菌群落测序数据已提交至NCBI SRA数据库(http://www.ncbi.nlm.nih.gov/traces/sra),登录号为PRJNA558446。
2 结果与分析
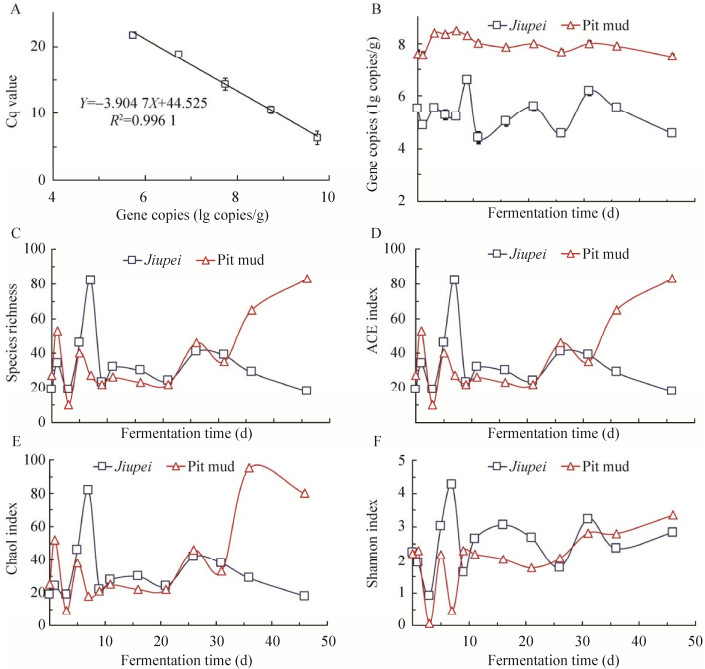
2.1 古菌生物量及群落α多样性 古菌16S rRNA基因V6区qPCR标准曲线为Y=−3.904 7X+44.525 (R2=0.996 1),以此计算浓香型白酒发酵过程酒醅和窖泥中古菌生物量(图 1A)。在整个发酵过程,窖泥(7.97 lg 16S rRNA copies/g)中古菌平均生物量高于酒醅(5.29 lg copies/g)约2.6个数量级(图 1B)。在发酵第1–31天之间酒醅中古菌生物量波动较大,第9天达最高值,为(6.60±0.06) lg copies/g,31 d后古菌生物量持续降低,发酵结束时为(4.56±0.01) lg copies/g。发酵过程窖泥中古菌生物量波动较小,第7天达到最高值(8.46±0.01) lg copies/g,此后缓慢降低,发酵结束时最低,为(7.50±0.06) lg copies/g。
对酒醅和窖泥样本中古菌群落进行高通量测序分析,所有样本序列数抽平至20 000条,共划分出136个OTU,覆盖率指数Coverage均在99.9%以上,窖泥样本中OTU数目为8–72个,酒醅样本为16–82个(图 1C)。稀疏曲线(Rarefaction curves)显示在10 000条序列时检测到的物种数达到饱和,表明所有样本的测序深度满足分析要求。
发酵过程菌群丰度(Community richness)指数ACE和Chao1的变化趋势与物种数(Species richness)基本一致(图 1D–E)。发酵前期(0–7 d),酒醅和窖泥中古菌群落ACE和Chao1指数波动较大,第9–21天基本稳定在25左右,随后酒醅中先上升后下降至18 (第46天),而窖泥中呈上升趋势,在发酵结束时ACE和Chao1指数分别为83和80。菌群多样性(Community diversity)指数Shannon在酒醅和窖泥中的变化趋势相似(图 1F)。在第0–21天,酒醅中古菌群落Shannon指数大于窖泥,随后窖泥中古菌群落Shannon指数逐渐上升,在发酵后期高于酒醅。
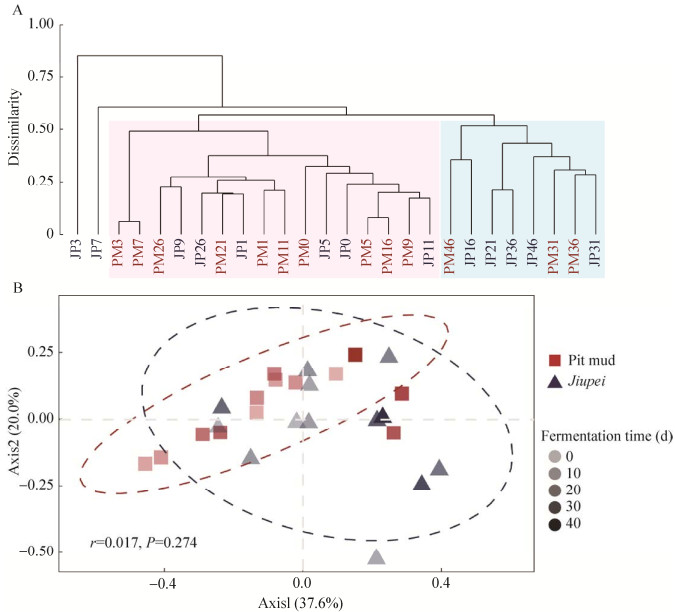
2.2 酒醅与窖泥古菌群落β多样性分析 通过计算古菌群落的Bray-Curtis相异性指数,对酒醅和窖泥样本进行聚类分析。酒醅和窖泥样品混杂在一起,表明发酵过程两者中古菌群落结构相似度较高(图 2)。从时间来看,窖泥古菌群落在发酵后期(31–46 d)与前期差异较大,分别聚为两支(图 2A)。第3和7天酒醅中古菌群落结构与其他时间样品差异较大,16 d后(26 d除外)酒醅古菌群落逐渐稳定,并与窖泥古菌群落结构比较接近。从PCoA分析结果来看,第一轴能表征样品间差异度的37.6%,第二轴能区分样品间20.0%的差异度(图 2B)。窖泥古菌群落随着发酵时间逐渐从第一轴负方向向正向演替,酒醅样品在第一轴和第二轴上的分布都比较分散,群落结构变化较大。
进一步通过ANOSIM分析可以证实酒醅和窖泥中的古菌群落差异并不显著(r=0.017,P=0.074)。Mantel test分析表明发酵过程酒醅古菌群落的演替规律与窖泥之间存在显著的相关性(r=0.30,P=0.03)。考虑到两者间古菌生物量的显著差异(图 1B),推测发酵过程窖泥古菌群落对酒醅的影响,可能是通过发酵时产生的黄水实现了两个生境中物种的交流。
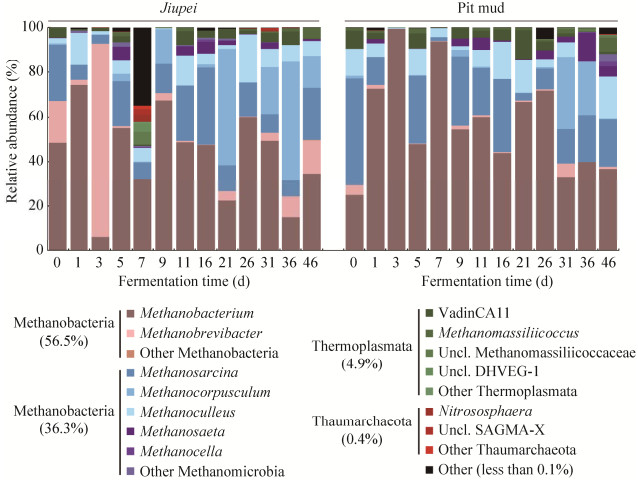
2.3 发酵过程酒醅与窖泥古菌群落演替规律 将OTU代表序列与SILVA数据库比对进行物种注释,136个OTU分属于3门、11纲、16科、17属。由于数据库中古菌信息的局限性,只有36.76%的OTU能够分类到属水平。广古菌门(Euryarchaeota)是窖池中的绝对优势类群,占所有序列丰度的97.67%,其次是泉古菌门(Crenarchaeota),仅占2.29%。
酒醅中古菌群落主要分布在甲烷杆菌属(平均相对丰度:43.17%)、甲烷短杆菌属(11.15%)、甲烷八叠球菌属(15.47%)和甲烷粒菌属(Methanocorpusculum,12.48%) (图 3)。甲烷短杆菌属能量代谢源于还原CO2为CH4,它在第3天丰度跃升至86.39%,可能是它能迅速利用发酵前期微生物的呼吸产生的二氧化碳。甲烷粒菌属在21–46 d之间相对丰度较高,平均为28.15%,可能是发酵后期由于微生物代谢活动减弱,温度逐渐回落。甲烷粒菌属是低温厌氧反应器中常见古菌,其最适温度为25 ℃[13]。
发酵起始时,窖泥中古菌群落主要分布在甲烷杆菌属(24.96%)、甲烷八叠球菌属(47.67%)、甲烷囊菌属(12.00%)和VadinCA11属(8.13%) (图 3)。发酵启动后,甲烷杆菌属丰度占比增加,在第3天,丰度占古菌群落的99.49%,在3–9 d其丰度波动较大,随后保持增长,26 d时为66.84%,但是发酵后期(31–46 d)其丰度略有降低,保持在36.55%左右。甲烷八叠球菌属相对丰度的消长规律与甲烷杆菌属的丰度变化呈显著负相关(r=−0.775,P=0.002),其发酵后期丰度占比为19.29%。VadinCA11属在21 d时相对丰度最高,为13.02%,发酵后期降至0.83%。
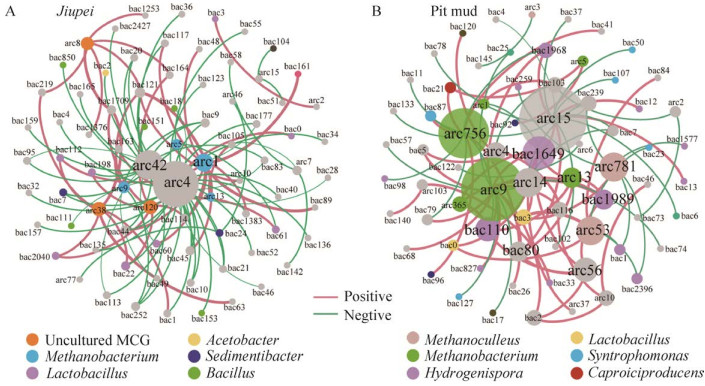
2.4 酒醅与窖泥古菌与细菌群落共现性分析 酒醅中古菌与细菌群落的共现性网络共有79个节点和102条边(其中62.75%为负相关),平均连接度为2.58,中心节点的连接度为32 (图 4A)。甲烷杆菌属和uncultured MCG (Miscellaneous crenarchaeotal group)与网络中的细菌节点多为正相关。MCG是一类至今尚未分离培养出的古菌,普遍存在于海洋和陆地环境中,被重新命名为深古菌门Bathyarchaeota[14]。
窖泥中细菌多样性较高,选取了平均相对丰度前100 (41.40%)的OTU与前20 (99.32%)的古菌OTU进行共现性网络分析,该网络共有70个节点和88条边(57.95%为正相关),平均连接度为2.54 (图 4B)。网络中心的古菌节点主要分布在甲烷囊菌属和甲烷杆菌属,甲烷杆菌属的OTU与图中多数细菌节点为正相关,特别是氢孢菌属Hydrogenispora和产己酸菌属Caproiciproducens。
3 讨论 泥窖池多菌种固态生香发酵是浓香型白酒酿造的典型特点,其中古菌是发酵过程重要的功能菌[1-2]。本研究采用高通量测序技术对比了浓香白酒酿造过程酒醅与窖泥中古菌群落的生物量、组成与演替规律。窖泥中古菌平均生物量约是酒醅的200倍,这种差异可能是由于两种生境的环境条件(特别是pH和酸度)不同导致的。正常或优质窖泥的pH偏中性[2],酒醅pH偏酸性(约3–4)[15],白酒发酵过程的主要古菌为产甲烷古菌,其生长最适pH偏中性[16]。除近发酵结束时,酒醅与窖泥之间古菌群落的丰富度和多样性差异并不显著。在发酵过程中,酒醅经历了一个从有氧、低渗到厌氧、高渗的环境,并且酸度持续增加,环境因子变化比较剧烈,这可能是发酵前期和中期酒醅古菌群落多样性波动较大的原因。
甲烷杆菌属是浓香型白酒发酵过程窖池中丰度占比最高的古菌群类。窖泥中甲烷杆菌属主要与氢孢菌属和产己酸菌属呈正相关关系。浓香型白酒发酵过程氢孢菌属被检出是窖泥中相对丰度最高的梭菌[17-18],目前该属仅有一个明确分类学地位的种,Hydrogenispora ethanolica是2014年从处理除草剂废水的厌氧污泥中分离出的模式种,能够发酵葡萄糖生成乙酸、乙醇和氢气,但体系中积累氢气和过量有机酸会反馈抑制产酸菌,降低其活性[19]。在2015年己酸菌属被正式分类和命名,其模式种半乳糖己酸菌Caproiciproducens galactitolivorans主要代谢终产物为己酸、乙酸、丁酸和氢气[20],2017年在浓香型白酒窖泥中第一次被报道,它是窖泥中丰度最高的细菌群类,丰度占比随窖龄延长而增加[21],且主要分布在窖泥表层[22]。甲烷杆菌属是严格的氢营养型产甲烷古菌,能够通过种间氢转移解除产酸菌的氢抑制效应[4]。
窖泥微生物群落宏基因组学分析发现了大量氢营养型和乙酸营养型产甲烷途径上重要酶的基因,如与乙酸降解产甲烷相关的乙酰辅酶A合成酶(acs)、乙酰脱羧/合成复合酶基因(cdh);与氢营养产甲烷相关的fwd、ftr、mtr和mcr等,氢营养型和乙酸营养型产甲烷古菌已被证明是窖泥中的优势产甲烷古菌[23]。除甲烷杆菌属外,发酵过程窖池中第二大古菌群类为混合营养型产甲烷古菌甲烷八叠球菌属,能够利用乙酸、H2和CO2产甲烷。窖泥中甲烷八叠球菌的丰度随窖龄增加而提高[1]。基于以上报道,推测产甲烷古菌与产酸菌之间的互作解除了氢抑制,实现了发酵过程的酸积累,促进了浓香型白酒典型风味的形成,但它们之间复杂的交互作用有待深入研究,可通过宏组学或纯培养等分析方法。
本研究通过分子生物学手段分析了浓香型白酒发酵过程酒醅与窖泥中古菌群落的结构多样性,并通过共现性分析探索了发酵过程古菌与细菌群落的相互作用关系,为认识和理解古菌在浓香型白酒酿造和风味形成中的作用提供了理论参考。
 2020, Vol. 36
2020, Vol. 36