中国科学院微生物研究所、中国微生物学会主办
文章信息
- 黄亚丽, 郑立伟, 黄媛媛, 贾振华, 宋水山, 李再兴
- Huang Yali, Zheng Liwei, Huang Yuanyuan, Jia Zhenhua, Song Shuishan, Li Zaixing
- 枯草芽孢杆菌菌剂不同施用方式对甜瓜土壤微生物多样性及生长的影响
- Effects of different application methods of Bacillus subtilis agent on soil microbial diversity and growth of muskmelon
- 生物工程学报, 2020, 36(12): 2644-2656
- Chinese Journal of Biotechnology, 2020, 36(12): 2644-2656
- 10.13345/j.cjb.200379
-
文章历史
- Received: June 24, 2020
- Accepted: November 2, 2020
2. 河北省科学院生物研究所,河北 石家庄 050081
2. Institute of Biology, Hebei Academy of Sciences, Shijiazhuang 050081, Hebei, China
甜瓜营养价值丰富、香甜可口,深受大众喜爱,是我国重要的经济作物[1]。然而,为了追求高产高效,在甜瓜种植过程中存在着过量施肥、重茬种植的现象。重茬引起土壤养分过度积累、微生物群落退化、酶活性降低、土传病害增多等一系列问题,导致甜瓜产量降低、品质下降[2]。通过土壤管理措施改良土壤微生态环境,是种植业可持续发展的关键[3]。微生物菌剂由于能够提高土壤酶活性、改变土壤微生物菌群、改良土壤养分环境而常被用于土壤微生态环境改良和土传病害的防治[4-5],具有良好的促长、增产效果[6]。枯草芽孢杆菌是目前应用最为广泛的微生物菌剂,在黄瓜[7]、番茄[8]、马铃薯[9]、香蕉[10]等作物上应用均具有良好的改良土壤微生态环境和促进作物生长的效果。
微生物菌剂的应用效果受诸多因素的影响,菌剂不同的施用方式由于影响菌剂的定殖导致其应用效果存在差异[11-12]。微生物菌剂的施用方式多样,包括穴施、蘸根、随水滴灌、撒施等[13],但是不同施用方式对根围土壤微生物多样性和作物生长的影响鲜见报道。研究不同微生物菌剂施用方式对土壤微生物多样性和作物生长的影响,对优化微生物菌剂的施用方式、提升微生物菌剂的应用效果具有重要的意义。本研究以设施甜瓜为研究对象,研究灌根、穴施、蘸根3种枯草芽孢杆菌施用方式对土壤微生物多样性、甜瓜营养生长和产量的影响,旨在确定合理的枯草芽孢杆菌施用方式,为采用微生物菌剂进行设施甜瓜土壤的微生态改良提供理论依据。
1 材料与方法 1.1 试验区概况试验于2019年在河北省农林科学院鹿泉大河试验园区(38°14′ N、114°39′ E)进行,为北温带半湿润大陆性季风气候区,年平均气温13.3 ℃,平均降雨525 mm,年均无霜期205 d。甜瓜种植于拱形塑料大棚中,棚室长30 m,宽15 m,南北走向,整地后覆盖黑色聚乙烯薄膜。供试土壤类型为壤质褐土,有机质含量为21.42 g/kg、总氮含量1.86 g/kg、有效磷含量61.47 mg/kg、有效钾152.38 mg/kg、pH值7.54。
1.2 供试甜瓜品种供试甜瓜品种为西州蜜5号,营养钵苗购自河北省农林科学院经济作物研究所。
1.3 供试肥料化肥为沃利沃氮磷钾复合肥(N-P2O5-K2O为25-10-25),由河南农心肥业有限公司生产;有机肥购自河北瑞安康生物科技有限公司;枯草芽孢杆菌菌剂(有效活菌数5×108 CFU/g)由河北省科学院生物研究所研制并中试生产。
1.4 试验设计试验设置灌根、穴施、蘸根3个施用方式,以常规施肥为对照。灌根:用量30 kg/hm2,移栽后随水滴灌;穴施:用量30 kg/hm2,移栽前施入移栽穴中;蘸根:菌剂清水稀释100倍,移栽时蘸根。每个处理3次重复,共12个小区,小区面积20 m2,随机排列。株行距为30 cm×80 cm,2019年3月5日定植,每株结1个瓜,2019年6月24日拉秧。
1.5 土壤样品采集于甜瓜的开花期、结果期、拉秧期采集根围土壤样品(根围2 cm),取样方法为五点取样法,采集的土壤样品于无菌袋密封保存并低温运送至实验室。开花期、结果期土壤样品于4 ℃保存,用于可培养微生物数量的测定;拉秧期的土壤样品分为两份:一部分4 ℃保存,用于可培养微生物数量的测定;另一部分-80 ℃超低温冰箱保存用于未培养微生物多样性测定。
1.6 测定指标和方法土壤可培养微生物:参考《土壤微生物研究原理与方法》[14]并进行适当改良,用稀释涂布平板方法测定土壤中可培养细菌、真菌的数量,其中细菌测定采用LB培养基,真菌测定采用PDA+200 U/mL庆大霉素培养基。
土壤微生物多样性:将采集样品送至生工生物工程(上海)股份有限公司,采用Illumina MiseqTM测序技术进行样品测定,对细菌的16S rRNA基因的V3–V4区和真菌ITS基因进行扩增及测序,通过Reads拼接、过滤、去嵌合体等数据预处理,对有效数据进行操作分类单元(Operational taxonomic units,OTU)聚类,按照97%相似度进行聚类,进行生物信息统计分析。
叶面积指数(Leaf area index,LAI):于开花期测定甜瓜叶面积,采用直接测量法测定单叶叶面积(Leaf area,LA)[15],叶面积指数计算参见文献[16]。
叶绿素含量:采用购买自南京建成生物工程研究所的试剂盒测定开花期中部叶片叶绿素含量,测定位置为叶顶端,避开叶脉。
1.7 数据处理采用Microsoft Excel 2007与SPSS 19.0软件对微生物数量、甜瓜生长等指标进行单因素方差分析,处理间差异显著性检验使用邓肯法(Duncan) (P < 0.05)。采用Mothur v1.30.1软件进行微生物Alpha多样性分析。采用R语言Vegan包进行非度量多维尺度NMDS (Non-metric multi-dimensional scaling)分析,基于RDP数据库对OTU进行物种分类。
2 结果与分析 2.1 菌剂不同施用方式对甜瓜根围土壤可培养微生物数量的影响分别采集甜瓜开花期、结果期和拉秧期的土壤样品,测定菌剂不同施用方式对土壤中可培养细菌和真菌数量的影响。由表 1结果可知,在甜瓜开花、结果和拉秧期,菌剂不同施用方式处理的细菌数量均显著高于对照。但是,3种菌剂施用方式处理间的细菌数量不存在显著差异。分析菌剂不同施用方式对甜瓜不同生育时期土壤真菌数量的影响发现,3个菌剂施用方式处理的真菌数量在开花期显著低于对照,其中以蘸根和穴施真菌数量最少,且显著低于灌根处理,表明由于枯草芽孢杆菌的定殖抑制了真菌的繁殖。但是随着菌剂施用时间延长,对土壤真菌数量的影响减弱,至拉秧期3个菌剂处理与对照间土壤真菌数量均不存在显著差异,说明菌剂施用对真菌的影响随施用时间的延长而减弱。
| Treatment | Flowering stage | Fruiting stage | Pulling stage | |||
| Bacteria (106 CFU/g) |
Fungi (104 CFU/g) |
Bacteria (106 CFU/g) |
Fungi (104 CFU/g) |
Bacteria (106 CFU/g) |
Fungi (104 CFU/g) |
|
| Control | 76.4±5.4b | 97.2±4.5a | 118.2±18.3b | 43.8±4.3a | 67.0±6.8b | 26.2±4.7a |
| Root irrigation | 105.9±8.2a | 79.5±6.4b | 145.0±41.6a | 32.7±6.3b | 131.2±11.2a | 24.5±8.2a |
| Hole application | 109.8±10.1a | 30.5±8.2c | 184.9±30.1a | 33.3±4.5b | 129.5±19.4a | 25.5±6.4a |
| Dipping roots | 93.8±6.3a | 48.2±4.8c | 143.7±35.8a | 40.3±3.8a | 138.2±6.2a | 33.7±5.8a |
| Different lowercase letters after the same column of values indicate significant differences (P < 0.05). | ||||||
图 1为菌剂不同施用方式处理细菌的Shannon指数、Simpson指数的统计分析数据。由图 1可知,3种菌剂施用方式处理的Shannon指数均高于对照,表明枯草芽孢杆菌的施用可以增加土壤微生物的丰富度和均匀度;Simpson指数则均低于对照,表明由于枯草芽孢杆菌的施用使土壤微生物种类更加丰富。由此可知,微生物菌剂施用均能提高土壤细菌群落的多样性。

|
| 图 1 菌剂不同施用方式对土壤中未培养细菌Shannon (A)和Simpson (B)指数的影响 Fig. 1 Effects of different treatments on Shannon (A) and Simpson (B) index of bacteria. |
| |
菌剂不同施用方式对甜瓜根围土壤真菌Alpha多样性也具有一定的影响,其中蘸根处理的真菌Shannon指数最低,而Simpson指数最高(图 2),表明蘸根方式施用枯草芽孢杆菌使土壤中以单一种类真菌为主的现象减弱,有利于甜瓜真菌病害发生率的降低。但3种菌剂施用方式处理未呈现规律性的变化,说明枯草芽孢杆菌施用对拉秧期土壤真菌的多样性影响较小。

|
| 图 2 菌剂不同施用方式对土壤中未培养真菌Shannon (A)和Simpson (B)指数的影响 Fig. 2 Effects of different treatments on Shannon (A) and Simpson (B) index of fungi. |
| |
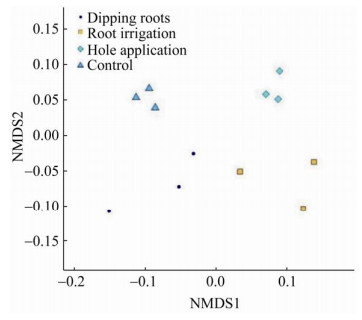
对菌剂不同施用方式处理的土壤细菌Beta多样性进行NMDS分析(图 3),由图 3结果可知,蘸根、灌根、穴施和常规对照4个处理中3个重复的微生物菌群均能够聚于一个区域,与其他处理明显分开,说明不同的处理之间细菌均有一定的差异,而同一处理之间存在较强的一致性。对每个处理3次重复的微生物进行综合分析并进行聚类,由图 4可以看出,穴施处理和灌根处理的细菌多样性较为相似,而蘸根处理的细菌则独立处于一个分枝。说明通过蘸根的方式施用菌剂可以较为明显地影响甜瓜根围土壤中的细菌菌群。
|
| 图 3 菌剂不同施用方式土壤中细菌的NMDS分析图 Fig. 3 Effects of different treatments on bacterial NMDS analysis. |
| |

|
| 图 4 菌剂不同施用方式土壤细菌属水平上聚类分析图 Fig. 4 Combined analysis chart of cluster tree and histogram of bacteria at genus level. |
| |
对不同菌剂施用方式处理的土壤真菌Beta多样性进行NMDS分析(图 5),由图 5结果可知,除对照3个重复的微生物菌群较为独立地位于一个区域,3个菌剂不同施用方式处理的区分度稍差,说明不同处理之间的真菌多样性的差异较小。对不同处理的未培养真菌群落构成进行了聚类分析,由图 6可以看出,对照与灌根聚类于一个分枝,之后为穴施处理,而蘸根处理的真菌则独立处于一个分枝。进一步说明通过蘸根的方式施用菌剂不仅可以较为明显地影响植物根围土壤中的细菌菌群,也对真菌菌群有较为明显的影响。

|
| 图 5 菌剂不同施用方式土壤中真菌的NMDS分析图 Fig. 5 Effects of different treatments on NMDS analysis of fungi. |
| |

|
| 图 6 菌剂不同施用方式土壤真菌属水平上聚类分析图 Fig. 6 Cluster analysis chart of fungi at genus level for different treatments. |
| |
表 2列出了各处理土壤细菌在门和属水平上的丰度变化。由表 2结果可知,4个处理土壤细菌排名前5位的优势菌门相同,均为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)。菌剂的施用使拟杆菌门(Bacteroidetes)的丰度显著降低,灌根、穴施和蘸根处理分别比对照降低15.33%、16.28%和19.55%,蘸根处理降低幅度最大。放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)的丰度显著升高,灌根、穴施和蘸根处理的放线菌门分别比对照增高35.81%、19.97%和22.29%,酸杆菌门则分别较对照增高21.38%、17.64%和30.19%,以蘸根处理增加幅度最大。分析不同处理土壤细菌属的种类和丰度发现,菌剂不同施用方式处理中变形菌门(Proteobacteria)中Povalibacter属、放线菌门(Actinobacteria)中诺卡氏属Nocardioides、酸杆菌门(Acidobacteria)中Gp16、Gp10属和厚壁菌门(Firmicutes)中芽孢杆菌属Bacillus的丰度均显著高于对照,酸杆菌门(Acidobacteria)中Devosia属和拟杆菌门(Bacteroidetes)中Salinimicrobium属的丰度显著低于对照。总体来说,菌剂的施用能够使未培养微生物中较多的微生物菌门和属处于上升的趋势,且以有益微生物为主。
| Taxonomy | Abundance (%) | ||||
| Phyla | Genera | Control | Root irrigation | Hole application | Dipping roots |
| Proteobacteria | 49.80±0.67a | 48.71±2.93a | 49.84±2.10a | 46.78±2.87a | |
| Sphingomonas | 7.20±0.41a | 7.19±0.41a | 6.81±0.11a | 6.75±0.71a | |
| Luteimonas | 2.52±0.27a | 2.22±0.25a | 2.29±0.05a | 2.43±0.29a | |
| Lysobacter | 2.02±0.08a | 2.60±0.49a | 2.08±0.55a | 2.23±0.09a | |
| Devosia | 1.76±0.13a | 1.25±0.27b | 1.34±0.16b | 1.30±0.09b | |
| Lacibacterium | 1.21±0.04b | 1.33±0.03b | 1.67±0.07a | 1.16±0.17b | |
| Povalibacter | 1.08±0.08b | 1.60±0.37a | 1.68±0.06a | 1.77±0.14a | |
| Steroidobacter | 1.40±0.11a | 1.33±0.22a | 1.15±0.21a | 1.03±0.14a | |
| Altererythrobacter | 1.07±0.04ab | 0.71±0.18c | 0.88±0.07bc | 1.21±0.09a | |
| Mesorhizobium | 1.07±0.10a | 0.79±0.18a | 0.93±0.18a | 0.89±0.08a | |
| Phaselicystis | 0.65±0.02a | 0.76±0.03a | 0.61±0.16a | 0.48±0.07a | |
| Pelagibius | 0.67±0.11a | 0.53±0.18a | 0.58±0.06a | 0.66±0.03a | |
| Phenylobacterium | 0.57±0.02a | 0.55±0.08a | 0.57±0.05a | 0.51±0.04a | |
| Cellvibrio | 0.62±0.12a | 0.51±0.20a | 0.54±0.42a | 0.55±0.35a | |
| Bacteroidetes | 11.61±0.17a | 9.83±0.13b | 9.72±0.49b | 9.34±0.71b | |
| Ohtaekwangia | 1.87±0.10b | 2.18±0.25a | 1.76±0.12b | 1.71±0.06b | |
| Chryseolinea | 1.06±0.09a | 1.00±0.11a | 1.14±0.12a | 0.67±0.08b | |
| Salinimicrobium | 1.32±0.12a | 0.64±0.04b | 0.41±0.03b | 0.45±0.27b | |
| Adhaeribacter | 0.66±0.11a | 0.64±0.18a | 0.47±0.03a | 0.60±0.05a | |
| Terrimonas | 0.45±0.01b | 0.50±0.02b | 0.72±0.09a | 0.43±0.07b | |
| Actinobacteria | 7.76±0.39c | 10.54±0.65a | 9.31±0.65b | 9.49±0.75ab | |
| Nocardioides | 0.47±0.05b | 0.91±0.17a | 0.68±0.05ab | 0.87±0.15a | |
| Acidobacteria | 6.69±0.34b | 8.12±0.44a | 7.87±0.13a | 8.71±0.36a | |
| Gp6 | 3.26±0.10c | 3.92±0.17a | 3.59±0.05b | 3.07±0.07c | |
| Gp16 | 0.90±0.07b | 1.23±0.11a | 1.18±0.09a | 1.10±0.12a | |
| Aridibacter | 0.91±0.05a | 0.72±0.12b | 0.91±0.01a | 0.65±0.09b | |
| Gp10 | 0.56±0.04b | 0.78±0.12a | 0.83±0.06a | 0.75±0.04a | |
| Planctomycetes | 5.38±0.64a | 4.47±1.11a | 4.53±0.68a | 6.64±4.34a | |
| Pirellula | 0.88±0.12a | 0.71±0.18a | 0.80±0.11a | 1.02±0.77a | |
| Firmicutes | 2.05±0.22a | 2.45±0.35a | 2.68±0.16a | 2.42±0.22a | |
| Bacillus | 0.56±0.04b | 0.69±0.16a | 0.74±0.05a | 0.64±0.03a | |
| Gemmatimonadetes | 2.19±0.12a | 2.60±0.30a | 2.49±0.20a | 2.11±0.15a | |
| Gemmatimonas | 2.19±0.12a | 2.60±0.30a | 2.49±0.20a | 2.11±0.15a | |
| Verrucomicrobia | 2.38±0.23a | 1.65±0.38a | 1.93±0.22a | 1.92±0.40a | |
| Subdivision3_genera_incertae_sedis | 0.75±0.09a | 0.51±0.06a | 0.67±0.08a | 0.61±0.13a | |
| Other | 11.83±0.21a | 11.62±1.92a | 11.60±0.83a | 12.60±0.42a | |
| Saccharibacteria_genera_incertae_sedis | 1.16±0.11a | 1.38±0.02a | 1.41±0.10a | 1.37±0.24a | |
| WPS-1_genera_incertae_sedis | 0.63±0.06a | 0.74±0.27a | 0.51±0.14a | 0.87±0.40a | |
| Parcubacteria_genera_incertae_sedis | 0.51±0.09a | 0.51±0.18a | 0.70±0.17a | 0.72±0.15a | |
| Different lowercase letters of the same line values indicate significant differences (P < 0.05). | |||||
表 3列出了不同处理甜瓜根围土壤的优势真菌菌门,结果表明各处理中子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、油壶菌门(Olpidiomycota)、丝孢菌门(Mortierellomycota)、担子菌门(Basidiomycota)为优势菌门,菌剂施用处理显著提高了壶菌门(Chytridiomycota)的丰度,其他4个菌门与对照间差异不显著。对各菌门中的属进行分析发现,3个菌剂不同施用方式处理均显著提高了子囊菌门(Ascomycota)中毛孢壳属(Unclassified_ Coniochaetaceae)的丰度,显著降低毛球壳属(Unclassified_Lasiosphaeriaceae)的丰度,蘸根处理的子囊菌门(Ascomycota)中白僵菌属Beauveria以及壶菌门(Chytridiomycota)中根囊壶菌属Rhizophlyctis的丰度显著增加。
| Taxonomy | Abundance (%) | ||||
| Phyla | Genera | Control | Root irrigation | Hole application | Dipping roots |
| Ascomycota | 42.15±2.96a | 41.26±0.08a | 42.31±3.80a | 43.75±5.94a | |
| Unclassified_Chaetomiaceae | 7.37±3.38a | 6.84±0.86a | 9.14±0.96a | 8.82±2.41a | |
| Unclassified_Sordariales | 4.64±1.00a | 5.86±2.16a | 2.81±1.67a | 3.18±0.34a | |
| Unclassified_Ascomycota | 3.79±1.39a | 3.00±0.31a | 6.48±4.54a | 2.27±0.22a | |
| Phaeoacremonium | 5.05±7.96a | 3.69±1.20a | 4.84±2.73a | 4.39±0.53a | |
| Beauveria | 3.03±0.71b | 2.84±0.29b | 2.77±0.44b | 6.26±2.55a | |
| Microascus | 3.29±1.12a | 2.52±0.69a | 2.74±1.01a | 3.36±0.47a | |
| Podospora | 2.59±1.79a | 3.19±0.21a | 1.75±0.30a | 2.07±0.26a | |
| Hydropisphaera | 1.35±0.30b | 1.26±0.47b | 3.24±0.80a | 3.53±0.99a | |
| Madurella | 2.33±1.97a | 2.66±1.98a | 0.62±0.46a | 0.82±0.21a | |
| Aspergillus | 0.88±0.21a | 0.89±0.25a | 1.15±0.49a | 1.53±0.04a | |
| Acremonium | 0.62±0.23a | 0.64±0.09a | 0.78±0.23a | 0.58±0.04a | |
| Unclassified_Xylariaceae | 0.38±0.64a | 1.17±1.99a | 0.31±0.51a | 0.35±0.60a | |
| Unclassified_Eurotiales | 0.43±0.23a | 0.98±1.12a | 0.31±0.15a | 0.26±0.18a | |
| Sarocladium | 0.16±0.05a | 0.27±0.11a | 1.23±1.42a | 0.42±0.08a | |
| Unclassified_Coniochaetaceae | 0.16±0.05b | 0.96±0.48a | 0.98±0.03a | 0.69±0.15a | |
| Unclassified_Lasiosphaeriaceae | 1.07±0.30a | 0.11±0.03c | 0.24±0.05b | 0.40±0.24b | |
| Fusarium | 0.37±0.07a | 0.34±0.08a | 0.41±0.21a | 0.29±0.02a | |
| Chrysosporium | 0.40±0.13a | 0.26±0.06a | 0.36±0.06a | 0.27±0.06a | |
| Remersonia | 0.39±0.09a | 0.28±0.07a | 0.34±0.08a | 0.24±0.12a | |
| Unclassified_Onygenales | 0.28±0.12a | 0.32±0.11a | 0.37±0.06a | 0.22±0.08a | |
| Chytridiomycota | 7.88±2.03b | 9.25±1.06a | 10.08±3.45a | 12.97±3.52a | |
| Rhizophlyctis | 7.37±5.19b | 5.10±1.01b | 6.78±1.47b | 12.16±3.90a | |
| Olpidium | 3.49±0.83a | 4.60±2.50a | 7.78±3.49a | 2.62±1.96a | |
| Unclassified_Spizellomycetaceae | 0.32±0.50a | 0.12±0.14a | 0.16±0.18a | 0.73±0.58a | |
| Olpidiomycota | 3.49±0.83a | 4.60±2.50a | 7.78±3.49a | 2.62±1.96a | |
| Mortierellomycota | 2.03±0.40a | 3.72±1.27a | 3.51±0.85a | 1.77±1.00a | |
| Mortierella | 1.72±0.12a | 2.98±0.99a | 3.01±0.85a | 1.48±0.75a | |
| Unclassified_Mortierellales | 0.26±0.25a | 0.67±0.32a | 0.40±0.07a | 0.26±0.28a | |
| Basidiomycota | 2.65±1.59a | 4.98±2.95a | 1.81±0.74a | 1.33±1.25a | |
| Coprinellus | 1.47±1.26a | 2.42±2.09a | 0.36±0.61a | 0.68±1.11a | |
| Conocybe | 0.73±0.54a | 1.75±1.21a | 1.06±0.25a | 0.17±0.08a | |
| Blastocladiomycota | 0.19±0.10b | 0.36±0.21b | 1.45±0.32a | 0.17±0.09b | |
| Unclassified_Blastocladiomycota | 0.16±0.10b | 0.33±0.18b | 1.25±0.22a | 0.13±0.03b | |
| Cercozoa | 0.28±0.09b | 0.57±0.15a | 0.55±0.02a | 0.21±0.14b | |
| Other | 41.34±6.75a | 39.24±6.47a | 37.51±4.59a | 37.17±1.87a | |
| Different lowercase letters of the same line values indicate significant differences (P < 0.05). | |||||
由表 4结果可知,3种菌剂施用方式对甜瓜营养生长和生殖生长均有一定的影响,3个处理的株高、茎粗、叶面积均高于对照,其中蘸根处理对甜瓜株高、叶面积指数、叶绿素含量的影响最大。对于单果重而言,蘸根处理较对照增产7.31%,而穴施和灌根处理单果重与对照差异不显著,可能是由于本研究甜瓜种植以每株单瓜的方式进行管理,从而使植株整个生长期较短,养分供应比较充足,造成不同处理间产量的差异相对较小。
| Treatment | Plant height (m) | Stem diameter (mm) | Leaf area index | Totol chlorophyll (mg/g) | Single fruit weight (g) |
| Control | 1.13±0.18a | 5.58±0.12a | 0.59±0.04b | 3.56±0.12a | 1 581.70±120.42b |
| Root irrigation | 1.17±0.27a | 5.61±0.17a | 0.64±0.12ab | 3.57±0.08a | 1 522.25±132.44b |
| Hole application | 1.21±0.34a | 5.80±0.14a | 0.64±0.09ab | 3.50±0.14a | 1 447.15±124.12b |
| Dipping roots | 1.23±0.24a | 5.78±0.26a | 0.68±0.04a | 3.72±0.14a | 1 697.30±98.48a |
| Different lowercase letters of the same column values indicate significant differences (P < 0.05). | |||||
施用农用微生物菌剂是目前常用的提高土壤中有益微生物种群数量与丰度[4]、抑制病原菌繁殖[5]的农艺措施。枯草芽孢杆菌是土壤生态系统常见的根际促生细菌,由于其良好的促长、防病、调节土壤微生态平衡作用[17-18],已经成为目前应用最多的微生物菌剂。菌剂施用时期和施用方式不同可以影响菌剂的定殖及增产效果[12]。高新昊等[19]研究表明,以基肥和基肥+追肥的方式施用微生物菌剂能够显著提高番茄产量和品质,而以追肥方式施用微生物菌剂的增产效果则不明显,明确不同施用方式对菌剂应用效果的影响对指导菌剂的合理应用具有重要的作用。本研究比较了蘸根、穴施和灌根3种方式施用枯草芽孢杆菌菌剂对甜瓜土壤可培养微生物数量的影响,结果显示甜瓜不同生育时期、菌剂处理的土壤细菌含量均高于对照,土壤真菌含量在开花期显著低于对照。细菌和真菌是土壤微生物的两大主要组成部分,其数量和比例变化能够较为敏感地反映环境变化带来的影响、决定着土壤功能的发挥[20]。土壤细菌含量下降、真菌数量上升,土壤从“细菌型”向“真菌型”转化,是土壤微生态失衡、病害加重的标志[21]。与本研究结果相似,金京京等[22]研究也发现,施用枯草芽孢杆菌B1514可湿性粉剂,小麦种植土壤中呈现细菌数量上升、真菌数量降低的结果。然而,邢嘉韵等[23]研究发现,微生物菌剂施用后马铃薯根际土壤细菌、真菌数量均呈现上升趋势,但是菌剂处理的细菌/真菌比值也增大,土壤“细菌化”状态明显。总之,多数研究均显示微生物菌剂施用使土壤中细菌数量升高,微生态失衡趋势得以有效逆转,为农作物生长提供有利的土壤环境。但是,由于可培养微生物数量指标较为综合,未能反映出不同菌剂施用方式处理之间的差异。
高通量测序技术能够准确测出大多数微生物的序列,已越来越多地应用于研究植物和土壤环境中微生物的群落结构和多样性,从而更为全面地反映微生物的均衡性、多样性[24-25]。本研究采用Illumina Miseq高通量测序技术对菌剂不同方式施用处理的土壤细菌、真菌的Alpha和Beta多样性、群落结构进行了全面的分析,3种不同菌剂施用方式处理的细菌Shannon指数均高于常规施肥对照,Simpson指数低于对照,表明3种方式均能够提高土壤细菌多样性。但是,菌剂施用方式对真菌的多样性影响则相对较小,这与可培养微生物的分析结果基本一致。余贤美等[26]的研究也发现采用浇灌法施用枯草芽孢杆菌Bs-15能够显著提高枣树土壤细菌的Shannon和Simpson,细菌多样性升高。但是,不同的微生物菌剂由于其作用机理不同,对土壤真菌、细菌多样性影响也不相同。木霉是一种能够拮抗病原真菌的微生物菌剂,其施用后对土壤中细菌多样性影响较小,但会使真菌多样性明显降低[27]。对菌剂不同施用方式处理土壤未培养微生物进行了聚类分析,蘸根处理的细菌和真菌均独立于一个分枝,说明该处理对甜瓜根围微生物菌群的影响较大,而灌根和穴施处理则相对较小。
另外,对不同处理的优势菌门进行分析发现,4个处理土壤细菌的优势菌门相同,微生物菌剂施用能够显著提高放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)的丰度,降低了拟杆菌门(Bacteroidetes)的丰度,与杨尚东等[28]的研究结果相似。其中,放线菌门的一些菌种已被广泛应用于植物病虫害的防治,酸杆菌门(Acidobacteria)是新划分出的细菌门,在土壤细菌中占比很高,一般嗜酸、寡营养、难培养[29]。在属水平上分析发现,厚壁菌门(Firmicutes)中芽孢杆菌属(Bacillus)呈显著升高,增加幅度在14.28%–32.14%之间,由于本研究施用的是枯草芽孢杆菌菌剂,该菌在土壤中的定殖增加了芽孢杆菌属的丰度。芽孢杆菌是目前应用最多的功能微生物属,其中包括枯草芽孢杆菌、解淀粉芽孢杆菌、巨大芽孢杆菌在内的10多种均实现了制剂化。枯草芽孢杆菌施用对拉秧期土壤根围真菌门的影响较小,仅对壶菌门(Chytridiomycota)的丰度有显著的影响。对各菌门中的属进行分析发现,3个不同施用方式处理仅对3个属的真菌具有增加作用,对绝大部分属均未有影响。对可培养真菌的测定也发现,在拉秧期真菌数量之间未存在显著差异,说明枯草芽孢杆菌菌剂施用对甜瓜拉秧期的真菌菌群的多样性影响较小。与对可培养真菌数量的分析相一致。
微生物菌剂通过多样的作用机制实现促长增产作用已经多有报道[30]。本研究所用的枯草芽孢杆菌菌株是本课题组筛选出的具有拮抗植物病原菌、促进幼苗生长的菌株。该菌剂在设施甜瓜上采用蘸根、穴施和灌根的方式施用在一定程度上均能够提高株高、茎粗、叶面积指数和叶绿素含量,其中以蘸根处理的促长、增产效果最为明显,说明该种施用方式改变了土壤微生物组成进而为甜瓜的生长提供了更好的生存条件。本研究分析了枯草芽孢杆菌菌剂不同施用方式对甜瓜土壤微生物多样性及生长的影响,其中蘸根方式对甜瓜土壤微生物及生长的影响相对较大,为枯草芽孢杆菌菌剂在设施农业合理施用及效果提供理论指导。
| [1] |
Lian QL, Zhang YF, Ding XM, et al. Quality and safety status of vegetables produced in protected facilities in Northern China and analysis of existing problems. China Veget, 2016(7): 15-21 (in Chinese). 连青龙, 张跃峰, 丁小明, 等. 我国北方设施蔬菜质量安全现状与问题分析. 中国蔬菜, 2016(7): 15-21. DOI:10.3969/j.issn.1000-6346.2016.07.006 |
| [2] |
Zhou YL, Qiao HY, Gao HC, et al. Effect of melon continuous cropping on rhizosphere soil microorganisms and enzyme activities. Northern Horticul, 2015(19): 158-161 (in Chinese). 周艳丽, 乔宏宇, 高红春, 等. 甜瓜连作对其根际土壤微生物和酶活性的影响. 北方园艺, 2015(19): 158-161. |
| [3] |
Tang XF, Liu YF, Zhang CJ, et al. Effect of different planting years on soil biological properties and bacterial diversity in protected cultivation of Cucumis melo L. Chin J Tropical Crops, 2018, 39(8): 1493-1500 (in Chinese). 唐小付, 刘岳飞, 张传进, 等. 设施甜瓜种植年限对土壤生物学特性和细菌多样性的影响. 热带作物学报, 2018, 39(8): 1493-1500. DOI:10.3969/j.issn.1000-2561.2018.08.004 |
| [4] |
Wang GF, Gao XD, Ma Y, et al. Amendment effect of bio-organic soil conditioner on leafy vegetable greenhouse soil with continuous cropping obstacle. Soil Fertil Sci China, 2020(2): 56-65 (in Chinese). 王光飞, 高晓东, 马艳, 等. 生物有机类复合调理剂在设施叶菜障碍土壤上的应用效果. 中国土壤与肥料, 2020(2): 56-65. |
| [5] |
Bhattacharyya PN, Jha DK. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World J Microbiol Biotechnol, 2012, 28(4): 1327-1350. DOI:10.1007/s11274-011-0979-9 |
| [6] |
Hong SH, Lee EY. Phytostabilization of salt accumulated soil using plant and biofertilizers: Field application. Int Biodeterior Biodegrad, 2017, 124: 188-195. DOI:10.1016/j.ibiod.2017.05.001 |
| [7] |
Qiao JQ, Chen ZY, Liang XJ, et al. Biocontrol efficacy on tomato bacterial wilt by Bacillus subtilis Bs916. Chin J Biol Contr, 2016, 32(2): 229-234 (in Chinese). 乔俊卿, 陈志谊, 梁雪杰, 等. 枯草芽孢杆菌Bs916防治番茄青枯病. 中国生物防治学报, 2016, 32(2): 229-234. |
| [8] |
Kang SH, Su YY, Li SF, et al. Effects of different concentrations of Bacillus subtilis on the growth and quality of cucumber seedlings. J Hebei Agricul Sci, 2014, 18(3): 52-53 (in Chinese). 康少辉, 苏浴源, 栗淑芳, 等. 不同浓度枯草芽孢杆菌对黄瓜秧苗长势和质量的影响. 河北农业科学, 2014, 18(3): 52-53. DOI:10.3969/j.issn.1088-1631.2014.03.016 |
| [9] |
Wu JH, Lv WX, Liu GJ, et al. Effects of Bacillus subtilis on potato black scurf and Verticillium wilt of potato and on soil enzyme activity. Chin Potato J, 2019, 33(2): 101-109 (in Chinese). 武建华, 吕文霞, 刘广晶, 等. 枯草芽孢杆菌对马铃薯黑痣病和黄萎病的防效及对土壤酶活性的影响. 中国马铃薯, 2019, 33(2): 101-109. DOI:10.3969/j.issn.1672-3635.2019.02.005 |
| [10] |
Fan SN, Yu GH, Chen YH, et al. Influence of Bacillus subtilis strain TR21 wettable powder on the banana rhizosphere microorganisms. Guangdong Agricul Sci, 2018, 45(10): 68-73 (in Chinese). 樊胜南, 喻国辉, 陈燕红, 等. 枯草芽孢杆菌TR21可湿性粉剂对香蕉根际土壤微生物的影响. 广东农业科学, 2018, 45(10): 68-73. |
| [11] |
Ma HY, Huang YY, Liu SY, et al. Effects of microbial agents on nutrient and bacterial community diversity in rhizosphere soil of eggplant cultivated in facilities. Microbiol China, 2020, 47(1): 140-150 (in Chinese). 马慧媛, 黄媛媛, 刘胜尧, 等. 微生物菌剂施用对设施茄子根际土壤养分和细菌群落多样性的影响. 微生物学通报, 2020, 47(1): 140-150. |
| [12] |
Zhao H, Wang TC, Xu J, et al. The Effect of different inoculation methods of plant growth-promoting rhizobacteria on cucumber in plastic shed in Spring. Vegetables, 2018(4): 8-12 (in Chinese). 赵鹤, 王铁臣, 徐进. 根际有益微生物不同接种方法对春季塑料大棚黄瓜生长的影响. 蔬菜, 2018(4): 8-12. |
| [13] |
Li QM, Lu XJ, Zhang MS, et al. Effects of microbial inoculants and rooting powder on muskmelon yield and soil ecological effect. Northern Horticul, 2020(7): 100-105 (in Chinese). 李青梅, 陆秀君, 张敏硕, 等. 微生物菌剂和生根粉对甜瓜产量和土壤生态效应的影响. 北方园艺, 2020(7): 100-105. |
| [14] |
Lin XG. Principles and Methods of Soil Microbiology Research. Beijing: Higher Education Press, 2010 (in Chinese). 林先贵. 土壤微生物研究原理与方法. 北京: 高等教育出版社, 2010. |
| [15] |
Wang HL, Li JX, Fan FC, et al. Evapotranspiration model and crop coefficient of greenhouse eggplant in North China. Chin J Eco-Agricul, 2018, 26(12): 1819-1827 (in Chinese). 王贺垒, 李家曦, 范凤翠, 等. 华北地区设施茄子蒸散量估算模型及作物系数确定. 中国生态农业学报, 2018, 26(12): 1819-1827. |
| [16] |
Li JM, Fan XY, Yan FF, et al. Effect of different irrigation amount based on transpiration model on yield and quality of muskmelon. Chin J Eco-Agricul, 2017, 33(21): 156-162 (in Chinese). 李建明, 樊翔宇, 闫芳芳, 等. 基于蒸腾模型决策的灌溉量对甜瓜产量及品质的影响. 农业工程学报, 2017, 33(21): 156-162. DOI:10.11975/j.issn.1002-6819.2017.21.018 |
| [17] |
Thatoi H, Behera BC, Mishra RR, et al. Biodiversity and biotechnological potential of microorganisms from mangrove ecosystems: a review. Ann Microbiol, 2013, 63(1): 1-19. DOI:10.1007/s13213-012-0442-7 |
| [18] |
Hu YJ, Wei JY, Lu J, et al. Research progress of Bacillus subtilis application in crops production. Crop Res, 2019, 33(2): 167-172 (in Chinese). 胡亚杰, 韦建玉, 卢健, 等. 枯草芽孢杆菌在农作物生产上的应用研究进展. 作物研究, 2019, 33(2): 167-172. |
| [19] |
Gao XH, Zhang ZB, Guo SR. Effect of microbial agent A73 on yield and quality of tomato in protected area. Shandong Agricul Sci, 2006(3): 54-55 (in Chinese). 高新昊, 张志斌, 郭世荣. 微生物菌剂A-73对保护地番茄产量与品质的影响. 山东农业科学, 2006(3): 54-55. |
| [20] |
Arroyo P, de Miera LES, Ansola G. Influence of environmental variables on the structure and composition of soil bacterial communities in natural and constructed wetlands. Sci Total Environ, 2015, 506-507: 380-390. |
| [21] |
Li CG, Li XM, Wang JG. Effect of soybean continuous cropping on bulk and rhizosphere soil microbial community function. Acta Ecologica Sin, 2006(4): 1144-1150 (in Chinese). 李春格, 李晓鸣, 王敬国. 大豆连作对土体和根际微生物群落功能的影响. 生态学报, 2006(4): 1144-1150. |
| [22] |
Jin JJ, Qi YZ, Zhen WC. Effects of Bacillus subtilis B1514 wettable powder on the control effects of wheat sharp eye spot, the soil microflora communities and the yield of wheat. Chin J Pest Sci, 2016, 18(5): 596-604 (in Chinese). 金京京, 齐永志, 甄文超. 枯草芽孢杆菌B1514可湿性粉剂对小麦纹枯病的防效及对土壤微生物区系和小麦产量的影响. 农药学学报, 2016, 18(5): 596-604. |
| [23] |
Xing JY, Lan SL, Li J, et al. Effects of Bacillus megaterium and Bacillus subtilis on growth physiology of Solanum tuberosum L. and microbial biomass in rhizosphere soil. J Hunan Agricul Univ: Nat Sci, 2017, 43(4): 377-381 (in Chinese). 邢嘉韵, 兰时乐, 李姣, 等. 巨大芽孢杆菌和枯草芽孢杆菌混合对马铃薯生长及土壤微生物含量的影响. 湖南农业大学学报:自然科学版, 2017, 43(4): 377-381. |
| [24] |
Ren TZ. Soil bioindicators in sustainable agriculture. Sci Agricul Sin, 2000, 33(1): 68-75 (in Chinese). 任天志. 持续农业中的土壤生物指标研究. 中国农业科学, 2000, 33(1): 68-75. |
| [25] |
Xin BM, Liu Y, Zhu DB, et al. Microbiota diversity analysis of potable water treated with silver ion using Illumina Miseq sequencing technology. Manned Spaceflight, 2017, 23(6): 824-828 (in Chinese). 辛冰牧, 刘亚, 朱德斌, 等. 应用Illumina MiSeq高通量测序技术分析活性银离子处理饮用水微生物多样性. 载人航天, 2017, 23(6): 824-828. |
| [26] |
Yu XM, Hou CM, Wang HR, et al. Colonization of Bacillus subtilis Bs-15 in jujube plant and soil and its influence on the microbial diversity in the soil. Chinese J Biol Cont, 2014, 30(4): 497-502 (in Chinese). 余贤美, 侯长明, 王海荣, 等. 枯草芽孢杆菌Bs-15在枣树体内和土壤中的定殖及其对土壤微生物多样性的影响. 中国生物防治学报, 2014, 30(4): 497-502. |
| [27] |
Wang N, Liu T, Jin YZ, et al. Effects of Trichoderma spp. on soil microbial diversity and growth and morbidity of strawberry. Jiangsu Agricul Sci, 2018, 46(18): 108-112 (in Chinese). 王宁, 刘铜, 靳亚忠, 等. 木霉菌对土壤微生物多样性及草莓生长和发病的影响. 江苏农业科学, 2018, 46(18): 108-112. |
| [28] |
Yang SD, Guo S, Ren KY, et al. Soil biological properties and bacterial community structures in rhizosphere soil of canes infected and non-infected by ratoon stunting disease. J Plant Nutri Fertiliz, 2019, 25(6): 910-916 (in Chinese). 杨尚东, 郭霜, 任奎喻, 等. 甘蔗宿根矮化病感病与非感病株根际土壤生物学性状及细菌群落结构特征. 植物营养与肥料学报, 2019, 25(6): 910-916. |
| [29] |
Wang GH, Liu JJ, Yu ZH, et al. Research progress of Acidobacteria ecology in soils. Biotechnol Bull, 2016, 32(2): 14-20 (in Chinese). 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展. 生物技术通报, 2016, 32(2): 14-20. |
| [30] |
Li W, Wang JT. Effects of Bacillus subtilis and phosphobacteria on soil properties and fruit quality in apple orchards. Jiangsu Agricul Sci, 2018, 46(3): 140-144 (in Chinese). 李伟, 王金亭. 枯草芽孢杆菌与解磷细菌对苹果园土壤特性及果实品质的影响. 江苏农业科学, 2018, 46(3): 140-144. |
 2020, Vol. 36
2020, Vol. 36