中国科学院微生物研究所、中国微生物学会主办
文章信息
- 熊俊茗, 马丽媛, 黄珊珊, 李相良, 王红梅
- Xiong Junming, Ma Liyuan, Huang Shanshan, Li Xiangliang, Wang Hongmei
- 分子生态网络揭示冶金微生物对能源底物的响应
- Molecular ecological network reveals the response of metallurgical microorganisms to energy substrates
- 生物工程学报, 2020, 36(12): 2674-2684
- Chinese Journal of Biotechnology, 2020, 36(12): 2674-2684
- 10.13345/j.cjb.200385
-
文章历史
- Received: June 25, 2020
- Accepted: October 28, 2020
- Published: November 10, 2020
2. 中南大学 生物冶金教育部重点实验室,湖南 长沙 410083;
3. 中国地质大学 (武汉) 生物地质与环境地质国家重点实验室,湖北 武汉 430074
2. Key Laboratory of the Ministry of Biometallurgy, Central South University, Changsha 410083, Hunan, China;
3. State Key Laboratory of Biological Geology and Environmental Geology, China University of Geosciences (Wuhan), Wuhan 430074, Hubei, China
生物冶金(Bio-metallurgy),是指在微生物的促进作用下对硫化矿物进行氧化溶解,将所需有价金属从难处理矿石释放到溶液中,并与原物质分离的过程。与传统技术相比,生物冶金可以显著降低金属冶炼过程中对环境的污染,作为一种低成本、高效和绿色环保的冶金技术已成为全球湿法冶金领域研究的热点。在硫化铜矿的生物浸出研究中,黄铜矿因其金属铜含量约占铜储量的70%而备受青睐[1],但同时其高晶格能也使生物浸出长期面临周期长、效率低等难题。
冶金微生物是指能够氧化亚铁离子或者氧化还原性无机硫化物,并以此进行能量代谢的菌株[2]。由于其处于具有极低pH、较高浓度的重金属,且有机质含量较低的环境中,大部分冶金微生物都是化能无机自养型菌株。它们以亚铁和(或)硫为能源底物,并以此驱动其他元素的物质循环[3-4]。同时在冶金微生物中存在少部分兼性异养类群,能利用其他细菌的代谢产物从而获得维持自身代谢所需的能量[5],其对铁硫元素循环也具有重要的推动作用。因此,冶金微生物类群中具有较多与铁硫代谢相关的基因和多种铁硫代谢途径[6],群落内部的相互作用关系也呈现出多样性。
网络分析作为一种有效的分析手段已经在许多领域中被广泛使用。随着生态学研究的不断深入,研究内容已经不再局限于对多样性、丰度以及物种组成的调查。网络分析能够有效揭示种间关系或者与环境之间的关系等[7]。通过高通量测序或者功能基因芯片所获取的数据,对其中样品两两进行相关分析后,可以绘制与之相关的分子生态网络[8]。利用微生物群落的组成信息和不同的函数计算出相关矩阵和网络拓扑学参数,如连接度、聚类系数等,通过对节点参数设置阈值进行划分,找出网络中关键物种,从而揭示不同网络节点间的相关关系以及相互作用关系。探究冶金微生物之间的相互关系,有助于在定向驯化过程中筛选基于协同作用高效发挥铁硫氧化功能的群落,以提高黄铜矿生物浸出的效率。
关键物种是指对生态群落结构、生态系统稳定起关键作用的物种,关键物种直接决定生态系统的结构和功能。关键物种具有两个主要特征:第一,关键物种的变化将对其所在群落造成较大影响;第二,关键物种对生态系统功能具有最高贡献[9-10]。如果从生态系统中移除这些物种,可能会导致生态系统发生根本性变化,其他物种也会因此受到直接或间接的影响。因此,对冶金微生物群落关键物种的挖掘,有利于深入解析微生物群落的稳定性及其铁硫氧化功能,以提高对黄铜矿的氧化溶解效率。
本研究中,采集多个地区酸性矿山废水(Acid mine drainage,AMD)样本,构建室内稳定的冶金微生物群落,经过不同能源底物分批驯化,利用基因序列信息划分操作分类单元(Operational taxonomic unit,OTU)后,对OTU表进行群落组成分析、多样性分析,同时构建共发生(Co-occurrence)网络,对比在不同能源底物驯化条件下,微生物群落的相互作用及其对能源底物的响应。
1 材料与方法 1.1 驯化实验采集来自江西德兴铜矿、福建紫金山铜矿、赞比亚谦比希铜矿、湖南郴州煤矿和云南腾冲热泉不同生境条件下生物样品,接种到含有硫酸亚铁、单质硫和黄铜矿的9K基础培养基中培养,构建室内稳定的冶金微生物群落。9K培养基含有下列成分(g/L):(NH4)2SO4 3.0,K2HPO4 0.5,KCl 0.1,Ca(NO3)2 0.01,MgSO4·7H2O 0.5。该培养物在室温(24–30 ℃)、pH 1.6–2.5条件下培养1年以上[11],在本研究中被用作原始群落(Original community,OC)。
用44.7 g/L FeSO4·7H2O和1 g/L S0 (富铁少硫)或4.47 g/L FeSO4·7H2O和10 g/L S0 (富硫少铁)对OC分别驯化培养,摇瓶传代培养3次,分别命名为OFe组(Fe1、Fe2、Fe3)和OS组(S1、S2、S3),每个处理设置3个生物学重复。
1.2 DNA提取及高通量测序当培养至对数后期时,取5.0 mL上清液,12 000×g离心10 min收集细胞,用TIANamp® Bacteria DNA试剂盒(中国天根生物技术有限公司)提取总DNA,利用1.0% (W/V)琼脂糖凝胶电泳和NanoDrop® ND-1000分光光度计(美国NanoDrop Technologies公司)检测DNA质量和浓度。
使用16S rRNA基因V4区引物(515F:5′-GT GCCAGCMGCCGCGGTAA-3′;806R:5′-GGACT ACHVGGGTWTCTAAT-3′)进行PCR扩增[12],反应条件如下:94 ℃预变性5 min;28个循环(94 ℃变性45 s;62 ℃退火45 s;72 ℃延伸1 min);72 ℃延伸10 min。利用EZNATM胶回收试剂盒(Gel Extraction Kit,Omega Bio-Tek)纯化PCR产物,用于文库制备,文库检验合格后,在Illumina MiSeq平台上机测序。
1.3 群落组成分析利用FastQ评估原始下机数据,经数据过滤及有效区间截取后[13],使用flash软件去除嵌合体,保留长度大于240 bp的序列[14]。在97%相似性水平上,通过UCLUST对数据进行OTU划分[15]之后基于RDP在置信度阈值为50%条件下获取OTU代表性序列的分类学信息[16]。
为了区分优势属——嗜酸硫杆菌属Acidithiobacillus中具有不同铁、硫氧化功能的菌株,基于BLASTn,将该属的OTU中相对丰度大于0.1%的OTU代表性序列与NCBI GenBank数据库进行比对,在分类学种水平上对其划分。
1.4 群落多样性分析Alpha多样性分析:根据样本OTU分布,采用R语言vegan包计算微生物群落的Shannon多样性指数(H)和Pielou均一度指数(J),并采用Mini tab软件对不同组别间多样性指数进行单因素方差分析(ANOVA),表征在两类能源底物驯化批次中,微生物群落物种多样性和分布均匀程度的变化[17-18]。
Beta多样性分析:通过R软件中的Vegan程序包(版本2.5-6),根据Uni-Frac距离矩阵对不同组群落进行非度量多维尺度(Nonmetric multi-dimensional scaling,NMDS)分析。
1.5 分子生态网络构建及拓扑结构分析基于R软件psych (版本1.8.12)程序包中corr.test函数,计算单个组别中所有OTU之间的Spearman相关性系数,获得相关性系数矩阵和P值矩阵,并采取Benjamini and Hochberg false discovery rate (FDR)法矫正P值。Spearman相关性系数和矫正后P值的阈值分别设置为0.6和0.01,运用R软件igraph程序包(版本1.2.4)中graph_from_ adjacency_matrix函数构建两组群落生态网络,基于ggplot2程序包(版本3.1.0)进行网络可视化。
采用igraph程序包和qgraph程序包(版本1.6.1)相关函数计算网络参数,以表征网络拓扑结构。包括节点数(No. of nodes)、边数(No. of edges)、正相互作用边数(No. of positive edges)、负相互作用边数(No. of negative edges)、连接度(Connectance)、平均度(Average degree)、直径(Diameter),聚类系数(Cluster coefficient)、平均路径长度(Average path length)以及模块化系数(Modularity)。
关键物种(Keystone)在群落中具有重要而关键的作用,具有高节点度(Degree)、高紧密中心性(Closeness centrality)及低介数中心性(Betweenness centrality)的特点[19],基于此特征对两组网络关键物种进行划分,并以第三百分位数为阈值。OFe组划分标准为:Degree > 19,Closeness centrality > 0.000 233 7,Betweenness centrality < 5;OS组划分标准为:Degree > 10,Closeness centrality > 0.000 137 8,Betweenness centrality < 82。
2 结果与分析 2.1 群落组成分析由于嗜酸硫杆菌属Acidithiobacillus在浸出系统中具有良好的竞争优势,并且属内的不同种之间铁、硫代谢功能差异大,因此基于NCBI-Blast,对注释到该属的OTU代表性序列进行比对,发现在种水平主要为嗜酸氧化亚铁硫杆菌A. ferrooxidans、氧化硫硫杆菌A. thiooxidans、嗜酸性喜温硫杆菌A. caldus、嗜酸性铁硫杆菌A. ferridurans和铁氧化嗜酸硫杆菌A. ferriphilus。其余物种则以属为分类单元,分析铁驯化和硫驯化不同阶段微生物群落的组成及演替规律。
如图 1所示,原始群落OC中,优势属种依次为A. caldus、钩端螺旋菌属Leptospirillum和硫化杆菌属Sulfobacillus。采用富铁少硫能源底物驯化过程中,与OC相比,A. caldus和Sulfobacillus的优势地位被A. ferriphilus和嗜酸菌属Acidiphilium所取代。随着驯化批次增加,Leptospirillum相对丰度由(60.5±0.6)%下降至(41.1±2.6)%,而A. ferriphilus占比逐渐上升,由(25.0±0.6)%增长至(42±2)%。当采用富硫少铁能源底物驯化时,第一批次优势属种与OC相似,随后A. thiooxidans相对丰度呈现大幅度上升,在第3批次驯化后其相对丰度占比为(90.0±0.5)%,成为群落中的绝对优势物种。
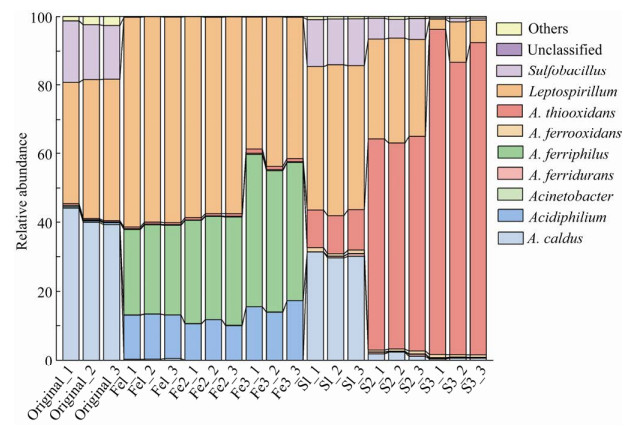
|
| 图 1 不同驯化条件下各批次间属种水平相对丰度 Fig. 1 Relative abundance of genus/species in different acclimation conditions. |
| |
如图 2所示,初始群落Shannon多样性指数和Pielou均匀度指数分别为1.34和0.32。第一次驯化后,Fe1群落生物多样性和物种均匀度下降,而S1群落对应指数的变化则呈现显著上升趋势。随着驯化批次增加,富铁少硫能源驯化过程中,群落生物多样性和物种均匀度仅略有上升,未呈现显著性变化。而在富硫少铁能源底物驯化过程中,冶金微生物群落Shannon多样性指数和Pielou均匀度指数均大幅度下降,且群落多样性之间具有显著性差异(P < 0.05)。

|
| 图 2 不同组间Shannon指数(A)及Pielou指数(B)分布 Fig. 2 Distribution of Shannon index (A) and Pielou index (B) among different groups. Boxes with different letters indicate significant differences (P < 0.05). |
| |
利用NMDS法对微生物群落进行聚类分析时,Stress < 0.05则表明结果具有良好的代表性[20],本研究中Stress值为0.025 8,表明NMDS聚类分析能够有效反映不同驯化组冶金微生物群落间的结构差异。如图 3所示,OC、OFe和OS微生物组分别聚类,表明驯化后群落结构发生显著改变。其中,OFe组群落聚类较为紧密,3次驯化的群落结构相似;而OS组同一驯化批次样本的微生物群落聚类紧密,而不同批次间群落聚类较为离散,表明在富硫少铁能源底物驯化中随着驯化批次的增加,冶金微生物群落结构发生显著性改变。

|
| 图 3 不同能源底物驯化过程中微生物群落变化 Fig. 3 Changes of microbial communities during acclimation of different energy substrates. |
| |
以OFe和OS分别构建分子生态网络,网络拓扑结构参数如表 1所示。OFe组分子生态网络的节点数和边数分别为140和814,低于OS组的230和1 022,表明OS组的微生物网络更加复杂。网络中边的正负相关性可以用于推断微生物之间的相互作用关系,菌种间正相关代表菌种生态位一致或可能存在共生关系,而负相关则预示着潜在竞争或捕食关系[21]。由于AMD模式系统微生物类群相对简单,两组网络中绝大多数的边均呈现正相关关系,表明菌株主要在协同作用下进行铁、硫物质代谢以供给自身能源。此外,OFe组网络连接度、平均度、网络直径及聚类系数较OS组高,表现出更紧密的聚集程度[7],呈现出明显的网络结构差异。
| Parameters | OFe | OS |
| No. of nodes | 140.00 | 230.00 |
| No. of edges (in total) | 814.00 | 1 022.00 |
| No. of edges (positive) | 813.00 | 1 017.00 |
| No. of edges (negative) | 1.00 | 5.00 |
| Connectance | 0.08 | 0.04 |
| Average degree | 11.63 | 8.89 |
| Diameter | 13.00 | 11.00 |
| Clustering coefficient | 0.79 | 0.65 |
| Average path length | 4.01 | 4.54 |
| Modularity | 0.56 | 0.71 |
网络中较短路径长度意味着物种间具有更高信息、能量和物质传递效率,菌群之间能够更有效地交流[22-23]。OFe组与OS组网络平均路径长度均较短,分别为4.01和4.54,表明这两组群落均能够快速应对多次能源底物驯化所造成的影响。
OS组模块性值高于OFe组,分别为0.71和0.56,Newman等提出该值大于0.4即认为网络具有模块化特征[24]。同一模块中的微生物群落可能占据相似的生态位,并具有类似的生态功能。由图 4可知,OS组网络较OFe组网络聚合效果较好,在OFe组分子生态网络中模块间更为分散,而OS组群落模块间较为集中,网络模块之间联系更为紧密。说明利用富硫少铁能源底物对群落进行驯化培养,使得群落分子生态网络具有更高的稳定性以及更紧密的种间互作共生关系。
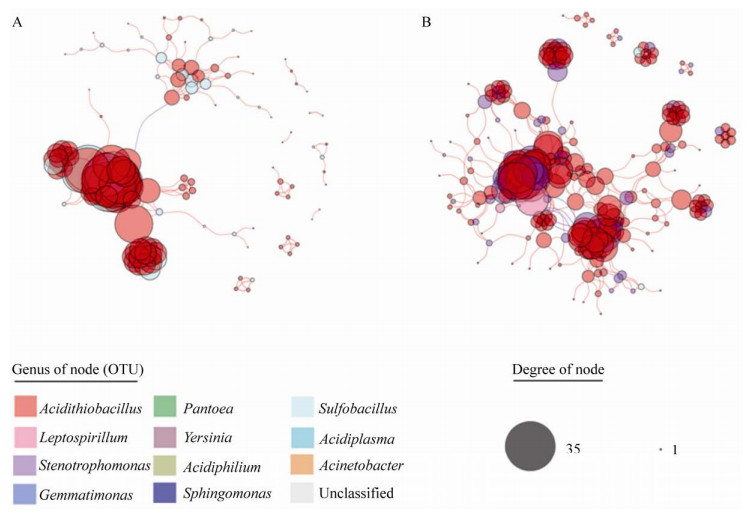
|
| 图 4 不同组分子生态网络图(A:OFe组网络;B:OS组网络) Fig. 4 Ecological network diagram of different groups of molecules. (A) OFe group network. (B) OS group network. |
| |
综合以上结果,OS组网络相较于OFe组网络具有较长平均路径,较强互作关系以及较低平均度,表明利用富硫少铁能源底物进行驯化培养会降低网络复杂程度,提高种间互作共生关系以及提高网络稳定性。
2.3.2 关键物种鉴定利用degree、betweenness及closeness指数对关键物种进行划分。通过注释,发现在富铁少硫能源底物驯化的微生物网络中,关键物种为A. sulfuriphilus、Acidiphilium和A. ferriphilus (表 2)。A. sulfuriphilus是硫氧化的专性化能自养型细菌,利用硫和还原无机硫阴离子作电子供体[25],Acidiphilium在群落中起到协助铁氧化的作用,而A. ferriphilus同时具有氧化单质硫和氧化亚铁离子的作用。
| OTU ID | Betweenness centrality | Closeness centrality | Degree | Class | Order | Family | Genus/Species |
| 254 | 2.167 | 0.000 234 9 | 21 | Gammaproteobacteria | Acidithiobacillales | Acidithiobacillaceae | Acidithiobacillus sulfuriphilus |
| 33 | 0.053 | 0.000 234 9 | 20 | Alphaproteobacteria | Rhodospirillales | Acetobacteraceae | Acidiphilium |
| 26 | 5.016 | 0.000 234 2 | 26 | Gammaproteobacteria | Acidithiobacillales | Acidithiobacillaceae | Acidithiobacillus ferriphilus |
在富硫少铁能源底物驯化的微生物群落中,基于阈值鉴定出的关键物种OTU丰度均低于0.01%,物种被注释为A. thiooxidans、Sulfobacillus与Leptospirillum (表 3)。A. thiooxidans为专性硫氧化自养型细菌,Leptospirillum为专性铁氧化自养型细菌,Sulfobacillus细菌同时具有铁氧化和硫氧化功能,且能够分解细胞残体等有机物,降低对自养菌的抑制作用[26],促进富硫少铁能源底物环境中的铁、硫代谢过程。
| OTU ID | Betweenness centrality | Closeness centrality | Degree | Class | Order | Family | Genus/Species |
| 604 | 81.405 | 0.000 139 7 | 22 | Gammaproteobacteria | Acidithiobacillales | Acidithiobacillaceae | Acidithiobacillus thiooxidans |
| 589 | 63.089 | 0.000 139 5 | 20 | Clostridia | Clostridiales | Clostridiales_Incertae Sedis ⅩⅦ | Sulfobacillus |
| 92 | 47.070 | 0.000 138 3 | 17 | Nitrospira | Nitrospirales | Nitrospiraceae | Leptospirillum |
| 16 | 0.515 | 0.000 137 8 | 11 | Nitrospira | Nitrospirales | Nitrospiraceae | Leptospirillum |
在硫化矿酸性矿山废水环境中,常以典型的Acidithiobacillus和Leptospirillum等化能无机自养菌占据优势地位[5],原始组群落经室内定向富集培养,已形成稳定群落,其类群与AMD环境的典型类群相符合。在不同能源底物驯化实验中,随着驯化批次增加,冶金微生物群落组成与结构发生较大程度改变,说明不同能源底物对于微生物群落的演替具有重要影响,进而影响对黄铜矿的生物浸出效率。
在富铁少硫能源底物驯化过程中,Shannon指数和Pielou指数未呈现显著变化,且NMDS结果表明,其群落组成聚类明显,即驯化过程冶金微生物群落没有发生显著变化。推测在该组中由于还原态硫化物的不足,导致主要的硫代谢微生物类群的生存发展受到限制,因此在之后驯化过程中硫氧化菌未表现出较高相对丰度。
在富硫少铁能源底物驯化过程中,随着驯化批次增加,Shannon指数和Pielou指数先上升后下降,推测上升过程是由于原始组群落转入富硫环境时,硫代谢菌具有充足能源,较多的硫代谢微生物类群得以生长繁殖,而随着驯化批次增加,多样性呈现下降态势,且最后优势种仅为A. thiooxidans。A. thiooxidans为专性自养型细菌[27],A. caldus为兼性自养型细菌[28],推测在富硫少铁能源底物中,在培养温度的影响下A. thiooxidans相较于A. caldus更具有竞争优势而成为绝对优势物种。
通过分析冶金微生物的分子生态网络(图 4),探讨能源底物对冶金微生物相互作用的影响。结果表明,不同能源底物驯化条件下冶金微生物分子生态网络存在较大差异(表 1)。研究认为,有效养分越多,分子生态网络的复杂度和网络稳定性越高,而群落高稳定性是实现群落功能的重要因素[29]。相比于富铁少硫能源底物,在富硫少铁能源底物驯化下正相互作用更强,网络节点数和网络相互作用显著增多,网络更加复杂化,表明富硫能源底物相较于富铁底物对微生物群落互作网络影响更大。生物浸出过程中,生物浸出效率与群落中冶金微生物的丰度以及微生物间的联系程度有着显著的相关关系。在黄铁矿浸出实验研究中,浸出效率与嗜酸性硫杆菌丰度呈现显著正相关关系,表明硫氧化微生物的富集能够促进矿物的生物溶解过程[30]。类似地,在江西德兴铜矿生物浸出系统构建的微生物分子生态网络显示,具有更紧密互作关系的菌群呈现出更高的浸出效率[31]。在本研究中,通过富硫能源底物驯化后,群落中硫氧化微生物丰度升高,同时分子生态网络分析结果表明,硫氧化微生物间具有较高程度的联系紧密度,因此该组微生物群落表现出更高的生物浸出能力。
关键物种在微生物群落中起重要且特殊作用,缺少关键物种会导致微生物群落结构和功能发生巨大改变。本研究中,基于网络结构属性确定了两种不同能源底物驯化条件下,不同冶金微生物群落中筛选的关键物种分布于Acidithiobacillus、Acidiphilium、Leptospirillum和Sulfobacillus四个属中。其中Acidiphilium属于化能自养型菌种,在好氧条件下以氧作为最终电子受体氧化简单有机物,在厌氧条件下以Fe3+为电子受体氧化有机物,同时会促进A. ferrooxidans亚铁离子氧化基因表达,促进其生长[32]。在富硫少铁能源底物驯化中,A. thiooxidans在群落中具有较高丰度,对硫元素传递与代谢发挥关键作用[11]。群落中Acidithiobacillus起到对亚铁离子、单质硫及硫化合物的氧化作用,能够将各种含硫化合物转化为酸性物质,以强化黄铜矿溶浸过程的酸解作用[33]。Leptospirillum是群落中主要的亚铁氧化菌,对矿物氧化溶解的直接和间接作用均发挥着重要的推动作用。该属具有更高的氧化还原电势,对二价铁离子的亲和力更高,受到高浓度三价铁离子的生长抑制作用更小[34-35]。Sulfobacillus具有嗜酸、耐高温、兼性异养等特点,能够氧化二价铁、硫化矿和还原性含硫化合物。在群落中Sulfobacillus具有较低的相对丰度,可以利用其他嗜酸菌产生的裂解物和渗出物[36],推动酸热环境的碳、硫等元素循环。
4 结论本研究选取具有硫铁代谢功能的冶金微生物,通过利用分子生态网络的方法,探讨在两种不同能源底物驯化作用下冶金微生物的群落组成特征,系统揭示了不同能源底物驯化过程中冶金微生物群落演替规律。结果显示,在不同能源底物中微生物群落组成差异较大,表现出能源底物对于微生物类群的选择性作用,其中富硫少铁能源底物对冶金微生物群落表现出更大的影响。
分子生态网络分析结果表明,在采用富硫少铁能源底物驯化过程中,微生物群落更加稳定、高效,有助于优势物种发挥铁、硫氧化功能。通过本研究,明确了富铁少硫、富硫少铁能源底物对微生物群落的影响,为生物冶金工业化应用过程的冶金微生物群落定向驯化提供了理论基础。
| [1] |
Panda S, Akcil A, Pradhan N, et al. Current scenario of chalcopyrite bioleaching: a review on the recent advances to its heap-leach technology. Bioresour Technol, 2015, 196: 694-706. DOI:10.1016/j.biortech.2015.08.064 |
| [2] |
Rawlings DE. The molecular genetics of Thiobacillus ferrooxidans and other mesophilic, acidophilic, chemolithotrophic, iron- or sulfur-oxidizing bacteria. Hydrometallurgy, 2001, 59(2/3): 187-201. |
| [3] |
Zhang X, Niu JJ, Liang YL, et al. Metagenome-scale analysis yields insights into the structure and function of microbial communities in a copper bioleaching heap. BMC Genet, 2016, 17: 21. |
| [4] |
Chen LX, Huang LN, Méndez-García C, et al. Microbial communities, processes and functions in acid mine drainage ecosystems. Curr Opin Biotechnol, 2016, 38: 150-158. DOI:10.1016/j.copbio.2016.01.013 |
| [5] |
Bond PL, Druschel GK, Banfield JF. Comparison of acid mine drainage microbial communities in physically and geochemically distinct ecosystems. Appl Environ Microbiol, 2000, 66(11): 4962-4971. DOI:10.1128/AEM.66.11.4962-4971.2000 |
| [6] |
Yin HQ, Liu ZH, Liu XD. Diversity of iron and sulfur metabolism in bioleaching microorganisms and their interaction with minerals. Acta Microbiol Sin, 2018, 58(4): 560-572 (in Chinese). 尹华群, 刘征华, 刘学端. 冶金微生物的铁硫代谢多样性及其与矿物的相互作用. 微生物学报, 2018, 58(4): 560-572. |
| [7] |
Ju F, Zhang T. Bacterial assembly and temporal dynamics in activated sludge of a full-scale municipal wastewater treatment plant. ISME J, 2015, 9(3): 683-695. DOI:10.1038/ismej.2014.162 |
| [8] |
Shen F, Huang R, Zeng J, et al. Progress of the molecular ecology network analysis. Environ Sci Technol, 2016, 39(S1): 94-98 (in Chinese). 沈烽, 黄睿, 曾巾, 等. 分子生态网络分析研究进展. 环境科学与技术, 2016, 39(S1): 94-98. |
| [9] |
Yang T, Shan XJ, Jin XS, et al. Keystone species of fish community in the Laizhou Bay. J Fish China, 2016, 40(10): 1613-1623 (in Chinese). 杨涛, 单秀娟, 金显仕, 等. 莱州湾鱼类群落的关键种. 水产学报, 2016, 40(10): 1613-1623. |
| [10] |
Wang FZ, Tang Y. Determination of key species in the food web and their impact on the robustness. Biodiver Sci, 2019, 27(10): 1132-1137 (in Chinese). 王凤珍, 唐毅. 食物网关键种的判定及其对稳健性的影响. 生物多样性, 2019, 27(10): 1132-1137. DOI:10.17520/biods.2019208 |
| [11] |
Ma LY, Wang XJ, Liu XD, et al. Intensified bioleaching of chalcopyrite by communities with enriched ferrous or sulfur oxidizers. Bioresour Technol, 2018, 268: 415-423. DOI:10.1016/j.biortech.2018.08.019 |
| [12] |
Peiffer JA, Spor A, Koren O, et al. Diversity and heritability of the maize rhizosphere microbiome under field conditions. Proc Natl Acad Sci USA, 2013, 110(16): 6548-6553. DOI:10.1073/pnas.1302837110 |
| [13] |
Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [14] |
Edgar RC, Haas BJ, Clemente JC, et al. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [15] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [16] |
Wang Q, Garrity GM, Tiedje JM, et al. Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Appl Environ Microbiol, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [17] |
Chen BS, Teh BS, Sun C, et al. Biodiversity and activity of the gut microbiota across the life history of the insect herbivore Spodoptera littoralis. Sci Rep, 2016, 6: 29505. DOI:10.1038/srep29505 |
| [18] |
Chen HF, Liang YY, Cheng ZX, et al. Stability evaluation of rice field ecosystems using multiple regression analysis. J Plant Prot, 2019, 46(4): 918-924 (in Chinese). 陈洪凡, 梁玉勇, 程正新, 等. 应用多元逐步回归分析法评价稻田生态系统稳定性. 植物保护学报, 2019, 46(4): 918-924. |
| [19] |
Liao HH, Yen JY, Guan YJ, et al. Differential responses of stream water and bed sediment microbial communities to watershed degradation. Environ Int, 2020, 134: 105198. DOI:10.1016/j.envint.2019.105198 |
| [20] |
Ziegler M, Seneca FO, Yum LK, et al. Bacterial community dynamics are linked to patterns of coral heat tolerance. Nat Commun, 2017, 8: 14213. DOI:10.1038/ncomms14213 |
| [21] |
Layeghifard M, Hwang DM, Guttman DS. Disentangling interactions in the microbiome: a network perspective. Trends Microbiol, 2017, 25(3): 217-288. DOI:10.1016/j.tim.2016.11.008 |
| [22] |
Wang F, Zhou JZ, Sun B. Structure of functional ecological networks of soil microbial communities for nitrogen transformations and their response to cropping in major soils in eastern China. Chin Sci Bull, 2014, 59(4/5): 387-396 (in Chinese). 汪峰, Zhou JZ, 孙波. 我国东部土壤氮转化微生物的功能分子生态网络结构及其对作物的响应. 科学通报, 2014, 59(4/5): 387-396. |
| [23] |
Wang Y, Zhang R, Zheng Q, et al. Bacterioplankton community resilience to ocean acidification: evidence from microbial network analysis. ICES J Mar Sci, 2016, 73(3): 865-875. DOI:10.1093/icesjms/fsv187 |
| [24] |
Newman MEJ. Modularity and community structure in networks. Proc Natl Acad Sci USA, 2006, 103(23): 8577-8582. DOI:10.1073/pnas.0601602103 |
| [25] |
Falagán C, Moya-Beltán A, Castro M, et al. Acidithiobacillus sulfuriphilus sp. nov.: an extremely acidophilic sulfur-oxidizing chemolithotroph isolated from a neutral pH environment. Int J Syst Evol Microbiol, 2019, 69(9): 2907-2913. DOI:10.1099/ijsem.0.003576 |
| [26] |
Wang XJ, Ma LY, Wu JJ, et al. Effective bioleaching of low-grade copper ores: insights from microbial cross experiments. Bioresour Technol, 2020, 308: 123273. DOI:10.1016/j.biortech.2020.123273 |
| [27] |
Ma LY, Wang XJ, Feng X, et al. Co-culture microorganisms with different initial proportions reveal the mechanism of chalcopyrite bioleaching coupling with microbial community succession. Bioresour Technol, 2017, 223: 121-130. DOI:10.1016/j.biortech.2016.10.056 |
| [28] |
Hallberg KB, Lindström EB. Characterization of Thiobacillus caldus sp. Nov., a moderately thermophilic acidophile. Microbiology, 1994, 140(12): 3451-3456. DOI:10.1099/13500872-140-12-3451 |
| [29] |
Zhou JZ, Deng Y, Luo F, et al. Functional molecular ecological networks. mBio, 2010, 1(4): e00169-10. DOI:10.1128/mBio.00169-10 |
| [30] |
Xiao YH, Liu XD, Ma LY, et al. Microbial communities from different subsystems in biological heap leaching system play different roles in iron and sulfur metabolisms. Appl Microbiol Biotechnol, 2016, 100(15): 6871-6880. DOI:10.1007/s00253-016-7537-1 |
| [31] |
Niu JJ, Deng J, Xiao YH, et al. The shift of microbial communities and their roles in sulfur and iron cycling in a copper ore bioleaching system. Sci Rep, 2016, 6: 34744. DOI:10.1038/srep34744 |
| [32] |
Küsel K, Roth U, Drake HL. Microbial reduction of Fe(Ⅲ) in the presence of oxygen under low pH conditions. Environ Microbiol, 2002, 4(7): 414-421. DOI:10.1046/j.1462-2920.2002.00314.x |
| [33] |
Bryant RD, McGroarty KM, Costerton JW, et al. Isolation and characterization of a new acidophilic Thiobacillus species (T. albertis). Can J Microbiol, 1983, 29(9): 1159-1170. DOI:10.1139/m83-178 |
| [34] |
Hippe H. Leptospirillum gen. nov. (ex Markosyan 1972), nom. Rev., including Leptospirillum ferrooxidans sp. nov. (ex Markosyan 1972), nom. rev. and Leptospirillum thermoferrooxidans sp. nov. (Golovacheva et al. 1992). Int J Syst Evol Microbiol, 2000, 50(2): 501-503. DOI:10.1099/00207713-50-2-501 |
| [35] |
Ma LY, Wang HM, Wu JJ, et al. Metatranscriptomics reveals microbial adaptation and resistance to extreme environment coupling with bioleaching performance. Bioresour Technol, 2019, 280: 9-17. DOI:10.1016/j.biortech.2019.01.117 |
| [36] |
Hallberg KB, Coupland K, Kimura S, et al. Macroscopic streamer growths in acidic, metal-rich mine waters in north wales consist of novel and remarkably simple bacterial communities. Appl Environ Microbiol, 2006, 72(3): 2022-2030. |
 2020, Vol. 36
2020, Vol. 36