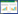中国科学院微生物研究所、中国微生物学会主办
文章信息
- 薛爱英, 冯国兴, 朱长春, 樊赛军
- Xue Aiying, Feng Guoxing, Zhu Changchun, Fan Saijun
- 组织基质金属蛋白酶抑制剂-2的表达纯化及活性鉴定
- Prokaryotic expression, purification and characterization of tissue inhibitor of metalloproteinase-2
- 生物工程学报, 2020, 36(12): 2868-2876
- Chinese Journal of Biotechnology, 2020, 36(12): 2868-2876
- 10.13345/j.cjb.200478
-
文章历史
- Received: August 3, 2020
- Accepted: October 8, 2020
- Published: October 13, 2020
组织基质金属蛋白酶抑制剂-2 (Tissue inhibitor of metalloproteinases-2,TIMP-2)是基质金属蛋白酶(MMPs)的内源性抑制剂[1],在哺乳动物正常组织间隙中广泛表达,相对分子量约为22 kDa[1-3]。哺乳动物TIMP家族有4个成员,在结构上均具有两个结构域,即由125个氨基酸构成的N端和由65个氨基酸构成的C端;单独的N端即可有效地抑制MMPs的活性[4-8]。TIMP-2和MMPs特异性结合[2],抑制MMPs的催化活性,从而减少细胞外基质的降解,降低肿瘤的侵袭活性和转移能力[5, 9]。近年来研究表明,TIMP-2以不依赖抑制MMPs活性的方式发挥作用,减少内皮细胞增殖和迁移[3, 5]、减少血管生成[7],以及通过改变肿瘤微环境抑制肿瘤生长[2]。因此,TIMP-2在肿瘤发生发展中的作用及机制的研究越来越受到关注。临床研究表明,蛋白TIMP-2在某些器官损伤诊断、肿瘤早期及预后诊断中可作为一个参考指标[10-12]。此外,Castellano等[13]发现脐带血血浆中的TIMP-2通过提高海马神经元的可塑性和活性,改善衰老小鼠学习记忆与空间探索能力,表明TIMP-2可能具有抗脑衰老功能,这为治疗中枢神经系统退行性疾病(如记忆减退、阿尔茨海默病等)提供新思路。
从较多的临床病理中发现,TIMP-2在人肿瘤(如食管癌、胃癌等[14])组织和血清中的表达水平较低,可能是增强的肿瘤侵袭导致[2];相反,增加TIMP-2的表达水平,肿瘤生长受到抑制,且化疗敏感性增强[15-16]。TIMP-2抑制肿瘤生长和减少血管生成等功能已被发现,而且对TIMP-2在生物体内的作用及相关机制的深入研究也在不断进行。TIMP-2在大肠杆菌中能高效表达[17],但对TIMP-2在胞内的具体存在形式没有研究,融合蛋白在胞内以溶解或包涵体的形式存在,或者两种形式均存在;而且,融合蛋白的表达条件及纯化后的活性鉴定均有待研究。因此,本文通过构建含有人TIMP-2基因的原核表达载体,在大肠杆菌中诱导表达,进而获得融合蛋白His-TIMP-2,并优化诱导表达条件,纯化及复性后验证His-TIMP-2的活性,为后期深入研究TIMP-2的作用及机制提供支持。
1 材料与方法 1.1 材料 1.1.1 实验材料人肺癌A549细胞,大肠杆菌Escherichia coli DH5α、E. coli BL21(DE3)菌株和原核表达载体pET28a (卡那霉素抗性)均由本实验室保存。
1.1.2 主要试剂高保真DNA聚合酶、反转录试剂盒、T4 DNA连接酶、卡那霉素、还原型谷胱甘肽、氧化型谷胱甘肽、异丙基-β-D-硫代半乳糖苷(IPTG)、细菌培养用胰蛋白胨和酵母提取物购自Solarbio公司;限制性内切酶(NheⅠ/XhoⅠ)和质粒提取试剂盒购自TransGen Biotech公司;TIMP-2小鼠单克隆抗体购于Abacam公司,HRP标记的羊抗鼠二抗购于Proteintech公司;明胶酶谱检测试剂盒购自南京信帆生物技术有限公司;色谱柱HisTrap™ HP购于Cytiva公司。
1.2 方法 1.2.1 人TIMP-2基因的克隆及载体pET28a的双酶切根据GenBank提供的人TIMP-2基因序列(GenBank登录号:NM_003255)以及原核表达载体pET28a上的多克隆位点,设计并合成引物,上游引物5′端和下游引物5′端分别加入NheⅠ和XhoⅠ酶切位点,引物序列见表 1。
| Primer name | Sequence (5′–3′) | Restriction enzyme |
| TIMP-2-F | CTAGCTAGCATGGGCGCCGCGGCCCGC | NheⅠ |
| TIMP-2-R | CCGCTCGAGTTATGGGTCCTCGATGTCG | XhoⅠ |
| The single underlined sequences indicate restriction enzyme sites. | ||
采用Trizol法提取人肺癌A549细胞的总RNA,反转录获得cDNA。以cDNA为模板,克隆人TIMP-2基因。用1%琼脂糖凝胶电泳鉴定克隆产物,切胶回收人TIMP-2基因片段。同时,在37 ℃条件下用限制性内切酶NheⅠ和XhoⅠ双酶切处理表达载体pET28a,得到线性化载体,同样经电泳鉴定后,切胶回收待用。
1.2.2 原核表达载体的构建用T4 DNA连接酶将回收的人TIMP-2基因片段与线性化表达载体pET28a在4 ℃条件下过夜连接,得到的连接产物转化E. coli DH5α,然后涂于含卡那霉素的LB平板上,37 ℃培养过夜。挑选菌落,即含重组表达载体pET28a-TIMP-2,扩大培养后提取质粒,进行双酶切处理,用琼脂糖凝胶电泳分析检测;同时对菌液进行测序分析,测序结果与GenBank提供的人TIMP-2的基因序列进行比对。
1.2.3 TIMP-2蛋白的诱导表达1) 将测序比对正确的重组质粒pET28a- TIMP-2转化于E. coli BL21(DE3)感受态细胞中,37 ℃培养。待长出单菌落后,挑选并接种到含卡那霉素的LB液体培养基中,在37 ℃摇床中振荡培养,转速为180 r/min;12 h后将菌液扩大培养,扩大比例为1︰100;当菌液的OD600为0.7–0.8时,加入IPTG诱导His-TIMP-2蛋白表达。
取1 mL诱导表达后的菌液,离心弃上清,用无菌水重悬菌体,加入电泳上样缓冲液混匀,然后100 ℃煮沸5 min,对全菌蛋白进行SDS-PAGE分析,鉴定融合蛋白的存在,其中分离胶浓度为12%。
2) 表达产物存在形式:取1 mL诱导表达的菌液,离心弃上清;用PE缓冲液(20 mmol/L NaH2PO4-K2HPO4,1 mmol/L EDTA,pH 7.2)重悬菌体,超声破菌。4 ℃离心15 min,转速为12 000 r/min,利用SDS-PAGE检测离心后得到的上清和沉淀,分析His-TIMP-2蛋白在大肠杆菌中的存在形式。
3) 诱导条件筛选:向37 ℃条件下培养的菌液(OD600为0.7–0.8)中,加IPTG溶液,使其终浓度分别为0.2、0.4、0.6、0.8、1.0、1.5、2.0 mmol/L,继续培养4 h,取1 mL菌液进行电泳,分析IPTG浓度对His-TIMP-2蛋白表达含量的影响。
向菌液中加入终浓度为1.0 mmol/L的IPTG溶液,分别于30 ℃、37 ℃、42 ℃条件下诱导,每个温度下分别于诱导2、4、6、8、10 h后取1 mL菌液进行电泳,分析诱导温度、诱导时间对His-TIMP-2蛋白表达含量的影响。
1.2.4 TIMP-2蛋白的纯化及复性包涵体的提取:经分析His-TIMP-2蛋白基本都存在于包涵体中,因此需从包涵体中分离纯化该蛋白。在上述得到的优化条件下诱导表达蛋白,然后破碎菌体,离心收集沉淀,向其中加入2 mol/L尿素,待沉淀完全溶解后静置30 min,离心弃上清;依次用Triton X-EDTA溶液(0.5% Triton X-100,10 mmol/L EDTA)、PE缓冲液重悬沉淀,离心弃上清。再用TE缓冲液(20 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0)重悬沉淀,离心弃上清;重复3次,得到包涵体。
包涵体的溶解:向包涵体中加入变性缓冲液(50 mmol/L Tris-HCl,8 mol/L尿素,2 mmol/L DTT,pH 8.0),50 ℃加热2 h,使包涵体溶解变性,离心收集上清[18]。
纯化:色谱柱HisTrap™ HP经平衡缓冲液(20 mmol/L Tris-HCl,0.1 mol/L NaCl,2 mol/L尿素,20 mmol/L咪唑,pH 8.0)冲洗平衡后,进样蛋白溶液,然后用平衡缓冲液冲洗。最后用缓冲液(20 mmol/L Tris-HCl,0.1 mol/L NaCl,2 mol/L尿素,0.5 mol/L咪唑,pH 8.0)洗脱吸附的蛋白,并收集。
复性:将纯化的蛋白缓慢加入到含还原型和氧化型谷胱甘肽的复性缓冲液(50 mmol/L Tris-HCl,0.8 mol/L尿素,pH 8.8)中,His-TIMP-2蛋白的终浓度不超过10 µg/mL;同时,在室温下缓慢搅拌,4 ℃静置过夜。浓缩蛋白溶液,再用缓冲液(50 mmol/L NaH2PO4-NaOH,pH 6.0)透析16 h,然后35 ℃孵育45 min。最后离心除去沉淀物,得到复性的His-TIMP-2蛋白。
1.2.5 融合蛋白的鉴定及活性检测1) Western blotting鉴定:以未诱导的菌液超声破碎后的总蛋白作为对照。向对照蛋白和复性的融合蛋白His-TIMP-2中分别加入电泳上样缓冲液,加热处理。选用鼠源抗TIMP-2抗体(一抗)及HRP标记的羊抗鼠二抗,用Western blotting免疫学法对复性的融合蛋白His-TIMP-2进行鉴定。
2) 活性检测:采用明胶酶谱法[9]检测复性后融合蛋白His-TIMP-2的活性。将生长状态良好的人肺癌A549细胞清洗后,加入不含血清的培养基DMEM培养。24 h后收集培养基,用10 kDa超滤离心管浓缩样品。取25 μL浓缩的细胞上清,向其中加入25 μL复性后的融合蛋白His-TIMP-2,得到混合样品。取相同体积浓缩的细胞上清和混合样品,分别加入等体积的2×非还原型电泳上样缓冲液,加热处理。按说用书进行明胶酶谱实验。
明胶酶谱中条带的亮度和面积可半定量表征明胶酶的活性[19],由软件分析图像中条带的密度值,并以活性明胶酶的比活表示明胶酶的含量。其中,
密度值=条带面积×(条带灰度−背景灰度)。
比活=条带密度值÷蛋白浓度。
比活单位为mL/mg。
根据明胶酶谱结果,分析复性后融合蛋白对A549细胞表达的MMPs的抑制能力。
本研究中所有电泳凝胶成像和Western blotting成像均用BIO-RAD化学发光凝胶成像仪完成。
2 结果与分析 2.1 目的基因的克隆及表达载体的构建从人肺癌A549细胞株中提取的总RNA反转录得到的cDNA,经PCR反应克隆得到目的基因TIMP-2,在琼脂糖凝胶电泳图谱中约665 bp处有一条明显的条带(图 1A),与目的基因大小一致。重组质粒经双酶切得到的产物,琼脂糖凝胶电泳分析的结果如图 1B所示,在约665 bp处有明显条带,为目的基因,表明成功构建重组表达载体pET28a-TIMP-2。鉴定为重组表达载体pET28a-TIMP-2阳性的菌液经测序分析,证明pET28a-TIMP-2中人TIMP-2的基因序列与GenBank提供的序列(NM-003255)一致。
|
| 图 1 pET28a-TIMP-2重组质粒的构建 Fig. 1 Construction of recombinant expression plasmid of pET28a-TIMP-2. (A) PCR amplification of TIMP-2 gene. M: marker; 1: amplification of the gene TIMP-2. (B) Double enzyme digestion of pET28a-TIMP-2 plasmid. 1: pET28a-TIMP-2 recombinant plasmid; 2: pET28a- TIMP-2 was digested by restriction enzymes of NheⅠ and XhoⅠ; M: marker. |
| |
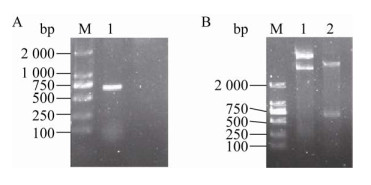
诱导表达的菌体处理后,用SDS-PAGE鉴定,结果如图 2A所示。与不含重组表达载体pET28a-TIMP-2的菌体及未加诱导剂IPTG的菌体的总蛋白相比,在诱导表达菌体的蛋白泳道中,约23 kDa处出现一条明显的蛋白条带。本研究中,TIMP-2蛋白与载体pET28a上的His标签蛋白融合表达,其分子量分别为22 kDa和0.8 kDa左右,与SDS-PAGE结果显示的融合蛋白分子量约23 kDa一致。这表明融合蛋白被成功诱导表达。

|
| 图 2 SDS-PAGE检测融合蛋白的表达及其存在形式 Fig. 2 Detection of fusion protein expression and its existing form by SDS-PAGE. (A) Detection of induced fusion protein His-TIMP-2 by SDS-PAGE. 1: the total protein in control E. coli BL21(DE3) without pET28a-TIMP-2 recombinant plasmid; 2: the total protein without IPTG induction in E. coli transformed by recombinant plasmid pET28a-TIMP-2; 3: the total protein induced by IPTG in E. coli transformed by recombinant plasmid pET28a-TIMP-2; M: protein marker. (B) SDS-PAGE analysis of existence form of His-TIMP-2 in E. coli transformed by recombinant plasmid pET28a-TIMP-2. After induction by IPTG, E. coli was broken by ultrasound and then centrifuged to collect the supernatant and precipitate. 1: the total protein in broken E. coli; 2: the supernatant; 3: the precipitate. |
| |
对融合蛋白在大肠杆菌中存在形式的分析结果如图 2B所示,菌液破碎后离心,在上清中基本不含融合蛋白His-TIMP-2,说明蛋白表达后以不溶的包涵体形式存在。这一现象主要是因为TIMP-2结构中含有6个二硫键[7],融合蛋白在大肠杆菌中表达时,巯基间不能在还原性细胞液中形成二硫键,导致蛋白错误折叠,形成包涵体[20]。
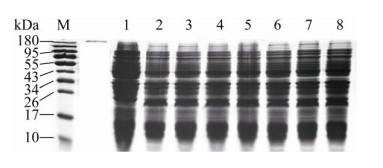
2.3 融合蛋白诱导表达条件的优化在添加诱导剂IPTG时,融合蛋白成功表达,从图 2A和图 3中均能直观地看出,图 3表示IPTG浓度对大肠杆菌中His-TIMP-2表达含量的影响。分析电泳结果,不同IPTG浓度下融合蛋白His-TIMP-2表达含量的结果见表 2,发现IPTG浓度对大肠杆菌表达融合蛋白的影响较小,可能是因为大肠杆菌高效表达融合蛋白,0.2–2 mmol/L范围内的IPTG均能有效诱导融合蛋白表达。因此,选择常用的IPTG诱导浓度为1 mmol/L,研究诱导温度和诱导时间对大肠杆菌中融合蛋白His-TIMP-2表达含量的影响。
|
| 图 3 SDS-PAGE分析37 ℃诱导时IPTG浓度对融合蛋白His-TIMP-2诱导表达的影响 Fig. 3 SDS-PAGE analysis for the effect of IPTG concentration on the expression amount of His-TIMP-2 in E. coli induced at 37 ℃. 1: 0 mmol/L IPTG; 2: 0.2 mmol/L IPTG; 3: 0.4 mmol/L IPTG; 4: 0.6 mmol/L IPTG; 5: 0.8 mmol/L IPTG; 6: 1.0 mmol/L IPTG; 7: 1.5 mmol/L IPTG; 8: 2.0 mmol/L IPTG. |
| |
| IPTG concentration (mmol/L) | His-TIMP-2 amount (%) |
| 0 | 0 |
| 0.2 | 12.9 |
| 0.4 | 11.3 |
| 0.6 | 12.4 |
| 0.8 | 14.3 |
| 1.0 | 14.8 |
| 1.5 | 14.1 |
| 2.0 | 12.5 |
| The experiment was done three times and the results presented the same trend. | |
大肠杆菌中融合蛋白的表达含量均采用SDS-PAGE分析,不同诱导温度、不同诱导时间下融合蛋白His-TIMP-2的表达含量见表 3。分析比较发现,在特定温度下,融合蛋白含量随诱导时间的增加而增加,例如37 ℃时,融合蛋白含量从0增加到20.7%。在诱导时间相同时,融合蛋白含量随诱导温度升高而呈增加的趋势,例如诱导4 h,温度从30 ℃升至42 ℃时,融合蛋白含量从10.3%增加到23.3%。而且,随着诱导温度的升高,融合蛋白含量达到最大值所需时间缩短,在30 ℃时,融合蛋白含量的增加趋势在研究范围内未出现平台;37 ℃时,融合蛋白含量在诱导8 h后基本不变;42 ℃时,融合蛋白含量在诱导4 h后基本达到最大值。因此,在His-TIMP-2的原核表达中,诱导温度和时间是关键因素。根据上述结果,融合蛋白His-TIMP-2诱导表达的最适条件为37 ℃诱导8 h或42 ℃诱导4 h。
| Temperature (℃) | His-TIMP-2 amount (%) | |||||
| 0 h | 2 h | 4 h | 6 h | 8 h | 10 h | |
| 30 | 0 | 7.3 | 10.3 | 12.2 | 14.8 | 16.6 |
| 37 | 0 | 8.2 | 16.0 | 17.9 | 20.2 | 20.7 |
| 42 | 0 | 10.7 | 23.3 | 24.4 | 21.4 | 22.3 |
| The experiment was done three times and the results presented the same trend. | ||||||
利用HisTrap™ HP亲和色谱柱纯化融合蛋白His-TIMP-2,杂质蛋白不能吸附在色谱柱上,形成穿透峰;吸附蛋白用高浓度咪唑竞争洗脱,结果如图 4A所示。在洗脱峰后,紫外基线较高,是因为洗脱液中含高浓度咪唑,而咪唑在280 nm处有吸收。收集穿透峰和洗脱峰,进行电泳分析(图 4B),穿透峰中不含融合蛋白,洗脱峰中融合蛋白的纯度为94%,进而得到融合蛋白His-TIMP-2一步纯化后的收率为88%,说明HisTrap™ HP色谱柱能有效纯化融合蛋白His-TIMP-2。

|
| 图 4 大肠杆菌中融合蛋白的纯化及其电泳分析 Fig. 4 Purification and SDS-PAGE analysis of fusion protein in E. coli. (A) Purification of His-TIMP-2 from the inclusion body produced by E. coli. Dissolved inclusion body of 5 mL was injected into the affinity column at a flow rate of 1.0 mL/min. After washing with 15 mL equilibration buffer, bound proteins were eluted with the elution buffer. The fractions of the detected peaks, flow-through (FT) peak and elution (E) peak, were collected to further analysis. (B) SDS-PAGE analysis for His-TIMP-2 purification. 1: dissolved inclusion body; 2: FT fraction; 3: elution fraction; M: molecular weight marker. |
| |
纯化的融合蛋白经复性后,用Western blotting法分析,结果如图 5A所示,在约23 kDa处有特异性蛋白条带,而未诱导的细菌总蛋白中没有His-TIMP-2蛋白条带,验证了复性后的融合蛋白;而且复性得到的融合蛋白收率为35%,与文献中稀释法复性的有关结果相当[20]。

|
| 图 5 Western blotting鉴定融合蛋白及明胶酶谱法分析融合蛋白的活性 Fig. 5 Identification of fusion protein by Western blotting and biological activity analysis of fusion protein by gelatin zymography. (A) Identification of His-TIMP-2 by Western blotting. The total protein without IPTG induction in E. coli transformed by recombinant plasmid pET28a-TIMP-2 was used as control. (B) Zymography of MMP-2 activity. 1: concentrated supernatant of A549 cell culture medium without bovine serum albumin; 2: mixture of the concentrated supernatant of A549 cell culture medium and the refolded His-TIMP-2 at a volume ratio of 1:1. |
| |
复性后融合蛋白(浓度为0.15 mg/mL)活性通过明胶酶谱法检测。在加有明胶的聚丙烯酰胺凝胶中进行SDS-PAGE,电泳结束后用酶反应缓冲液孵育凝胶,然后染色、脱色。凝胶中含底物明胶而被染色,形成深色背景;而在有明胶酶条带的位置处,底物被降解,因而不被染色,形成透亮区域。人肺癌A549细胞表达的MMP-2 (明胶酶A)能分解明胶,如图 5B所示,在MMP-2相应位置处(约72 kDa)呈现透亮条带;用明胶酶谱法定量分析,A549上清液浓缩得到的样品中MMP-2的比活为(1 797 559.43±83 821.86) mL/mg。加入复性的融合蛋白后,未出现明显的透亮条带,表明融合蛋白能有效抑制基质金属蛋白酶的活性,使明胶未被降解。因此,复性的融合蛋白具有抑制MMP-2活性的能力。
人TIMP-2能抑制多种MMPs的活性[21],明胶酶谱法可对MMP-2 (明胶酶A)和MMP-9 (明胶酶B)两种酶进行活性鉴定,但是本研究中MMP-2处条带比较明显,MMP-9处(92 kDa)没有出现明显条带。在明胶酶谱中,条带强弱与酶活性成正比,可能是样品中MMP-9含量较少,导致未检出明显的MMP-9条带。
3 讨论与TIMP家族其他成员蛋白相比,人TIMP-2在大多数正常成人的组织间隙内表达量较大,以抑制或独立于抑制MMPs活性的方式发挥抑制肿瘤生长等作用[2, 5, 7]。研究发现,人TIMP-2表达后不进行糖基化修饰[21],该特点使体外表达的人TIMP-2的状态更接近体内的天然状态,进而使体外研究人TIMP-2的功能及机理更有意义。因此,本研究借助广泛使用的原核系统对人TIMP-2进行体外表达,并优化诱导表达条件。
IPTG是一种非常有效的诱导剂,但有一定潜在毒性,且价格昂贵。本研究中,0.2–2 mmol/L浓度范围内的IPTG均能有效诱导融合蛋白表达;且增大IPTG浓度,融合蛋白His-TIMP-2的表达含量没有显著变化,文献中亦有类似报道[22]。因此,融合蛋白His-TIMP-2在较低浓度IPTG诱导下就有高效表达,而且低浓度IPTG产生较低毒性,并能节省成本。
诱导温度和诱导时间是影响融合蛋白表达的关键因素。在一定范围内,随诱导温度的升高和诱导时间的增长,融合蛋白His-TIMP-2的表达含量增大,这与E. coli BL21(DE3)表达外源蛋白的相关研究一致[23]。本研究中融合蛋白His-TIMP-2诱导表达的最适温度和时间为37 ℃诱导8 h或42 ℃诱导4 h。
研究发现融合蛋白His-TIMP-2在大肠杆菌中以包涵体的形式存在,这与蛋白本身存在6个二硫键有关[7]。经一步亲和纯化,得到高纯度(94%)融合蛋白His-TIMP-2。初步采用最简单的稀释法对融合蛋白进行复性,得到的复性蛋白能有效抑制MMP-2的催化活性。后期将深入探索不同的复性方法,如添加剂(低浓度脲等)辅助复性、色谱柱复性等,或多种复性方法联合使用,来提高蛋白的复性收率。此外,研究采用明胶酶谱法半定量分析人肺癌A549细胞表达的MMP-2的比活,初步测定复性后融合蛋白对MMP-2的抑制能力。该方法测定的酶种类及酶比活的精确度有限,后续将采用更精确的方法测定融合蛋白对不同MMPs的抑制能力,并与天然TIMP-2及重组TIMP-2蛋白比较,进一步分析融合蛋白His-TIMP-2的活性。
本研究深入揭示人TIMP-2蛋白在原核系统中的表达特征,为研究蛋白的高效表达、纯化及复性提供数据支持,并为后期体内外研究人TIMP-2的功能及机制奠定基础,对提高肿瘤治疗效果具有重要意义。
| [1] |
Butler GS, Hutton M, Wattam BA, et al. The specificity of TIMP-2 for matrix metalloproteinases can be modified by single amino acid mutations. J Biol Chem, 1999, 274(29): 20391-20396. DOI:10.1074/jbc.274.29.20391 |
| [2] |
Stetler-Stevenson WG, Gavil NV. Normalization of the tumor microenvironment: evidence for tissue inhibitor of metalloproteinase-2 as a cancer therapeutic. Connect Tissue Res, 2014, 55(1): 13-19. DOI:10.3109/03008207.2013.867339 |
| [3] |
Peeney D, Jensen SM, Castro NP, et al. TIMP-2 suppresses tumor growth and metastasis in murine model of triple-negative breast cancer. Carcinogenesis, 2020, 41(3): 313-325. DOI:10.1093/carcin/bgz172 |
| [4] |
Huang W, Suzuki K, Nagase H, et al. Folding and characterization of the amino-terminal domain of human tissue inhibitor of metalloproteinases-1 (TIMP-1) expressed at high yield in E. coli. FEBS Let, 1996, 384(2): 155-161. DOI:10.1016/0014-5793(96)00304-3 |
| [5] |
Stetler-Stevenson WG. Tissue inhibitors of metalloproteinases in cell signaling: metalloproteinase-independent biological activities. Sci Signal, 2008, 1(27): re6. |
| [6] |
Williamson RA, Marston FAO, Angal S, et al. Disulphide bond assignment in human tissue inhibitor of metalloproteinases (TIMP). Biochem J, 1990, 268(2): 267-274. DOI:10.1042/bj2680267 |
| [7] |
Remillard TC, Bratslavsky G, Jensen-Taubman S, et al. Molecular mechanisms of tissue inhibitor of metalloproteinase 2 in the tumor microenvironment. Mol Cell Ther, 2014, 2: 17. DOI:10.1186/2052-8426-2-17 |
| [8] |
Cruz-Munoz W, Khokha R. The role of tissue inhibitors of metalloproteinases in tumorigenesis and metastasis. Crit Rev Clin Lab Sci, 2008, 45(3): 291-338. DOI:10.1080/10408360801973244 |
| [9] |
Waleh NS, Murphy BJ, Zaveri NT. Increase in tissue inhibitor of metalloproteinase-2 (TIMP-2) levels and inhibition of MMP-2 activity in a metastatic breast cancer cell line by an anti-invasive small molecule SR13179. Cancer Lett, 2010, 289(1): 111-118. DOI:10.1016/j.canlet.2009.08.006 |
| [10] |
Wang W, Zhang YF, Liu MX, et al. TIMP2 is a poor prognostic factor and predicts metastatic biological behavior in gastric cancer. Sci Rep, 2018, 8(1): 9629. DOI:10.1038/s41598-018-27897-x |
| [11] |
Adler C, Heller T, Schregel F, et al. TIMP-2/IGFBP7 predicts acute kidney injury in out-of-hospital cardiac arrest survivors. Crit Care, 2018, 22(1): 126. DOI:10.1186/s13054-018-2042-9 |
| [12] |
Groblewska M, Mroczko B, Gryko M, et al. Serum levels and tissue expression of matrix metalloproteinase 2 (MMP-2) and tissue inhibitor of metalloproteinases 2 (TIMP-2) in colorectal cancer patients. Tumor Biol, 2014, 35(4): 3793-3802. DOI:10.1007/s13277-013-1502-8 |
| [13] |
Castellano JM, Mosher KI, Abbey RJ, et al. Human umbilical cord plasma proteins revitalize hippocampal function in aged mice. Nature, 2017, 544(7651): 488-492. DOI:10.1038/nature22067 |
| [14] |
Groblewska M, Mroczko B, Kozlowski M, et al. Serum matrix metalloproteinase 2 and tissue inhibitor of matrix metalloproteinases 2 in esophageal cancer patients. Folia Histochem Cytobiol, 2012, 50(4): 590-598. DOI:10.5603/FHC.2012.0083 |
| [15] |
Hałoń A, Nowak-Markwitz E, Donizy P, et al. Enhanced immunoreactivity of TIMP-2 in the stromal compartment of tumor as a marker of favorable prognosis in ovarian cancer patients. J Histochem Cytochem, 2012, 60(7): 491-501. DOI:10.1369/0022155412446978 |
| [16] |
Suemitsu R, Yoshino I, Tomiyasu M, et al. Serum tissue inhibitors of metalloproteinase-1 and -2 in patients with non-small cell lung cancer. Surg Today, 2004, 34(11): 896-901. DOI:10.1007/s00595-004-2853-y |
| [17] |
Xu GQ, Wang W, Sun DQ, et al. Gene clone and expression of human tissue inhibitor of matrix metalloproteinases 2 in Escherichia coli. Guizhou Med J, 2016, 40(4): 344-347 (in Chinese). 徐国强, 王伟, 孙达权, 等. 人TIMP-2基因的克隆及其原核表达. 贵州医药, 2016, 40(4): 344-347. DOI:10.3969/j.issn.1000-744X.2016.04.003 |
| [18] |
Nasrabadi D, Rezaeiani S, Sayadmanesh A, et al. Inclusion body expression and refolding of recombinant bone morphogenetic protein-2. Avicenna J Med Biotechnol, 2018, 10(4): 202-207. |
| [19] |
Zhang XP, Zhou FJ, Shen PF, et al. Significance of activated matrix metalloproteinase 2 (MMP2) in progression of bladder transitional cell carcinoma. Chin J Cancer, 2003, 22(6): 637-639. |
| [20] |
Williamson RA. Refolding of TIMP-2 from Escherichia coli inclusion bodies//Clark IM, Ed. Matrix Metalloproteinase Protocols. Methods in Molecular Biology™. Totowa, N.J.: Humana Press, 2001, 151: 257-265. |
| [21] |
Brew K, Nagase H. The tissue inhibitors of metalloproteinases (TIMPs): an ancient family with structural and functional diversity. Biochim Biophys Acta, 2010, 1803(1): 55-71. DOI:10.1016/j.bbamcr.2010.01.003 |
| [22] |
Ding JY, Yi Y, Lu XX, et al. Effect of different temperature, time and different concentration of IPTG and strains on HDVAg expression. J Med Res, 2012, 41(5): 31-34 (in Chinese). 丁军颖, 伊瑶, 卢学新, 等. 不同温度、时间、IPTG和菌种浓度对丁肝抗原蛋白表达量的影响. 医学研究杂志, 2012, 41(5): 31-34. |
| [23] |
Collins T, Azevedo-Silva J, Costa AD, et al. Batch production of a silk-elastin-like protein in E. coli BL21(DE3): key parameters for optimisation. Microb Cell Fact, 2013, 12(1): 21. DOI:10.1186/1475-2859-12-21 |
 2020, Vol. 36
2020, Vol. 36