中国科学院微生物研究所、中国微生物学会主办
文章信息
- 万子栋, 高天鹏, 周玉霞, 王引弟, 常国华, 巨天珍, 杨颖丽, 张庆
- Wan Zidong, Gao Tianpeng, Zhou Yuxia, Wang Yindi, Chang Guohua, Ju Tianzhen, Yang Yingli, Zhang Qing
- 重金属复合胁迫下碱蓬萌发生长及富集特征
- Seed germination, bud growth and heavy-metal accumulation of Suaeda salsa
- 生物工程学报, 2020, 36(3): 493-507
- Chinese Journal of Biotechnology, 2020, 36(3): 493-507
- 10.13345/j.cjb.190571
-
文章历史
- Received: December 19, 2019
- Accepted: February 25, 2020
2. 甘肃省矿区污染治理与生态修复工程研究中心,甘肃 兰州 730070;
3. 西安文理学院 生物与环境工程学院,陕西 西安 710065;
4. 兰州城市学院 地理与环境工程学院,甘肃 兰州 730070
2. The Engineering Research Center of Mining Pollution Treatment and Ecological Restoration of Gansu Province, Lanzhou 730070, Gansu, China;
3. College of Biological and Environmental Engineering, Xi'an University, Xi'an 710065, Shaanxi, China;
4. College of Geography and Environmental Engineering, Lanzhou City University, Lanzhou 730070, Gansu, China
重金属污染已成为全球性问题,2014年《全国土壤污染状况调查公报》[1]显示,我国土壤总的超标率为16.1%,污染类型以无机型为主。其中Ni和Cu两种无机污染物点位超标率分别为4.8%和2.1%,分别位于重金属污染物的第2位和第4位。造成土壤重金属污染的原因众多,Ovečka和Takáč[2]认为除重金属元素土壤背景值高的地区外,其他地区的重金属污染都是由于人类活动造成的。重金属污染会对植物的生长造成严重的危害,并通过植物富集污染食物链。重金属耐受性植物主要通过降低吸收和细胞内固定来降低重金属的危害[2-5]。
Cu和Ni是植物生长和发育所必需的重要微量元素,在低浓度时促进植物的生长发育,高浓度时会对植物产生毒性。前人研究表明植物正常生长所必需Ni的量为在15–20 mg/kg干重,Cu的量为1–20 mg/kg干重[6-8]。Cu和Ni的毒性表现在破坏包括碳固定和新陈代谢在内的许多生理过程[8-11],高浓度Cu破坏Ca2+和K+的通量[12],高浓度Ni增加植物体内的Na+、K+和Ca2+的含量[13]。
金昌市是著名的“镍都”,也是全国Cu、Ni重金属土壤污染的主要地区。胡小娜等[14]的研究表明金昌市区土壤中的Cu、Ni含量的平均值为397.54、340.57 mg/kg,远高于当地土壤背景值(Cu:24.1 mg/kg、Ni:35.2 mg/kg)。碱蓬Suaeda salsa (L.) Pall.是金昌矿区比较常见的一种盐生植物,具有极好的耐盐碱性[15-16]和重金属耐受性[17-18]。以往关于重金属对碱蓬的毒理研究主要集中于Pb、Cd和Mn[17-19],而有关Ni和Cu对广泛分布于金川镍铜矿区荒漠植物碱蓬生长发育影响的研究鲜见报道。为了阐释金川镍铜矿区Cu和Ni对碱蓬的影响以及碱蓬重金属富集能力,在预实验的基础上,参照当地气候条件,设置Cu、Ni单一和复合胁迫,研究不同胁迫梯度下碱蓬种子萌发、芽期生理生化指标变化情况及其在野外条件下重金属富集和转移特征,为矿区重金属污染植物修复和荒漠化治理提供理论依据。
1 材料与方法 1.1 试验设计 1.1.1 种子萌发试验2018年10月自金川矿区周边荒漠采集试验所用碱蓬S. salsa种子(千粒重0.605 8 g,本实验所用皆为饱满种子)。试验所用试剂主要有CuSO4·5H2O (分析纯),NiCl2·6H2O (分析纯)。
依据金昌土壤背景值(Cu:24.1 mg/kg、Ni:35.2 mg/kg)设计重金属浓度最小值,金川矿区实测Cu、Ni含量平均值(Cu 397.54 mg/kg、Ni 340.57 mg/kg)设计重金属浓度最大值;以普遍存在于金昌矿区周边的荒漠植物碱蓬作为实验植物;实验所采用的昼夜时长、光照和温度模拟金昌矿区4月份碱蓬上年落地种子自然萌发时的当地平均温度、光照和昼夜时间长度设计。
按照国标《草种子检验规程发芽试验》GB/T 2930.4–2017[20],采用培养皿纸上法,选取颗粒饱满、消毒完成的碱蓬种子50粒,置于直径90 mm铺有3层滤纸的培养皿中。放置于培养箱培养。培养温度为25 ℃/20 ℃ (昼/夜),光周期14 h/10 h (昼/夜),光强5 000 lux。3次重复。试验设计如表 1所示。
| Stress treatment | Concentration gradient (mg/L) | ||||
| Gradient 1 | Gradient 2 | Gradient 3 | Gradient 4 | Gradient 5 | |
| CK | 0 | 0 | 0 | 0 | 0 |
| Cu | 20 | 40 | 80 | 160 | 320 |
| Ni | 20 | 40 | 80 | 160 | 320 |
| Cu20 (Cu+Ni) | 20+20 | 20+40 | 20+80 | 20+160 | 20+320 |
| Cu320 (Cu+Ni) | 320+20 | 320+40 | 320+80 | 320+160 | 320+320 |
| Ni20 (Ni+Cu) | 20+20 | 20+40 | 20+80 | 20+160 | 20+320 |
| Ni320 (Ni+Cu) | 320+20 | 320+40 | 320+80 | 320+160 | 320+320 |
为测定碱蓬的重金属富集与转移能力,2019年5月,在甘肃省矿区污染治理与生态修复工程研究中心金昌实验站的试验田中分别设置5种重金属梯度类型的土壤,分别是:农田土(T1)、原生态土(T2,金昌市周边未受人类活动干扰的下四分荒漠土壤)、原生态土+尾砂(T3,质量比1︰1,尾砂采自尾矿坝)、原生态土+凹凸棒+废渣(T4,质量比1︰1︰1,废渣采自废渣堆)和原生态土+凹凸棒+尾砂(T5,质量比1︰1︰1)。并在上述类型的每个梯度试验田中播种碱蓬,正常田间管理,于2019年10月采集了上述5类土壤中的碱蓬植株与根周围土壤(距地表 5 cm),并分离出碱蓬的根系、茎和叶。将碱蓬植物样品(根系、茎和叶)在105 ℃烘箱中杀青30 min,再于70 ℃烘至恒重,然后研磨、过筛、装袋,用于Cr、Ni、Cu、Zn和Pb含量测定。将土样风干、研磨、过筛、装袋后,用于测定土壤Cr、Ni、Cu、Zn、Pb含量和土壤pH。pH用pH计(PHS-3E,上海雷磁电子有限公司)检测(水土比5︰1),金属元素用火焰原子吸收分光光度计(TAS-990F,北京普析通用仪器有限公司)测定。
1.2 指标 1.2.1 发芽指标试验中,碱蓬的发芽率按照下式计算:
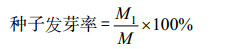
|
式中:M1为全部正常发芽粒数,M为供试种子粒数。
当碱蓬种子萌发结束时(连续3 d不发芽),每组随机抽取15株碱蓬,用游标卡尺进行测量碱蓬的根长和芽长(以初生根长度为根长,初生根以上部分为芽长,无法分辨根部的发芽种子测量其发芽长度)。
1.2.2 生理生化指标丙二醛(MDA)含量采用硫代巴比妥酸法测定[21];过氧化物酶(POD)活性采用愈创木酚法测定[22];脯氨酸含量的测定采用茚三酮比色法[21];可溶性蛋白含量测定采用考马斯亮蓝染色法[22]。每组处理每个生理指标重复测3次。
1.2.3 重金属转移系数与富集系数碱蓬的转移系数(Translocation factor,TF)按照下式计算[23]:
TF=碱蓬地上部分重金属含量/碱蓬地下部分重金属含量。
碱蓬的富集系数(Bioconcentration factors,BCF)按照下式计算:
BCF=碱蓬重金属含量/对应土壤重金属含量。
1.3 数据分析用R 3.4.2软件进行数据处理,用Origin 2018作图,采用单因素方差分析(ANOVA)和最小显著差异法(LSD)比较同一处理不同梯度间差异水平碱蓬生理指标的差异水平(α=0.05),结果以“x±s”表示。
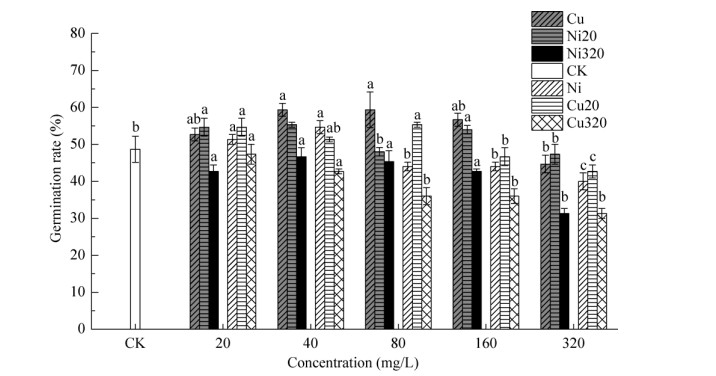
2 结果与分析 2.1 Cu、Ni胁迫对碱蓬种子萌发的影响 2.1.1 发芽率Cu、Ni胁迫对碱蓬种子发芽的影响见图 1。6组不同胁迫下,Cu320复合胁迫碱蓬发芽率随着胁迫浓度升高呈下降趋势,在Cu+Ni [(320+320) mg/L]复合胁迫时达到最低发芽率,较对照降低35.6%。其余胁迫水平下,碱蓬种子发芽率均随着胁迫浓度升高呈先升后降趋势。Cu、Ni、Cu20和Ni20胁迫下最大发芽率的胁迫浓度分别为40、80、(20+80)和(20+40) mg/L,较对照分别增加21.9%、12.3%、13.7%和13.7%。Cu单一胁迫促进发芽作用最高,Cu320复合胁迫抑制发芽程度最高。
|
| 图 1 Cu、Ni胁迫下碱蓬的发芽率(Cu、Ni20和Ni320处理下横轴浓度表示Cu2+浓度,Ni、Cu20和Cu320处理下横轴浓度表示Ni2+浓度。不同小写字母表示同一处理不同梯度间在P < 0.05水平差异显著) Fig. 1 The germination ratio of S. salsa under Cu and Ni stress. Horizontal axis represents the concentration of Cu2+ under Cu, Ni20 and Ni320 treatment; while under Ni, Cu20 and Cu320 treatment, horizontal axis represents the concentration of Ni2+. Different lowercase letters meant significant difference gradients in the same treatment at 0.05 level. |
| |
胁迫浓度为20、40、80、160、320 mg/L时,Cu单一胁迫碱蓬发芽率较Ni单一胁迫分别提高2.6%、8.5%、34.8%、28.8%和11.7%,表明Ni对碱蓬毒性更强。Cu2+浓度为20、320 mg/L时,Ni20复合胁迫碱蓬发芽率较Cu单一胁迫分别高3.8%和6.0%;Ni320复合胁迫碱蓬发芽率均低于Cu单一胁迫和Ni20复合胁迫。Ni2+浓度为20、80、160、320 mg/L时,Cu20复合胁迫碱蓬发芽率较Ni单一胁迫分别提高6.5%、25.8%、6.1%和6.7%;Cu320复合胁迫的发芽率均低于Ni单一胁迫和Cu20复合胁迫。较单一Cu(Ni)胁迫,低浓度Ni(Cu)与Cu(Ni)复合胁迫促进碱蓬发芽,Cu与Ni两种重金属表现为相互拮抗型;高浓度的Ni(Cu)与Cu(Ni)复合胁迫抑制碱蓬发芽,Cu与Ni两种重金属表现为相互协同型。
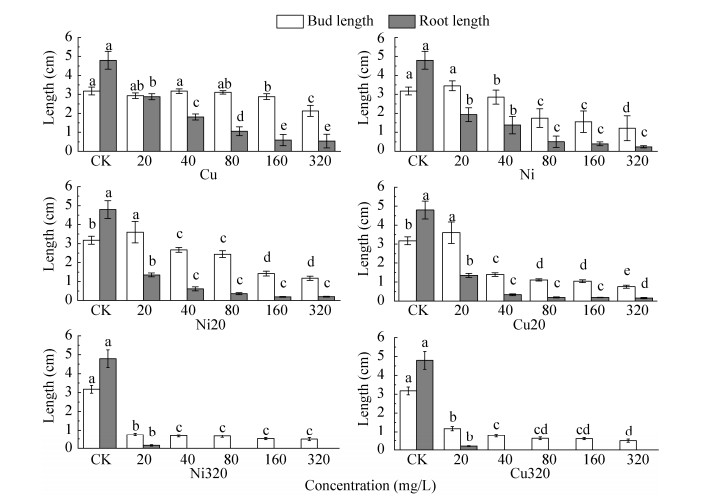
2.1.2 芽长和根长Cu、Ni胁迫对芽期碱蓬芽长和根长的影响见图 2。6组不同胁迫水平下,碱蓬芽长和根长均随着胁迫浓度的升高而下降。其中CK组中根长达到最大值(4.79 cm);Cu+Ni ((20+20) mg/L)复合胁迫芽长达到最大值(3.60 cm),较CK高11.8%;Cu+Ni ((320+320) mg/L)复合胁迫下芽长达到最小值(0.49 cm)。胁迫浓度为40、80、160、320 mg/L,Cu单一胁迫碱蓬芽长较Ni单一胁迫分别高11.2%、7.8%、85.1%和75.3%;Cu胁迫下碱蓬根长均高于Ni胁迫下碱蓬根长,表明碱蓬对于Cu的耐受性高于Ni,Ni对芽期碱蓬毒性较大。在相同的Cu2+ (Ni2+)浓度下,复合胁迫下碱蓬根长和芽长均低于单一胁迫,高浓度复合胁迫对碱蓬生长的抑制作用更强,Cu与Ni两种重金属表现为相互协同型。总体上,低浓度Cu(≤40 mg/L)、Ni (≤20 mg/L)单一胁迫和低浓度Ni+Cu ((20+20) mg/L)复合胁迫均促进碱蓬地上部分生长。
|
| 图 2 Cu、Ni胁迫下碱蓬的芽长和根长(Cu、Ni20和Ni320处理下横轴浓度表示Cu2+浓度,Ni、Cu20和Cu320处理下横轴浓度表示Ni2+浓度。不同小写字母表示同一处理不同梯度间在P < 0.05水平差异显著) Fig. 2 The bud and root length of S. salsa during the post-germination stage under Cu and Ni stress. Horizontal axis represents the concentration of Cu2+ under Cu, Ni20 and Ni320 treatment; while under Ni, Cu20 and Cu320 treatment, horizontal axis represents the concentration of Ni2+. Different lowercase letters meant significant difference gradients in the same treatment at 0.05 level. |
| |
Cu、Ni胁迫对芽期碱蓬MDA含量的影响见图 3。6组不同胁迫下,碱蓬MDA含量整体呈上升趋势。Cu+Ni ((320+320) mg/L)复合胁迫MDA含量最大(0.223 5 μmol/g FW;FW表示鲜重),Cu+Ni ((20+20) mg/L)复合胁迫MDA含量最小(0.004 1 μmol/g FW),较CK低31.8%。

|
| 图 3 Cu、Ni胁迫下芽期碱蓬MDA含量(Cu、Ni20和Ni320处理下横轴浓度表示Cu2+浓度,Ni、Cu20和Cu320处理下横轴浓度表示Ni2+浓度。不同小写字母表示同一处理不同梯度间在P < 0.05水平差异显著) Fig. 3 The MDA content of S. salsa during the post-germination stage under Cu and Ni stress. Horizontal axis represents the concentration of Cu2+ under Cu, Ni20 and Ni320 treatment; while under Ni, Cu20 and Cu320 treatment, horizontal axis represents the concentration of Ni2+. Different lowercase letters meant significant difference gradients in the same treatment at 0.05 level. |
| |
在胁迫浓度为40、80、160、320 mg/L时,Cu单一胁迫碱蓬MDA含量较Ni单一胁迫分别低4.8%、21.6%、57.7%和18.9%;表明在单一胁迫下,Ni对碱蓬的毒性强于Cu。Cu2+浓度为80、160、320 mg/L时,Cu单一胁迫下碱蓬MDA含量较Ni20复合胁迫分别低77.4%、83.5%和49.1%。Cu单一胁迫和Ni20复合胁迫MDA含量均低于Ni320复合胁迫;表明低浓度Ni (20 mg/L)和低浓度Cu (≤40 mg/L)复合胁迫对于碱蓬的毒性较小;高浓度Ni和各个浓度的Cu复合胁迫对于碱蓬毒性较大。
Ni2+浓度为40、80、160 mg/L时,Ni单一胁迫碱蓬MDA含量较Cu20复合胁迫分别低13.9%、79.0%和60.0%。Ni单一胁迫和Cu20复合胁迫碱蓬MDA含量均低于Cu320复合胁迫;表明低浓度Cu (20 mg/L)和Ni (20、320 mg/L)复合胁迫时对碱蓬毒性较小;高浓度Cu和各个浓度的Ni复合胁迫对于碱蓬毒性较大。较单一Cu(Ni)胁迫,低浓度Ni(Cu)与Cu(Ni)复合胁迫碱蓬MDA含量较低,Cu与Ni两种重金属表现为相互拮抗型;高浓度Ni(Cu)与Cu(Ni)复合胁迫碱蓬MDA含量较高,Cu与Ni两种重金属表现为相互协同型。
2.2.2 可溶性蛋白Cu、Ni胁迫对芽期碱蓬可溶性蛋白的影响见图 4。6组不同胁迫下,碱蓬可溶性蛋白含量较CK有显著提高(Cu:1.8%–60.1%;Ni:3.4%–284.9%;Cu20:42.5%–174.3%;Ni20:22.2%–57.6%;Cu320:57.6%–149.0%;Ni320:149.0%–239.4%)。Cu20、Cu320和Ni胁迫,碱蓬可溶性蛋白含量均随着胁迫浓度的升高而呈上升趋势;Ni20和Cu胁迫,碱蓬可溶性蛋白含量随着胁迫浓度的升高呈先降后升的趋势;Ni320胁迫,碱蓬可溶性蛋白含量随着胁迫浓度的升高呈先升后降的趋势。Ni320 mg/L胁迫可溶性蛋白含量最大(8 156.26 μg/g FW);CK组的最小(2 119.08 μg/g FW)。

|
| 图 4 Cu、Ni胁迫下芽期碱蓬可溶性蛋白含量(Cu、Ni20和Ni320处理下横轴浓度表示Cu2+浓度,Ni、Cu20和Cu320处理下横轴浓度表示Ni2+浓度。不同小写字母表示同一处理不同梯度间在P < 0.05水平差异显著) Fig. 4 The soluble protein content of S. salsa during the post-germination stage under Cu and Ni stress. Horizontal axis represents the concentration of Cu2+ under Cu, Ni20 and Ni320 treatment; while under Ni, Cu20 and Cu320 treatment, horizontal axis represents the concentration of Ni2+. Different lowercase letters meant significant difference gradients in the same treatment at 0.05 level. |
| |
在胁迫浓度为40、80、160、320 mg/L时,Cu单一胁迫碱蓬可溶性蛋白含量较Ni单一胁迫分别低5.5%、46.3%、41.0%和64.7%。Cu2+浓度为80和320 mg/L时,Cu单一胁迫碱蓬可溶性蛋白含量较Ni20复合胁迫分别低30.8%和13.9%。Ni2+浓度为20、40、80 mg/L时,Ni单一胁迫碱蓬可溶性蛋白含量较Cu20复合胁迫分别低27.5%、5.1%和15.7%,较Cu320复合胁迫分别低34.4%、23.5%和8.4%。
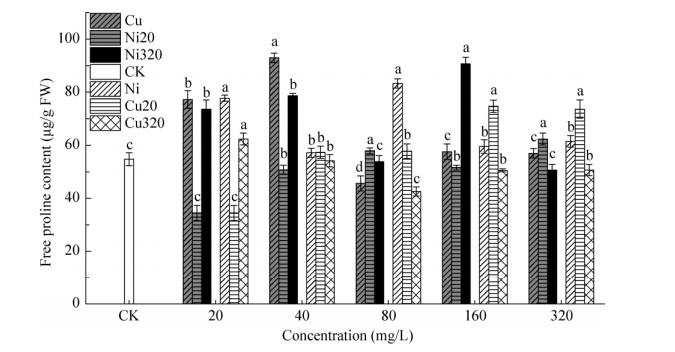
2.2.3 游离脯氨酸Cu、Ni胁迫对芽期碱蓬游离脯氨酸的影响见图 5。6组不同胁迫下,Cu20、Ni20复合胁迫碱蓬的游离脯氨酸含量均随胁迫浓度的升高而上升,Ni320复合胁迫碱蓬游离脯氨酸含量随胁迫浓度升高呈先升后降的趋势,Cu320复合胁迫碱蓬游离脯氨酸含量随胁迫浓度升高呈现先降后升的趋势。Cu、Ni单一胁迫碱蓬游离脯氨酸含量随胁迫浓度升高呈先升后降,最后趋于稳定。Cu (40 mg/L)胁迫碱蓬游离脯氨酸含量最大(92.96 μg/g FW);Cu+Ni ((20+20) mg/L)复合胁迫碱蓬游离脯氨酸含量最小(34.49 μg/g FW),较CK低36.9%。
|
| 图 5 Cu、Ni胁迫下芽期碱蓬游离脯氨酸含量(Cu、Ni20和Ni320处理下横轴浓度表示Cu2+浓度,Ni、Cu20和Cu320处理下横轴浓度表示Ni2+浓度。不同小写字母表示同一处理不同梯度间在P < 0.05水平差异显著) Fig. 5 The free proline content of S. salsa during the post-germination stage under Cu and Ni stress. Horizontal axis represents the concentration of Cu2+ under Cu, Ni20 and Ni320 treatment; while under Ni, Cu20 and Cu320 treatment, horizontal axis represents the concentration of Ni2+. Different lowercase letters meant significant difference gradients in the same treatment at 0.05 level. |
| |
在胁迫浓度为80、160、320 mg/L时,Cu单一胁迫碱蓬游离脯氨酸含量较Ni单一胁迫分别低45.2%、3.2%和8.7%。Cu2+浓度为80、320 mg/L时,Cu单一胁迫碱蓬游离脯氨酸含量较Ni20复合胁迫分别低21.2%和9.8%,较Ni320复合胁迫分别低15.1%和36.4%。Ni2+浓度为160、320 mg/L时,Ni单一胁迫碱蓬游离脯氨酸含量较Cu20复合胁迫分别低20.3%和16.7%。Ni单一胁迫碱蓬游离脯氨酸含量均高于Cu320复合胁迫。
2.2.4 POD活性Cu、Ni胁迫对芽期碱蓬POD活性的影响见图 6。6组不同胁迫下,碱蓬POD活性随胁迫浓度升高均呈上升趋势。Cu20、Ni20复合胁迫碱蓬POD活性随胁迫浓度升高而呈局部先升再降再升再降,整体先升后降的趋势;Cu320、Ni320复合胁迫碱蓬POD活性随胁迫浓度升高呈先降后升,趋于稳定的趋势。Cu浓度320 mg/L胁迫下碱蓬POD活性最大(1 521.65 U/g FW);CK活性最小(634.09 U/g FW)。

|
| 图 6 Cu、Ni胁迫下芽期碱蓬POD活性(Cu、Ni20和Ni320处理下横轴浓度表示Cu2+浓度,Ni、Cu20和Cu320处理下横轴浓度表示Ni2+浓度。不同小写字母表示同一处理不同梯度间在P < 0.05水平差异显著) Fig. 6 The POD activity of S. salsa during the post-germination stage under Cu and Ni stress on. Horizontal axis represents the concentration of Cu2+ under Cu, Ni20 and Ni320 treatment; while under Ni, Cu20 and Cu320 treatment, horizontal axis represents the concentration of Ni2+. Different lowercase letters meant significant difference gradients in the same treatment at 0.05 level. |
| |
Cu2+浓度为20、40 mg/L时,Cu单一胁迫碱蓬POD活性较Ni单一胁迫分别低6.3%和25.9%,较Ni20复合胁迫分别低38.4%和36.8%,较Ni320复合胁迫分别低42.1%和21.3%。Ni2+浓度为20、40、80、160 mg/L时Ni单一胁迫碱蓬POD活性较Cu20复合胁迫分别低34.3%、17.6%、5.8%和24.0%。Ni浓度为20、40 mg/L时,Ni单一胁迫碱蓬POD活性较Cu320复合胁迫分别低41.0%和21.5%。较单一Cu(Ni)胁迫,低浓度Ni(Cu)与Cu(Ni)复合胁迫碱蓬POD活性较高,Cu与Ni两种重金属表现为相互拮抗型;高浓度Ni(Cu)与Cu(Ni)复合胁迫碱蓬POD活性较低,Cu与Ni两种重金属表现为相互协同型。
2.3 碱蓬富集和转移重金属能力碱蓬根周围土壤、根、茎和叶片重金属含量见表 2。结果显示,五类土壤均属于碱性土壤(pH值依次为8.43、8.45、8.23、8.12和8.73)。通过内梅罗指数法得五类土壤综合污染指数大小顺序为T2(0.21) < T1(0.38) < T4(0.92) < T5(13.09) < T3(37.77);表明T1和T2两类土壤未受重金属污染,T4土壤处于临界状态,T3和T5两类土壤处于重污染状态。除T2土壤中碱蓬叶片Zn含量高于根周围土壤外,其余土壤中碱蓬体内重金属含量均低于根周围土壤。碱蓬体内重金属含量顺序整体上呈Zn > Cu > Ni > Pb > Cr的趋势。
| Soil | Part | Cr (mg/L) | Ni (mg/L) | Cu (mg/L) | Zn (mg/L) | Pb (mg/L) |
| T1 | Soil | 51.80 | 31.20 | 43.20 | 134.00 | 36.00 |
| Root | 1.23 | 2.91 | 8.08 | 40.30 | 0.72 | |
| Stem | 2.11 | 1.43 | 5.66 | 22.00 | 0.92 | |
| Leaf | 2.51 | 2.77 | 7.68 | 61.20 | 2.70 | |
| T2 | Soil | 45.60 | 24.80 | 25.00 | 46.70 | 18.10 |
| Root | 1.15 | 1.23 | 5.09 | 27.90 | 0.65 | |
| Stem | 0.81 | 0.98 | 4.20 | 14.00 | 0.75 | |
| Leaf | 2.15 | 2.36 | 15.10 | 336.00 | 4.78 | |
| T3 | Soil | 364.00 | 129.00 | 1 483.00 | 15 232.00 | 2 582.00 |
| Root | 2.06 | 1.80 | 18.10 | 97.30 | 7.55 | |
| Stem | 1.39 | 1.43 | 6.99 | 50.90 | 2.88 | |
| Leaf | 2.38 | 2.11 | 5.25 | 45.70 | 1.26 | |
| T4 | Soil | 100.00 | 78.50 | 91.10 | 335.00 | 73.40 |
| Root | 1.64 | 1.96 | 7.34 | 34.20 | 1.63 | |
| Stem | 0.88 | 1.45 | 4.58 | 15.00 | 0.62 | |
| Leaf | 3.70 | 4.68 | 9.01 | 46.50 | 2.60 | |
| T5 | Soil | 238.00 | 132.00 | 957.00 | 5 165.00 | 957.00 |
| Root | 1.71 | 1.71 | 9.52 | 21.90 | 0.94 | |
| Stem | 1.19 | 1.37 | 8.85 | 49.50 | 2.97 | |
| Leaf | 2.36 | 2.37 | 8.30 | 52.00 | 2.18 |
碱蓬茎和叶的转移系数见表 3。结果显示,碱蓬叶片的转移系数整体上高于碱蓬茎部的转移系数。各重金属的转移系数顺序为:茎,Pb > Cr > Zn > Ni > Cu;叶,Zn > Pb > Cr > Ni > Cu。在T1、T2和T5三类土壤中碱蓬茎部Pb的转移系数最大,T3和T4两类土壤中碱蓬茎部和叶片Ni的转移系数最大,T1中碱蓬叶片Pb的转移系数最大,T2和T5两类土壤中Zn的转移系数最大。五类土壤中碱蓬茎部Pb的平均转移系数大于1,叶片平均转移系数均大于1。
| Part | Soil | Cr | Ni | Cu | Zn | Pb |
| Stem | T1 | 1.72 | 0.49 | 0.70 | 0.55 | 1.28 |
| T2 | 0.71 | 0.80 | 0.83 | 0.50 | 1.16 | |
| T3 | 0.67 | 0.79 | 0.39 | 0.52 | 0.38 | |
| T4 | 0.53 | 0.74 | 0.62 | 0.44 | 0.38 | |
| T5 | 0.70 | 0.80 | 0.93 | 2.26 | 3.15 | |
| Mean value | 0.87 | 0.72 | 0.69 | 0.85 | 1.27 | |
| Leaf | T1 | 2.04 | 0.95 | 0.95 | 1.52 | 3.73 |
| T2 | 1.87 | 1.92 | 2.97 | 12.04 | 7.39 | |
| T3 | 1.16 | 1.17 | 0.29 | 0.47 | 0.17 | |
| T4 | 2.26 | 2.39 | 1.23 | 1.36 | 1.60 | |
| T5 | 1.38 | 1.39 | 0.87 | 2.37 | 2.31 | |
| Mean value | 1.74 | 1.56 | 1.26 | 3.55 | 3.04 |
碱蓬根、茎和叶的富集系数见表 4。结果显示,五类土壤中碱蓬不同部位的平均富集系数趋势为:叶 > 根 > 茎。重金属的平均富集系数趋势为:根和茎,Zn > Cu > Ni > Pb > Cr;叶,Zn > Cu > Pb > Ni > Cr。其中,T1、T2和T4三类综合污染指数小于1的土壤中碱蓬体内重金属含量远高于T3和T5两类重污染土壤中碱蓬重金属含量。此外,不同土壤中碱蓬根部Cr,茎部Cr、Cu、Zn、Pb,叶中Ni、Cu、Zn、Pb的趋势同五类土壤的污染指数趋势相反,均为T2 > T1 > T4 > T5 > T3。
| Part | Soil | Cr | Ni | Cu | Zn | Pb |
| Root | T1 | 0.024 | 0.093 | 0.187 | 0.301 | 0.020 |
| T2 | 0.025 | 0.050 | 0.204 | 0.597 | 0.036 | |
| T3 | 0.006 | 0.014 | 0.012 | 0.006 | 0.003 | |
| T4 | 0.016 | 0.025 | 0.081 | 0.102 | 0.022 | |
| T5 | 0.007 | 0.013 | 0.010 | 0.004 | 0.001 | |
| Mean value | 0.016 | 0.039 | 0.099 | 0.202 | 0.016 | |
| Stem | T1 | 0.041 | 0.046 | 0.131 | 0.164 | 0.026 |
| T2 | 0.018 | 0.040 | 0.168 | 0.300 | 0.041 | |
| T3 | 0.004 | 0.011 | 0.005 | 0.003 | 0.001 | |
| T4 | 0.009 | 0.018 | 0.050 | 0.045 | 0.008 | |
| T5 | 0.005 | 0.010 | 0.009 | 0.010 | 0.003 | |
| Mean value | 0.015 | 0.025 | 0.073 | 0.104 | 0.016 | |
| Leaf | T1 | 0.048 | 0.089 | 0.178 | 0.457 | 0.075 |
| T2 | 0.047 | 0.095 | 0.604 | 7.195 | 0.264 | |
| T3 | 0.007 | 0.016 | 0.004 | 0.003 | 0.000 | |
| T4 | 0.037 | 0.060 | 0.099 | 0.139 | 0.035 | |
| T5 | 0.010 | 0.018 | 0.009 | 0.010 | 0.002 | |
| Mean value | 0.030 | 0.056 | 0.179 | 1.561 | 0.075 |
重金属对植物毒理作用通常表现为抑制植物发芽、生根、幼苗生长和促进植物坏死[9-10, 24]。发芽率是反映种子胁迫耐受性的指标之一;根和茎是植物运输水和养分的重要部位[25],也是衡量植物生长状况的重要指标。本研究表明,Ni对碱蓬的毒性高于Cu,碱蓬对Cu的耐受性较高,与袁华茂等[26]的研究结论相似,这可能是因为碱蓬对于Cu的需求量高于Ni。低浓度复合胁迫促进碱蓬发芽,Cu、Ni互为拮抗作用;高浓度复合胁迫抑制碱蓬发芽,Cu、Ni互为协同作用,这与杨佳等[18]的研究结果类似。这可能是因为Cu和Ni均为碱蓬生长所必需的元素,低浓度时Cu2+和Ni2+浓度处于碱蓬生长所需求的浓度范围,促进碱蓬生长,高浓度则高于此浓度范围,抑制碱蓬生长[6-8]。所有胁迫组碱蓬根长均低于对照组,与Zhang等[17]的研究结果类似。碱蓬生长受到抑制可能是因为碱蓬暴露于过量的重金属环境下使得重金属离子进入细胞,造成细胞代谢紊乱,影响细胞特别是根尖细胞的有丝分裂,抑制芽期碱蓬的生长[10, 24-25]。在重金属Cu、Ni胁迫下碱蓬生长受到严重抑制,与Liu等[25]和寇士伟等[27]的研究结果一致,芽期碱蓬的根长与芽长均随胁迫浓度的升高而降低,这是因为根系的发育程度决定了其运输水分和无机盐的效率[28-30],进而影响芽长。同CK相比,胁迫组芽长均大于根长,表明重金属胁迫对根部的抑制作用强于芽长,这是由于芽期碱蓬根部富集较多的重金属(Cu:52.7%,Ni:62.9%)[26],而重金属的毒性随其含量的增加而增加[31],最终使得植物根系生长受到更加严重的抑制。总之,低浓度Cu和Ni单一胁迫和复合胁迫促进碱蓬种子萌发,高浓度Cu、Ni单一和复合胁迫抑制种子萌发;低浓度Cu、Ni单一和复合胁迫促进碱蓬芽长的生长,高浓度时抑制芽长的生长,所有Cu和Ni胁迫都抑制碱蓬根部的生长。与对应浓度的单一胁迫相比,复合胁迫下对碱蓬的芽长和根长的抑制作用更强,表明在碱蓬芽长与根长的生长方面,Cu、Ni互为协同作用,这可能也和芽期碱蓬根部富集较多的重金属有关[26]。
3.2 Cu与Ni胁迫对碱蓬芽期生长的影响Cu通过芬顿反应和哈伯–韦斯反应产生活性氧化物(ROS)[11-12, 32-33];Ni虽不能直接参与生成ROS,但能通过影响植物细胞内抗氧化酶和非酶的抗氧化物的形成而影响ROS含量[10, 24]。ROS会对膜脂质和蛋白质造成氧化损伤,植物通过抗氧化酶(POD、CAT和SOD等)和非酶的抗氧化物质(抗坏血酸、酚类、脯氨酸和谷胱甘肽等)来降低ROS的毒性[2, 10, 24]。MDA是膜脂质过氧化反应产物,它的含量多少反映细胞的损坏程度,是衡量植物逆境生长的重要指标[34]。本实验中芽期碱蓬MDA含量整体上随着重金属胁迫浓度的增加而增加,与以往研究结果一致[26, 35],说明随着胁迫浓度的增加,Cu、Ni两种重金属对芽期碱蓬的毒性越严重,Cu+Ni ((20+20) mg/L)胁迫对细胞膜损坏最小,Cu+Ni ((320+320) mg/L)胁迫对细胞膜损坏最大;与胁迫下的芽长和根长的生长趋势正好相反,推测植物芽长和根长降低的原因可能是由于重金属胁迫导致植物细胞膜脂质过氧化,细胞膜遭到破坏,进而影响植物的生长发育。
重金属胁迫下,植物体通过增加渗透调节物质的含量来改变渗透压、络合和转运重金属离子等途径来提高自身对重金属的耐受性[24]。可溶性蛋白和游离脯氨酸对于维持细胞的渗透平衡和调节生长发育有着重要的作用。可溶性蛋白是构成生物体酶系统的重要组成部分,与植物的耐逆性密切相关[35]。脯氨酸是植物体内缓解重金属毒性的重要物质,通过螯合重金属清除ROS (主要是羟自由基),防止细胞过氧化损伤[24, 31-32]。本研究表明,在Cu、Ni不同胁迫水平下,芽期碱蓬可溶性蛋白与脯氨酸的含量变化各异,但整体上胁迫组碱蓬可溶性蛋白含量较CK高1.8%–284.9%;胁迫组脯氨酸含量整体上高于CK,与李晶等[36]的研究结果一致。这表明在重金属胁迫下植物会通过提高可溶性蛋白和脯氨酸的产量来提高自身的耐逆性。
POD是植物抗氧酶化系统的重要组成部分,它通过过氧化氢促进酚类物质的降解,可以有效清除植物在氧化应激下产生的ROS和酚类物质[31]。本试验单一胁迫下,芽期碱蓬POD活性均呈上升趋势,与刘振国等[37]和于方明等[38]的研究结果一致;在4组复合胁迫下,芽期碱蓬POD活性整体上呈先升后降的趋势(临界浓度均为40 mg/L),与王昊等[39]的研究结果相似。表明POD分解底物有一定的范围,在此范围内,POD活性随底物浓度的增加而增加,超出这个范围POD活性下降。本实验结果表明:相比单一胁迫,低浓度(≤40 mg/L)时,Cu和Ni复合胁迫促进POD的活性;高浓度(≥80 mg/L)时,Cu和Ni复合胁迫会抑制POD活性。
与对应浓度的单一胁迫相比,复合胁迫在低浓度时,MDA含量降低,POD活性升高,促进芽期碱蓬的生长,Cu、Ni互为拮抗作用;高浓度时,MDA含量升高,POD活性降低,抑制芽期碱蓬的生长,Cu、Ni互为协同作用。这与何洁等[40]的研究结果相似。这是由于低浓度时Cu2+和Ni2+浓度处于碱蓬生长所必需的浓度范围,有益于碱蓬生长,Cu、Ni互为拮抗作用;高浓度时则高于此浓度范围,有害于碱蓬生长,Cu、Ni互为协同作用[6-8]。
3.3 碱蓬重金属富集和转移能力植物的转移系数反映重金属在植物体内的迁移与累积情况,TF > 1是重金属超富集植物区别于普通植物的重要特征之一[41]。转移系数越大,越有利于重金属在植物地上部的积累。试验结果显示,五类土壤碱蓬的叶片的平均转移系数均大于1,碱蓬茎部Pb的平均转移系数大于1,表明碱蓬体内的重金属主要累积与样品,而茎部主要累积Pb。富集系数反映植物从土壤中提取重金属的能力。试验结果显示,碱蓬BCF叶 > BCF根 > BCF茎,这一结果和袁华茂等[26]报道碱蓬BCF根 > BCF叶 > BCF茎的结果有所差异,这可能是由于本研究中碱蓬生长于干旱地区,而袁华茂等[26]研究的碱蓬位于湿地。研究中还发现碱蓬对于Zn和Cu的富集能力较强,与张乐添等[42]的研究结果类似。此外,碱蓬茎和叶的大部分重金属的富集系数与土壤污染程度的趋势相反,表明碱蓬对于重金属的富集能力还与土壤污染程度有关。
综上所述,碱蓬在金昌当地土壤Cu、Ni平均浓度下具有较高的发芽率,对Cu和Ni具有较高的耐受性;碱蓬对于Zn、Cu和Ni的富集系数较高,可以富集土壤中Zn、Cu、Ni三种重金属,且碱蓬叶片的转移系数大于1,能够将重金属转移到植物地上部分,便于最终回收处理重金属。因此在当前矿区土壤环境背景下(Cu:397.54 mg/L、Ni:340.57 mg/kg),碱蓬可以作为矿区生态恢复和重金属污染修复的备选植物。
| [1] |
Ministry of Environmental Protection, Ministry of Land and Resources. Bulletin of national soil pollution investigation. China Environ Prot Ind, 2014(5): 10-11 (in Chinese). 环境保护部, 国土资源部. 全国土壤污染状况调查公报. 中国环保产业, 2014(5): 10-11. |
| [2] |
Ovečka M, Takáč T. Managing heavy metal toxicity stress in plants: biological and biotechnological tools. Biotechnol Adv, 2014, 32(1): 73-86. |
| [3] |
Kintlová M, Blavet N, Cegan R, et al. Transcriptome of barley under three different heavy metal stress reaction. Genom Data, 2017, 13: 15-17. |
| [4] |
Zhang T, Yan HL, He ZY. Advances in molecular mechanisms of arsenic hyperaccumulation of Pteris vittata L.. Chin J Biotech, 2020, 36(3): 397-406 (in Chinese). 张田, 闫慧莉, 何振艳. 蜈蚣草中砷超富集的分子机制研究进展. 生物工程学报, 2020, 36(3): 397-406. |
| [5] |
Peng JS, Yi HY, Gong JM. Isolation and characterization of cadmium tolerant gene SpMT2 in the hyperaccumulator Sedum plumbizincicola. Chin J Biotech, 2020, 36(3): 541-548 (in Chinese). 彭佳师, 易红英, 龚继明. 超积累植物伴矿景天镉耐受基因SpMT2的分离及功能鉴定. 生物工程学报, 2020, 36(3): 541-548. |
| [6] |
Nieminen TM, Ukonmaanaho L, Rausch N, et al. Biogeochemistry of nickel and its release into the environment//Sigel A, Sigel H, Sigel RKO, eds. Nickel and Its Surprising Impact in Nature. Hoboken, NJ: Wiley, 2007, 2: 1-29.
|
| [7] |
Hänsch R, Mendel RR. Physiological functions of mineral micronutrients (Cu, Zn, Mn, Fe, Ni, Mo, B, Cl). Curr Opin Plant Biol, 2009, 12(3): 259-266. |
| [8] |
Jadia CD, Fulekar HM. Phytoremediation: the application of vermicompost to remove zinc, cadmium, copper, nickel and lead by sunflower plant. Environ Eng Manag J, 2018, 7(5): 547-558. |
| [9] |
Khalid S, Shahid M, Niazi NK, et al. A comparison of technologies for remediation of heavy metal contaminated soils//Whitacre D, ed. Reviews of Environmental Contamination and Toxicology. New York, NY: Springer, 2012, 182: 247-268.
|
| [10] |
Ahmad MSA, Ashraf M. Essential roles and hazardous effects of nickel in plants. Rev Environ Contam Toxicol, 2011, 214: 125-167. |
| [11] |
Pena LB, Azpilicueta CE, Gallego SM. Sunflower cotyledons cope with copper stress by inducing catalase subunits less sensitive to oxidation. J Trace Elemen Med Biol, 2011, 25(3): 125-129. |
| [12] |
Rodrigo-Moreno A, Andrès-Colás N, Poschenrieder C, et al. Calcium-and potassium-permeable plasma membrane transporters are activated by copper in Arabidopsis root tips: linking copper transport with cytosolic hydroxyl radical production. Plant Cell Environ, 2013, 36(4): 844-855. |
| [13] |
Sethy SK, Ghosh S. Effect of heavy metals on germination of seeds. J Nat Scie Biol Med, 2013, 4(2): 272-275. |
| [14] |
Hu XN, Nan ZR, Liu XW, et al. The characteristics of heavy metal pollution in the residential area soil of Jinchang city. J Arid Land Resour Environ, 2011, 25(1): 180-184 (in Chinese). 胡小娜, 南忠仁, 刘晓文, 等. 金昌城市居民区土壤重金属分布特征研究. 干旱区资源与环境, 2011, 25(1): 180-184. |
| [15] |
Jin HX, Dong DK, Yang QH, et al. Salt-responsive transcriptome profiling of Suaeda glauca via RNA sequencing. PLoS ONE, 2016, 11(3): e0150504. |
| [16] |
Duan HM, Ma YC, Liu RR, et al. Effect of combined waterlogging and salinity stresses on euhalophyte Suaeda glauca. Plant Physiol Biochem, 2018, 127: 231-237. |
| [17] |
Zhang X, Li M, Yang HH, et al. Physiological responses of Suaeda glauca and Arabidopsis thaliana in phytoremediation of heavy metals. J Environ Manag, 2018, 223: 132-139. |
| [18] |
Yang J, Wang CY, Chen D, et al. Responses and accumulation characteristics of Suaeda salsa under combined and single Stress of Pb2+ and Cd2+. J Soil Water Conservat, 2016, 30(2): 323-327 (in Chinese). 杨佳, 王趁义, 陈翟, 等. 碱蓬对Pb2+、Cd2+单一及复合胁迫的反应及其吸收累积特征. 水土保持学报, 2016, 30(2): 323-327. |
| [19] |
Yang YZ, Zhang CH, Zheng QS, et al. Uptake, translocation and subcellular distribution characteristics of cadmium and sodium in Suaeda salsa and Atriplex triangularis. J Agro-Environ Sci, 2015, 34(4): 619-626 (in Chinese). 杨亚洲, 张春华, 郑青松, 等. 碱蓬和滨藜对镉和钠吸收、转运及亚细胞分布特性的比较研究. 农业环境科学学报, 2015, 34(4): 619-626. |
| [20] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 2930.4-2017 Rules of seed testing for forage, turfgrass and other herbaceous plant-The germination test. Beijing: Standards Press of China, 2017 (in Chinese). 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 2930.4-2017草种子检验规程发芽试验.北京: 中国标准出版社, 2017. |
| [21] |
Tang SH, Luo C. Experimental Course of Plant Physiology. Chongqing: Southwest China Normal Univ Press, 2012: 201-204 (in Chinese). 汤绍虎, 罗充. 植物生理学实验教程. 重庆: 西南师范大学出版社, 2012: 201-204. |
| [22] |
Chen JX, Wang XF. Experimental Guidance of Plant Physiology. 2nd Edition. Guangzhou: South China Univ of Technol Press, 2006: 24-73 (in Chinese). 陈建勋, 王晓峰. 植物生理学实验指导. 2版. 广州: 华南理工大学出版社, 2006: 24-73. |
| [23] |
Lou TX, Lü SL, Li YX. Application potential of Salicornia europaea in remediation of Cd, Pb and Li contaminated saline soil. Chin J Biotech, 2020, 36(3): 481-492 (in Chinese). 娄腾雪, 吕素莲, 李银心. 盐角草在Cd、Pb、Li污染盐土修复中的应用潜力. 生物工程学报, 2020, 36(3): 481-492. |
| [24] |
Hossain MA, Piyatida P, Da Silva JAT, et al. Molecular mechanism of heavy metal toxicity and tolerance in plants: central role of glutathione in detoxification of reactive oxygen species and methylglyoxal and in heavy metal chelation. J Bot, 2012, 2012: 872875. |
| [25] |
Liu SJ, Yang CY, Xie WJ, et al. The effects of cadmium on germination and seedling growth of Suaeda salsa. Proced Environ Sci, 2012, 16: 293-298. |
| [26] |
Yuan HM, Li XG, Li N, et al. Accumulation and transportation of heavy metals by Suaeda salsa in the Northeastern coastal wetland of the Jiaozhou bay. Oceanol Limnol Sin, 2011, 42(5): 676-683 (in Chinese). 袁华茂, 李学刚, 李宁, 等. 碱蓬(Suaeda salsa)对胶州湾滨海湿地重金属的富集与迁移作用. 海洋与湖沼, 2011, 42(5): 676-683. |
| [27] |
Kou SW, Ni GF, Ma LT, et al. Effects of Cd, Pb and Cu compound pollution on the growth and physiological characteristics of mustard plants. Res Environ Sci, 2011, 24(3): 281-286 (in Chinese). 寇士伟, 倪高风, 马岚婷, 等. Cd-Pb-Cu复合污染对芥菜生长及生理特性的影响. 环境科学研究, 2011, 24(3): 281-286. |
| [28] |
Teixeira JAS, Ten Tusscher KH. The systems biology of lateral root formation: connecting the dots. Mol Plant, 2019, 12(6): 784-803. |
| [29] |
Poirier V, Roumet C, Munson AD. The root of the matter: linking root traits and soil organic matter stabilization processes. Soil Biol Biochem, 2018, 120: 246-259. |
| [30] |
Bouain N, Krouk G, Lacombe B, et al. Getting to the root of plant mineral nutrition: combinatorial nutrient stresses reveal emergent properties. Trends Plant Sci, 2019, 24(6): 542-552. |
| [31] |
Thounaojam TC, Panda P, Mazumdar P, et al. Excess copper induced oxidative stress and response of antioxidants in rice. Plant Physiol Biochem, 2012, 53: 33-39. |
| [32] |
Berni R, Luyckx M, Xu X, et al. Reactive Oxygen Species and heavy metal stress in plants: impact on the cell wall and secondary metabolism. Environ Exp Bot, 2019, 161: 98-106. |
| [33] |
Mostofa MG, Seraj ZI, Fujita M. Exogenous sodium nitroprusside and glutathione alleviate copper toxicity by reducing copper uptake and oxidative damage in rice (Oryza sativa L.) seedlings. Protoplasma, 2014, 251(6): 1373-1386. |
| [34] |
Ibrahim E A. Seed priming to alleviate salinity stress in germinating seeds. J Plant Physiol, 2016, 192: 38-46. |
| [35] |
Wang SY, Jiang H. Effects of Pb2+, Cr6+, Hg2+ and Cu2+ on physiological and biochemical characteristics in Suaeda salsa. Chin Wild Plant Resour, 2014, 33(1): 12-15 (in Chinese). 王思瑶, 姜华. Pb2+、Cr6+、Hg2+和Cu2+对碱蓬幼苗生长及生理生化指标的影响. 中国野生植物资源, 2014, 33(1): 12-15. |
| [36] |
Li J, Xu YL, Li GY, et al. Analyses of heavy metal accumulation and physiological characteristics in leaves of main arbor and shrub plants in traffic roads of Lanzhou city. Ecol Environ Sci, 2019, 28(5): 999-1006 (in Chinese). 李晶, 徐玉玲, 黎桂英, 等. 兰州市交通道路主要乔灌木植物叶片重金属积累及生理特性的分析. 生态环境学报, 2019, 28(5): 999-1006. |
| [37] |
Liu ZG, Wang TH, Wang W. Effects of CuO NPs on ROS, antioxidant enzyme activity and root activity of the alfalfa seedlings. Asian J Ecotoxicol, 2016, 11(5): 117-124 (in Chinese). 刘振国, 王天慧, 王伟. 纳米氧化铜(CuO NPs)对紫花苜蓿幼苗根系活性氧(ROS)、抗氧化酶活性和根系活力的影响. 生态毒理学报, 2016, 11(5): 117-124. |
| [38] |
Yu FM, Qi PY, Liu KH, et al. Effects of lime on the growth and antioxidant enzyme system of Camellia oleifera in manganese-contaminated soil. J Agro-Environ Sci, 2019, 38(8): 1882-1890 (in Chinese). 于方明, 漆培艺, 刘可慧, 等. 锰污染土壤石灰改良对油茶生长及抗氧化酶系统的影响. 农业环境科学学报, 2019, 38(8): 1882-1890. |
| [39] |
Wang H, Zhao XG, Chen BJ, et al. Research progress on toxic effects of ocean acidification combined with heavy metals, organic pollutants and engineered nanoparticles. Asian J Ecotoxicol, 2019, 14(1): 2-17 (in Chinese). 王昊, 赵信国, 陈碧鹃, 等. 海洋酸化与重金属、有机污染物和人工纳米颗粒的联合毒性效应研究进展. 生态毒理学报, 2019, 14(1): 2-17. |
| [40] |
He J, Gao YT, He X, et al. The effect of Zn and Cd on growth and antioxidant enzymes activity of Suaeda heteroptera Kitagawa. Acta Scien Circum, 2013, 33(1): 312-320 (in Chinese). 何洁, 高钰婷, 贺鑫, 等. 重金属Zn和Cd对翅碱蓬生长及抗氧化酶系统的影响. 环境科学学报, 2013, 33(1): 312-320. |
| [41] |
Chen KH, Zhang K, Li QS, et al. Remediation effects of four halophytes on Cd and Pb compound pollution. J Agro-Environ Sci, 2017, 36(3): 458-465 (in Chinese). 陈柯罕, 张科, 李取生, 等. 四种盐生植物对Cd Pb复合污染提取修复效果比较研究. 农业环境科学学报, 2017, 36(3): 458-465. |
| [42] |
Zhang LT, Li JX, Wen YH, et al. Study on enrichment characteristics of metallic elements in wetland soil using haloduric Suaeda salsas. J Instrum Anal, 2018, 37(11): 1287-1293 (in Chinese). 张乐添, 李景喜, 温永红, 等. 耐高盐碱蓬对湿地土壤中金属元素的富集特征研究. 分析测试学报, 2018, 37(11): 1287-1293. |
 2020, Vol. 36
2020, Vol. 36




