中国科学院微生物研究所、中国微生物学会主办
文章信息
- 徐珊姗, 周金登, 双陈冬, 周庆, 李爱民
- Xu Shanshan, Zhou Jindeng, Shuang Chendong, Zhou Qing, Li Aimin
- Fe3O4对施氏假单胞菌反硝化过程的影响
- Effects of Fe3O4 on the denitrification performance of Pseudomonas stutzeri
- 生物工程学报, 2021, 37(10): 3685-3695
- Chinese Journal of Biotechnology, 2021, 37(10): 3685-3695
- 10.13345/j.cjb.210426
-
文章历史
- Received: June 4, 2021
- Accepted: September 2, 2021
- Published: September 9, 2021
随着工业化进程加快,水污染问题日趋严重。水环境中过量的硝酸盐会对人体健康和生态环境造成危害[1]。许多国家和机构组织都规定了水中硝酸盐氮的限值,如世界卫生组织(World Health Organization,WHO) 规定饮用水中硝酸盐浓度限值为50 mg-NO3–/L[2],我国为10 mg-N/L[3],此外《城镇污水处理厂污染物排放标准(GB18918-2002)》[4]中一级A标准要求总氮(Total nitrogen,TN) 浓度不超过15 mg/L。
在废水处理中,生物反硝化是目前广泛应用的硝酸盐去除工艺[5],它是指在缺氧的环境下,反硝化菌以NO3–-N为末端电子受体,将其还原为N2的过程。然而,反硝化需要的停留时间长,易受温度、碳源、pH等外界因素影响[6]。报道显示,我国北方污水处理厂在冬季反硝化效果不佳,导致出水总氮很难达标[7-8]。因此有必要开发反硝化强化技术,以提高反硝化速率,保障出水稳定达标。
铁是微生物生长必需的微量元素[9],铁元素不同价态间的氧化还原过程,对环境中其他污染物的降解[10-11]、微生物的生长代谢过程[12-13]都有重要的作用。研究表明,铁氧化物能够作为胞外呼吸的终端电子受体/供体、电子储存介质或是种间电子传递介体促进微生物代谢过程[14-16]。在反硝化研究中,Zhang等[17]发现针铁矿α-FeOOH、纤铁矿γ-FeOOH、赤铁矿α-Fe2O3和磁铁矿γ-Fe2O3能够作为电子介体促进芽孢杆菌Bacillus sp.的反硝化过程。Ni等[18]发现,当活性污泥长期暴露于50 mg/L的Fe3O4纳米颗粒后,总氮去除率由80.3%提高到94.4%,反硝化酶Nor、Nar、Nir活性分别提高了12%、23%、27%。乔楠等[19]将好氧反硝化菌负载于Fe3O4纳米颗粒上,发现细菌对总氮、总磷(Total phosphorus,TP)、化学需氧量(Chemical oxygen demand,COD) 的去除率随着Fe3O4用量的增加而提高。
目前,Fe3O4对反硝化微生物的影响及其作用机制的研究较少。本研究采用向反硝化体系中投加Fe3O4纳米颗粒的方式考察其对施氏假单胞菌Pseudomonas stutzeri反硝化过程的影响,旨在从反硝化动力学过程、微生物生长代谢水平、反硝化酶与功能基因的表达等角度,探讨Fe3O4对P. stutzeri反硝化过程的影响机制,为反硝化强化技术的开发提供理论支撑。
1 材料与方法 1.1 实验材料本实验所用的施氏假单胞菌ATCC17588冻干粉购自中国普通微生物菌种保藏管理中心;纳米Fe3O4 (20 nm)、石墨粉(8 000目) 均购自上海麦克林生化科技有限公司;磷酸盐缓冲溶液(PBS) 购自江苏凯基生物技术股份有限公司。
1.2 培养基LB肉汤培养基:购自青岛海博生物技术有限公司,作为活化培养基,121 ℃高压灭菌15 min。
反硝化培养基(g/L):CH3COONa 3.086、KNO3 0.619、K2HPO4·3H2O 4.78、MgSO4·7H2O 0.2、KH2PO4 1.24和1 mL微量元素溶液。
微量元素溶液(g/L):MnCl2·6H2O 0.03、(NH4)6Mo7O24·4H2O 2.00、FeCl2·4H2O 1.50、ZnCl2 0.05、CoCl2·6H2O 1.61和H3BO3 2.86。
所用试剂均为分析纯,除KNO3、ZnCl2、H3BO3购自国药集团化学试剂有限公司;MgSO4·7H2O购自西陇科学股份有限公司;其余均购自南京化学试剂有限公司。
1.3 实验方法 1.3.1 菌种的活化于250 mL锥形瓶中加入100 mL LB肉汤,接种菌株,置于37 ℃、200 r/min的数显振荡培养箱中恒温振荡培养,取培养10 h后(OD600=0.8) 的菌液进行反硝化实验。
1.3.2 反硝化实验取1 mL上述培养好的菌液接种至100 mL无菌反硝化培养基中,进行P. stutzeri生物反硝化实验。
为考察无机颗粒物对P. stutzeri反硝化的影响,在以下体系中开展实验:4 000 mg/L Fe3O4+ P. stutzeri;4 000 mg/L石墨粉+P. stutzeri;P. stutzeri (Control)。为进一步研究Fe3O4对P. stutzeri的影响,向反硝化体系中分别加入500 mg/L、1 000 mg/L、2 000 mg/L、4 000 mg/L、6 000 mg/L Fe3O4。
1.3.3 游离细菌与粘附细菌的电镜表征用磁铁将Fe3O4吸附于锥形瓶底部,将上清液离心,得到游离细菌(Fe3O4_S),将底部的Fe3O4与细菌混合物用PBS反复清洗,得到粘附细菌(Fe3O4_A)。用2.5%戊二醛对菌体进行固定化,4 h后离心,用PBS清洗3遍,去上清。用30%、50%、70%、80%、90%的梯度乙醇溶液对菌体脱水,每次15 min,之后在100%乙醇中脱水2次,离心,去上清后置于1︰1乙醇和叔丁醇混合液中15 min,去上清,用纯叔丁醇置换2次,每次15 min。最后将细菌悬浮液滴在盖玻片上,置于−80 ℃冰箱冷冻后放入冷冻干燥机中,样品充分干燥后在电镜下观察。
1.3.4 总蛋白质含量测定蛋白质含量采用二喹啉甲酸(Bicinchoninic acid,BCA) 法微量蛋白质浓度试剂盒测定。取一定体积的菌液,利用超声破碎仪在冰水浴中进行细胞破碎(功率400 W,破碎1.0 s停1.0 s,15 min)。破碎后4 ℃、8 000 r/min离心15 min,取上清液,经0.22 μm的滤膜过滤后用于溶液体系总蛋白量的测定。
1.3.5 反硝化功能基因和反硝化还原酶表达将上述不同体系反硝化12 h后的细菌混合液置于高速离心机中,0 ℃、8 000 r/min离心15 min,倒去上清液,用0.1 mol/L PBS (pH 7.4) 清洗3次,重复离心后将沉淀物置于−80 ℃冰箱中保存,利用实时荧光定量PCR (RT-qPCR) 测定功能基因的相对表达量,利用非标记(Label-free) 定量蛋白组学分析酶的相对表达量。
RT-qPCR反应在ABI7300型荧光定量PCR仪上进行,设3次重复实验,目的基因及引物如表 1所示,反应体系20 μL,包括2× Taq Plus Master Mix 10 μL、Primer F (5 μmol/L) 0.8 μL、Primer R (5 μmol/L) 0.8 μL、cDNA 1 μL、ddH2O 7.4 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s;退火30 s,35个循环;72 ℃延伸1 min。采用2–ΔΔCt法进行相对定量,–ΔΔCt可根据以下公式计算:
| Target genes | Primers | Sequences (5′–3′) |
| napA | napA-F | GCGTCGCCTTCTATGTCTCCG |
| napA-R | GCCTCGCCTTGGCTTCTTC | |
| narJ | narJ-F | ATCCCGCTTTACCTCGAATACC |
| narJ-R | AAGTTGACCTGTTCCTCCTCCC | |
| nirB | nirB-F | GTTCTACCGTCACTCCGCTCAC |
| nirB-R | CCGTGGCTGCTGTAGTAGTCG | |
| norR | norR-F | TCGTTTCGACGCTGCCAATG |
| norR-R | TGCCCGTCACGCACGCTTT | |
| nosZ | nosZ-F | CAACGCCGAGTTCATCATCC |
| nosZ-R | TCTCCGAGTTGTAGCAGGTGG | |
| 16S rRNA | 16S RNA1F | GCGCGTAGGTGGTTCGTTAA |
| Loading control | 16S RNA1R | AAATTCCACCACCCTCTGCC |
ΔCt=Ct (目标基因)–Ct (内参基因,16S rRNA)。
ΔΔCt=ΔCt (实验组)–ΔCt (对照组)。
Label-free测定流程如下:从样品中提取蛋白,用BCA法定量蛋白质浓度;蛋白质经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS- PAGE) 分析并评价样品质量是否符合后续实验要求;对质量达标的蛋白样品进行还原烷基化处理,每个样品取等量蛋白用胰蛋白酶(Trypsin) 酶解,对已酶解的肽段进行定量;取等量样本进行LC-MS分析。
1.4 分析方法乙酸根、亚硝酸根、硝酸根的测定选用标准HJ/T 84-2001离子色谱法[20] (ICS-1100离子色谱仪,赛默飞,美国)。OD600通过酶标仪(Multiskan FC,赛默飞,美国) 测定。溶液中的Fe2+和Fe3+根据HJ/T 345-2007邻菲啰啉比色法测定[21]。将干细胞硝化后用电感离子耦合等离子体原子发射光谱仪(ICP-OES) 测定细胞内铁含量。
使用Uniprot数据库,通过软件Proteome Discover 2.2进行搜库和蛋白质鉴定,计算一级质谱相关的肽段峰面积,再对样品中每个肽段的谱图积分,进行定量。通过软件InterProScan进行GO功能注释,通过KEGG对蛋白质进行通路分析。使用SAS 8.0软件进行单因素方差分析及Pearson相关性分析。
2 结果与分析 2.1 Fe3O4对反硝化过程的影响从图 1可以看出,向P. stutzeri反硝化体系中分别投加Fe3O4和石墨后,体系中硝酸盐氮、乙酸盐以及OD600都呈现出前期变化缓慢后期快速的趋势。在实验前期,乙酸盐和硝酸盐浓度均无明显降低,微生物生长迟缓。从8 h开始,微生物进入快速生长阶段,乙酸盐被快速降解,硝酸盐氮明显降低,12 h时Fe3O4体系中硝酸盐氮被彻底还原,16 h时对照组硝酸盐氮被完全去除,而石墨体系中仍残余20 mg/L硝酸盐氮。
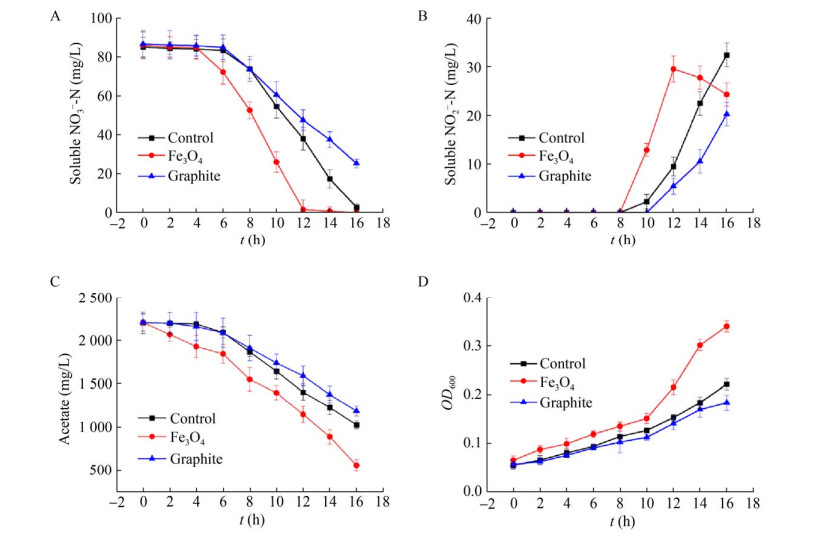
|
| 图 1 不同无机物对反硝化过程的影响 Fig. 1 Effects of different inorganic substances on denitrification. (A) NO3–-N reduction. (B) NO2–-N reduction. (C) Acetate degradation. (D) Cell growth of P. stutzeri. |
| |
对比3个体系可以发现,Fe3O4对反硝化起促进作用,石墨起抑制作用。选用单一底物限制的Monod模型[22]来描述6 h后P. stutzeri反硝化动力学,3个体系拟合结果R2均大于0.9,硝酸盐氮最大比降解速率Vmax-Fe3O4 (=23.7 h–1) > Vmax-control (=18.0 h–1) > Vmax-graphite (=17.1 h–1)。由于石墨与Fe3O4均可作为导体促进微生物胞外电子传递[23],说明胞外电子传递并不是Fe3O4促进反硝化的主要机制。
进一步考察了Fe3O4投加量对反硝化过程的影响。从图 2可以看出随着Fe3O4投加量的增加,OD600增加,P. stutzeri的生长速率提高,同时硝酸盐氮的还原速率也显著提高,通过Monod方程拟合计算出最大比降解速率,发现当Fe3O4投加量分别为500 mg/L、1 000 mg/L、2 000 mg/L、4 000 mg/L、6 000 mg/L时,硝酸盐氮最大比降解速率分别为19.4 h–1、19.6 h–1、21.5 h–1、23.7 h–1、24.0 h–1,表明Fe3O4对 P. stutzeri反硝化过程的促进作用随着投加量的增加而加强。
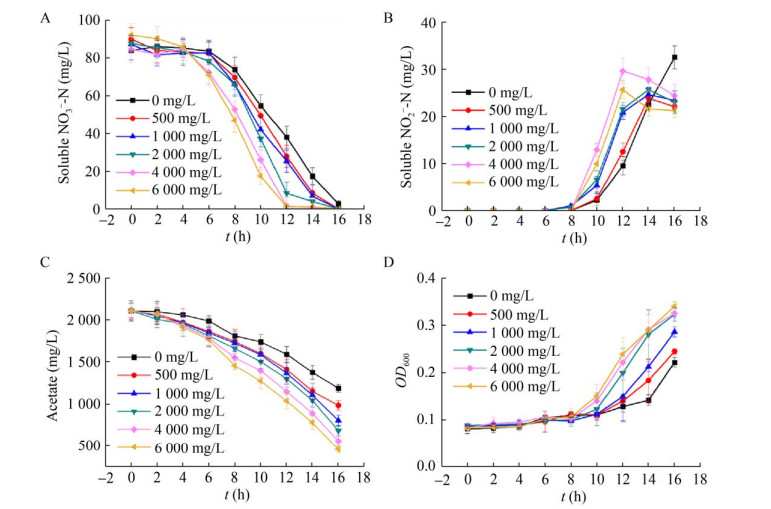
|
| 图 2 不同Fe3O4投加量对反硝化过程的影响 Fig. 2 Effects of different concentrations of Fe3O4 on denitrification. (A) NO3–-N reduction. (B) NO2–-N reduction. (C) Acetate degradation. (D) Cell growth of P. stutzeri. |
| |
近年来的研究发现,微生物与含铁矿物之间存在着多种相互作用机制。铁氧化物在中性水环境中多为不可溶矿物,难以穿透微生物的细胞质膜进入到胞内。因此,微生物会通过直接或间接方式利用胞外的矿物进行呼吸作用[24]。为了探究P. stutzeri对Fe3O4的利用机制,测定了不同体系中的Fe2+和Fe3+浓度。
所有体系中均未检测出Fe3+,图 3反映了体系中Fe2+浓度变化,可以看出,反硝化培养基中投加Fe3O4后,在未接种细菌的体系中,Fe2+浓度没有变化,说明体系中的Fe3O4没有溶出。而在接种P. stutzeri后,无论有无Fe3O4的存在,Fe2+浓度均明显降低,说明P. stutzeri可以利用Fe2+。通过对溶液中Fe2+浓度的变化计算,发现在无Fe3O4生物体系中P. stutzeri摄取的Fe2+总量(4.355 μg) 与有Fe3O4体系中的摄取量(4.358 μg) 几乎相同。
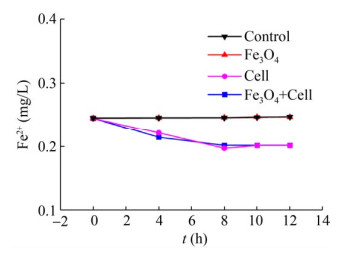
|
| 图 3 不同反硝化体系中的亚铁浓度 Fig. 3 Concentration of Fe2+ in different denitrification systems. |
| |
另一方面,对细胞内铁含量进行分析,从图 4可以看出,随着Fe3O4投加量增加至4 000 mg/L,细胞内铁含量由0.427 mg/g增加至0.864 mg/g。而P. stutzeri从溶液中Fe2+的摄取量几乎相等,说明P. stutzeri可以直接将Fe3O4中的铁元素运载到细胞内进行生长代谢,而不需要将Fe3O4转化为溶解态的Fe2+和Fe3+再利用。有研究表明,一些微生物可以分泌铁载体(Siderophore) 将矿物晶格中的铁离子转化为可溶性的含铁络合物,然后进入胞内参与代谢过程[25]。
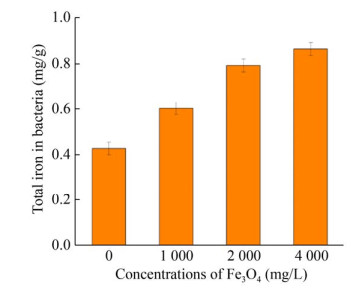
|
| 图 4 不同Fe3O4投加量下生物细胞内铁含量 Fig. 4 Intracellular iron content under different concentrations of Fe3O4. |
| |
P. stutzeri具备完整的氮代谢通路,反硝化过程涉及多种酶和多种中间产物,4种反硝化还原酶包括硝酸盐还原酶(Nap或Nar)、亚硝酸盐还原酶(Nir)、一氧化氮还原酶(Nor)、一氧化二氮还原酶(Nos),对应的编码基因分别是napA、narJ、nirB、norR和nosZ[26]。
从图 5可以发现,投加Fe3O4后,P. stutzeri反硝化功能基因napA、narJ、nirB、norR、nosZ表达量分别提高了55.7%、24.9%、24.5%、36.5%、120%,对应的反硝化还原酶Nap、Nar、Nir、Nor、Nos表达量提高了85.0%、147%、16.5%、47.1%、95.9% (P < 0.05)。这说明Fe3O4的存在可以提高P. stutzeri反硝化还原酶的表达,有效促进硝酸盐还原以及一氧化二氮还原为氮气的末端反应。

|
| 图 5 有/无Fe3O4体系中反硝化功能基因和酶的相对表达量 Fig. 5 Relative expression of denitrifying genes and reductases (Fe3O4/Control). (A) Denitrifying genes. (B) Denitrifying reductases. |
| |
有研究发现纳米颗粒可以很容易地附着到细胞表面,对微生物的代谢活动造成影响[27]。对Fe3O4反硝化体系上清液中的游离细菌(Fe3O4_S) 与Fe3O4粘附细菌(Fe3O4_A) 进行扫描电镜表征,图 6A中游离细菌表面无明显颗粒态物质存在,图 6B中细菌周围布满Fe3O4,这表明在反硝化过程有一部分细菌可与Fe3O4进行直接粘附。

|
| 图 6 Fe3O4体系中游离细菌和粘附细菌扫描电镜 Fig. 6 SEM of bacteria surface. (A) Bacteria suspended. (B) Bacteria adhered to Fe3O4. |
| |
将实验鉴定到的蛋白按粘附细菌和游离细菌分组,探究Fe3O4对细菌蛋白的差异影响。共鉴定出2 530种差异蛋白,差异倍数(Fold change) 大于2.0倍的差异蛋白为99种,以游离细菌为参照,粘附细菌表达上调的差异蛋白有67种,表达下调的有32种,这说明Fe3O4调控了P. stutzeri的蛋白表达。表 2列出了差异倍数前5位的差异上调蛋白和下调蛋白,GO注释表明上调蛋白主要涉及的生物学过程包括碳水化合物代谢和翻译,KEGG注释表明差异上调蛋白主要调控淀粉和蔗糖代谢、单糖转运系统底物结合蛋白和周质铁结合蛋白。由此可以发现,与Fe3O4的直接接触促进了P. stutzeri对碳源的代谢过程、蛋白质的生物合成以及对铁的吸收转运过程。差异下调蛋白则主要涉及磷脂酰肌醇磷酸化、代谢过程、氧化-还原过程和翻译,调控的KEGG通路包括烟酸和烟酰胺代谢、硫代谢以及缬氨酸、亮氨酸和异亮氨酸的生物合成。
| Proteins | GO description(biological process) | KEGG description | Fold change |
| Up-regulated protein | |||
| Maltokinase | Carbohydrate metabolic process | Starch and sucrose metabolism, metabolic pathways | 70.9 |
| 30S ribosomal protein S17 | Translation | Small subunit ribosomal protein | 7.6 |
| ABC transporter substrate-binding protein | – | Simple sugar transport system substrate-binding protein | 7.5 |
| BMP family ABC transporter substrate-binding protein | – | Simple sugar transport system substrate-binding protein | 6.2 |
| Membrane protein | – | Periplasmic iron binding protein | 5.9 |
| Down-regulated protein | |||
| Nicotinate phosphoribosyltransferase | – | Nicotinate and nicotinamide metabolism | 0.2 |
| 3′(2′), 5′-bisphosphate nucleotidase CysQ | Phosphatidylinositol phosphorylation | Sulfur metabolism | 0.2 |
| 3-isopropylmalate dehydratase small subunit | Metabolic process | Valine, leucine and isoleucine biosynthesis | 0.3 |
| Acyl-CoA dehydrogenase | Oxidation-reduction process | – | 0.3 |
| 50S ribosomal protein L35 | Translation | Large subunit ribosomal protein | 0.3 |
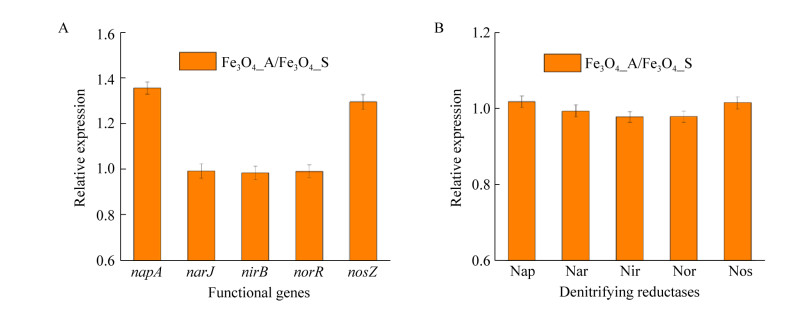
图 7反映了Fe3O4体系中粘附细菌与游离细菌反硝化功能基因、反硝化还原酶的变化,可以看出反硝化基因和酶的相对表达量均在1.0左右,在游离细菌与粘附细菌中的表达量没有明显差别。
|
| 图 7 粘附细菌与游离细菌的反硝化功能基因和酶的相对表达量 Fig. 7 Relative expression levels of denitrifying genes and reductases (Fe3O4_A/Fe3O4_S). (A) Denitrifying genes. (B) Denitrifying reductases. |
| |
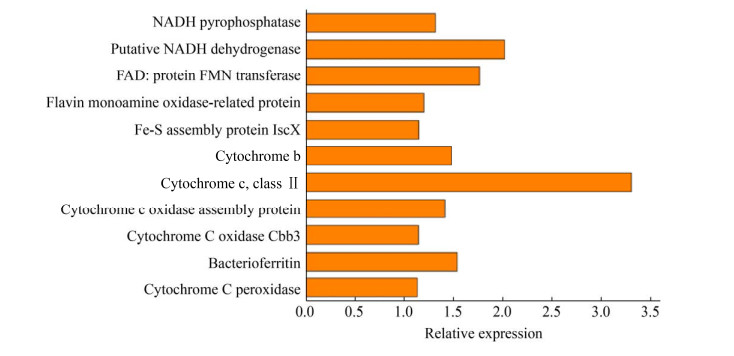
P. stutzeri反硝化电子传递链包括NADH、FAD、Fe-S中心、泛醌、Cu中心以及细胞色素a、b、c[28],其中大量的蛋白(如细胞色素c) 都含有铁活性中心[29]。从图 8可以发现,相较于游离细菌,粘附细菌的电子传递蛋白均有不同程度的提高,NADH脱氢酶、FAD、细胞色素c的相对表达量分别是游离细菌的2.02倍、1.76倍、3.30倍。
|
| 图 8 粘附细菌反硝化电子传递蛋白的相对表达量 Fig. 8 Relative expression levels of election transfer proteins involved in denitrification. |
| |
测定了有/无Fe3O4体系中总蛋白浓度的变化,发现在添加Fe3O4后,蛋白浓度由195 μg/mL增加至252 μg/mL,进一步测定了Fe3O4体系中游离细菌和粘附细菌的蛋白浓度,发现游离细菌的蛋白浓度(256 μg/mL) 高于粘附细菌(219 μg/mL)。结合基因、酶以及蛋白的变化可以发现,与Fe3O4的直接接触提高了电子传递蛋白的表达,促进了粘附细菌的生长代谢,使得整个体系中的细菌数目增加(结合前文图 2D),反硝化速率因此得到提高。
3 总结本研究探讨了Fe3O4对P. stutzeri反硝化过程的影响。研究发现随着Fe3O4投加量由0 mg/L增加至4 000 mg/L,硝酸盐氮最大比降解速率由18.0 h–1提高至23.7 h–1,体系中总蛋白浓度和细胞内的铁含量均显著增加。RT-qPCR和label-free分析结果显示,Fe3O4体系中的反硝化功能基因和对应的反硝化还原酶表达量均显著提升,当Fe3O4投加量为4 000 mg/L时,P. stutzeri反硝化功能基因napA、narJ、nirB、norR、nosZ表达量分别提高了55.7%、24.9%、24.5%、36.5%、120%,对应反硝化还原酶Nap、Nar、Nir、Nor、Nos的表达量提高了85.0%、147%、16.5%、47.1%、95.9%。游离细菌和Fe3O4粘附细菌的反硝化功能基因以及反硝化相关酶没有显著差别,但Fe3O4粘附细菌的NADH脱氢酶、FAD、细胞色素c等电子传递相关蛋白表达量均有所提高。这说明Fe3O4通过与细菌直接接触可促进生长代谢,导致体系中细菌总数的增加,从而提高反硝化速率。
| [1] |
Ward MH, Jones RR, Brender JD, et al. Drinking water nitrate and human health: an updated review. Int J Environ Res Public Health, 2018, 15(7): E1557. DOI:10.3390/ijerph15071557
|
| [2] |
Guidelines for Drinking-water quality: fourth edition incorporating the first addendum. Geneva: World Health Organization, 2017.
|
| [3] |
生活饮用水卫生标准. GB 5749-2006. 2006-12-29. Standards for drinking water quality. GB 5749-2006. 2006-12-29 (in Chinese). |
| [4] |
城镇污水处理厂污染物排放标准. GB 18918-2002. 2002-12-24. Discharge standard of pollutants for municipal wastewater treatment plant. GB 18918-2002. 2002-12-24 (in Chinese). |
| [5] |
Du R, Cao S, Li B, et al. Performance and microbial community analysis of a novel DEAMOX based on partial-denitrification and anammox treating ammonia and nitrate wastewaters. Water Res, 2017, 108: 46-56. DOI:10.1016/j.watres.2016.10.051
|
| [6] |
Lee YY, Choi H, Cho KS. Effects of carbon source, C/N ratio, nitrate, temperature, and pH on N2O emission and functional denitrifying genes during heterotrophic denitrification. J Environ Sci Health A Tox Hazard Subst Environ Eng, 2019, 54(1): 16-29. DOI:10.1080/10934529.2018.1503903
|
| [7] |
杨红, 白文龙, 梅小乐, 等. 寒冷地区冬季脱氮除磷工艺调控及效果分析. 中国给水排水, 2021, 37(6): 107-111. Yang H, Bai WL, Mei XL, et al. Adjustment and analysis of nitrogen and phosphorus removal process to resist winter in cold regions. China Water Wastewater, 2021, 37(6): 107-111 (in Chinese). |
| [8] |
Li L, Qian GS, Ye LL, et al. Research on the enhancement of biological nitrogen removal at low temperatures from ammonium-rich wastewater by the bio-electrocoagulation technology in lab-scale systems, pilot-scale systems and a full-scale industrial wastewater treatment plant. Water Res, 2018, 140: 77-89. DOI:10.1016/j.watres.2018.04.036
|
| [9] |
Das NK, Schwartz AJ, Barthel G, et al. Microbial metabolite signaling is required for systemic iron homeostasis. Cell Metab, 2020, 31(1): 115-130. DOI:10.1016/j.cmet.2019.10.005
|
| [10] |
Shi M, Min X, Ke Y, et al. Recent progress in understanding the mechanism of heavy metals retention by iron (oxyhydr)oxides. Sci Total Environ, 2021, 752: 141930. DOI:10.1016/j.scitotenv.2020.141930
|
| [11] |
钱子妍, 吴川, 何璇, 等. 铁循环微生物对环境中重金属的影响研究进展. 环境化学, 2021, 40(3): 834-850. Qian ZY, Wu C, He X, et al. Study on the influence of iron redox cycling microorganisms on heavy metals in the environment. Environ Chem, 2021, 40(3): 834-850 (in Chinese). |
| [12] |
Newsome L, Morris K, Cleary A, et al. The impact of iron nanoparticles on technetium-contaminated groundwater and sediment microbial communities. J Hazard Mater, 2019, 364: 134-142. DOI:10.1016/j.jhazmat.2018.10.008
|
| [13] |
Dong H, Li L, Lu Y, et al. Integration of nanoscale zero-valent iron and functional anaerobic bacteria for groundwater remediation: a review. Environ Int, 2019, 124: 265-277. DOI:10.1016/j.envint.2019.01.030
|
| [14] |
邱轩, 石良. 微生物和含铁矿物之间的电子交换. 化学学报, 2017, 75(6): 583-593. Qiu X, Shi L. Electrical interplay between microorganisms and iron-bearing minerals. Acta Chimica Sin, 2017, 75(6): 583-593 (in Chinese). |
| [15] |
Orsetti S, Laskov C, Haderlein SB. Electron transfer between iron minerals and quinones: estimating the reduction potential of the Fe(Ⅱ)-goethite surface from AQDS speciation. Environ Sci Technol, 2013, 47(24): 14161-14168. DOI:10.1021/es403658g
|
| [16] |
刘娟, 李晓旭, 刘枫, 等. 铁氧化物-微生物界面电子传递的分子机制研究进展. 矿物岩石地球化学通报, 2018, 37(1): 39-47, 159. Liu J, Li XX, Liu F, et al. Research advantages on molecular mechanisms of interfacial electron transfer between iron oxide and microbe. Bull Mineral Petrol Geochem, 2018, 37(1): 39-47, 159 (in Chinese). |
| [17] |
Zhang W, Li XM, Liu TX, et al. Enhanced nitrate reduction and current generation by Bacillus sp. in the presence of iron oxides. J Soils Sediments, 2012, 12(3): 354-365. DOI:10.1007/s11368-011-0460-2
|
| [18] |
Ni SQ, Ni J, Yang N, et al. Effect of magnetic nanoparticles on the performance of activated sludge treatment system. Bioresour Technol, 2013, 143: 555-561. DOI:10.1016/j.biortech.2013.06.041
|
| [19] |
乔楠, 张静, 张金榜, 等. 纳米Fe3O4负载好氧反硝化菌脱氮除磷性能. 化工进展, 2009, 28(11): 2058-2062. Qiao N, Zhang J, Zhang JB, et al. Nitrogen, phosphorus and COD removal characteristics of an aerobic denitrifying bacterial strain loaded on nano Fe3O4. Chem Ind Eng Prog, 2009, 28(11): 2058-2062 (in Chinese). |
| [20] |
水质无机阴离子的测定离子色谱法. HJ/T 84-2001. 2001-12-19 Water quality. Determination of inorganic anions. Ion chromatography method. HJ/T 84-2001. 2001-12-19 (in Chinese) |
| [21] |
水质铁的测定邻菲啰啉分光光度法. HJ/T 345-2007. 2007-03-10. Water quality. Determination of iron. phenanthroline spectrophotometry. HJ/T 345-2007. 2007-03-10 (in Chinese). |
| [22] |
黄河浪. 城市污水处理厂污泥中磺胺类抗生素降解技术研究. 环境科学与管理, 2017, 42(12): 74-77. Huang HL. Study on degradation technology of sulfonamides in sludge of municipal wastewater treatment plant. Environ Sci Manag, 2017, 42(12): 74-77 (in Chinese). DOI:10.3969/j.issn.1673-1212.2017.12.018 |
| [23] |
Jain A. Extracellular electron transfer mechanism in Shewanella loihica PV-4 biofilms formed at indium tin oxide and graphite electrodes. Int J Electrochem Sci, 2013, 8: 1778.
|
| [24] |
Dong GW, Chen YB, Yan ZY, et al. Recent advances in the roles of minerals for enhanced microbial extracellular electron transfer. Renew Sustain Energy Rev, 2020, 134: 110404. DOI:10.1016/j.rser.2020.110404
|
| [25] |
董子阳, 胡佳杰, 胡宝兰. 微生物铁载体转运调控机制及其在环境污染修复中的应用. 生物工程学报, 2019, 35(11): 2189-2200. Dong ZY, Hu JJ, Hu BL. Regulation of microbial siderophore transport and its application in environmental remediation. Chin J Biotechnol, 2019, 35(11): 2189-2200 (in Chinese). |
| [26] |
Berks BC, Ferguson SJ, Moir JW, et al. Enzymes and associated electron transport systems that catalyse the respiratory reduction of nitrogen oxides and oxyanions. Biochim Biophys Acta, 1995, 1232(3): 97-173. DOI:10.1016/0005-2728(95)00092-5
|
| [27] |
Wu L, Zhu G, Zhang X, et al. Silver nanoparticles inhibit denitrification by altering the viability and metabolic activity of Pseudomonas stutzeri. Sci Total Environ, 2020, 706: 135711. DOI:10.1016/j.scitotenv.2019.135711
|
| [28] |
Chen J, Strous M. Denitrification and aerobic respiration, hybrid electron transport chains and co-evolution. Biochim Biophys Acta, 2013, 1827(2): 136-144. DOI:10.1016/j.bbabio.2012.10.002
|
| [29] |
Chen H, Zhao X, Cheng Y, et al. Iron robustly stimulates simultaneous nitrification and denitrification under aerobic conditions. Environ Sci Technol, 2018, 52(3): 1404-1412. DOI:10.1021/acs.est.7b04751
|
 2021, Vol. 37
2021, Vol. 37




