中国科学院微生物研究所、中国微生物学会主办
文章信息
- 刘聪洋, 王美妮, 张佳梦, 钱柚粉, 肖锟, 王仁女, 董伟, 潘涛
- Liu Congyang, Wang Meini, Zhang Jiameng, Qian Youfen, Xiao Kun, Wang Rennü, Dong Wei, Pan Tao
- 一株多环芳烃降解菌及其在多种强化体系中降解菲的潜力
- A polycyclic aromatic hydrocarbon degrading strain and its potential of degrading phenanthrene in various enhanced systems
- 生物工程学报, 2021, 37(10): 3696-3707
- Chinese Journal of Biotechnology, 2021, 37(10): 3696-3707
- 10.13345/j.cjb.210212
-
文章历史
- Received: March 15, 2021
- Accepted: June 17, 2021
2. 广东省微生物研究所 华南应用微生物国家重点实验室,广东 广州 510070
2. State Key Laboratory of Applied Microbiology Southern China, Guangdong Institute of Microbiology, Guangzhou 510070, Guangdong, China
多环芳烃是一类疏水性有机污染物,通常吸附于土壤颗粒罅隙内或与稠密的非水相液体(如杂酚油或煤焦油)混溶引入地下,是典型的持久性污染源[1]。由于具有致癌性、致突变性和致畸性,多环芳烃成为人们广泛关注的污染物[2]。微生物降解是处理多环芳烃污染的主要手段[3]。自然界中,能利用多环芳烃的细菌主要分布于变形菌门、拟杆菌门、厚壁菌门和放线菌门[4]。大多数关于多环芳烃生物降解的研究都与假单胞菌属、分枝杆菌属和希瓦氏菌属的细菌有关,例如恶臭假单胞菌Pseudomonas putida ATCC 17514[5]、分枝杆菌Mycobacterium sp. strain PYR-1[6]、希瓦氏菌Shewanella sp. 13-24[7]等。然而,莫拉氏菌属Moraxella中可以降解多环芳烃的菌株尚未见报道,即使有关环境有机污染物Moraxella属生物降解菌种的信息也十分有限。几株未鉴定到种的Moraxella sp.可以分别降解羟基化、甲氧基化和羧基化苯衍生物[8],苯二甲酸盐、水杨酸盐[9]和2, 6-二磺酸萘[10]等。其中,虽然Moraxella sp. ASL4能够以多环芳烃萘的衍生物2, 6-二磺酸萘和1, 6-二磺酸萘为底物,但是该菌对萘本身的降解活性低于5%[10]。
强疏水性及在环境中的赋存状态,导致了多环芳烃的生物利用度极低,造成了污染的持久性。因此,各种强化修复手段被发展以促进多环芳烃的快速降解[11]。其中,添加非水相溶剂形成的水-有机溶剂两相分配体系(Aqueous-organic two-phase systems,AOTS)[12-14]、添加化学或生物表面活性剂形成的胶束水溶液体系(Micellar aqueous system,MAS)[15-16]和添加浊点低于室温的非离子表面活性剂形成的浊点体系(Cloud point system,CPS)[17-18],得到广泛应用。然而,目前有相当数量降解多环芳烃的微生物菌种无法适应这些强化修复手段,因此难以实际应用。由低浓度表面活性剂Triton X-100形成的MAS中,一株假单胞菌和一株分枝杆菌对固体蒽的降解被抑制[19]。Pan等发现,相比CPS,MAS对鞘氨醇单胞菌Sphingomonas polyaromaticivorans降解菲产生了更强的细胞毒性[20]。因此,对于新发掘的多环芳烃生物降解微生物菌种资源,测试其对这些强化修复手段的适应性,是判断其应用潜力的主要依据。
本研究从石化污染土壤中分离出一株以菲为唯一碳源和能源的多环芳烃降解菌。通过生理生化、菌落与菌体形态和16S rRNA基因同源性分析,综合判断其分类。优化菲降解条件并通过代谢产物分析,判断其降解机理。最后,探索该菌株在不同降解体系中对菲的降解情况,分析其应用潜力,为后期菲污染土壤生物修复的工程实践提供理论和应用依据。
1 材料与方法 1.1 主要试剂菲,色谱纯,购自国药控股化学试剂有限公司;槐糖脂SL50,浓度500 g/L,纯度95%,购自青岛新科绿环生物科技有限公司;邻苯二甲酸二辛酯(Di(2-ethylhexyl)phthalate,DEHP)、Triton X-114及其他化学试剂皆为分析纯。
1.2 培养基LB液体培养基:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,加蒸馏水定容至1 L,调pH至7.0。LB固体培养基在此配方上添加20 g琼脂粉制成。LB培养基主要用于培养种子液和斜面菌种保藏。
无机盐培养基(Minimal salt medium,MSM):Na2HPO4 0.8 g,KH2PO4 0.2 g,(NH4)2SO4 1 g,(NH4)6Mo7O24·4H2O 0.001 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.1 g,FeCl3·3H2O 0.005 g,加蒸馏水定容至1 L,调节pH至7.2。在MSM中添加菲后用于生物降解实验。
1.3 土壤样品采集从江西省赣州市周边长期受石化品污染的土壤中采集样品,采集深度为5–10 cm。随机采集3个点,每点采集50 g土壤样品。样品用灭菌自封袋密封后,置于4 ℃冰箱保存。
1.4 菲降解菌分离取20 g混合土样加入到含有100 mL无菌水和少量灭菌玻璃珠的250 mL三角瓶中,在30 ℃、150 r/min的恒温摇床内振荡30 min后,静置一段时间,将上清液用4层无菌纱布过滤杂质。滤液经0.45 μm滤膜抽滤后,用少量无菌水将菌膜洗脱后,加入到菲起始浓度为100 mg/L的MSM中,30 ℃、150 r/min培养至溶液浑浊或变色。取10%培养液转移至新的MSM中,菲以100 mg/L为梯度逐渐提高到400 mg/L,富集培养完成。采用平板涂布、划线分离得到纯菌种。选择菲降解率最高的一株细菌,4 ℃冰箱保存。
1.5 菌种鉴定和保藏形态特征鉴定:将降解菌划线于含有菲的MSM固体平板上,30 ℃培养48 h后观察菌落形态特征。采用细菌革兰氏染色法判断该降解菌的革兰氏类型。利用扫描电子显微镜(Scanning electron microscope,SEM) 观察降解菌的显微结构。
生理生化鉴定:参考《伯杰细菌鉴定手册》[21]和《常见细菌系统鉴定手册》[22]鉴定降解菌的生理生化指标,包括糖发酵、ONPG测定、VP实验、吲哚实验、明胶水解、接触酶、氧化酶、精氨酸双水解酶、氨基酸脱羧酶、尿素酶、柠檬酸盐利用、产硫化氢、硝酸盐还原、反硝化和产氨测定。
16S rRNA基因序列测定与系统发育分析:采用细菌16S rRNA基因通用上下游引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′) 和1492R (5′-GGTTACCTTGTTACGACTT-3′) 扩增降解菌的16S rRNA基因。测序由生工生物工程(上海)股份有限公司完成,测序结果采用NCBI-BLAST进行同源分析,系统发育树采用MEGA-X软件构建。
1.6 菲降解条件的优化在水溶液体系中,测试降解菌对菲降解的最佳条件。分别以15 ℃、20 ℃、25 ℃、30 ℃、37 ℃、40 ℃、45 ℃作为温度实验组,以5.0、6.0、7.0、8.0、9.0、10.5、11.5作为pH实验组,以50、100、150、200、250、300 r/min作为摇床转速实验组,以100、200、400、600、800、1 200 mg/L的菲浓度作为底物耐受性实验组。以上各组实验,每组设置3个平行,对照组加菲但不接种降解菌,150 r/min摇床避光培养48 h后,检测细胞生长和菲的残留。
1.7 代谢产物分析在最佳菲降解条件下,分别取50 mL降解前期和降解后期的细胞培养液,混合后经二氯甲烷萃取、HCl (1︰5,V/V) 调酸、2 mol/L NaOH调碱、无水硫酸钠干燥以及硅烷化(BSTFA和TMCS,体积比:99/1) 等步骤后,利用气相色谱-质谱联用(Gas chromatography-mass spectrometry,GC-MS) 检测菲代谢产物。
1.8 降解体系在MSM基础上,添加不同试剂或材料后制成不同的降解体系。以下体系中,未加特殊说明时,菲的浓度皆为400 mg/L。
水溶液体系(Aqueous system,AS):取1个500 mL的已灭菌干燥三角瓶,在瓶底添加3 mL菲浓度为20 g/L的菲-二氯甲烷母液。缓慢转动三角瓶,使母液均匀分布在三角瓶瓶底。待二氯甲烷完全挥发,瓶底出现一层透明的菲晶体层。向体系中加入150 mL MSM,并接种降解菌,30 ℃、150 r/min避光培养。
AOTS:采用改进的恒定界面面积法进行设置[23]。具体为:取1个500 mL的三角瓶,装入150 mL MSM。取1根通心试管(上下平齐开口,管底部对称切割4个宽2 mm深4 mm的凹槽,以允许管内外液体交换),插入到液面以下。将0.1 g菲溶解到2 mL DEHP中后转移到试管内液面上方。接种后置于磁力搅拌器上,30 ℃避光培养。
MAS:在水溶液体系中,添加浓度为5个临界胶束浓度(Critical micelle concentration,CMC)的槐糖脂。接种降解菌后,30 ℃、150 r/min避光培养。
CPS:在水溶液体系中,加入20 g/L非离子表面活性剂Triton X-114形成浊点系统。降解试验在30 ℃、150 r/min避光条件下进行。
1.9 菲污染土壤修复采用泥浆-水体系(Slurry-aqueous system,SAS),利用CPF312修复多环芳烃菲污染土壤。取石化品污染土壤风干后过100目筛去除沙砾等杂质。取18 g土置于50 mL塑料离心管中,再加入0.4 mL 30 g/L菲二氯甲烷溶液母液。随后,利用漩涡混匀仪将离心管中的菲二氯甲烷溶液与土壤混匀。待二氯甲烷挥发完全后,将菲污染土壤避光保存7 d使菲老化。取15 g菲老化土壤加入到250 mL锥形瓶中,加入35 mL MSM培养基,土水比为3︰7。系统中,菲总浓度约为200 mg/L。CFP312菌种经LB培养基活化后,调OD600值为0.5后接种1 mL到SAS系统中。随后,将SAS降解体系置于30 ℃、150 r/min避光培养3 d。
1.10 取样、分析和检测方法对于以上4种降解体系,培养完成后,取1 mL水相培养液,置于1.5 mL塑料离心管中于8 000 r/min离心10 min后弃去上清液。细胞沉淀用蒸馏水洗涤3次后,用蒸馏水重悬,并采用双光束紫外可见分光光度计(760 CRT,上海精密科学仪器有限公司) 在600 nm处检测细胞的光密度值(Optical density,OD)。
AS中菲的检测:培养完成后,弃去上清液,用适量乙腈溶解瓶底吸附的残留菲,适当稀释后经0.45 μm滤膜过滤除菌后检测。
MAS中菲的检测:除需要考虑瓶底吸附的菲以外,还要考虑被胶束增溶到水相中菲的残留情况。培养完成时,取0.2 mL水相培养液加入0.8 mL乙腈于1.5 mL塑料离心管中,8 000 r/min离心10 min后取0.8 mL上清液用0.45 μm滤膜过滤除菌后检测残留菲。
AOTS中,菲主要存在于有机相中。因此,培养结束后,用移液枪吸取0.1 mL有机相溶解于0.9 mL乙腈中,过滤除菌后检测残留菲。
CPS中,瓶底的菲已全部被增溶到溶液中。培养结束时,单手握持并晃动三角瓶保持体系均匀混合,然后用移液枪吸取0.1 mL培养液溶解于0.9 mL乙腈中,过滤除菌后检测残留菲。
SAS中,上清液中菲的测定:将泥浆样品转移至1.5 mL离心管中,8 000 r/min离心10 min,取0.6 mL体积上清液和等体积乙腈混合,然后将混合液过0.22 μm有机滤膜后检测菲含量;土壤中菲的测定:将锥形瓶中泥浆样品装入50 mL离心管内,5 000 r/min、4 ℃离心后倒去上清液,将10 g土壤沉淀经冷冻干燥后,取3 g冻干土置于100 mL三角瓶中。随后,参考Reid等的方法[24],加入25 mL羟丙基-β-环糊精,150 r/min振荡20 h提取土壤中可生物利用的残留菲。取1.5 mL上清液过0.22 μm滤膜后用于检测菲的含量。
菲浓度利用Agilent 1260高效液相色谱(Agilent公司,美国) 进行分析。具体条件为:C18色谱柱(5 μm,150 mm×4.6 mm),紫外检测器,检测波长为254 nm,乙腈︰水(80︰20) 作为流动相,流速为1 mL/min,菲的保留时间为2.7 min。菲降解率的计算公式如下:
降解率(%)=(菲残留浓度/菲起始浓度)×100。
菲的降解速率如下表示:
降解速率(mg/(L·h))=(菲起始浓度–菲残留浓度)/时间。
GC-MS检测菲代谢产物采用Agilent 5977A-7890B气相色谱-质谱联用仪(Agilent公司,美国)。气相色谱条件:色谱柱HP-5 (30 m×0.25 mm,0.25 μm) 弹性石英毛细管柱。升温程序:初始温度60 ℃,以20 ℃/min升温至180 ℃,保持时间1 min,运行时间9 min;再以10 ℃/min升温至300 ℃;保持10 min,运行时间31 min;传输线温度280 ℃;不分流进样,进样量1 μL;载气为氦气(纯度99.999%),流量1 mL/min;溶剂延迟4.0 min。质谱条件:电子轰击(EI) 离子源;离子源温度230 ℃,四极杆温度150 ℃,质子扫描范围m/z (质荷比) 为40–500。
2 结果与分析 2.1 菲降解菌的分离经过富集培养、稀释涂布及划线纯化等步骤,分离出一株菲降解菌,命名为CFP312。该菌以多环芳烃菲为唯一碳源和能源。在30 ℃、pH 7.0、150 r/min条件下培养48 h,该菌可以将菲从400 mg/L降到64 mg/L,降解率为84 %。
在LB平板上,CFP312的菌落呈现白色略黄、圆形、个头较小、略显透明、表面光滑湿润、易于挑起、边缘齐整、有光泽。革兰氏阴性,不产芽孢(图 1A–B)。扫描电镜下观察到细胞为长杆状,菌体大小(0.6–0.8) μm×(2.2–2.7) μm,好氧(图 1C–D)。

|
| 图 1 CFP312菌落形态(A、B) 和菌体SEM图像(C、D) Fig. 1 Morphological observation of strain CFP312. (A–B) A photograph of the colony on LB medium. (C–D) A scanning electron micrograph of the strain. |
| |
CFP312菌株不能发酵d-葡萄糖、d-甘露醇、肌醇、d-山梨醇、l-鼠李糖、蔗糖、d-(+)-蜂蜜二糖、苦杏仁苷、l-阿拉伯糖、d-(+)-α-乳糖、d-木糖等11种糖类。柠檬酸盐利用、明胶水解、吲哚实验、VP实验、产硫化氢、产氨以及β-半乳糖苷酶、精氨酸双水解酶、赖氨酸脱羧酶、鸟氨酸脱羧酶和尿素酶等皆为阴性。接触酶和氧化酶阳性,能够还原硝酸盐为亚硝酸盐和将硝酸盐反硝化为氮气。
利用NCBI-BLAST对降解菌16S rRNA基因进行同源性分析时发现,CFP312与M. osloensis的同源性达到99%。说明该菌在分子系统分类学上应归属于Moraxella属。利用MEGA-X软件,采用NJ法构建CFP312的系统发育树如图 2所示。因此,结合该降解菌菌落形态、菌体大小和生理生化等特征,综合推断该菌株为Moraxella sp.。将CFP312的16S rRNA基因序列提交至GenBank数据库获取基因登录号为MK283753。随后,菌种已送至广东省微生物菌种保藏中心(GDMCC)保藏,保藏编号为GDMCC 60595。
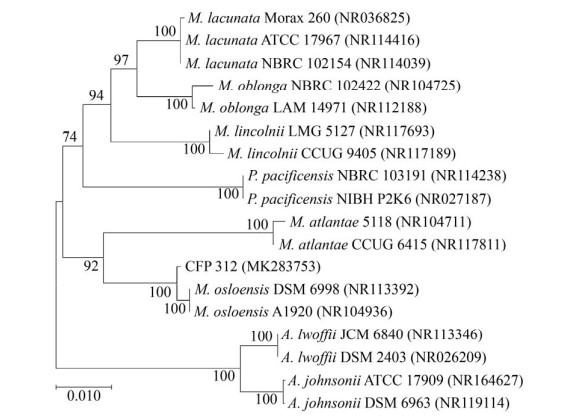
|
| 图 2 菌株CFP312基于16S rRNA基因序列的系统发育树 Fig. 2 Phylogenetic tree based on 16S rRNA genes of strain CFP312. |
| |
GC-MS分析结果如图 3所示,除底物菲外,还检测到了3, 4-二氢-3, 4-二羟基菲(Phenanthrene- 3, 4-dihydrodiol)。目前,有关菲的有氧代谢途径,最关键的第一步加氧反应有4种途径,分别由菲-1, 2-双加氧酶、菲-3, 4-双加氧酶、菲-9, 10-双加氧酶和菲-9, 10-单加氧酶催化完成[25]。据此推断,降解菌CFP312是通过在菲的3, 4位进行双加氧随后开环并进一步降解的(图 3)。这说明降解菌主要通过3, 4位双加氧途径降解菲并将其作为唯一的碳源和能源。

|
| 图 3 菲代谢产物的GC-MS检测及开环催化步骤 Fig. 3 GC-MS spectra of phenanthrene metabolites and the proposed ring-opening reaction. |
| |
温度对降解菌CFP312的影响如图 4A所示。该菌株对高温比较敏感,当培养温度超过40 ℃时,细胞生长和菲降解都受到明显的影响。相比之下,低温更适合该菌的生长。即使培养温度低至15 ℃,菲的降解率也能达到50%左右。这可能与降解菌来源于土壤有关。一般情况下,土壤温度相对较低。菌株对碱性pH的耐受性比较宽泛,pH 7.0–10.0之间能保持60%以上的菲降解率且细胞生长良好(图 4B)。酸性条件(pH 6.0) 下,细胞生长和菲降解明显下降。细胞生长和菲降解随着摇床转速升高而逐步增加,但总体来说,影响不大(图 4C)。这可能和三角瓶中培养基总量不多、溶氧消耗不大有关。菲浓度在100–600 mg/L,菲降解率超过80% (图 4D)。而菲浓度超过800 mg/L以后,48 h的降解率已降到50%以下,但菌体生长并未受到影响。这表明该降解菌对高浓度菲耐受性较好,若进一步延长培养时间,应该可以获得更高的降解率。综合以上结果,CFP312降解菲的最佳条件为:温度30 ℃、pH 7.0、摇床转速150 r/min、菲的底物浓度400 mg/L。

|
| 图 4 不同因素对菌株CFP312降解菲的影响 Fig. 4 Effects of different factors on the degradation of phenanthrene by strain CFP312. |
| |
在最佳条件下,降解菌在AS中的细胞生长曲线和菲的生物降解曲线如图 5所示。前24 h,细胞增殖很快并伴随着菲的快速生物降解。随后,菲的降解趋缓而细胞增殖也开始减慢。总体上,细胞生长和菲呈现负相关,表明该菌株利用菲进行生长。培养到60 h,菲在AS系统中的残留少于30 mg/L,降解率超过90%。在48 h和60 h时,菲的降解速率分别为2.00、2.14 mg/(L·h)。在表 1所列的菲降解菌株中,Mishra等报道刘志恒菌Zhihengliuella sp. ISTPL4在第3、7天时,对250 mg/L菲的降解速率分别达到了1.21、1.29 mg/(L·h)[26]。而假黄单胞菌Pseudoxanthomonas sp. DMVP2能将300 mg/L菲的降解速率提高到1.78 mg/(L·h)[27]。相比之下,菌株CFP312对无机盐培养基中菲的降解效率明显更高。

|
| 图 5 菌株CFP312的细胞生长和菲的降解曲线 Fig. 5 Cell growth and phenanthrene degradation profile strain of CFP312. |
| |
| Bacterial strains | Initial phenanthrene concentration (mg/L) | Degradation time (d) | Degradation rate (%) | Degradation speed (mg/(L·h)) | References |
| Mycobacterium sp. strain PYR-1 | 26.7 | 14 | 90 | 0.14 | [6] |
| Rhodococcus wratislaviensis strain 9 | 50 | 7 | 100 | 0.30 | [28] |
| Mycobacterium SCSH | 50 | 7 | 100 | 0.30 | [29] |
| Rhodococcus sp. strain p52 | 200 | 9 | 53 | 0.63 | [30] |
| Zhihengliuella sp. ISTPL4 | 250 | 3, 7 | 81, 87 | 1.21, 1.29 | [26] |
| Pseudoxanthomonas sp. DMVP2 | 300 | 5 | 100 | 1.78 | [27] |
| Moraxella sp. CFP312 | 400 | 2, 2.5 | 84, 90 | 2.00, 2.14 | This study |
如图 6所示,培养48 h后,与AS系统相比,AOTS中菲的降解和细胞生长都显示出明显的滞后。这可能与AOTS系统中有限的传质界面有关。细胞在MAS和CPS系统中的生长与在AS中没有显著的差别,说明MAS和CPS中表面活性剂的添加不会抑制菌株CFP312的生长。但菲在CPS中的降解率明显更低,这可能是因为部分菲被增溶到浊点系统中的凝聚层相后,不能被水相中的细胞摄取。总的来说,MAS中降解菌保持较高细胞增长的同时完成了菲的高效降解,表明降解菌具有利用表面活性剂强化其原位处理土壤菲污染的潜力。

|
| 图 6 不同体系中菌株CFP312对菲的生物降解 Fig. 6 Biodegradation of phenanthrene by strain CFP312 in different systems. |
| |
如图 7所示,培养3 d后,与对照相比,添加了菌株CFP312的SAS中,无论是上清液还是土壤中,可生物利用的菲明显残留更少。上清液中,可生物利用的菲从1.8 mg/L下降到0.6 mg/L左右;而在土壤中,可生物利用的菲从120 mg/L降低到50 mg/L左右。这充分说明,降解菌的添加强化了污染土壤中菲的降解。

|
| 图 7 泥浆水体系中菌株CFP312对菲污染土壤的生物修复 Fig. 7 Bioremediation of phenanthrene-contaminated soil by strain CFP312 in slurry-aqueous system. |
| |
Moraxella属可以降解多环芳烃的菌株尚未见报道。本研究从石化品污染土壤中分离到1株多环芳烃降解菌,经菌落和菌体形态观察(图 1)、生理生化检测和16S rRNA基因同源性分析(图 2) 鉴定属于莫拉氏菌Moraxella sp.。在30 ℃、pH 7.2、150 r/min条件下培养48 h,该菌可将400 mg/L菲降解84%以上。该菌株的发现,极大地拓宽了Moraxella属菌种在环境有机污染物治理的应用潜力。
GC-MS结果表明,降解菌CFP312有可能是利用菲-3, 4-双加氧酶将菲氧化,完成菲生物降解途径的第一个关键步骤(图 3)。细菌通过3, 4位双加氧降解菲在环境中是比较普遍的。如M. vanbaalenii PYR-1[31]、Pseudomonas sp. strain PP2[32]、Zhihengliuella sp. ISTPL4[26]等。但该途径在Moraxella属中,属首次发现。CFP312的适合生长条件为温度15–37 ℃ (最佳30 ℃) 和pH 7.0–10.0 (最佳7.0) (图 4A–B)。当环境温度超过40 ℃时,CFP312对菲的降解活性显著降低。对于Moraxella属的已知菌种,如M. osloensis SUB4,同样对高温敏感[33]。当培养温度超过40 ℃时,SUB4的脱色活性明显下降[33]。而当培养温度为25 ℃时,400 mg/L菲在48 h的降解率降低到了60%左右。这主要归因于以下事实:在高温时,细菌体内的降解酶系易失活;而在较低温度下,酶催化的反应变慢,导致细胞增殖减缓,随后菲的降解降低。菲浓度的增高并不影响降解菌CFP312的细胞生长(图 4C)。Patel等发现Pseudoxanthomonas sp. DMVP2即使在菲浓度高达4 000 mg/L时,依然代谢旺盛[27]。这可能与菲的饱和溶解度低(1.6 mg/L,25 ℃) 有关。无机盐培养基降解体系中的菲浓度虽高,但主要以晶体形式存在,无法直接接触培养基中的游离细胞,故不影响细胞的生长。
最佳生长条件下,菌株CFP312在48 h和60 h内,菲的降解速率分别为2.00、2.14 mg/(L·h) (图 5)。与已报道的诸多菌种相比(表 1),具有高效率的优势。污染物的快速降解,意味着菌种CFP312在环境多环芳烃菲污染治理中,有极大的应用潜力。菲作为一种疏水性强、半衰期长的难降解有机污染物,溶解于土壤水系中可供生物利用的部分是极少的[34]。通常情况下,此类污染物或吸附于土壤颗粒罅隙内、或被土壤中非水相溶剂所捕获,很难被微生物降解[35]。AOTS[36]、MAS[20, 37]和CPS[18]是3种常见的多环芳烃污染强化降解手段,旨在克服此类污染物的低生物利用度[38],应用广泛。
AS、AOTS、MAS、CPS这4种系统中,AS常用于分析降解菌对晶体菲的生物降解[6, 26–30],AOTS常用于分析降解菌对溶解于疏水性溶剂中菲的生物降解[13],MAS和CPS分别是强化多环芳烃原位和异位生物降解的两种手段[16, 20]。因此,检测降解菌CFP312是否能适应以上降解系统,是判断该菌是否具有广泛应用价值的重要前提。如图 6所示,降解菌CFP312在MAS和CPS系统中,细胞生长和菲降解相对较快,具有良好的适应性。这主要是因为在这两种系统中菲的表观溶解度增加加速了菲向细胞的传质[20]。在AOTS中,细胞生长和菲降解受到明显的影响。García-Junco等通过添加生物表面活性剂,强化了菲在AOTS系统中的生物降解[15, 23]。然而这一策略是否对降解菌CFP312有用,还有待实验验证。
在SAS中测试了CFP312对菲污染土壤的降解能力(图 7)。结果发现,接种CFP312后,污染土壤中可生物降解的菲明显降低。这说明降解菌具有实际处理多环芳烃污染土壤的能力。
多环芳烃在环境中污染范围广、影响大,其生物降解受到强疏水性和低生物利用度等限制。尽管目前已发掘大量可降解多环芳烃的微生物,但在各种强化修复手段的应用中效果难以估计。菌株CFP312不仅具有高效的菲降解能力,同时适应诸多多环芳烃强化修复方法,具有可观的应用潜力。
| [1] |
Alegbeleye OO, Opeolu BO, Jackson VA. Polycyclic aromatic hydrocarbons: a critical review of environmental occurrence and bioremediation. Environ Manage, 2017, 60(4): 758-783. DOI:10.1007/s00267-017-0896-2
|
| [2] |
Kuppusamy S, Thavamani P, Venkateswarlu K, et al. Remediation approaches for polycyclic aromatic hydrocarbons (PAHs) contaminated soils: technological constraints, emerging trends and future directions. Chemosphere, 2017, 168: 944-968. DOI:10.1016/j.chemosphere.2016.10.115
|
| [3] |
Peng RH, Xiong AS, Xue Y, et al. Microbial biodegradation of polyaromatic hydrocarbons. FEMS Microbiol Rev, 2008, 32(6): 927-955. DOI:10.1111/j.1574-6976.2008.00127.x
|
| [4] |
Mallick S, Chakraborty J, Dutta TK. Role of oxygenases in guiding diverse metabolic pathways in the bacterial degradation of low-molecular-weight polycyclic aromatic hydrocarbons: a review. Crit Rev Microbiol, 2011, 37(1): 64-90. DOI:10.3109/1040841X.2010.512268
|
| [5] |
Rodrigues AC, Wuertz S, Brito AG, et al. Fluorene and phenanthrene uptake by Pseudomonas putida ATCC 17514: kinetics and physiological aspects. Biotechnol Bioeng, 2005, 90(3): 281-289. DOI:10.1002/bit.20377
|
| [6] |
Moody JD, Freeman JP, Doerge DR, et al. Degradation of phenanthrene and anthracene by cell suspensions of Mycobacterium sp. strain PYR-1. Appl Environ Microbiol, 2001, 67(4): 1476-1483. DOI:10.1128/AEM.67.4.1476-1483.2001
|
| [7] |
Hilyard EJ, Jones-Meehan JM, Spargo BJ, et al. Enrichment, isolation, and phylogenetic identification of polycyclic aromatic hydrocarbon-degrading bacteria from Elizabeth River sediments. Appl Environ Microbiol, 2008, 74(4): 1176-1182. DOI:10.1128/AEM.01518-07
|
| [8] |
Vasudevan N, Paulraj LS. Plasmid-mediated degradation of hydroxylated, methoxylated, and carboxylated benzene derivatives in Moraxella sp.. Ann N Y Acad Sci, 1994, 721: 399-406. DOI:10.1111/j.1749-6632.1994.tb47411.x
|
| [9] |
Rani M, Prakash D, Sobti RC, et al. Plasmid-mediated degradation of o-phthalate and salicylate by a Moraxella sp.. Biochem Biophys Res Commun, 1996, 220(2): 377-381. DOI:10.1006/bbrc.1996.0413
|
| [10] |
Wittich RM, Rast HG, Knackmuss HJ. Degradation of naphthalene-2, 6-and naphthalene-1, 6-disulfonic acid by a Moraxella sp.. Appl Environ Microbiol, 1988, 54(7): 1842-1847. DOI:10.1128/aem.54.7.1842-1847.1988
|
| [11] |
Hwang HM, Hu X, Zhao X. Enhanced bioremediation of polycyclic aromatic hydrocarbons by environmentally friendly techniques. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2007, 25(4): 313-352. DOI:10.1080/10590500701704011
|
| [12] |
李力, 于波, 许平. 双液相系统中疏水化合物的微生物降解. 中国生物工程杂志, 2005, 25(S1): 107-111. Li L, Yu B, Xu P. Biodegradation of hydrophobic compound in two-liquid-phase system. China Biotechnol, 2005, 25(S1): 107-111 (in Chinese). |
| [13] |
Ortega-Calvo JJ, Alexander M. Roles of bacterial attachment and spontaneous partitioning in the biodegradation of naphthalene initially present in nonaqueous-phase liquids. Appl Environ Microbiol, 1994, 60(7): 2643-2646. DOI:10.1128/aem.60.7.2643-2646.1994
|
| [14] |
魏连爽, 谢文娟, 林爱军. 两相分配生物反应器治理高浓度有机污染研究进展. 应用与环境生物学报, 2012, 18(3): 511-517. Wei LS, Xie WJ, Lin AJ. Advance in researches on degradation of organic pollutants with high concentration in a two-phase partitioning bioreactor. Chin J Appl Environ Biol, 2012, 18(3): 511-517 (in Chinese). |
| [15] |
García-Junco M, Gomez-Lahoz C, Niqui-Arroyo JL, et al. Biosurfactant-and biodegradation-enhanced partitioning of polycyclic aromatic hydrocarbons from nonaqueous-phase liquids. Environ Sci Technol, 2003, 37(13): 2988-2996. DOI:10.1021/es020197q
|
| [16] |
Xiao K, Wang RN, Liu CY, et al. Influence of Triton X-100 and β-cyclodextrin on the bioavailability and biodegradation of crystalline phenanthrene covered with biofilms. Process Biochem, 2021, 102: 173-179. DOI:10.1016/j.procbio.2020.12.019
|
| [17] |
Pan T, Deng T, Zeng X, et al. Extractive biodegradation and bioavailability assessment of phenanthrene in the cloud point system by Sphingomonas polyaromaticivorans. Appl Microbiol Biotechnol, 2016, 100(1): 431-437. DOI:10.1007/s00253-015-6980-8
|
| [18] |
Pan T, Wang RN, Xiao K, et al. Continuous degradation of phenanthrene in cloud point system by reuse of Sphingomonas polyaromaticivorans cells. AMB Express, 2019, 9(1): 1-8. DOI:10.1186/s13568-018-0728-7
|
| [19] |
Chen P, Pickard MA, Gray MR. Surfactant inhibition of bacterial growth on solid anthracene. Biodegradation, 2000, 11(5): 341-347. DOI:10.1023/A:1011160004678
|
| [20] |
Pan T, Liu C, Zeng X, et al. Biotoxicity and bioavailability of hydrophobic organic compounds solubilized in nonionic surfactant micelle phase and cloud point system. Environ Sci Pollut Res Int, 2017, 24(17): 14795-14801. DOI:10.1007/s11356-017-9076-4
|
| [21] |
Balows A. Bergey's manual of determinative bacteriology. eighth edition. Am J Public Heal, 1975, 65(3): 315.
|
| [22] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001. Dong XZ, Cai MY. Identification of common bacterial systems manua. Beijing: Science Press, 2001 (in Chinese). |
| [23] |
García-Junco M, De Olmedo E, Ortega-Calvo JJ. Bioavailability of solid and non-aqueous phase liquid (NAPL)-dissolved phenanthrene to the biosurfactant-producing bacterium Pseudomonas aeruginosa 19SJ. Environ Microbiol, 2001, 3(9): 561-569. DOI:10.1046/j.1462-2920.2001.00223.x
|
| [24] |
Reid BJ, Stokes JD, Jones KC, et al. Nonexhaustive cyclodextrin-based extraction technique for the evaluation of PAH bioavailability. Environ Sci Technol, 2000, 34(15): 3174-3179. DOI:10.1021/es990946c
|
| [25] |
Ghosal D, Ghosh S, Dutta TK, et al. Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons (PAHs): a review. Front Microbiol, 2016, 7: 1369.
|
| [26] |
Mishra A, Rathour R, Singh R, et al. Degradation and detoxification of phenanthrene by actinobacterium Zhihengliuella sp. ISTPL4. Environ Sci Pollut Res, 2020, 27(22): 27256-27267. DOI:10.1007/s11356-019-05478-3
|
| [27] |
Patel V, Cheturvedula S, Madamwar D. Phenanthrene degradation by Pseudoxanthomonas sp. DMVP2 isolated from hydrocarbon contaminated sediment of Amlakhadi canal, Gujarat, India. J Hazard Mater, 2012,, 201/202: 43-51. DOI:10.1016/j.jhazmat.2011.11.002
|
| [28] |
Subashchandrabose SR, Venkateswarlu K, Naidu R, et al. Biodegradation of high-molecular weight PAHs by Rhodococcus wratislaviensis strain 9: overexpression of amidohydrolase induced by Pyrene and BaP. Sci Total Environ, 2019, 651(pt 1): 813-821.
|
| [29] |
Guo CL, Dang Z, Wong Y, et al. Biodegradation ability and dioxgenase genes of PAH-degrading Sphingomonas and Mycobacterium strains isolated from mangrove sediments. Int Biodeterior Biodegrad, 2010, 64(6): 419-426. DOI:10.1016/j.ibiod.2010.04.008
|
| [30] |
Yang HY, Jia RB, Chen B, et al. Degradation of recalcitrant aliphatic and aromatic hydrocarbons by a dioxin-degrader Rhodococcus sp. strain p52. Environ Sci Pollut Res, 2014, 21(18): 11086-11093. DOI:10.1007/s11356-014-3027-0
|
| [31] |
Stingley RL, Khan AA, Cerniglia CE. Molecular characterization of a phenanthrene degradation pathway in Mycobacterium vanbaalenii PYR-1. Biochem Biophys Res Commun, 2004, 322(1): 133-146. DOI:10.1016/j.bbrc.2004.07.089
|
| [32] |
Krishnan S, Prabhu Y, Phale PS. o-Phthalic acid, a dead-end product in one of the two pathways of phenanthrene degradation in Pseudomonas sp. strain PP2. Indian J Biochem Biophys, 2004, 41: 227232.
|
| [33] |
Karunya A, Rose C, Valli Nachiyar C. Biodegradation of the textile dye Mordant Black 17 (Calcon) by Moraxella osloensis isolated from textile effluent-contaminated site. World J Microbiol Biotechnol, 2014, 30(3): 915-924. DOI:10.1007/s11274-013-1509-8
|
| [34] |
Weissenfels WD, Klewer HJ, Langhoff J. Adsorption of polycyclic aromatic hydrocarbons (PAHs) by soil particles: influence on biodegradability and biotoxicity. Appl Microbiol Biotechnol, 1992, 36(5): 689-696.
|
| [35] |
Ortega-Calvo JJ, Birman I, Alexander M. Effect of varying the rate of partitioning of phenanthrene in nonaqueous-phase liquids on biodegradation in soil slurries. Environ Sci Technol, 1995, 29(9): 2222-2225. DOI:10.1021/es00009a011
|
| [36] |
Lee JY, Kwon TS, Lee YC. Removal of polycyclic aromatic hydrocarbons from contaminated soil in a two-phase partitioning bioreactor. Korean J Chem Eng, 2017, 34(9): 2418-2422. DOI:10.1007/s11814-017-0143-9
|
| [37] |
Posada-Baquero R, Grifoll M, Ortega-Calvo JJ. Rhamnolipid-enhanced solubilization and biodegradation of PAHs in soils after conventional bioremediation. Sci Total Environ, 2019, 668: 790-796. DOI:10.1016/j.scitotenv.2019.03.056
|
| [38] |
Leech C, Tighe MK, Pereg L, et al. Bioaccessibility constrains the co-composting bioremediation of field aged PAH contaminated soils. Int Biodeterior Biodegrad, 2020, 149: 104922. DOI:10.1016/j.ibiod.2020.104922
|
 2021, Vol. 37
2021, Vol. 37




