中国科学院微生物研究所、中国微生物学会主办
文章信息
- 和生辉, 潘志远, 韩妮, 葛燕, 常宇骁, 魏文婷, 刘月娇, 张倩文, 杨瑞馥, 毕玉晶
- He Shenghui, Pan Zhiyuan, Han Ni, Ge Yan, Chang Yuxiao, Wei Wenting, Liu Yuejiao, Zhang Qianwen, Yang Ruifu, Bi Yujing
- 利用培养组学技术分离鉴定体外降解胆固醇肠道细菌及其功能评价
- Isolation and identification of cholesterol-degrading intestinal bacteria by culturomics and evaluation of their functions
- 生物工程学报, 2021, 37(11): 3734-3744
- Chinese Journal of Biotechnology, 2021, 37(11): 3734-3744
- 10.13345/j.cjb.210336
-
文章历史
- Received: May 5, 2021
- Accepted: September 18, 2021
2. 解放军总医院卫勤训练中心,北京 100850
2. Medical Service Training Center of PLA General Hospital, Beijing 100850, China
随着人民生活水平的提升,高胆固醇血症患者逐年增加,过高的胆固醇水平已经成为诱发冠心病、脑卒中等心脑血管疾病的重要因素[1]。目前,药物治疗是国内外降低胆固醇的主流方式,但其费用较高,同时存在肌溶解、肝损伤等副作用[2]。20世纪70年代,Mann等调查发现经常饮用发酵乳的人群,其血清胆固醇水平不高,如非洲Maasai人、新生儿以及常饮酸乳的美国人等,由此推断益生菌具有降低人体血清胆固醇的作用[3-4]。目前,益生菌降胆固醇机制较为明确的主要有以下3种:一是菌体吸收,Gilliland等提出益生菌通过降解胆汁酸促进胆固醇的分解代谢进而降低胆固醇的观点,并通过一系列实验证实细菌对胆固醇有吸收作用[5];二是胆汁酸-胆固醇共沉淀,Klaver等提出共沉淀作用去除胆固醇,胆固醇的溶解度取决于胆汁酸的溶解度,而胆汁酸由结合态转化为游离态后容易吸附到膳食成分和菌体上,因其溶解度下降而使胆固醇共沉淀析出,但这一现象仅存在于pH小于5.0的情况,当环境中的pH大于7.0时,这些沉淀又可以重新溶解[6];三是细胞膜吸附作用,Dambekodi等在对双歧杆菌胆固醇降解能力研究时,发现细胞膜对于培养基中的胆固醇具有吸附作用[7]。由于体内“微生物群”对机体胆固醇代谢有着重要的影响,且益生菌制剂具有价格低、安全性好、收益长期等优点,使用益生菌降低胆固醇成为研究的热点[8]。近年来,测序技术的广泛应用证实了肠道菌群的多样性,但很多细菌尚未被分离和培养出来,培养组学的出现弥补了测序技术的不足,通过培养组学技术,科研人员能够培养出数百种与人类健康或疾病相关的细菌,使得深入研究肠道菌群与宿主之间的关系成为可能[9-10]。
胆汁酸在肝脏内以胆固醇为原料合成,在人体肠道内浓度为0.3–3.0 g/L,作为胆固醇代谢重要的排泄途径,体内三分之一的胆固醇分解代谢是通过胆汁酸合成实现的。胆汁酸合成后储存在胆囊内,受到刺激时分泌进入肠道,发挥乳化脂肪、促进胆固醇吸收、增强胰腺脂解作用以及信号传导等多种重要功能。胆汁酸通过肠肝循环被重新吸收,并在这一过程中,实现对机体胆固醇代谢的调节[11]。胆汁酸功能的发挥,离不开肠道细菌对其的修饰作用,反过来胆汁酸在肠道内形成胆汁酸压力,对于保持肠道菌群的正常区系有着重要作用[12-14]。
综合国内外的研究,降胆固醇益生菌研究主要集中在从乳制品及植物发酵食品中筛选得到的乳杆菌属,对于从健康人肠道筛选具备降胆固醇能力细菌及功能评价还少有报道[5, 15]。本研究通过利用培养组学的方法,以牛胆汁酸或人工混合胆汁酸(简称Mix胆汁酸) 作为条件,分离出了耐胆汁酸的肠道细菌,进而筛选出体外降胆固醇的优势菌株,并针对这些细菌进行体外降甘油三酯以及人工胃液耐受能力的评估,为将来进一步开发降胆固醇益生菌制品提供了重要的研究基础。
1 材料与方法 1.1 实验材料 1.1.1 实验样本选取健康成年人新鲜粪便,选取样本的标准为:(1) 年龄25–35周岁非孕期健康成年人,具有健康的生活方式;(2) 近一个月高脂饮食且身体质量指数(Body mass index,BMI) 指数长期位于20–23之间;(3) 半年内,未吃过抗菌药以及其他导致肠道微生态紊乱的药物;(4) 无抽烟、嗜酒等不良嗜好;(5) 无胃肠道肿瘤、息肉、炎症性肠病(Inflammatory bowel disease,IBD) 等消化系统疾病;(6) 无糖尿病、心脏病、高血压、恶性肿瘤等重大疾病。
1.1.2 实验试剂牛胆粉(G8281,北京索莱宝科技有限公司)、牛磺胆酸钠盐水合物(T4009,Sigma)、甘氨胆酸钠盐水合物(G7132,Sigma)、胆固醇(C8280,北京索莱宝科技有限公司)、植物油(市购)、盐酸(7647-01-0,国药集团化学试剂有限公司)、胃蛋白酶(P8160,北京索莱宝科技有限公司)、总胆固醇(Total cholesterol,TC) 含量检测试剂盒(BC1980,北京索莱宝科技有限公司)、甘油三酯(Total triglyceride,TG) 测试盒(A110-1-1,南京建成生物工程研究所),YCFA培养基配制试剂,MRS肉汤培养基(CM-1175,OXOID),MRS固体培养基(CM-1163,OXOID)。
1.1.3 实验仪器全温振荡培养箱(HZQ-F160,宿州培英实验设备有限公司)、厌氧培养箱(INVIVO2 400,英国Ruskinn公司)、超声细胞粉碎机(Scientz-IID,宁波新芝生物科技股份有限公司)、组织细胞破碎仪(Bullet Blender BBX24B,美国Next Advance) 等。
1.1.4 培养基YCFA及MRS胆汁酸培养基,YCFA及MRS胆固醇培养基,YCFA及MRS甘油三酯培养基[16-18]。
1.2 实验方法 1.2.1 耐胆汁酸肠道细菌筛选取新鲜粪便与无菌PBS混匀,静置取上清加入含脱脂绵羊血和瘤胃液的血培养瓶中。实验采用延长预培养方法进行培养,于第0、3、6、9、15、30、45、60天抽取混合菌液,转接到含牛胆汁酸或Mix胆汁酸的两种YCFA培养基进行后续分离培养及鉴定,直至第60天实验结束。
实验中分牛胆汁酸组和Mix胆汁酸组,各胆汁酸组又分为需氧组和厌氧组。其中,Mix胆汁酸组中胆汁酸成分按照甘氨胆酸钠盐水合物: 牛磺胆酸钠盐水合物3:1的比例进行混合制成,模拟人体内胆汁酸组成[19-20]。
1.2.2 体外降胆固醇能力评估取胆固醇0.1 g、吐温-80 1.0 mL、蔗糖酯0.1 g、冰乙酸5.0 mL,混合后经超声破碎,获得胆固醇乳化液[21-22]。将上述制备好的胆固醇乳化液按照2% (V/V) 的比例加入YCFA以及MRS培养基中,并按照0 g/L、0.3 g/L、3 g/L的浓度向其中添加牛胆汁酸,调整MRS胆固醇培养基pH为6.5±0.2,YCFA胆固醇培养基为8.0±0.2,培养基高压灭菌后冷却分装备用,下同。
以鼠李糖乳杆菌GG株(Lactobacillus rhamnosus GG,LGG) 为阳性对照,将耐胆汁酸肠道细菌,按照2×107 CFU的量接种于胆固醇培养基[22]。实验中采用总胆固醇(TC) 含量检测试剂盒测定发酵液中胆固醇含量,并且根据不同氧需求细菌生长周期的情况特点,需氧及兼性厌氧细菌一般需要12–24 h到达对数晚期或者平台期,厌氧菌需要3–5 d到达对数晚期或平台期,因此需氧细菌、兼性厌氧细菌以及LGG选择12 h及24 h两个时间节点,厌氧菌选择3 d和5 d两个时间节点测定。实验中每株细菌每种胆汁酸浓度设置3个平行,并重复实验。
1.2.3 体外降甘油三酯能力评价2%聚乙烯醇水溶液与植物油按照3:1的体积比进行混合后,使用高速组织细胞破碎仪将其充分混匀,得到植物油乳化液。将上述制备好的植物油乳化液按照3% (V/V) 的比例加入YCFA以及MRS培养基中,并按照0 g/L、0.3 g/L、3 g/L的浓度向其中添加牛胆汁酸,调整pH后灭菌备用[23]。
鉴于肠道细菌体外降甘油三酯实验相关文献报道较少,实验方法和评价方式初步成型,绝对厌氧培养条件受限,前期先以LGG作为阳性对照,只将需氧及兼性厌氧的6株胆固醇降解优势菌株——奇异变形菌Proteus mirabilis、斯氏普罗威登斯菌Providencia stuartii、普通变形菌Proteus vulgaris、潘氏变形菌Proteus penneri、污蝇解克杆菌Wohlfahrtiimonas chitiniclastica、雷氏普罗威登斯菌Providencia rettgeri按照2×107 CFU的量接种于甘油三酯培养基。实验中采用甘油三酯(TG) 测试盒测定发酵液中甘油三酯的含量,于12 h及24 h两个时间节点测定。实验中每株细菌每种胆汁酸浓度设置3个平行,并重复实验。
1.2.4 人工胃液耐受能力评估将P. mirabilis、P. stuartii、P. vulgaris、P. penneri、W. chitiniclastica、P. rettgeri及LGG菌株,按照2×107 CFU的量接种于pH分别为2.0、3.0、4.0的3种人工胃液[24],并于接种后的0 h、1 h、2 h、3 h四个时间节点滴板计数。以0 h菌落数为初始值,计算各时间节点细菌生存率。实验中每株细菌设置3个平行,并重复实验。
1.2.5 数据统计与分析体外降胆固醇能力评估、体外降甘油三酯能力评估及人工胃液耐受能力评估中的数据统计与分析采用GraphPad Prim 8软件中t检验,P < 0.05为有显著差异。
2 结果与分析 2.1 耐胆汁酸肠道细菌的筛选 2.1.1 耐胆汁酸肠道细菌分离情况实验分离耐胆汁酸肠道细菌275株,含1个界、5个门、7个纲、10个目、16个科、19个属、36个种,种水平分离详情见表 1。
| No. | Chinese names | Names |
| 1 | 大肠埃希氏菌 | Escherichia coli |
| 2 | 粪肠球菌 | Enterococcus faecalis |
| 3 | 加氏乳球菌 | Lactococcus garvieae |
| 4 | 链状双歧杆菌 | Bifidobacterium catenulatum |
| 5 | 粪便拟杆菌 | Bacteroides stercoris |
| 6 | 马赛拟杆菌 | Bacteroides massiliensis |
| 7 | 青春双歧杆菌 | Bifidobacterium adolescentis |
| 8 | 乳乳球菌 | Lactococcus lactis |
| 9 | 单形拟杆菌 | Bacteroides uniformis |
| 10 | 长双歧杆菌 | Bifidobacterium longum |
| 11 | 普通拟杆菌 | Bacteroides vulgatus |
| 12 | 双歧双歧杆菌 | Bifidobacterium bifidum |
| 13 | 迪氏副拟杆菌 | Parabacteroides distasonis |
| 14 | 奇异变形菌 | Proteus mirabilis |
| 15 | 斯氏普罗威登斯菌 | Providencia stuartii |
| 16 | 普通变形菌 | Proteus vulgaris |
| 17 | 潘氏变形菌 | Proteus penneri |
| 18 | 黏液真杆菌 | Eubacterium limosum |
| 19 | 缓慢爱格士氏菌 | Eggerthella lenta |
| 20 | 铅黄肠球菌 | Enterococcus casseliflavus |
| 21 | 污蝇解克杆菌 | Wohlfahrtiimonas chitiniclastica |
| 22 | 河流漫游球菌 | Vagococcus fluvialis |
| 23 | 泰国肠球菌 | Enterococcus thailandicus |
| 24 | 鹑鸡肠球菌 | Enterococcus gallinarum |
| 25 | 微小微单胞菌 | Parvimonas micra |
| 26 | 雷氏普罗威登斯菌 | Providencia rettgeri |
| 27 | 屎肠球菌 | Enterococcus faecium |
| 28 | 混料芽孢杆菌 | Bacillus farraginis |
| 29 | 产胞梭菌 | Clostridium sporogenes |
| 30 | 粪厌氧棒状菌 | Anaerostipes caccae |
| 31 | 病毒性蓖麻杆菌 | Butyricimonas virosa |
| 32 | 奇特龙梭菌 | Clostridium citroniae |
| 33 | 水獭漫游球菌 | Vagococcus lutrae |
| 34 | 死亡梭杆菌 | Fusobacterium mortiferum |
| 35 | 霍内克芽孢杆菌 | Bacillus horneckiae |
| 36 | 韩国泡菜大洋芽孢杆菌 | Oceanobacillus kimchii |
8个实验时间节点菌种分离结果见图 1。实验中的前3个时间节点,其时长为6 d,占总时长的1/10,能分离到的菌种数为29种,能够首次分离到的细菌为29种,整个实验分离细菌总数36种,占比80.56%。实验中后3个时间节点占总时长的1/2,能分离到的菌种数为11种,能够首次分离到的细菌为4种,占比11.11%。随着预培养时间的延长,培养基养分消耗、代谢废物的增多以及pH的变化等,对预培养中细菌的生存构成重大挑战,实验前期分离的菌种数目和首次分离到的菌种数都远远多于实验后期。
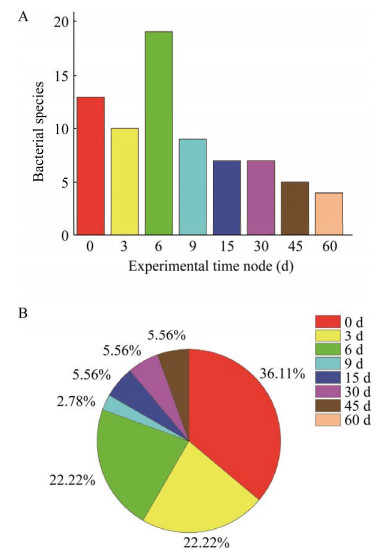
|
| 图 1 各实验时间节点菌种分离结果 Fig. 1 Isolation of strains at each experimental time point. The number of bile-tolerant bacteria (A) and the proportion of the total number of bile-tolerant bacteria (B) isolated at 8 experimental time points. |
| |
如图 2所示,按照分离种类(种水平),牛胆汁酸组分离获得24种细菌,其中5种为单独牛胆汁酸组分离获得的;Mix胆汁酸组分离获得31种细菌,12种为单独牛胆汁酸组分离获得的。按照需氧情况来划分,牛胆汁酸组分离到需氧菌12种,兼性厌氧菌3种,厌氧菌9种;Mix胆汁酸组分离到需氧菌10种,兼性厌氧菌4种,厌氧菌17种。通过增设Mix胆汁酸组,增加了耐胆汁酸肠道细菌的分离种类,在厌氧菌的分离方面尤为突出。

|
| 图 2 不同胆汁酸培养基菌种分离结果 Fig. 2 Isolation of bacteria from media containing different bile acids. The species of bacteria (A) and the species of aerobic, facultative and anaerobic bacteria (B) isolated from the two groups. |
| |
耐胆汁酸肠道细菌体外降胆固醇结果比较如图 3所示。对于15株需氧及兼性厌氧菌,12 h测定其胆固醇降解率,0 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有5种;0.3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有7种;3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有8种;3个胆汁酸组无差异的有1种。24 h测定其胆固醇降解率,0 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有1种;0.3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有0种;3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有6种;3个胆汁酸组无差异的有9种。结果表明,无论是12 h还是24 h,3 g/L胆汁酸组都表现出更好的胆固醇降解效果。
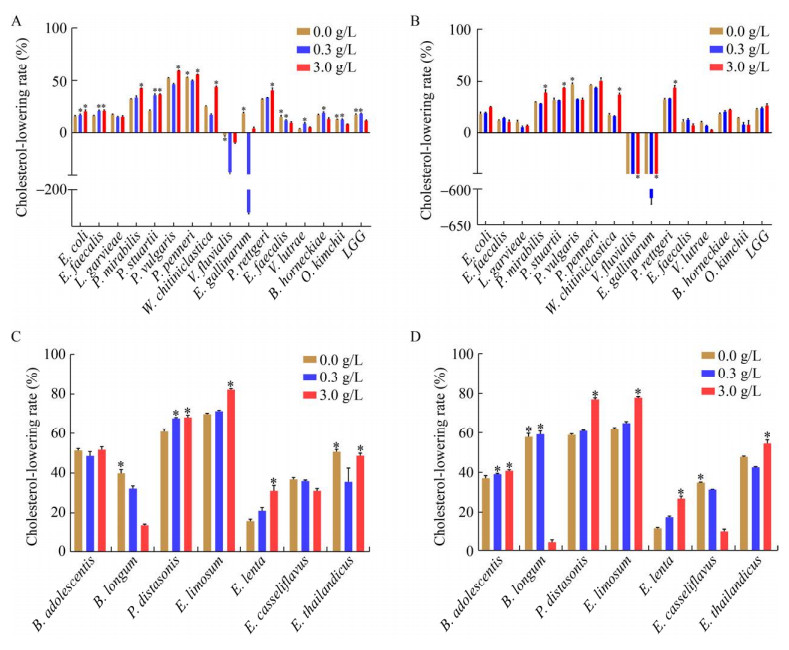
|
| 图 3 耐胆汁酸肠道细菌体外胆固醇降解率 Fig. 3 Cholesterol-lowering rate of bile-tolerant bacteria in vitro. A and B show the cholesterol-lowering rate of 15 strains (aerobic and facultative anaerobic) at 12 h and 24 h, respectively. C and D show cholesterol-lowering rate of 7 strains (anaerobic) in vitro in 3 days and 5 days, respectively. Among the three bile acid concentration groups for each bacterium, the group with the best cholesterol-lowering rate is marked with * above the histogram. |
| |
对于7株厌氧菌,3 d测定其胆固醇降解率,0 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有2种;0.3 g/L胆汁酸组降解率最优(P < 0.05)或者共同最优的有1种;3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有4种;3个胆汁酸组无差异的有1种。5 d测定其胆固醇降解率,0 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有2种;0.3 g/L胆汁酸组降解率最优(P < 0.05)或者共同最优的有2种;3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有5种;3个胆汁酸组无差异的有0种。对于厌氧菌而言,无论是3 d还是5 d,3 g/L胆汁酸组都表现出更好的胆固醇降解效果。
人体内胆汁酸浓度为0.3–3.0 g/L,并且体外降胆固醇实验中,多数细菌在3 g/L胆汁酸组降解率最优,因此,选择每株细菌3 g/L胆汁酸组,两个时间节点中胆固醇降解率较大者进行纵向比较,以LGG 24 h降解率为阳性对照,低于其胆固醇降解率80%的为胆固醇降解劣势菌株;达到其降解率80%–150%为效果近似菌株;达到其降解率150%及以上的为胆固醇降解优势菌株。根据上述标准筛选得到P. mirabilis、P. stuartii、P. vulgaris、P. penneri、W. chitiniclastica、P. rettgeri、B. adolescentis、P. distasonis、E. limosum、E. thailandicus共计10株细菌为降胆固醇优势菌株;E. coli、B. horneckiae、E. lenta、E. casseliflavus这4株细菌为效果近似菌株;E. faecalis、L. garvieae、V. fluvialis、E. faecium、E. gallinarum、V. lutrae、O. kimchii、B. longum 这8株细菌为降胆固醇劣势菌株。
2.3 6株降胆固醇优势菌株体外降甘油三酯能力评估6株降胆固醇优势菌株体外12 h及24 h甘油三酯降解率比较如图 4所示。在12 h测定体外甘油三酯降解率时,0 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有0种;0.3 g/L胆汁酸组降解率共同最优的有2种;3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有5种;3个胆汁酸组无差异的有1种。24 h测定体外甘油三酯降解率时,0 g/L胆汁酸组降解率最优(P < 0.05)有1种;0.3 g/L胆汁酸组降解率共同最优的有2种;3 g/L胆汁酸组降解率最优(P < 0.05) 或者共同最优的有4种;3个胆汁酸组无差异的有1种。结果表明,无论是12 h还是24 h,3 g/L胆汁酸组都表现出更好的甘油三酯降解效果。

|
| 图 4 6株降胆固醇优势细菌体外甘油三酯降解率 Fig. 4 Triglyceride-lowering rate of 6 dominant cholesterol-lowering bacteria in vitro. A and B show triglyceride-lowering rate of 6 dominant cholesterol- lowering bacteria in vitro for 12 hours and 24 hours, respectively. Among the three bile acid concentration groups for each bacterium, the group with the best triglyceride-lowering rate is marked with * above the histogram. |
| |
每株细菌选择3 g/L胆汁酸浓度组,两个测定时间点中的较大值进行纵向比较。结果显示,P. mirabilis、P. stuarti、P. vulgaris、P. penneri、W. chitiniclastica、P. rettgeri体外降甘油三酯效果均优于LGG (P < 0.05)。
2.4 6株降胆固醇优势菌株人工胃液耐受能力评价6株降胆固醇优势菌株人工胃液耐受能力评价如图 5所示,随着人工胃液作用时间的延长及pH值的下降,实验菌株的生存率明显下降。当pH值为2.0时,只有P. stuartii和P. rettgeri生长,3 h生存率分别为2.98%±0.75%和5.00%±0.99%,虽然高于其他菌株,但由于其较低的生存率,评价的意义不大。当pH值为3.0时,作用1 h,P. penneri、W. chitiniclastica、P. rettgeri生存率与LGG相同,其余3株细菌生存率低于LGG;作用2 h,P. penneri和W. chitiniclastica生存率高于LGG,其余菌株均低于LGG;作用3 h,6株菌株的生存率均低于LGG。当pH值为4.0时,各菌株生存率随时间变化如图 5C所示,作用1 h,P. mirabilis生存率与LGG相同,其他菌株均高于LGG;作用2 h,P. mirabilis生存率与LGG相同,其他菌株均高于阳性对照;作用3 h,P. mirabilis、P. vulgaris生存率低于LGG,其他细菌与LGG生存率相同。
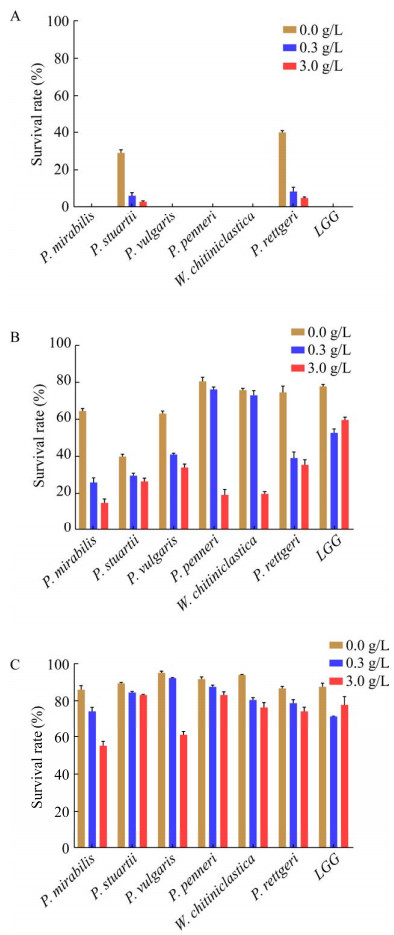
|
| 图 5 6株降胆固醇优势细菌人工胃液耐受力 Fig. 5 The artificial gastric juice tolerance of 6 dominant cholesterol-lowering bacteria in artificial gastric juice with pH 2.0 (A), pH 3.0 (B), and pH 4.0 (C) at 1 h, 2 h and 3 h. |
| |
近年来,关于利用哺乳动物肠道微生物与结合胆汁酸盐的相互作用来降低血清中的胆固醇成为研究的热点。肠道微生物对胆固醇代谢的调控主要是通过胆盐水解酶(Bile salt hydrolase,BSH) 水解结合胆汁酸来实现的。BSH能够催化牛磺酸或甘氨酸与甾醇基础的胆汁酸之间的氨基骨架水解,将其由结合态变为游离态,这是肠道微生物对胆汁酸进行其他修饰的基础。胆汁酸转变为游离态,其微生物毒性和溶解性下降,一方面促进游离胆汁酸共沉淀的发生;另一方面粪便胆汁酸排出增加,体内胆汁酸含量的减少;再者胆固醇胶束的形成受到制约,影响食物中胆固醇的吸收。已有实验证明,口服含活性胆盐水解酶的乳酸菌可以在动物体内降低血清胆固醇水平[25]。
活性BSH已经在乳酸菌Lactobacillus、双歧杆菌Bifidobacterium、肠球菌Enterococcus、梭菌Clostridium以及类菌体Bacteroides等细菌中被发现,而在生活环境缺乏胆盐的细菌中尚未发现具有活性BSH的菌株。BSH存在明显的种属特异性,这是由于胆盐水解酶基因bsh编码区的调节在各个种属之间是有所差异,导致BSH酶的大小、亚基组成、最适pH值、底物特性及动力学性质等方面变化较大。相关文献报道,基于系统发育树,BSH分为8种类型,并且人体肠道菌群中BSH的相对丰度与性别、年龄以及体重之间的相关性较弱,但与地理环境之间的关系相当密切[26]。不同类型BSH对于不同种类结合胆汁酸的水解能力不同,但绝大多数对甘氨酸结合型胆汁酸的水解能力要强于牛磺酸结合型胆汁酸。通过调查研究,我们还发现,有些菌株如植物乳杆菌存在4种类型BSH,同时存在多个同源bsh基因对于研究bsh基因功能具有重要意义[26]。
本研究以健康人体粪便为样本,创新性地利用牛胆汁酸和Mix胆汁酸两种筛选条件,体外模拟人胆汁酸环境,大大增加了耐胆汁酸肠道细菌的发现和分离,为进一步筛选降胆固醇细菌提供了更多的测试目标。
体外降胆固醇实验中的所有细菌均为筛选得到的耐胆汁酸肠道细菌,这些细菌对胆汁酸有良好的耐受力,部分细菌能够利用胆汁酸,促进其对胆固醇及甘油三酯的吸收和利用,因此,大多数细菌3 g/L胆汁酸组的降解率最优。通过以3 g/L胆汁酸浓度为条件,成功筛选到降胆固醇优势菌株。
对于部分降胆固醇优势菌株进行体外降甘油三酯能力评价,全部细菌3 g/L胆汁酸组的甘油三酯降解率最优,考虑其机理同体外胆固醇降解实验,进行实验的6株细菌体外降甘油三酯效果均优于阳性对照LGG。随后对其进行人工胃液耐受能力评价,结果表明,人工胃液pH越低,作用时间越长,细菌的生存率越低,并且随着pH值越低,作用相同时间,细菌生存率下降越明显。人工胃液中的盐酸、胃蛋白酶对细菌具有杀伤作用,因此随着pH值的下降和人工胃液作用时间的延长,细菌的生存率下降。另外,由于这些实验菌株分离于正常人肠道弱碱性环境,并且用于培养分离这些细菌的YCFA培养基也为弱碱性[18],因此相同作用时间下,6株细菌在pH 4.0的人工胃液中生存率要高于pH 3.0人工胃液,在pH 3.0的人工胃液中生存率要高于在pH 2.0中。
总体来说,本研究通过利用培养组学的技术,成功筛选出了耐胆汁酸肠道细菌。因地制宜,根据耐胆汁酸菌种库细菌的生长特点,建立了一套适合本研究对象的筛选降胆固醇肠道细菌的方案,筛选出了P. mirabilis、P. stuartii、P. vulgaris、P. penneri、W. chitiniclastica、P. rettgeri、B. adolescentis、P. distasonis、E. limosum、E. thailandicus共计10株降胆固醇优势菌株,并针对其中6株——P. mirabilis、P. stuarti、P. vulgaris、P. penneri、W. chitiniclastica、P. rettgeri进行体外降甘油三酯能力以及人工胃液耐受能力进行评估,为将来进一步开发降胆固醇益生菌制品提供了研究基础。鉴于目前关于人肠道细菌降胆固醇的研究报道较少,且本研究中所有数据均来自体外实验,所以,实验中筛选出的降胆固醇优势菌株的体内降胆固醇效果及临床意义有待进一步研究和考证。
| [1] |
Burnett JR, Hooper AJ, Hegele RA. Remnant cholesterol and atherosclerotic cardiovascular disease risk. J Am Coll Cardiol, 2020, 76(23): 2736-2739. DOI:10.1016/j.jacc.2020.10.029
|
| [2] |
Kashani A, Sallam T, Bheemreddy S, et al. Review of side-effect profile of combination ezetimibe and statin therapy in randomized clinical trials. Am J Cardiol, 2008, 101(11): 1606-1613. DOI:10.1016/j.amjcard.2008.01.041
|
| [3] |
Mann GV. Studies of a surfactant and cholesteremia in the Maasai. Am J Clin Nutr, 1974, 27(5): 464-469. DOI:10.1093/ajcn/27.5.464
|
| [4] |
Mann GV. A factor in yogurt which lowers cholesteremia in man. Atherosclerosis, 1977, 26(3): 335-340. DOI:10.1016/0021-9150(77)90086-7
|
| [5] |
Gilliland SE, Nelson CR, Maxwell C. Assimilation of cholesterol by Lactobacillus acidophilus. Appl Environ Microbiol, 1985, 49(2): 377-381. DOI:10.1128/aem.49.2.377-381.1985
|
| [6] |
Klaver FA, van der Meer R. The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile salt-deconjugating activity. Appl Environ Microbiol, 1993, 59(4): 1120-1124. DOI:10.1128/aem.59.4.1120-1124.1993
|
| [7] |
Dambekodi PC, Gilliland SE. Incorporation of cholesterol into the cellular membrane of Bifidobacterium longum. J Dairy Sci, 1998, 81(7): 1818-1824. DOI:10.3168/jds.S0022-0302(98)75751-0
|
| [8] |
刘俊兰, 刘瑶, 吕慧颖, 等. 人体共生菌及其抗菌分子研究进展. 生物工程学报, 2018, 34(8): 1316-1325. Liu JL, Liu Y, Lv HY, et al. Research progress in human symbiotic bacteria and its antibacterial molecules. Chin J Biotech, 2018, 34(8): 1316-1325 (in Chinese). |
| [9] |
Diakite A, Dubourg G, Dione N, et al. Optimization and standardization of the culturomics technique for human microbiome exploration. Sci Rep, 2020, 10(1): 9674. DOI:10.1038/s41598-020-66738-8
|
| [10] |
Lagier JC, Hugon P, Khelaifia S, et al. The rebirth of culture in microbiology through the example of culturomics to study human gut microbiota. Clin Microbiol Rev, 2015, 28(1): 237-264. DOI:10.1128/CMR.00014-14
|
| [11] |
Russell DW. The enzymes, regulation, and genetics of bile acid synthesis. Annu Rev Biochem, 2003, 72: 137-174. DOI:10.1146/annurev.biochem.72.121801.161712
|
| [12] |
Funabashi M, Grove TL, Wang M, et al. A metabolic pathway for bile acid dehydroxylation by the gut microbiome. Nature, 2020, 582(7813): 566-570. DOI:10.1038/s41586-020-2396-4
|
| [13] |
Zhan K, Zheng H, Li J, et al. Gut microbiota-bile acid crosstalk in diarrhea-irritable bowel syndrome. Biomed Res Int, 2020, 2020: 3828249.
|
| [14] |
Sayin SI, Wahlström A, Felin J, et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist. Cell Metab, 2013, 17(2): 225-235. DOI:10.1016/j.cmet.2013.01.003
|
| [15] |
Ishimwe N, Daliri EB, Lee BH, et al. The perspective on cholesterol-lowering mechanisms of probiotics. Mol Nutr Food Res, 2015, 59(1): 94-105. DOI:10.1002/mnfr.201400548
|
| [16] |
Naud S, Khelaifia S, Mbogning Fonkou MD, et al. Proof of concept of culturomics use of time of care. Front Cell Infect Microbiol, 2020, 10: 524769. DOI:10.3389/fcimb.2020.524769
|
| [17] |
Tidjani Alou M, Naud S, Khelaifia S, et al. State of the art in the culture of the human microbiota: new interests and strategies. Clin Microbiol Rev, 2020, 34(1): e00129-19.
|
| [18] |
Duncan SH, Hold GL, Harmsen HJM, et al. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov.. Int J Syst Evol Microbiol, 2002, 52(pt 6): 2141-2146.
|
| [19] |
Yang YX, Zhang JF. Bile acid metabolism and circadian rhythms. Am J Physiol Gastrointest Liver Physiol, 2020, 319(5): G549-G563. DOI:10.1152/ajpgi.00152.2020
|
| [20] |
Horáčková Š, Plocková M, Demnerová K. Importance of microbial defence systems to bile salts and mechanisms of serum cholesterol reduction. Biotechnol Adv, 2018, 36(3): 682-690. DOI:10.1016/j.biotechadv.2017.12.005
|
| [21] |
Kumar M, Nagpal R, Kumar R, et al. Cholesterol-lowering probiotics as potential biotherapeutics for metabolic diseases. Exp Diabetes Res, 2012, 2012: 902917.
|
| [22] |
Tomaro-Duchesneau C, Jones ML, Shah D, et al. Cholesterol assimilation by Lactobacillus probiotic bacteria: an in vitro investigation. Biomed Res Int, 2014, 2014: 380316.
|
| [23] |
Liu Y, Zhao F, Liu J, et al. Selection of cholesterol-lowering lactic acid bacteria and its effects on rats fed with high-cholesterol diet. Curr Microbiol, 2017, 74(5): 623-631. DOI:10.1007/s00284-017-1230-1
|
| [24] |
Sağlam H, Karahan AG. Plasmid stability of potential probiotic Lactobacillus plantarum strains in artificial gastric juice, at elevated temperature, and in the presence of novobiocin and acriflavine. Arch Microbiol, 2021, 203(1): 183-191. DOI:10.1007/s00203-020-02017-4
|
| [25] |
Damodharan K, Palaniyandi SA, Yang SH, et al. Functional probiotic characterization and in vivo cholesterol-lowering activity of Lactobacillus helveticus isolated from fermented cow milk. J Microbiol Biotechnol, 2016, 26(10): 1675-1686. DOI:10.4014/jmb.1603.03005
|
| [26] |
Song Z, Cai Y, Lao X, et al. Taxonomic profiling and populational patterns of bacterial bile salt hydrolase (BSH) genes based on worldwide human gut microbiome. Microbiome, 2019, 7(1): 9. DOI:10.1186/s40168-019-0628-3
|
 2021, Vol. 37
2021, Vol. 37




