中国科学院微生物研究所、中国微生物学会主办
文章信息
- 刘胡林, 徐兴然, 凌开建, 邹祥
- Liu Hulin, Xu Xingran, Ling Kaijian, Zou Xiang
- 阴道微生物组:种群特征与疾病干预治疗
- Vaginal microbiome: community characteristics and disease intervention
- 生物工程学报, 2021, 37(11): 3801-3811
- Chinese Journal of Biotechnology, 2021, 37(11): 3801-3811
- 10.13345/j.cjb.210204
-
文章历史
- Received: March 11, 2021
- Accepted: July 5, 2021
- Published: July 15, 2021
2. 陆军军医大学第一附属医院妇产科, 重庆 400038
2. Department of Obstetrics and Gynecology, The first Affiliates Hospital of Army Military Medical University, Chongqing 400038, China
微生物组(Microbiome) 是指在特定身体部位或环境中存在的微生物的集合[1]。人体内栖息着大量的微生物,这些微生物共享我们的身体空间,是影响人类健康的重要因素。女性阴道是微生物在人体上的重要栖居地。据世界卫生组织(World Health Organization,WHO) 数据估计,中国每年有超过2亿妇女饱受生殖道感染相关疾病的困扰[2]。生殖道感染治疗不及时将导致更严重的妇科疾病,如阴道炎、早产、妇科肿瘤等。目前,国内外学者普遍认为,生殖道感染的发生与阴道菌群失调有关。因此,准确解析女性阴道微生物组的种群特征,理解菌落相互作用以及菌群-宿主相互作用,对于降低患病风险和疾病的精准治疗具有重要意义。
近年来,微生物组测序技术正在加快对人体微生物组的了解,对人体微生物组正由描述性研究逐渐转向微生物组精准解析、宿主靶向调控以及合成微生物组等深层次展开,目前相关研究表明了许多疾病如神经系统疾病、慢性代谢性疾病、自身免疫性疾病等与人体微生物组存在着联系[3]。与人体肠道以及口腔微生物组研究相比,女性阴道微生物组研究相对较少且不全面。因此,本文综述了阴道微生物组学与生殖道疾病发生、进展和治疗的最新进展,同时对阴道菌群干预调控、体外微生物组培养以及合成微生物组学进行了展望,介绍了阴道微生物组研究的新方向。
1 阴道微生物组阴道微生物组是指寄居于女性阴道的微生物群,包括细菌、病毒和真菌等。最早,阴道菌群是通过光学显微镜和培养的方法进行研究的,目前通过分子技术工具(如基因组测序等) 能检测到更多的以前“不可培养”的物种。Diop等对目前PubMed/MEDLINE数据库中报道在人阴道中分离或基于分子手段发现的581种细菌进行了分类,发现它们分布在10个门,主要是放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes) 和变形杆菌门(Proteobacteria),分为96个不同的科、206个不同的属[4]。除细菌外,其他微生物如真菌导致的疾病也十分常见,尽管相比于细菌其种类较少。已经发现的真菌分布在3个门,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycete)和卵菌门(Oomycete)。常见的代表菌包括念珠菌Candida、曲霉Aspergillus等[5-6]。在这些微生物中(表 1),大量微生物还“未被培养”,只有少部分细菌/真菌是同时基于培养和分子手段发现的,需要新的培养策略来培养在人体阴道中检测到的“未培养”微生物,而阴道中新物种的发现也需要培养技术与分子技术的结合。
| Phylum | Family | |
| Bacteria | Firmicutes | Lactobacillaceae, Streptococcaceae |
| Proteobacteria | Enterobacteriaceae, Pseudomonadaceae | |
| Actinobacteria | Corynebacteriaceae, Actinomycetaceae | |
| Bacteroidete | Prevotellaceae, Bacteroidaceae | |
| Fungi | Ascomycota | Cryptacoccaceae, Arthrodermataceae |
| Basidiomycete | Malasseziaceae | |
| Oomycete | Pythiaceae |
阴道微生物群组成具有个体差异,取决于宿主年龄、种族、生理周期、激素波动、性行为,以及益生菌、抗生素等药物的使用,呈现出一种复杂而动态的菌群特征[7-10]。根据育龄妇女阴道细菌种类的多样性和组成,这些独特的微生物群落状态(Community state type,CST) 已分为5种主要类型[11],其中4个CST由乳杆菌(Lactobacillus,LAB) 控制,即卷曲乳杆菌Lactobacillus crispatus (CST-Ⅰ)、格氏乳杆菌Lactobacillus gasseri (CST-Ⅱ)、惰性乳杆菌Lactobacillus iners (CST-Ⅲ) 或詹氏乳杆菌Lactobacillus jensenii (CST-Ⅳ)。而CST-Ⅳ不含大量的乳酸杆菌,由多种严格以及兼性厌氧菌组成,在临床上多表现为细菌性阴道病。
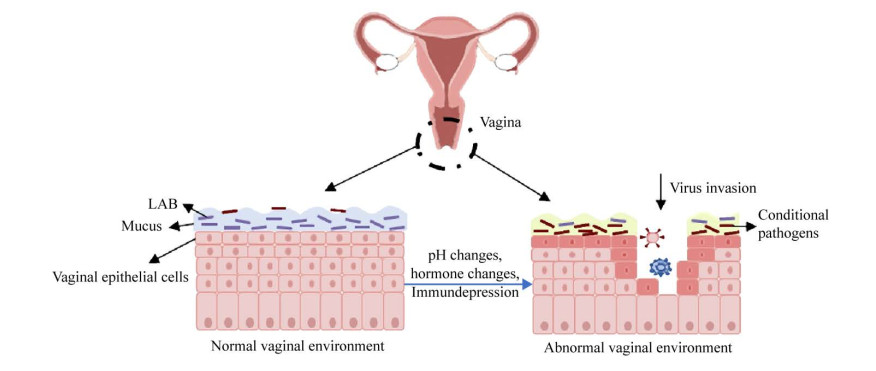
2 阴道微生物组对疾病发生、进展的影响大多数女性阴道微生物群组成以乳酸菌属为主,这类细菌可以主动或被动利用上皮细胞中丰富的糖原产生乳酸,使阴道内pH维持在4.0左右,以防止其他不耐酸的致病菌的繁殖。此外,乳杆菌产生的过氧化氢(H2O2) 和其他抑菌物质如细菌素等,也对其他微生物产生抑制作用,同时,乳杆菌还通过竞争排斥机制阻止其他微生物对上皮细胞的吸附成膜[12]。但是,宿主的某些不良生活习惯,如抗生素及激素药物的滥用、不当的冲洗、不注重贴身衣物卫生、不洁的性生活等,可能导致阴道环境内pH的改变和局部免疫功能下降,病原菌乘机优势生长,侵占粘膜上皮的优势地形,通过多种方式引起上皮细胞损伤和炎症,导致各种阴道炎症的发生,常见的如细菌性阴道炎(Bacterial vaginitis,BV)、外阴阴道假丝酵母菌病(Vulvovaginal candidiasis,VVC)、需氧性阴道炎(Aerobic vaginitis,AV) 等,反复的炎症可能进一步促进病毒感染,甚至导致肿瘤发生和进展(图 1)。
|
| 图 1 阴道微生物组变化导致疾病发生过程 Fig. 1 The process by which changes in the vaginal microbiome lead to disease. |
| |
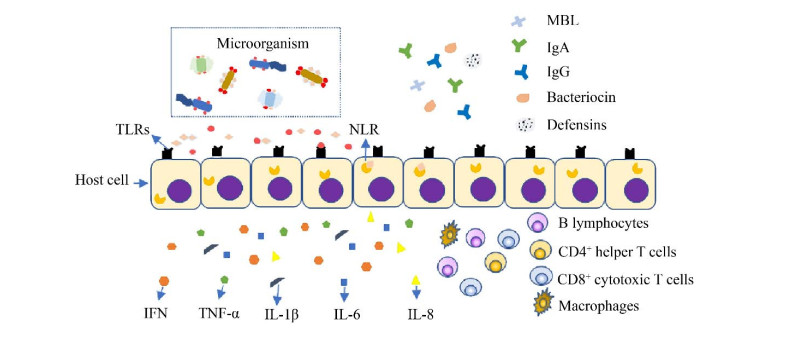
人类阴道菌群是一个复杂的微生物群落,研究表明,它可能参与阴道上皮细胞对致病性损伤的反应。人体微生物组与上皮系统间的相互作用,包括营养物质的交换和信号分子的调节等,可以保护宿主免受病原体的伤害。阴道内微生物可刺激模式受体如Toll样受体(Toll-like receptors,TLRs) 和Nod样受体(Nucleotide binding oligomerization domain like receptors,NLR),从而启动上皮细胞和先天性免疫细胞分泌细胞因子,启动细胞因子或趋化因子信号级联反应,导致白细胞介素、肿瘤坏死因子-α和干扰素的分泌,以招募或激活免疫细胞[13]。天然免疫应答中的各种防御因子,如甘露糖结合凝集素、免疫球蛋白A、免疫球蛋白G、细菌素和防御素等,能通过不同的机制达到清除病原体的目的,可以保护宿主免受病原体的伤害(图 2)[14-17]。此外,某些BV相关细菌菌株不引起明显的炎症反应,但是仍然可能通过介导细菌素和粘蛋白的表达以改变阴道免疫屏障因素[18],提示微生物菌群可能通过破坏免疫屏障、介导局部免疫而引起炎症。
当阴道环境的pH发生变化、激素水平波动和机体免疫低下时,往往菌群失调的风险会增加。常见的阴道炎如细菌性阴道炎、外阴阴道假丝酵母菌病和需氧性阴道炎等都表现出明显的阴道pH变化和菌群失调的特点(表 2)。其打破正常稳态呈现出病理状态的具体机制,包括微生物之间对营养的竞争、微生物间和微生物与宿主的信号转导、微生物生物膜形成、微生物代谢产物的影响等,都有待深入研究。
| Diseases | Flora characteristics | Metabolites/Biomarkers |
| BV | G. vaginalis, Prevotella, Mobiluncus↑ | Biogenic amines↑, sialidase (+) |
| AV | Escherichia coli, Streptococcus, Staphylococcus aureus↑ | Purulent discharge, sialidase (+), coagulase (+), β-glucuronidase (+) |
| VVC | Candida albicans↑ | Okara-like discharge, candidalysin(+) |
BV是阴道内常见的微生物感染疾病,特征是乳酸杆菌减少,阴道加德纳氏菌Gardnerella vaginalis、普氏菌Prevotella、拟杆菌Mobiluncus等厌氧菌增多。多项研究发现,BV与多种胺类、有机酸类、短链脂肪酸类、氨基酸类、含氮碱类和单糖类等代谢产物的变化有关[20-21]。对BV患者进行代谢组学分析,发现在BV病例中,蛋白质氨基酸减少,而胺的总量增加,这可能是氨基酸脱羧为生物胺的结果。这些生物胺(包括酪胺、三甲胺和尸胺) 的合成被认为是BV患者阴道内pH升高的原因,同时这些生物胺还对乳酸杆菌的生长造成不利的影响[22]。在BV患者的阴道分泌液中可以检测到较高浓度的各种短链有机酸,例如厌氧菌产生的乙酸盐、丁酸盐、丙酸盐和琥珀酸盐。这些短链有机酸可能参与了女性生殖道先天免疫细胞的招募和激活[23]。同时,某些厌氧菌如阴道加德纳氏菌分泌唾液酸酶降解粘液,可破坏上皮细胞的粘膜屏障,进一步增加了阴道感染的风险[22]。此外,与BV相关的微生物在感染过程中协同生成一种多微生物生物膜,与浮游细胞相比,生物膜对高5倍浓度的H2O2和高4–8倍浓度的乳酸有更强的耐受性[24],这可能表明生物膜的形成有助于微生物的存活,也可能是阴道炎反复难治的原因。
2.1.2 外阴阴道假丝酵母菌病VVC是继BV之后第二大常见的阴道感染疾病,70%–75%的妇女一生中会经历一次VVC,5%–10%的妇女会发生复发性VVC[26]。在超过85%的病例中,外阴念珠菌病主要由白色念珠菌Candida albicans引起,在阴道感染中起作用的白色念珠菌的毒力因子包括黏附、生物膜形成、菌丝形成和表型转换、细胞外水解酶产生[27-28]。此外,白色念珠菌粘膜感染过程中,会分泌一些蛋白酶如天冬氨酰蛋白酶(Saps) 使补体因子H和巨噬细胞上的补体受体CR3、CR4失活,从而逃避宿主免疫系统的清除[29]。但与传统认知不同的是,VVC患者阴道中的乳酸杆菌在数量上与正常人无异,甚至有些研究表明VVC妇女体内的乳酸杆菌数量略多于正常妇女[30]。在乳杆菌种类上,某些特定的卷曲乳杆菌L. crispatus和发酵乳杆菌Lactobacillus fermentum似乎具有抗真菌活性[31-32]。说明乳酸杆菌的数量优势或许并不能保护机体免受VVC,而其他因素包括乳酸杆菌种类、宿主局部免疫机制在VVC发病中可能更重要。
2.1.3 需氧性阴道炎AV患病率为7%–12%,在妊娠期较为常见,并且与各种不良的妊娠结局有关(早产:OR为3.06,95% CI为1.58–5.95)[33]。与BV不同,它伴有更严重的炎症,一些条件致病菌如大肠杆菌Escherichia coli、链球菌属Streptococcus和金黄色葡萄球菌Staphylococcus aureus会大量繁殖[34]。与BV相似,AV患者阴道中乳酸菌数量减少或缺失,并伴随分泌物增加,其化脓性分泌物可能与链球菌引起的阴道上皮细胞溶解有关[35]。相比于BV患者,患有AV的女性表现出局部免疫调节失衡的现象。在AV中,IL-1β、IL-6和IL-8等细胞因子增加[36],比BV表现出更强的炎症反应。
2.2 妇科肿瘤妇科肿瘤的发生率居高不下,根据2019年国家癌症中心公布的数据,女性生殖道三大癌症宫颈癌、子宫癌和卵巢癌已经是我国女性前十发病/死亡的癌种[37]。研究发现,造成各种生殖道肿瘤的危险因素是多样的,包括病毒感染、基因突变(如brca1/2这一抑癌基因)、肥胖等,而最近的一些研究表明,生殖道肿瘤的发生和进展与阴道微生物菌群变化也具有相关性(表 3)[36-40]。
| Diseases | Flora changes | References | |
| High-grade squamous intraepithelial lesion | ↑G. vaginalis, Lactobacillus acidophilus ↓L. crispatus, Lactobacillus taiwanensis, L. iners |
[38] | |
| Low-grade squamous intraepithelial lesion | ↑L. acidophilus, L. iners ↓L. crispatus |
[38] | |
| Cervical intraepithelial neoplasia | ↑Aspergillus vaginae, G. vaginalis | [39] | |
| Cervical cancer | ↑C. trachomatis | [40] | |
| Endometrial cancer | ↑A. vaginae. Porphyromonas sp. | [41] | |
| Ovarian cancer | ↑Proteobacteria, Firmicute | [40] |
人乳头瘤病毒(Human papillomavirus,HPV)的持续性感染被普遍认为是宫颈癌发生的关键,但是只有少数女性会有持续的HPV感染并进展到宫颈病变。Kovachev等[43]分析了32名患宫颈癌的病例,23名(71.9%) 患者患有阴道菌群障碍,表现为与BV相关的厌氧菌优势生长;在另一项研究中也证明宫颈癌的发生与BV及宫颈HPV感染具有相关性(OR:1.43,95% CI:1.11–1.84)[44]。研究表明,BV患者所呈现的CST-Ⅳ可能比CST-Ⅰ或CST-Ⅱ有更大的促炎反应[45-46],促炎介质不仅可以促进HPV持续性感染,并可在肿瘤微环境的范围内进一步激活下游信号传导途径,促进肿瘤形成进展[47]。在感染HPV的女性中普遍存在L. crispatus减少的情况,L. crispatus比例高的妇女往往不会检测到HPV[48];Motevaseli等用L. crispatus培养上清液处理Hela细胞后,检测结果显示处理细胞的自噬基因以及HPV E6癌基因的表达明显降低[49]。表明健康的微生物菌群及其代谢产物可能可以改善宫颈癌的发展,而菌群失调可能增加HPV感染的风险,进而增加宫颈癌的发生率。
相似地,通过对比卵巢癌患者或BRCA1基因突变患者与健康女性的宫颈阴道微生物图谱,发现卵巢癌或其危险因素(即年龄和brca基因的突变) 与低乳酸杆菌比例的阴道微生物菌群有显著相关性[50]。16S RNA测序结果显示卵巢癌组织中细菌多样性降低,变形菌门(Proteobacteria)/厚壁菌门(Firmicutes) 的比率在卵巢癌病人的癌组织中明显增加。此外,一些特殊的物种可能与肿瘤发展有关。多项研究发现卟啉单胞菌Porphyromonas somerae是子宫内膜癌患者最丰富的物种[51],虽然尚没有研究证明这些物种的丰度和比例变化在肿瘤发展中的具体作用,但是已有的研究提示我们或许生殖道肿瘤的进展与微生物尤其是微生物的种类和丰度变化相关。
3 阴道微生物组干预方法的现状菌群失调是指各种微生物在数量和质量上发生较大变化而超出正常范围的状态。人们已经逐渐意识到阴道菌群失调是导致炎症、感染和肿瘤发生的关键因素。为了治疗由阴道微生物失调引起的疾病,必须针对引起疾病的病原菌定殖或者乳酸杆菌缺少的微生物菌群进行干预,以恢复正常的阴道微环境。此前,临床医生采用的传统治疗办法主要针对病原菌进行抗菌干预,包括抗生素、带有清洁成分和抗菌成分的中药复方洗剂和化学洗剂等,但是它们都存在时效短、易复发的问题。近年来,益生菌在改善肠道微生物失调方面已受到关注,益生菌植入法及针对促进益生菌生长的营养补充方法也开始尝试用于阴道菌群紊乱的治疗。
3.1 抗菌干预对于阴道常见炎症,包括细菌性阴道炎、需氧性阴道炎、外阴阴道假丝酵母菌病等,多种抗生素作为成熟药物被批准临床上使用。BV的标准治疗包括口服或阴道内使用抗生素,治愈率约为80%[52]。然而,口服甲硝唑7 d治愈的BV患者,1年内BV复发率高达58%[53]。同样的,在抗生素治疗的VVC中也呈现出较高的复发率,并导致耐药菌株的增加[54]。此外,使用抗生素治疗可能引起进一步的菌群失调,抗生素的局部高浓度能够抑制一种或多种乳酸杆菌菌株,并对正常阴道菌群的平衡产生有害影响[55]。由于使用抗生素带来的复发率高、耐药性等的可能负面影响,迫切需要寻求新的治疗方案。
3.2 益生菌干预益生菌指在摄取足够数量后,对宿主健康有益的活性微生物,。已有大量的研究报道乳酸菌对维持阴道微生物菌群健康平衡的重要性。益生菌的搭配使用,能提高BV和VVC的治愈率,降低复发率[56-57]。事实上,尽管益生菌的市场和销售不断增加,但临床试验的结果并不一致,而且单一使用通常效果不佳。
此外,随着合成生物学的进步,针对特定疾病进行基因修饰获得的工程益生菌也日益发展,有望成为下一代生物治疗药物。而乳酸杆菌作为阴道内益生菌,也成为阴道内粘膜给药的候选载体。通过遗传改造阴道内定殖的乳酸杆菌,可以使其在阴道内定殖的同时分泌抗病毒肽[58-60],而不会引起细胞毒性或促炎细胞因子。然而,目前仅有5个工程益生菌进入临床试验阶段,且这些益生菌都是针对肠道,尚无阴道用的工程益生菌进入临床试验阶段。
3.3 营养干预在围产期、月经初潮和更年期,雌激素水平的增加导致大量的糖原沉积在阴道上皮。在此期间,上皮细胞本身和/或阴道菌群对糖原进行厌氧代谢,是阴道内共生菌的营养来源[61]。临床上常常以补充雌激素治疗老年性阴道炎,研究表明,更年期激素替代疗法可以维持阴道微生物菌群的物种多样性,并缓解外阴阴道萎缩的症状[62]。但是雌激素补充不当可能导致白色念珠菌大量繁殖,容易诱发VVC,且有研究表明雌激素过度补充会刺激子宫内膜增生,增加子宫内膜癌的发生率[63]。除使用雌激素间接的营养干预外,一些商用的阴道制剂(如Canesbalance®) 也以直接补充糖原来促进乳酸菌生长以恢复正常菌群状态,虽然其效果还未得到临床指南的充分评估,但其具有较好的依从性[64]。
益生元是不可消化的食物成分,能被有益细菌发酵产生短链脂肪酸,因此可以选择性地刺激某些有益细菌的生长,或者增强有益细菌的活性[65]。它们具有优化、维护和恢复阴道生态系统菌群的潜力[66]。目前,低聚果糖和低聚半乳糖已被用作肠道健康的益生元[67],近年来,越来越多的研究证实了蔗糖、乳果糖、低聚果糖等可以在改善或恢复阴道正常菌群中发挥积极的作用[68-70],它们被认为可通过促进优势微生物乳酸杆菌生长和乳酸产生以恢复pH范围,维持正常的阴道微环境,但是益生元目前在临床的使用还甚少。
4 体外微生物组培养技术基于某一种或某一类病原菌的抗菌治疗目前仍然是现阶段临床治疗的首选,但是其带来的耐药性和高复发率等问题有待解决,而基于阴道中乳酸杆菌的补充和营养干预的方法似乎是有潜力的选择。而现有研究结果显示,目前筛选出的益生菌和益生元在体内体外的研究常常表现出不一致的结果,临床上的结果也常常不理想,说明人们对于阴道微生物组的认识还有待深入研究,在阴道微生物组干预方法的建立中缺少适合的体外评价模型。
在高通量测序技术问世之前,人们已经有关于部分病原菌与人体健康关系的研究,但是,由于技术的限制,这些研究缺乏将整个微生物组、整个动态环境考虑在内的能力。实际上,阴道微生物组失调是一个复杂的过程,不仅仅涉及某一单一菌种的增多或者减少,更涉及益生菌和病原菌、宿主之间的物质交换和信号传导等复杂过程。所以,基于体外微生物组培养技术,开展菌落互作、合成菌群等相关研究是未来重要的研究领域。
传统观念认为人体微生物组不可培养,但是近年来通过人工胃、人工肠、消化液和粘液的模拟,形成了一套完整的菌群体外生态模拟器,肠道微生物组培养有力地实现了不可培养的突破[71]。同样,阴道中存在与肠道类似的部分菌种,可以追溯至母体的继承[72]。阴道微生物组或许也可以通过体外生态模拟(传统观念认为不可) 实现。目前对于阴道微生物组的培养还报道甚少,1992年的一项研究发明了一种可以培养多种阴道中优势菌群的培养基,但是只停留在“可培养”的阶段[73]。近年,离体人类阴道粘膜培养系统被尝试用于阴道细菌群落培养,该系统被用于对健康无症状供体中收集的阴道细菌群落进行可控制、可复制定殖[74],但仍具有一定局限性,不能完全模拟体内复杂的阴道环境。笔者课题组也正在基于生物反应器培养技术,开展体外阴道微生物组的培养、体外群落互作等关键技术研究。
5 总结与展望人类微生物组计划已为寻找更加精准的疾病诊疗分子标记、实现个性化精准医疗打开窗口。尽管困扰女性的生殖道炎症、肿瘤、病毒感染等疾病的发病机理复杂多样,阴道微生物菌群失调已成为一个潜在的诊疗窗口。在现有高通量测序、高分辨率成像等技术支持下,人体微生物组复杂组成逐渐清晰。对于阴道微生物组而言,由于受到女性周期性节律变化的影响,阴道微环境相比于肠道、口腔的微生物组具有自身的特点,更容易受到外界干预、演变及失衡,也是造成反复性阴道炎症等疾病难以治愈的主要成因;此外阴道微生物组的物种主要基于分子测序手段等发现,还存在大量“未被培养”的微生物。因此,在特定阴道微环境中了解微生物组群落差异、演绎及菌株功能差异,建立定量化体外微生物组培养及精准解析技术,对认识理解阴道微生物组与疾病发生、宿主互作机制具有重要的理论基础;同时利用合成生物学思想,开展阴道微生物组群落干预、合成微生物组等关键技术的开发,建立合成微生物群落,实现个体化精准治疗方案,将有利于提升妇女健康医疗水平。
| [1] |
Lederberg J, McCray AT. 'Ome sweet' omics—a genealogical treasury of words. Scientist, 2001, 15(7): 8.
|
| [2] |
The world health report 2007: a safer future: global public health security in the 21st century[EB/OL]. [2021-7-2] https://www.who.int/whr/2007/whr07_en.pdf.
|
| [3] |
Althani AA, Marei HE, Hamdi WS, et al. Human microbiome and its association with health and diseases. J Cell Physiol, 2016, 231(8): 1688-1694. DOI:10.1002/jcp.25284
|
| [4] |
Diop K, Dufour JC, Levasseur A, et al. Exhaustive repertoire of human vaginal microbiota. Hum Microbiome J, 2019, 11: 100051. DOI:10.1016/j.humic.2018.11.002
|
| [5] |
Guo R, Zheng N, Lu H, et al. Increased diversity of fungal flora in the vagina of patients with recurrent vaginal candidiasis and allergic rhinitis. Microb Ecol, 2012, 64(4): 918-927. DOI:10.1007/s00248-012-0084-0
|
| [6] |
Zheng NN, Guo XC, Lv W, et al. Characterization of the vaginal fungal flora in pregnant diabetic women by 18S rRNA sequencing. Eur J Clin Microbiol Infect Dis, 2013, 32(8): 1031-1040. DOI:10.1007/s10096-013-1847-3
|
| [7] |
Cauci S, Driussi S, De Santo D, et al. Prevalence of bacterial vaginosis and vaginal flora changes in peri- and postmenopausal women. J Clin Microbiol, 2002, 40(6): 2147-2152. DOI:10.1128/JCM.40.6.2147-2152.2002
|
| [8] |
Chaban B, Links MG, Jayaprakash TP, et al. Characterization of the vaginal microbiota of healthy Canadian women through the menstrual cycle. Microbiome, 2014, 2: 23. DOI:10.1186/2049-2618-2-23
|
| [9] |
Donders G, Bellen G, Janssens D, et al. Influence of contraceptive choice on vaginal bacterial and fungal microflora. Eur J Clin Microbiol Infect Dis, 2017, 36(1): 43-48. DOI:10.1007/s10096-016-2768-8
|
| [10] |
Schwebke JR, Richey CM, Weiss2 HL. Correlation of behaviors with microbiological changes in vaginal flora. J Infect Dis, 1999, 180(5): 1632-1636. DOI:10.1086/315065
|
| [11] |
Ravel J, Gajer P, Abdo Z, et al. Vaginal microbiome of reproductive-age women. Proc Natl Acad Sci USA, 2011, 108(Supplement 1): 4680-4687.
|
| [12] |
Miller EA, Beasley DE, Dunn RR, et al. Lactobacilli dominance and vaginal pH: why is the human vaginal microbiome unique?. Front Microbiol, 2016, 7: 1936.
|
| [13] |
Brotman RM, Ravel J, Bavoil PM, et al. Microbiome, sex hormones, and immune responses in the reproductive tract: challenges for vaccine development against sexually transmitted infections. Vaccine, 2014, 32(14): 1543-1552. DOI:10.1016/j.vaccine.2013.10.010
|
| [14] |
Wang YY, Kannan A, Nunn KL, et al. IgG in cervicovaginal mucus traps HSV and prevents vaginal herpes infections. Mucosal Immunol, 2014, 7(5): 1036-1044. DOI:10.1038/mi.2013.120
|
| [15] |
Cole AM, Cole AL. Antimicrobial polypeptides are key anti-HIV-1 effector molecules of cervicovaginal host defense. Am J Reproductive Immunol, 2008, 59(1): 27-34.
|
| [16] |
Mason CP, Tarr AW. Human lectins and their roles in viral infections. Mol Basel Switz, 2015, 20(2): 2229-2271.
|
| [17] |
Hazrati E, Galen B, Lu WY, et al. Human α- and β-defensins block multiple steps in herpes simplex virus infection. J Immunol, 2006, 177(12): 8658-8666. DOI:10.4049/jimmunol.177.12.8658
|
| [18] |
Doerflinger SY, Throop AL, Herbst-Kralovetz MM. Bacteria in the vaginal microbiome alter the innate immune response and barrier properties of the human vaginal epithelia in a species-specific manner. J Infect Dis, 2014, 209(12): 1989-1999. DOI:10.1093/infdis/jiu004
|
| [19] |
Villa P, Cipolla C, D'Ippolito S, et al. The interplay between immune system and microbiota in gynecological diseases: a narrative review. Eur Rev Med Pharmacol Sci, 2020, 24(10): 5676-5690.
|
| [20] |
Srinivasan S, Morgan MT, Fiedler TL, et al. Metabolic signatures of bacterial vaginosis. mBio, 2015, 6(2): e00204-00215.
|
| [21] |
Vitali B, Cruciani F, Picone G, et al. Vaginal microbiome and metabolome highlight specific signatures of bacterial vaginosis. Eur J Clin Microbiol Infect Dis, 2015, 34(12): 2367-2376. DOI:10.1007/s10096-015-2490-y
|
| [22] |
Borgogna J-LC. Examining the potential role of biogenic amines in vaginal microbial ecology and gynecological health[D]. Montana: Montana State University, 2019.
|
| [23] |
Vitali B, Cruciani F, Picone G, et al. Vaginal microbiome and metabolome highlight specific signatures of bacterial vaginosis. Eur J Clin Microbiol Infect Dis, 2015, 34(12): 2367-2376. DOI:10.1007/s10096-015-2490-y
|
| [24] |
Lewis WG, Robinson LS, Gilbert NM, et al. Degradation, foraging, and depletion of mucus sialoglycans by the vagina-adapted Actinobacterium Gardnerella vaginalis. J Biol Chem, 2013, 288(17): 12067-12079. DOI:10.1074/jbc.M113.453654
|
| [25] |
Jung HS, Ehlers MM, Lombaard H, et al. Etiology of bacterial vaginosis and polymicrobial biofilm formation. Crit Rev Microbiol, 2017, 43(6): 651-667. DOI:10.1080/1040841X.2017.1291579
|
| [26] |
Gonçalves B, Ferreira C, Alves CT, et al. Vulvovaginal candidiasis: epidemiology, microbiology and risk factors. Crit Rev Microbiol, 2016, 42(6): 905-927. DOI:10.3109/1040841X.2015.1091805
|
| [27] |
Moyes DL, Wilson D, Richardson JP, et al. Candidalysin is a fungal peptide toxin critical for mucosal infection. Nature, 2016, 532(7597): 64-68. DOI:10.1038/nature17625
|
| [28] |
De Bernardis F, Graziani S, Tirelli F, et al. Candida vaginitis: virulence, host response and vaccine prospects. Med Mycol, 2018, 56(suppl_1): 26-31. DOI:10.1093/mmy/myx139
|
| [29] |
Svoboda E, Schneider AE, Sándor N, et al. Secreted aspartic protease 2 of Candida albicans inactivates factor H and the macrophage factor H-receptors CR3 (CD11b/CD18) and CR4 (CD11c/CD18). Immunol Lett, 2015, 168(1): 13-21. DOI:10.1016/j.imlet.2015.08.009
|
| [30] |
Mijac VD, Dukić SV, Opavski NZ, et al. Hydrogen peroxide producing lactobacilli in women with vaginal infections. Eur J Obstet Gynecol Reprod Biol, 2006, 129(1): 69-76. DOI:10.1016/j.ejogrb.2005.11.036
|
| [31] |
Jang SJ, Lee K, Kwon B, et al. Vaginal Lactobacilli inhibit growth and hyphae formation of Candida albicans. Sci Rep, 2019, 9(1): 8121. DOI:10.1038/s41598-019-44579-4
|
| [32] |
Kang CH, Kim Y, Han SH, et al. In vitro probiotic properties of vaginal Lactobacillus fermentum MG901 and Lactobacillus plantarum MG989 against Candida albicans. Eur J Obstet Gynecol Reprod Biol, 2018, 228: 232-237. DOI:10.1016/j.ejogrb.2018.07.005
|
| [33] |
Han C, Li H, Han L, et al. Aerobic vaginitis in late pregnancy and outcomes of pregnancy. Eur J Clin Microbiol Infect Dis, 2019, 38(2): 233-239. DOI:10.1007/s10096-018-3416-2
|
| [34] |
Donders GGG, Bellen G, Grinceviciene S, et al. Aerobic vaginitis: no longer a stranger. Res Microbiol, 2017, 168(9/10): 845-858.
|
| [35] |
Tao Z, Zhang L, Zhang Q, et al. The pathogenesis of Streptococcus anginosus in aerobic vaginitis. Infect Drug Resist, 2019, 12: 3745-3754. DOI:10.2147/IDR.S227883
|
| [36] |
Rumyantseva TA, Bellen G, Savochkina YA, et al. Diagnosis of aerobic vaginitis by quantitative real-time PCR. Arch Gynecol Obstet, 2016, 294(1): 109-114. DOI:10.1007/s00404-015-4007-4
|
| [37] |
Zhang S, Sun K, Zheng R, et al. Cancer incidence and mortality in China, 2015. J Nat Cancer Cent, 2021, 1(1): 2-11. DOI:10.1016/j.jncc.2020.12.001
|
| [38] |
Kwasniewski W, Wolun-Cholewa M, Kotarski J, et al. Microbiota dysbiosis is associated with HPV-induced cervical carcinogenesis. Oncol Lett, 2018, 16(6): 7035-7047.
|
| [39] |
Godoy-Vitorino F, Romaguera J, Zhao C, et al. Cervicovaginal fungi and bacteria associated with cervical intraepithelial neoplasia and high-risk human papillomavirus infections in a hispanic population. Front Microbiol, 2018, 9: 2533. DOI:10.3389/fmicb.2018.02533
|
| [40] |
Bhatla N, Puri K, Joseph E, et al. Association of Chlamydia trachomatis infection with human papillomavirus (HPV) & cervical intraepithelial neoplasia—a pilot study. Indian J Med Res, 2013, 137(3): 533-539.
|
| [41] |
Walther-António MR, Chen J, Multinu F, et al. Potential contribution of the uterine microbiome in the development of endometrial cancer. Genome Med, 2016, 8(1): 122. DOI:10.1186/s13073-016-0368-y
|
| [42] |
Zhou B, Sun C, Huang J, et al. The biodiversity composition of microbiome in ovarian carcinoma patients. Sci Rep, 2019, 9(1): 1691. DOI:10.1038/s41598-018-38031-2
|
| [43] |
Kovachev SM. Cervical cancer and vaginal microbiota changes. Arch Microbiol, 2020, 202(2): 323-327. DOI:10.1007/s00203-019-01747-4
|
| [44] |
Gillet E, Meys JF, Verstraelen H, et al. Bacterial vaginosis is associated with uterine cervical human papillomavirus infection: a meta-analysis. BMC Infect Dis, 2011, 11: 10. DOI:10.1186/1471-2334-11-10
|
| [45] |
Rose WA 2nd, McGowin CL, Spagnuolo RA, et al. Commensal bacteria modulate innate immune responses of vaginal epithelial cell multilayer cultures. PLoS ONE, 2012, 7(3): e32728. DOI:10.1371/journal.pone.0032728
|
| [46] |
Anahtar MN, Byrne EH, Doherty KE, et al. Cervicovaginal bacteria is a major modulator of host inflammatory responses in the female genital tract. Immunity, 2015, 42(5): 965-976. DOI:10.1016/j.immuni.2015.04.019
|
| [47] |
Shrihari TG. Dual role of inflammatory mediators in cancer. Ecancermedicalscience, 2017, 11: 721.
|
| [48] |
Arokiyaraj S, Seo SS, Kwon M, et al. Association of cervical microbial community with persistence, clearance and negativity of human papillomavirus in Korean women: a longitudinal study. Sci Rep, 2018, 8: 15479. DOI:10.1038/s41598-018-33750-y
|
| [49] |
Motevaseli E, Azam R, Akrami SM, et al. The effect of Lactobacillus crispatus and Lactobacillus rhamnosus culture supernatants on expression of autophagy genes and HPV E6 and E7 oncogenes in the HeLa cell line. Cell J, 2016, 17(4): 601-607.
|
| [50] |
Nené NR, Reisel D, Leimbach A. Association between the cervicovaginal microbiome, BRCA1 mutation status, and risk of ovarian cancer: a case-control study. Lancet Oncol, 2019, 20(10): E559.
|
| [51] |
Caselli E, Soffritti I, D'Accolti M, et al. Atopobium vaginae and Porphyromonas somerae induce proinflammatory cytokines expression in endometrial cells: a possible implication for endometrial cancer?. Cancer Manag Res, 2019, 11: 8571-8575. DOI:10.2147/CMAR.S217362
|
| [52] |
Joesoef MR, Schmid GP. Bacterial vaginosis: review of treatment options and potential clinical indications for therapy. Clin Infect Dis, 1995, 20(Suppl 1): S72-S79.
|
| [53] |
Bradshaw CS, Morton AN, Hocking J, et al. High recurrence rates of bacterial vaginosis over the course of 12 months after oral metronidazole therapy and factors associated with recurrence. J Infect Dis, 2006, 193(11): 1478-1486. DOI:10.1086/503780
|
| [54] |
Collins LM, Moore R, Sobel JD. Prognosis and long-term outcome of women with idiopathic recurrent vulvovaginal candidiasis caused by Candida albicans. J Low Genit Tract Dis, 2020, 24(1): 48-52. DOI:10.1097/LGT.0000000000000496
|
| [55] |
Neut C, Verrière F, Nelis HJ. Topical treatment of infectious vaginitis: effects of antibiotic, antifungal and antiseptic drugs on the growth of normal vaginal Lactobacillus strain. Open J Obstet Gynecol, 2015, 5(3): 173-180. DOI:10.4236/ojog.2015.53024
|
| [56] |
Wang ZY, He YN, Zheng YJ. Probiotics for the treatment of bacterial vaginosis: a meta-analysis. Int J Environ Res Public Health, 2019, 16(20): E3859. DOI:10.3390/ijerph16203859
|
| [57] |
Kovachev SM, Vatcheva-Dobrevska RS. Local probiotic therapy for vaginal Candida albicans infections. Probiotics Antimicrob Proteins, 2015, 7(1): 38-44. DOI:10.1007/s12602-014-9176-0
|
| [58] |
Yamamoto HS, Xu Q, Fichorova RN. Homeostatic properties of Lactobacillus jensenii engineered as a live vaginal anti-HIV microbicide. BMC Microbiol, 2013, 13: 4. DOI:10.1186/1471-2180-13-4
|
| [59] |
Liu JJ, Reid G, Jiang Y, et al. Activity of HIV entry and fusion inhibitors expressed by the human vaginal colonizing probiotic Lactobacillus reuteri RC-14. Cell Microbiol, 2007, 9(1): 120-130. DOI:10.1111/j.1462-5822.2006.00772.x
|
| [60] |
Lagenaur LA, Sanders-Beer BE, Brichacek B, et al. Prevention of vaginal SHIV transmission in macaques by a live recombinant Lactobacillus. Mucosal Immunol, 2011, 4(6): 648-657. DOI:10.1038/mi.2011.30
|
| [61] |
Ayre WB. The glycogen-estrogen relationship in the vaginal tract. J Clin Endocrinol Metab, 1951, 11(1): 103-110. DOI:10.1210/jcem-11-1-103
|
| [62] |
Gliniewicz K, Schneider GM, Ridenhour BJ, et al. Comparison of the vaginal microbiomes of premenopausal and postmenopausal women. Front Microbiol, 2019, 10: 193. DOI:10.3389/fmicb.2019.00193
|
| [63] |
Gompel A. Progesterone, progestins and the endometrium in perimenopause and in menopausal hormone therapy. Climacteric, 2018, 21(4): 321-325. DOI:10.1080/13697137.2018.1446932
|
| [64] |
Anstey Watkins J, Ross JDC, Thandi S, et al. Acceptability of and treatment preferences for recurrent bacterial vaginosis—topical lactic acid gel or oral metronidazole antibiotic: qualitative findings from the VITA trial. PLoS ONE, 2019, 14(11): e0224964. DOI:10.1371/journal.pone.0224964
|
| [65] |
Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr, 1995, 125(6): 1401-1412. DOI:10.1093/jn/125.6.1401
|
| [66] |
Al-Ghazzewi FH, Tester RF. Biotherapeutic agents and vaginal health. J Appl Microbiol, 2016, 121(1): 18-27. DOI:10.1111/jam.13054
|
| [67] |
Liu F, Li P, Chen M, et al. Fructooligosaccharide (FOS) and galactooligosaccharide (GOS) increase Bifidobacterium but reduce butyrate producing bacteria with adverse glycemic metabolism in healthy young population. Sci Rep, 2017, 7(1): 11789. DOI:10.1038/s41598-017-10722-2
|
| [68] |
Coste I, Judlin P, Lepargneur JP, et al. Safety and efficacy of an intravaginal prebiotic gel in the prevention of recurrent bacterial vaginosis: a randomized double-blind study. Obstet Gynecol Int, 2012, 147867.
|
| [69] |
Khazaeian S, Navidian A, Navabi-Rigi SD, et al. Comparing the effect of sucrose gel and metronidazole gel in treatment of clinical symptoms of bacterial vaginosis: a randomized controlled trial. Trials, 2018, 19(1): 585. DOI:10.1186/s13063-018-2905-z
|
| [70] |
Collins SL, McMillan A, Seney S. Promising prebiotic candidate established by evaluation of lactitol, lactulose, raffinose, and oligofructose for maintenance of a Lactobacillus-dominated vaginal microbiota. Appl Environ Microbiol, 2018, 84(5): e02200-02217.
|
| [71] |
De Boever P, Deplancke B, Verstraete W. Fermentation by gut microbiota cultured in a simulator of the human intestinal microbial ecosystem is improved by supplementing a soygerm powder. J Nutr, 2000, 130(10): 2599-2606. DOI:10.1093/jn/130.10.2599
|
| [72] |
Dobbler P, Mai V, Procianoy RS, et al. The vaginal microbial communities of healthy expectant Brazilian mothers and its correlation with the newborn's gut colonization. World J Microbiol Biotechnol, 2019, 35(10): 159. DOI:10.1007/s11274-019-2737-3
|
| [73] |
Geshnizgani AM, Onderdonk AB. Defined medium simulating genital tract secretions for growth of vaginal microflora. J Clin Microbiol, 1992, 30(5): 1323-1326. DOI:10.1128/jcm.30.5.1323-1326.1992
|
| [74] |
Medina-Colorado AA, Vincent KL, Miller AL, et al. Vaginal ecosystem modeling of growth patterns of anaerobic bacteria in microaerophilic conditions. Anaerobe, 2017, 45: 10-18. DOI:10.1016/j.anaerobe.2017.04.014
|
 2021, Vol. 37
2021, Vol. 37