中国科学院微生物研究所、中国微生物学会主办
文章信息
- 韦科宏, 陈廷涛
- Wei Kehong, Chen Tingtao
- 阴道菌群移植治疗细菌性阴道炎的发展现状及展望
- Vaginal microbiota transplantation for treatment of bacterial vaginosis: a review
- 生物工程学报, 2021, 37(11): 3820-3827
- Chinese Journal of Biotechnology, 2021, 37(11): 3820-3827
- 10.13345/j.cjb.210163
-
文章历史
- Received: February 24, 2021
- Accepted: June 8, 2021
细菌性阴道炎(Bacterial vaginosis,BV) 是一类由阴道菌群失调引起的疾病,多以乳杆菌下降及厌氧菌(包括阴道加德纳菌和阴道阿托比波菌) 升高为特征。BV发病率介于5%–50%之间,可导致瘙痒、异味和白带异常,已成为全球范围内影响妇女日常生活、性生活质量及公共卫生安全的重要问题[1]。当前,BV以抗生素治疗为主(包括甲硝唑和克林霉素),但抗生素疗法治愈率低且复发率高,难以达到患者的预期[2]。因此,我们迫切需要寻求一种安全、有效的治疗方法以减轻BV患者生理和心理的负担。
正常状态下,阴道菌群以乳杆菌作为优势菌,其产生的过氧化氢(H2O2)、细菌素和短链脂肪酸等物质维持了阴道酸性、健康的环境[3];而阴道菌群平衡如果被打破将会引起或加剧一系列的妇科疾病,因此恢复紊乱的阴道菌群至平衡状态,是治疗此类疾病的大方向。
目前,恢复宿主肠道菌群平衡最为有效的方法当属粪菌移植(Fecal microbiota transplantation,FMT),其主要是通过将健康志愿者整个粪菌系统移植到患者肠道内,恢复患者肠道微生物的多样性及组成[4]。且FMT已被批准用于临床治疗包括艰难梭菌感染(Clostridium difficile infection,CDI)在内的多种疾病,显示出非常好的疗效和产业化前景[5]。鉴于FMT对CDI等疾病的良好效果,菌群移植(Microbiota transplantation,MT) 逐渐成为公众媒体和相关领域的研究热点,为阴道、皮肤、口腔和鼻腔MT提供了强有力的理论基础。本文概述了阴道菌群移植(Vaginal microbiota transplantation,VMT) 及其在BV治疗中的应用,以期为VMT作为一种活菌生物药物的开发和应用提供理论支撑。
1 阴道微生物环境与其他黏膜部位相同,女性生殖道拥有特定的微生物组成,其在维持妇女健康中起着至关重要的作用。对于大多数育龄妇女而言,其阴道微生物主要由乳杆菌、棒状杆菌、双歧杆菌、类杆菌、梭形杆菌、非溶血性链球菌、表皮葡萄球菌、大肠埃希菌、加德纳菌、消化链球菌以及原虫、病毒、支原体和白假丝酵母菌等组成[6],其中乳杆菌分离率达50%–80%,是阴道优势菌[7]。
乳杆菌可生成大量的H2O2、细菌素等抑菌物质,抑制其他病原微生物的生长及过度繁殖[3, 8];此外,乳杆菌与阴道上皮细胞一起产生抗菌物质乳酸,为阴道提供pH 4.0–4.5的酸性环境,在维持阴道健康和抵御外界感染中起着重要的作用[9-10]。一些因素如荷尔蒙改变、阴道冲洗、性伴侣改变导致的阴道菌群紊乱,往往伴随着乳杆菌丰度的下降及病原菌数量的上升[11],进而导致如BV、尿道感染和性传播疾病感染等一系列疾病[12]。
2 细菌性阴道炎任何具有白带异常、难闻、瘙痒、灼痛等症状的疾病均可划归为阴道炎。其中,育龄妇女中最常见的阴道炎为BV,占阴道炎发病率的40%–50%[13]。
BV的发生与阴道内微生物的改变密切相关,当阴道内正常乳杆菌优势被厌氧菌(以加德纳菌、阴道阿托波氏菌为主,其他包括普雷沃菌属、拟杆菌属和消化链球菌属) 所替代时,阴道中H2O2和有机酸水平下降,导致BV的发生。BV的诊断通常使用Amsel标准进行,包括阴道pH值大于4.5、嗅觉试验阳性、均质稀薄分泌物以及显微镜检查阴道液中存在线索细胞,其中至少3项为阳性的患者可被诊断为BV[14]。BV的发生会引发一系列并发症,如子宫内膜或宫颈组织的炎症、尿路感染、慢性盆腔疼痛,同时增加HIV (Human immunodeficiency virus) 和其他性传播疾病感染的风险[15]。对于怀孕的BV病人,其可增加新生儿早产、胎膜早破和低出生体重的可能性[16]。
BV的常规药物治疗包括口服或局部使用克林霉素和甲硝唑,但抗生物疗法效果不佳、复发率高,且有使疾病更严重的风险,如治疗后出现继发性假丝酵母菌感染、阴道炎类型的转变以及阴道微生态环境的改变[17-18]。值得注意的是,尽管抗生素治疗可以在短时间内清除厌氧菌,但在停止治疗后,可以很快观察到BV相关的细菌,特别是阴道加德纳菌的再现。临床研究表明,致病菌及其生物膜对抗生素的耐药,可导致BV患者6个月内的复发率达到76%,特别是阴道具有较高浓度病原菌的妇女[19]。
生物膜作为屏障为阴道加德纳菌等致病菌提供稳定的内环境,保护其免受化学消毒、抗细菌药物和机体免疫反应的侵害,其存在提示患者具有较高的细菌耐药和BV复发的可能性[20-21]。复发性BV患者需要更长的治疗时间才有可能使阴道菌群恢复到以乳杆菌为主的正常环境[2]。考虑到瘙痒、灼痛等症状严重影响BV患者的日常生活和性生活满意程度、抗生素治疗的高复发率以及目前新药物的缺乏等诸多因素,迫切需要寻求一种新的BV疗法以改善BV患者的生理、心理及经济负担[22]。
3 阴道菌群移植为恢复阴道内乳杆菌占主导的正常环境,阴道内或口服给予以乳杆菌为主的益生菌,为BV的治疗提供了新的研究方向[23]。体外研究表明,从健康妇女阴道分离出来的乳杆菌可以抑制阴道加德纳菌的黏附,甚至能够代替已经黏附于阴道上皮的加德纳菌[24-25]。已有临床试验证实,益生菌单独或联合抗生素使用能够降低BV的复发率,缩短治愈时间[26-27]。研究者指出,阴道给予乳杆菌能够在BV患者中显示出良好的安全性及疗效,同时验证了乳杆菌在阴道中的定殖能力[28]。然而,也有临床试验表明,尽管阴道给予含有乳杆菌的胶囊可以增加乳杆菌的定殖,但其不能提高BV的治愈率或减轻复发[29]。对于某些肠道疾病而言,单一益生菌或混合益生菌的干预不足以维持人体健康或治疗疾病,而FMT在治疗这些疾病时显示出较高的治愈率,预示整个微生物生态系统移植在治疗由微生物紊乱引起的疾病方面更为有效[30]。因此,用健康妇女的阴道菌群完全代替患者的阴道菌群,以重构阴道菌群达到一个新的平衡来治疗BV,从理论上来讲要较单一或者复合菌更为有效。
早在1955年,Gardner等发现,通过将BV患者的阴道分泌物移植入健康志愿者阴道内,能够使健康群体患病,成功率达73%[31]。反过来,研究人员推测通过VMT,将健康供体阴道微生物移植入患者阴道内,可以恢复患者阴道内的正常微生物组成,以达到治疗疾病的效果(图 1)。笔者团队在2017年的研究表明,将健康大鼠阴道菌群移植入BV模型大鼠阴道内,能够恢复其子宫组织形态,降低血清IL-6、IL-8、TNF-α等炎症因子的浓度,对阴道菌群失调造成的大鼠细菌性阴道感染具有明显的治疗和恢复作用[32-33]。2018年,笔者团队进一步研究结果表明,通过将健康妇女阴道菌群移植入模型组大鼠阴道内,能够有效调节凋亡因子的表达,同时通过升高抑炎因子和降低促炎因子的表达而发挥抗炎作用;VMT保持或恢复了实验组大鼠阴道菌群的多样性,比抗生素药物组显示出更积极的防止阴道炎复发的作用[6]。2019年底,由Lev-Sagie等在以色列哈达萨医学中心开展的临床研究进一步表明,VMT对长期治疗复发的、抗生素无反应的顽固性BV有着非常好的改善作用,接受VMT治疗的5位BV患者中,其中4位在VMT治疗5–21个月后得到了有效恢复,表现为症状的显著改善、Amsel标准阴性和显微镜下以乳杆菌为主的阴道液体形态,治愈率高达80%[34]。且作者没有观察到与VMT相关的任何不良反应[34]。
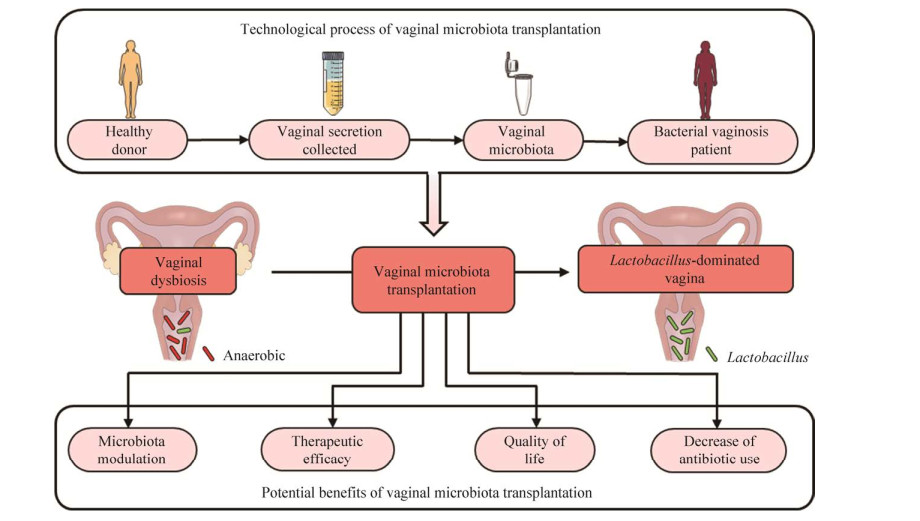
|
| 图 1 VMT的主要技术路线和潜在优势 Fig. 1 Technological processes and potential benefits of VMT. |
| |
尽管目前的临床试验表明VMT效果良好,但仍然需要更多的高质量、大样本的随机、安慰剂对照临床试验来进一步为VMT治疗BV提供更可靠的临床依据。通过检索临床注册网站ClinicalTrial.gov发现,美国的两项Ⅰ/Ⅱ期临床试验(临床试验号:NCT03769688和NCT04046900) 以及在以色列进行的一项临床对照试验(临床试验号:NCT02236429) 正在招募或计划招募参与者(n=10–126) 来评估VMT治疗BV的安全性和有效性。其中,临床试验号为NCT02236429的研究拟通过比较来自健康供体的阴道分泌液和患者自身阴道分泌液的自体移植,来探索VMT的有效性。
4 VMT的注意事项目前尚没有明确的文件规定如何筛选VMT供体,但是安全性应当作为进行VMT供体筛选的优先考虑因素。因此,研究者应根据当前与移植相关的行业指南,结合阴道菌群和性传播感染的特点,制定调查问卷和纳入、排除标准,在开展VMT前严格筛选供体,对其进行问卷调查、访谈。此外,应将供体一般情况(性伴侣个数、性生活状况及频率、是否使用影响阴道菌群的药物)、生殖道健康以及是否怀孕等情况纳入考量;同时,其血液、阴道拭子和尿液样本中的多种传染性病原体(如HIV、人乳头瘤病毒(Human papilloma virus,HPV)、支原体、霉菌等) 应当严格接受实验室检查,及时排除任何不合格者。任何不符合人体细胞、组织及基于细胞和组织的产品的医学史、行为史、旅游史的妇女都应排除。对于受体,应当使用统一的方法诊断BV,并对一般免疫能力和潜在怀孕进行诊断测试,而怀孕、备孕、HIV感染或免疫缺陷患者应予以排除。作为保障VMT安全性的关键步骤,供体的筛选应当严格而准确,以减少和防止任何不良事件的发生。
和其他研究一样,对于VMT的伦理审查应当充分讨论VMT的安全问题,这也是目前VMT临床研究的开展相对困难的主要原因之一。由于人们更愿意接受来自与自己更亲近的人群的阴道菌群,近亲之间的VMT也许为实验的进行提供了可能。且研究人员应完全确保受试者对可能面临的风险的知情同意。由于受试者需要接受详尽的调查和血液、阴道分泌物的实验室检查,此过程可能出现潜在疾病的发现,而导致因个人信息的泄露引发的不良后果。此外,Delong等指出,由于不同种族、地域的BV发病率差异,相关人员在招募受试者时,应透明、谨慎地解决种族差异的问题[35]。
当前美国食品药品监督管理局(Food and drug administration,FDA) 认为MT是一种药物,是活体生物治疗产品(Live biotherapeutic product,LBP),并在2013年发布的一份指导文件中指出,其打算在特定条件下对使用FMT产品治疗并对标准疗法无反应的CDI患者的新药临床试验申请(Investigational new drug application,IND) 要求行使执法自由裁量权。2020年,中华医学会肠外肠内营养学分会、中国国际医疗保健促进交流会加速康复外科学分会、中国微生态治疗创新联盟和上海预防医学会微生态专业委员会制定了《菌群移植途径的建立与临床应用中国专家共识》,提出了针对FMT的移植途径选择、方法学、临床应用以及不良事件的监测。可见我国对MT这一大领域的充分重视[36]。全国范围内尚无对MT的统一监管措施和正式批准文件,但随着研究数量的增多,有关部门应针对VMT建立一个完善的系统,其整个流程(包括供体筛选、分泌物筛查、运输、保存、分配、给药) 都应该受到相关部门的监管,旨在保障患者利益和公共卫生安全[37]。
还需注意的是,尽管目前临床试验表明VMT具有良好的治愈率,并不是所有BV患者在接受首次VMT之后都有临床反应,有的患者需要接受多次治疗甚至需要更换供体才能达到预期的效果。此外,并不是所有患者都能通过VMT受益[34]。也就是说,VMT的疗效与疗程具有不确定性,这可能与样本取样、运输、给药过程中样本和采样装置受到污染或保存方式不当使菌群失活,生物屏障(细菌生物膜、黏液、现有微生物群、宫腔内容物) 阻止微生物定殖,以及不恰当的术后管理或者个人因素等有关,提示研究人员应对VMT的整个操作流程进行严格的监控,避免因操作不当或管理不当给病人带来不必要的麻烦。同时,VMT需要更深入的研究来阐明影响治疗结果的不良因素[38]。
5 VMT的发展前景BV是一个广泛传播的健康问题,其发病率仍然处于较高的阶段。BV对患者的生活质量和心理状况都构成一定的影响,使得其承受心理和生理的巨大负担,而抗生素的反复使用更是加重了患者的经济负担。基于二代测序技术的快速发展,MT在治疗疾病方面的运用逐渐发展起来。VMT包括将健康供体阴道中的整个微生物菌群移植进入患者阴道内,以恢复其微生物整体的多样性、稳定性以及正常组成。VMT的初步临床结果证明了VMT的可行性,显示出了良好的治疗效果。相较于BV的其他治疗方法,以重建阴道微生物环境为主的VMT可以完全将女性阴道微生物环境恢复到健康状态以治疗BV及防止其复发。VMT在复发性BV的治疗中显示出优于当前常规抗生素药物治疗的疗效,同时解决了抗生素治疗带来的抗生素滥用、耐药菌产生和复发率高等相关弊端,将会给BV患者带来前所未有的疗效。同时,考虑到VMT巨大的潜在受益人群,VMT的产业化生产将会减轻社会的负担并带来巨大的经济收益。
有研究者认为,为了取得更好的治疗效果,在供体和受体接受VMT之前,可以对其样本进行基因组测序[39]。虽然单独或联合使用几种益生菌的BV治疗效果不理想,随着高通量测序的不断发展,我们是否可以通过体外制备能够完全模拟健康人体阴道菌群组成的菌群药物,来达到和VMT一样甚至更优的治疗效果是另一个研究热点。此方法被称为选择性菌群移植(Selective microbiota transplantation,SMT),被称为是介于传统益生菌和整体菌群之间的菌群组成[40]。也就是说,为了解决潜在性传播疾病发生的可能性以及人体内阴道菌群组成的不确定性,制备能够模拟健康人体的微生物菌群,将会是VMT的衍生产物。此方法可以解决VMT过程中最大的安全性问题,而且可以通过调节其中每一种微生物的相对丰度来达到不同患者的个体化治疗,具有更高的特异性和可控性,并降低患者的治疗成本,实现精准治疗[41]。但目前尚无其他微生物疗法可以替代整体的VMT。
除了导致BV,阴道菌群紊乱与一系列疾病包括盆腔炎、子宫内膜炎、尿道炎都有着密切的联系[15]。因此,通过VMT恢复阴道菌群在治疗这些疾病中可能有良好的促进作用。此外,有证据表明,生殖道菌群失调或者特定的细菌定殖可通过直接和间接的机制,包括调节雌激素代谢,在妇科恶性肿瘤(宫颈癌、子宫内膜癌、卵巢癌) 的发生发展中发挥积极的作用。Laniewski等指出,VMT有望改善患者对癌症治疗的反应性和生活质量[42]。也就是说,尽管当前VMT正在发展阶段,我们对阴道菌群的组成和功能的理解以及针对阴道菌群治疗疾病的潜力的深度探索是一个快速发展和充满希望的领域,VMT有望针对更多的适应症进行治疗。
6 总结与展望VMT的初步临床疗效已经显现。作为直接靶向BV致病原因,调节阴道菌群是最直接、最有效的干预措施,在确保安全性的情况下,VMT可以缩短BV的治疗时间、提高BV的治愈率和防止抗生素治疗带来的并发症等。进一步的研究将会围绕VMT的作用机制、精准的个性化治疗以及相关法律法规的完善展开。VMT系统的完善需要多学科的合作,相关人员应尽快制定VMT受试者筛选指南,并继续探究VMT在治疗BV及其他妇科疾病的应用潜力,研发一种安全有效的新型治疗方案,同时做好安全性评价工作。我们有理由相信安全、标准、高效的VMT将会给BV患者带来新的希望,具有良好的应用前景。我们预测VMT可能在接下来的十年内快速发展,涉及其他如口腔、鼻腔、皮肤的MT也并不遥远。
| [1] |
Mastromarino P, Vitali B, Mosca L. Bacterial vaginosis: a review on clinical trials with probiotics. New Microbiol, 2013, 36(3): 229-238.
|
| [2] |
Bagnall P, Rizzolo D. Bacterial vaginosis: a practical review. JAAPA, 2017, 30(12): 15-21. DOI:10.1097/01.JAA.0000526770.60197.fa
|
| [3] |
Aroutcheva AA, Simoes JA, Faro S. Antimicrobial protein produced by vaginal Lactobacillus acidophilus that inhibits Gardnerella vaginalis. Infect Dis Obstet Gynecol, 2001, 9(1): 33-39. DOI:10.1155/S1064744901000060
|
| [4] |
Allegretti JR, Mullish BH, Kelly C, et al. The evolution of the use of faecal microbiota transplantation and emerging therapeutic indications. Lancet, 2019, 394(10196): 420-431. DOI:10.1016/S0140-6736(19)31266-8
|
| [5] |
Bakken JS, Borody T, Brandt LJ, et al. Treating Clostridium difficile infection with fecal microbiota transplantation. Clin Gastroenterol Hepatol, 2011, 9(12): 1044-1049. DOI:10.1016/j.cgh.2011.08.014
|
| [6] |
孟凡景. 阴道菌群移植及阴道益生菌组合对细菌性阴道炎的治疗及其机制研究[D]. 南昌: 南昌大学, 2018. Meng FJ. Therapy and mechanism of vaginal microbiota transplantation and combination of vaginal probiotics in the vaginal bacterial infections[D]. Nanchang: Nanchang University, 2018 (in Chinese). |
| [7] |
Hyman RW, Fukushima M, Diamond L, et al. Microbes on the human vaginal epithelium. Pro Natl Acad Sci USA, 2005, 102(22): 7952-7957. DOI:10.1073/pnas.0503236102
|
| [8] |
Boskey ER, Cone RA, Whaley KJ, et al. Origins of vaginal acidity: high D/L lactate ratio is consistent with bacteria being the primary source. Hum Reprod, 2001, 16(9): 1809-1813. DOI:10.1093/humrep/16.9.1809
|
| [9] |
Buchta V. Vaginal microbiome. Ceska Gynekol, 2018, 83(5): 371-379.
|
| [10] |
O'Hanlon DE, Moench TR, Cone RA. In vaginal fluid, bacteria associated with bacterial vaginosis can be suppressed with lactic acid but not hydrogen peroxide. BMC Infect Dis, 2011, 11: 200. DOI:10.1186/1471-2334-11-200
|
| [11] |
Brusselaers N, Shrestha S, van de Wijgert J, et al. Vaginal dysbiosis and the risk of human papillomavirus and cervical cancer: systematic review and meta-analysis. Am J Obstet Gynecol, 2019, 221(1): 9-18. e8. DOI:10.1016/j.ajog.2018.12.011
|
| [12] |
Stapleton AE. The vaginal microbiota and urinary tract infection. Microbiol Spectr, 2016, 4(6): 10.
|
| [13] |
Paladine HL, Desai UA. Vaginitis: diagnosis and treatment. Am Fam Physician, 2018, 97(5): 321-329.
|
| [14] |
Hainer BL, Gibson MV. Vaginitis. Am Fam Physician, 2011, 83(7): 807-815.
|
| [15] |
van de Wijgert JHHM, Jespers V. The global health impact of vaginal dysbiosis. Res Microbiol, 2017, 168(9/10): 859-864.
|
| [16] |
Owen MK, Clenney TL. Management of vaginits. Am Fam Physician, 2005, 70(11): 2125-32.
|
| [17] |
Verwijs MC, Agaba SK, Darby AC, et al. Impact of oral metronidazole treatment on the vaginal microbiota and correlates of treatment failure. Am J Obstet Gynecol, 2020, 222(2): 157. e1-157. e13. DOI:10.1016/j.ajog.2019.08.008
|
| [18] |
Vargason AM, Anselmo AC. Clinical translation of microbe-based therapies: current clinical landscape and preclinical outlook. Bioeng Transl Med, 2018, 3(2): 124-137. DOI:10.1002/btm2.10093
|
| [19] |
Javed A, Parvaiz F, Manzoor S. Bacterial vaginosis: an insight into the prevalence, alternative treatments regimen and it's associated resistance patterns. Microb Pathog, 2019, 127: 21-30. DOI:10.1016/j.micpath.2018.11.046
|
| [20] |
Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science, 1999, 284(5418): 1318-1322. DOI:10.1126/science.284.5418.1318
|
| [21] |
Jung HS, Ehlers MM, Lombaard H, et al. Etiology of bacterial vaginosis and polymicrobial biofilm formation. Crit Rev Microbiol, 2017, 43(6): 651-667. DOI:10.1080/1040841X.2017.1291579
|
| [22] |
Sobel R, Sobel JD. Metronidazole for the treatment of vaginal infections. Expert Opin Pharmacother, 2015, 16(7): 1109-1115. DOI:10.1517/14656566.2015.1035255
|
| [23] |
Falagas M, Betsi GI, Athanasiou S. Probiotics for the treatment of women with bacterial vaginosis. Clin Microbiol Infect, 2007, 13(7): 657-664. DOI:10.1111/j.1469-0691.2007.01688.x
|
| [24] |
Boris S, Suárez JE, Vázquez F, et al. Adherence of human vaginal lactobacilli to vaginal epithelial cells and interaction with uropathogens. Infect Immun, 1998, 66(5): 1985-1989. DOI:10.1128/IAI.66.5.1985-1989.1998
|
| [25] |
Mastromarino P, Brigidi P, Macchia S, et al. Characterization and selection of vaginal Lactobacillus strains for the preparation of vaginal tablets. J Appl Microbiol, 2002, 93(5): 884-893. DOI:10.1046/j.1365-2672.2002.01759.x
|
| [26] |
Bodean O, Munteanu O, Cirstoiu C, et al. Probiotics——a helpful additional therapy for bacterial vaginosis. J Med Life, 2013, 6(4): 434-436.
|
| [27] |
Bohbot JM, Daraï E, Bretelle F, et al. Efficacy and safety of vaginally administered lyophilized Lactobacillus crispatus IP 174178 in the prevention of bacterial vaginosis recurrence. J Gynecol Obstet Hum Reprod, 2018, 47(2): 81-86. DOI:10.1016/j.jogoh.2017.11.005
|
| [28] |
Hemmerling A, Harrison W, Schroeder A, et al. Phase 2a study assessing colonization efficiency, safety, and acceptability of Lactobacillus crispatus CTV-05 in women with bacterial vaginosis. Sex Transm Dis, 2010, 37(12): 745-750. DOI:10.1097/OLQ.0b013e3181e50026
|
| [29] |
Marcotte H, Larsson PG, Andersen KK, et al. An exploratory pilot study evaluating the supplementation of standard antibiotic therapy with probiotic lactobacilli in South African women with bacterial vaginosis. BMC Infect Dis, 2019, 19(1): 824. DOI:10.1186/s12879-019-4425-1
|
| [30] |
Robinson CJ, Bohannan BJ, Young VB. From structure to function: the ecology of host-associated microbial communities. Microbiol Mol Biol Rev, 2010, 74(3): 453-476. DOI:10.1128/MMBR.00014-10
|
| [31] |
Gardner HL, Dukes CD. Haemophilus vaginalis vaginitis: a newly defined specific infection previously classified "nonspecific" vaginitis. Am J Obstet Gynecol, 1955, 69(5): 962-976. DOI:10.1016/0002-9378(55)90095-8
|
| [32] |
王鑫. 阴道菌群移植对细菌性阴道感染疾病治疗作用的初步研究[D]. 南昌: 南昌大学, 2017. Wang X. A preliminary study of the vaginal flora transplantation for treatment of bacterial vaginal infections[D]. Nanchang: Nanchang University, 2017 (in Chinese). |
| [33] |
Chen T, Xia C, Hu H, et al. Dysbiosis of the rat vagina is efficiently rescued by vaginal microbiota transplantation or probiotic combination. Int J Antimicrob Agents, 2021, 57(3): 106277. DOI:10.1016/j.ijantimicag.2021.106277
|
| [34] |
Lev-Sagie A, Goldman-Wohl D, Cohen Y, et al. Vaginal microbiome transplantation in women with intractable bacterial vaginosis. Nat Med, 2019, 25(10): 1500-1504. DOI:10.1038/s41591-019-0600-6
|
| [35] |
DeLong K, Zulfiqar F, Hoffmann DE, et al. Vaginal microbiota transplantation: the next frontier. J Law Med Ethics, 2019, 47(4): 555-567. DOI:10.1177/1073110519897731
|
| [36] |
中华医学会肠外肠内营养学分会, 中国国际医疗保健促进交流会加速康复外科分会, 中国微生态治疗创新联盟, 等. 菌群移植途径的选择与建立临床应用中国专家共识. 中华胃肠外科杂志, 2020, 23(Z1): 14-20. Parenteral and Enteral Nutrition Branch of Chinese Medical Association, Enhanced Recovery After Surgery Branch of China International Health Care Promotion and Exchange Association, China Microecological Treatment Innovation Alliance, et al. Chinese experts consensus on clinical practice of the selection and establishment of fecal microbiota transplantation delivery routes. Chin J Gastrointest Surg, 2020, 23(Z1): 14-20 (in Chinese). DOI:10.3760/cma.j.cn.441530-20200420-00228 |
| [37] |
Hoffmann D, Palumbo F, Ravel J, et al. Improving regulation of microbiota transplants. Science, 2017, 358(6369): 1390-1391. DOI:10.1126/science.aaq0034
|
| [38] |
Harkins CP, Kong HH, Segre JA. Manipulating the human microbiome to manage disease. JAMA, 2020, 323(4): 303-304. DOI:10.1001/jama.2019.19602
|
| [39] |
Ma DW, Chen YD, Chen TT. Vaginal microbiota transplantation for the treatment of bacterial vaginosis: a conceptual analysis. FEMS Microbiol Lett, 2019, 366(4): fnz025.
|
| [40] |
Zhang F, Cui B, He X, et al. Microbiota transplantation: concept, methodology and strategy for its modernization. Protein Cell, 2018, 9(5): 462-473. DOI:10.1007/s13238-018-0541-8
|
| [41] |
Hoffmann DE, Palumbo FB, Ravel J, et al. A proposed definition of microbiota transplantation for regulatory purposes. Gut Microbes, 2017, 8(3): 208-213. DOI:10.1080/19490976.2017.1293223
|
| [42] |
Łaniewski P, Ilhan ZE, Herbst-Kralovetz MM. The microbiome and gynaecological cancer development, prevention and therapy. Nat Rev Urol, 2020, 17(4): 232-250. DOI:10.1038/s41585-020-0286-z
|
 2021, Vol. 37
2021, Vol. 37




