中国科学院微生物研究所、中国微生物学会主办
文章信息
- 林楚慧, 曾婷, 邓宇虹, 杨文林, 熊婧琳
- Lin Chuhui, Zeng Ting, Deng Yuhong, Yang Wenlin, Xiong Jinglin
- 脆弱拟杆菌BF839治疗寻常型银屑病:一项单臂、开放初步临床试验
- Treatment of psoriasis vulgaris using Bacteroides fragilis BF839: a single-arm, open preliminary clinical study
- 生物工程学报, 2021, 37(11): 3828-3835
- Chinese Journal of Biotechnology, 2021, 37(11): 3828-3835
- 10.13345/j.cjb.210198
-
文章历史
- Received: March 10, 2021
- Accepted: June 3, 2021
- Published: June 18, 2021
2. 广州医科大学, 广东 广州 510182
2. Guangzhou Medical University, Guangzhou 510182, Guangdong, China
银屑病的患病率为0.47%[1],是一种遗传与环境共同作用诱发、免疫介导的慢性、复发性、炎症性、系统性疾病,典型临床表现为鳞屑性红斑或斑块,局限或广泛分布,治疗困难,常罹患终身。银屑病的发病机制目前仍不明确,有学者认为CD4+ T淋巴细胞的免疫功能异常对银屑病的病变起关键作用[2],因此CD4+ T淋巴细胞的免疫调节被认为可以作为潜在的银屑病治疗靶标。已有文献表明,银屑病患者存在肠道菌群失调[3],其肠道菌群特征与炎症性肠病患者肠道菌群特征相似[4]。人类共生菌脆弱拟杆菌(Bacteroides fragilis,BF) 被报道可诱导CD4+ T细胞向调节性T细胞(Treg) 分化,从而分泌白细胞介素10 (IL-10) 等细胞因子抑制炎症性自身免疫反应,并能够治愈动物实验性结肠炎[5]。因此,使用脆弱拟杆菌单一菌株能否有效治疗银屑病值得研究。脆弱拟杆菌BF839是我国微生物学家张季阶于1983年9月从健康婴幼儿粪便中分离培养并产业化的肠道共生菌,经生理生化鉴定以及动物毒力试验等证明是一株无毒无害的脆弱拟杆菌[6],具有增强免疫、预防肠道和呼吸道疾病、促进儿童身体生长发育等功效[7],由其发酵制得的图腾益生液,填补了拟杆菌作为益生菌的空白。它于1997年被批准为中国新资源食品,已在中国上市超过20年,其安全性值得信任。目前尚未有使用脆弱拟杆菌治疗银屑病的研究,有关益生菌治疗银屑病的临床报道目前只有4项[8-11],因此本研究设计了一个单臂、开放的探索性临床研究,旨在初步了解脆弱拟杆菌BF839对银屑病的治疗效果和安全性。
1 材料与方法 1.1 研究对象选择2019年4月至2019年10月在广州医科大学附属第二医院皮肤科就诊、经病理确诊的27例寻常型银屑病患者作为研究对象。本研究方案经广州医科大学附属第二医院伦理委员会批准,患者均签署知情同意书。临床试验注册号:中国临床试验注册中心,ChiCTR1900022383。患者纳入标准:年龄6–70周岁;表现为反复发作的头皮、躯干、四肢的对称性红斑、丘疹、红斑块,表面白色鳞屑;病理符合寻常型银屑病诊断标准[12]。排除标准:入组前4周银屑病治疗方案有变化;入组前4周内曾服用益生菌、抗生素或同时接受了其他临床试验;入组前12周内有口服糖皮质激素类、免疫抑制剂、生物制剂及光化学疗法等全身治疗;妊娠或处于哺乳期的女性;合并有其他心、肺、肾脏等重要脏器功能损害或疾病的患者。退出标准:试验期间增加其他银屑病相关治疗(包括全身及外用治疗);服用抗生素;服用其他益生菌;参加其他临床研究;不按要求服用本研究益生菌(少服 > 20%试验用量) (图 1)。
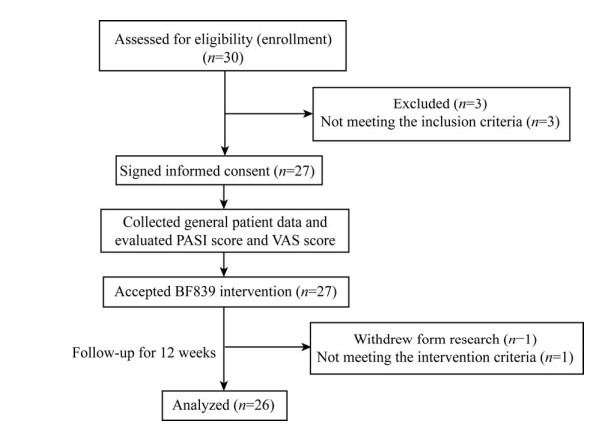
|
| 图 1 试验流程图 Fig. 1 Experimental flowchart. |
| |
患者口服脆弱拟杆菌BF839粉剂(图腾益生液粉剂,10 g/支,活菌量106 CFU/支,沈阳新图腾生物工程有限公司生产),饭后20 min内温开水冲服,每次1支,每日2次,连续服用12周。在试验期间,仍维持入组前4周的治疗方案(允许减停外用药,否则视为退出)。
1.2.2 观察指标及疗效标准入组前及治疗后4周、8周、12周分别进行PASI评分和VAS评分,与治疗前的评分比较,计算评分下降率。
终极指标:入组前及治疗后4周、8周、12周分别进行PASI评分,与治疗前的评分比较,计算评分下降率。疗效判断标准:PASI30定义为评分治疗后下降率≥30%的患者比例;PASI50定义为评分治疗后下降率≥50%的患者比例;PASI75定义为评分治疗后下降率≥75%的患者比例。
次级指标:入组前及治疗后4周、8周、12周分别进行VAS评分。VAS评分疗效判断标准:有效,VAS评分较干预前评分降低;无效,VAS评分较干预前没变化或增加。
1.2.3 PASI与VAS评分标准PASI评分由以下公式计算得出:PASI评分= (E头+I头+D头)×A头×0.1+(E上肢+I上肢+D上肢)×A上肢×0.2+(E躯干+I躯干+D躯干)×A躯干×0.3+(E下肢+I下肢+D下肢)×A下肢×0.43。其中A代表皮损面积大小系数,根据皮损面积占该部位的总面积比例赋予0–6的分值:0=无皮疹(即0);1=1%–9%;2=l0%–29%;3=30%–49%;4=50%–69%;5=70%–89%;6=90%–100%。其中E、I、D分别代表各部位皮损的红斑、浸润、鳞屑的严重程度,具体严重程度评分为:红斑(E):1-呈淡红色,2-红色,3-深红色,4-红色极深;浸润(I):0-皮损与正常皮肤平齐,1-皮损轻微高出于正常皮肤表面,2-中等度隆起,斑块的边缘为圆或斜坡型,3-皮损肥厚,隆起明显,4-皮损高度增厚,隆起极为明显;鳞屑(D):0-表面无可见鳞屑,1-大多数皮损表面上覆有鳞屑,以细微的鳞屑为主,2-大多数皮损表面完全或不完全覆有鳞屑,鳞屑呈片状,3-几乎全部皮损表面覆有鳞屑,鳞屑较厚成层,4-全部皮损表面均覆有鳞屑,鳞屑很厚成层。VAS评分:0-无瘙痒;1–3-轻度瘙痒(不影响生活、睡眠);4–6-中度瘙痒(生活、睡眠受到影响);7–10-重度瘙痒(严重影响生活、睡眠)。
1.3 统计学方法所有数据采用SPSS 17.0统计软件分析。计量资料均用(x±s) 表示,根据数据的正态性和方差齐性,采用配对t检验。计数资料用率(%) 表示,采用卡方检验。P < 0.05认为有统计学意义。
2 结果与分析 2.1 患者一般资料共入组27例患者,男18例,女9例;年龄22–67岁,平均年龄为(44.0±14.1) 岁;入组前PASI评分为9.1±5.9;VAS评分为2.9±2.2;病程1–30年,平均病程(10.7±7.0) 年;体质指数(BMI) (23.1±4.1) kg/m2,其中BMI≥24.0的超重/肥胖患者11例;入组前12周均无口服糖皮质激素类、免疫抑制剂、生物制剂及光化学疗法等全身治疗:全身用药患者0例(0%);局部皮肤外用药患者15例(55.6%):其中规律用药(1天1次) 比例为20.0% (3/15),包括糖皮质激素类1例、维生素D3衍生物1例,糖皮质激素类合并维生素D3衍生物1例;不规律用药(≥2天1次) 比例为80% (12/15),包括糖皮质激素类1例、维生素D3衍生物合并角质促成剂2例、硫磺软膏1例、中药膏5例;其他不明成分3例;无用药者12例(44.4%)。既往大便异常8例。
2.2 12周完成率12周完成率为96.3% (26/27),1例患者在完成4周的治疗后,因外出未携带试验用品造成停服 > 20 %试验用量而退出试验。
2.3 治疗前后有效率及PASI评分比较第4周PASI30为42.3%,PASI50为23.1%,PASI75为7.7%;第8周PASI30为53.8%,PASI50为34.6%,PASI75为7.7%;第12周PASI30为65.4%,PASI50为42.3%,PASI75为19.2% (表 1)。
| Time | PASI75 | PASI50 | PASI30 |
| 4 weeks | 2 (7.7) | 6 (23.1) | 11 (42.3) |
| 8 weeks | 2 (7.7) | 9 (34.6) | 14 (53.8) |
| 12 weeks | 5 (19.2) | 11 (42.3) | 17 (65.4) |
治疗前平均PASI评分为9.1±5.9,治疗4周时平均PASI评分为6.9±5.0,治疗8周时平均PASI评分为5.8±4.6,治疗12周时平均PASI评分为5.8±4.9,与治疗前相比,差异均具有显著统计学意义(P < 0.01) (表 2)。
| Time | x±s | T value | P value |
| Before therapy | 9.1±5.9 | ||
| 4 weeks | 6.9±5.0 | 3.4 | 0.002 |
| 8 weeks | 5.8±4.6 | 5.5 | 0.000 |
| 12 weeks | 5.8±4.9 | 4.2 | 0.000 |
治疗12周后27例患者中有11例VAS评分降低,9例无变化,6例加重,有效率为42.3% (11/26)。治疗前后瘙痒程度VAS评分差异无显著性差异(P > 0.05) (表 3)。
| Time | x±s | T value | P value |
| Before therapy | 2.9±2.2 | ||
| 4 weeks | 2.7±2.3 | 0.7 | 0.517 |
| 8 weeks | 2.3±2.0 | 1.4 | 0.174 |
| 12 weeks | 2.3±2.1 | 1.3 | 0.209 |
26例患者,以PASI30作为疗效分组,分成有无疗效两组进行分析,两组间性别、年龄、病程、合并用药、治疗前BMI、治疗前大便情况、治疗前PASI评分、治疗前VAS评分差异均无统计学意义(P > 0.05) (表 4)。
| Influencing factors | Invalid group | Effective group | T value/x2 | P value |
| Gender (%) | ||||
| Male | 7 (70.0) | 10 (62.5) | 0.2 | 1.000 |
| Female | 3 (30.0) | 6 (37.5) | ||
| Age (SD) | 41.3±14.8 | 46.6±13.6 | 0.9 | 0.358 |
| Period of disease (SD) | 12.8±8.6 | 9.9±5.6 | 1.1 | 0.301 |
| Combined medication (%) | ||||
| Yes | 4 (40.0) | 12 (75.0) | 1.9 | 0.171 |
| No | 6 (60.0) | 4 (25.0) | ||
| BMI before treatment (%) | ||||
| Obesity | 2 (20.0) | 2 (12.5) | 1.3 | 0.736 |
| Overweight | 2 (20.0) | 4 (25.0) | ||
| Normal | 6 (60.0) | 9 (56.3) | ||
| Thin | 0 (0.0) | 1 (6.3) | ||
| Stool situation before treatment (%) | ||||
| Constipation | 2 (20.0) | 4 (25.0) | 2.3 | 0.320 |
| Diarrhea | 0 (0.0) | 2 (12.5) | ||
| Normal | 8 (80.0) | 10 (62.5) | ||
| PASI score before treatment (SD) | 8.3±5.8 | 9.6±6.0 | 0.5 | 0.605 |
| VAS score before treatment (SD) | 3.0±2.3 | 2.9±2.2 | 0.1 | 0.889 |
1例患者出现便秘,在服用本益生菌后开始出现,持续2周,可自行缓解,不良反应率为3.8% (1/26)。
2.7 药物减停率26例患者中,治疗前12周和治疗12周内均无口服糖皮质激素类、免疫抑制剂、生物制剂及光化学疗法等全身治疗。全身用药患者0例(0%),局部皮肤外用药患者15例(57.7%),无用药治疗患者11例(42.3%)。在服用脆弱拟杆菌BF839 12周内,患者的减停外用药率为60.0% (9/15),其中减量33.3% (5/15),停药26.7% (4/15),其余40.0% (6/15) 没变化,加药0%。
3 讨论益生菌是一类可调节肠道微生态平衡的活性微生物,能够参与免疫调节、代谢等过程[13]。肠——皮肤轴是近年提出的皮肤与肠道微生物通过炎症介质、代谢物和肠道屏障相互作用的新机制[14],这也为改善银屑病皮疹提供了一种新疗法-肠道菌群调节。口服益生菌可能成为一种有效、简单、安全、廉价、可长期使用的治疗方法。但何种菌株或菌株复合物能治疗银屑病的研究数据有限,尚不足以给出合适的益生菌治疗方案[15]。卢秀仪[10]报道银屑病患者在口服阿维A胶囊治疗下辅以双歧杆菌四联活菌片治疗3个月后,该实验组较对照组的有效率(PASI30) 提高了20%,在另外一项临床试验中,Vicente等使用益生菌混合物与局部类固醇一起辅助治疗银屑病患者,试验组较对照组的有效率(PASI75) 提高了24.8%[11]。以上结果显示,益生菌治疗对银屑病有疗效,但是这些都是混合菌株,且都是在全身用药的基础上进行的添加治疗,目前尚无用单一菌株治疗银屑病的研究。
我们的初步研究发现,经脆弱拟杆菌BF839治疗12周PASI30为65.4%、PASI50为42.3%、PASI75为19.2%;治疗前PASI评分为9.1±5.9,治疗12周后PASI评分为5.8±4.9,具有显著统计学差异(P < 0.01)。1项随机双盲安慰剂对照试验显示[16]:安慰剂组中无全身用药及光疗且有/无外用药的银屑病患者治疗12周后,PASI50为11.8%,PASI75为11.8%。而本研究脆弱拟杆菌治疗后PASI50为42.3%,PASI75为19.2%,均高于安慰剂效应,这显示脆弱拟杆菌BF839对银屑病治疗有一定疗效。12周的VAS有效率为42.3%,瘙痒程度的改善情况不如皮损严重程度明显,也许与治疗前银屑病患者瘙痒不明显、VAS评分较低有关。尽管本试验没有限定患者的银屑病外用药,但是完全无外用药者达44.4%,全身用药患者占0%,局部皮肤用药者只占55.6%,其中不规律用药者多达80%;另外结果显示患者是否合并使用银屑病外用药物对疗效并没有显著差异,这提示患者在脆弱拟杆菌治疗前后的病情改变倾向于益生菌治疗导致。
目前显示银屑病的治疗药物(如糖皮质激素、维A酸类、甲氨蝶呤、环孢霉素、生物制剂(IL-17A单抗Taltz) 等) 长期使用有明显毒副作用[17-20]。有学者回顾性分析了100例银屑病患者在IL-17A抑制剂Taltz (ixekizumab) 治疗过程中约26%的患者出现了副作用,其中约53.8%为注射部位局部反应[18];多达60%的患者在接受单一甲氨蝶呤(MTX) 治疗后可出现包括胃肠道耐受不良、乏力、关节痛和发烧等不良反应,尤其在不正确地以较高剂量服用MTX时可发生危及生命的严重不良反应[19]。另外31例病人服用阿维A后不良反应发生率达32.26%[20]。而本试验显示,在脆弱拟杆菌治疗过程中仅1例银屑病患者出现便秘的不良反应且之后自行缓解,不良反应率为3.8%,试验完成率为96.3% (26/27),药物减停率达60.0%,说明脆弱拟杆菌BF839具有较好的安全性和依从性。尽管与传统药物及生物制剂相比,益生菌疗效可能稍差,但是不良反应轻微且发生率低,这是一个明显的优势,尤其对于需要长期甚至终身治疗的银屑病患者,安全性更为重要。
综上所述,脆弱拟杆菌BF839对银屑病治疗有一定疗效,可降低PASI评分及药物使用率,不良反应低,是一种短期有效、安全的治疗方法,值得进一步研究。本研究的局限性是单臂试验,样本量较小,下一步将开展随机双盲对照试验,扩大样本量,明确其短期疗效并进行更长期的试验设计,观察是否可减少复发,提高患者生活质量。
| [1] |
丁晓岚, 王婷琳, 沈佚葳, 等. 中国六省市银屑病流行病学调查. 中国皮肤性病学杂志, 2010, 24(7): 598-601. Ding XL, Wang TL, Shen YW, et al. Prevalence of psoriasis in China: an epidemiological survey in six provinces. Chin J Dermatovenereol, 2010, 24(7): 598-601 (in Chinese). |
| [2] |
程龙龙, 姜述堃, 杜阳, 等. 银屑病的发病机制及其研究进展. 医学综述, 2019, 25(2): 227-232. Cheng LL, Jiang SK, Du Y, et al. Pathogenesis of psoriasis and its research progress. Med Recapitul, 2019, 25(2): 227-232 (in Chinese). DOI:10.3969/j.issn.1006-2084.2019.02.004 |
| [3] |
王丽玮, 罗玲玲, 崔盘根, 等. 肠道菌群与银屑病关系的研究进展. 中华皮肤科杂志, 2019, 52(5): 357-360. Wang LW, Luo LL, Cui PG, et al. Relationship between intestinal flora and psoriasis. Chin J Dermatol, 2019, 52(5): 357-360 (in Chinese). DOI:10.3760/cma.j.issn.0412-4030.2019.05.018 |
| [4] |
Scher JU, Ubeda C, Artacho A, et al. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol, 2015, 67(1): 128-139. DOI:10.1002/art.38892
|
| [5] |
Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc Natl Acad Sci USA, 2010, 107(27): 12204-12209. DOI:10.1073/pnas.0909122107
|
| [6] |
张季阶, 于丽娴, 徐灵芝, 等. 一株无毒脆弱拟杆菌的分离鉴定. 宁夏医学杂志, 1991, 13(4): 216-218. Zhang JJ, Yu LX, Xu LZ, et al. Isolation and identification of a non-toxic Bacteroides fragilis. Ningxia Med J, 1991, 13(4): 216-218 (in Chinese). |
| [7] |
张季阶, 张洪梅, 张翼, 等. 脆弱拟杆菌(BF839)菌液的临床应用研究. 中国生物制品学杂志, 1995, 8(2): 63-65. Zhang JJ, Zhang HM, Zhang Y, et al. Clinical application of Bacteroides fragilis (BF839) fluid. Chin J Biol, 1995, 8(2): 63-65 (in Chinese). |
| [8] |
Vijayashankar M, Raghunath N. Pustular psoriasis responding to probiotics — a new insight. Our Dermatol Online, 2012, 3(4): 326-329. DOI:10.7241/ourd.20124.71
|
| [9] |
Groeger D, O'Mahony L, Murphy EF, et al. Bifidobacterium infantis 35624 modulates host inflammatory processes beyond the gut. Gut Microbes, 2013, 4(4): 325-339. DOI:10.4161/gmic.25487
|
| [10] |
卢秀仪. 益生菌治疗寻常性银屑病的随机、双盲、对照研究. 中国当代医药, 2017, 24(8): 47-49. Lu XY. The randomized, double blind and control study of probiotics in the treatment of psoriasis vulgaris. China Mod Med, 2017, 24(8): 47-49 (in Chinese). DOI:10.3969/j.issn.1674-4721.2017.08.013 |
| [11] |
Vicente Navarro López, Asunción Martinez-Andres, Ana Ramírez-Bosca, et al. Efficacy and safety of oral administration of a mixture of probiotic strains in patients with psoriasis: a randomized controlled clinical trial[EB/OL]. [2019-09-23] https://www.researchgate.net/publication/335920830.
|
| [12] |
张学军. 皮肤性病学. 5版. 北京: 人民卫生出版社, 2001. Zhang XJ. Dermatology. Beijing: People's Medical Publishing House, 2001 (in Chinese). |
| [13] |
史佳鹭, 闫芬芬, 李慧臻, 等. 益生菌对溃疡性结肠炎影响的研究进展. 食品科学, 2020, 41(15): 301-308. Shi JL, Yan FF, Li HZ, et al. Recent advances in understanding the potential impact of probiotic on ulcerative colitis. Food Sci, 2020, 41(15): 301-308 (in Chinese). DOI:10.7506/spkx1002-6630-20190720-259 |
| [14] |
Arck P, Handjiski B, Hagen E, et al. Is there a 'gut-brain-skin axis'?. Exp Dermatol, 2010, 19(5): 401-405. DOI:10.1111/j.1600-0625.2009.01060.x
|
| [15] |
Szántó M, Dózsa A, Antal D, et al. Targeting the gut-skin axis—probiotics as new tools for skin disorder management?. Exp Dermatol, 2019, 28(11): 1210-1218. DOI:10.1111/exd.14016
|
| [16] |
Disphanurat W, Viarasilpa W, Chakkavittumrong P, et al. The clinical effect of oral vitamin D2 supplementation on psoriasis: a double-blind, randomized, placebo-controlled study. Dermatol Res Pract, 2019, 2019: 5237642.
|
| [17] |
Boehncke WH, Brembilla NC. Immunogenicity of biologic therapies: causes and consequences. Expert Rev Clin Immunol, 2018, 14(6): 513-523. DOI:10.1080/1744666X.2018.1468753
|
| [18] |
Deza G, Notario J, Lopez-Ferrer A, et al. Initial results of ixekizumab efficacy and safety in real-world plaque psoriasis patients: a multicentre retrospective study. J Eur Acad Dermatol Venereol, 2019, 33(3): 553-559. DOI:10.1111/jdv.15288
|
| [19] |
Yélamos O, Puig L. Systemic methotrexate for the treatment of psoriasis. Expert Rev Clin Immunol, 2015, 11(5): 553-563. DOI:10.1586/1744666X.2015.1026894
|
| [20] |
王媛, 张悦, 程岩峰, 等. 甲氨蝶呤、环孢素与维A酯治疗中重度银屑病效果的系统评价. 中国误诊学杂志, 2011, 11(1): 12-14. Wang Y, Zhang Y, Cheng YF, et al. Efficacy and safety of cyclosporine, methotrexate and etretinate in psoriasis: systematic review. Chin J Misdiagnostics, 2011, 11(1): 12-14 (in Chinese). |
 2021, Vol. 37
2021, Vol. 37




