
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 胡暄, 王松, 于璐, 张晓鹏, 陈薇
- Hu Xuan, Wang Song, Yu Lu, Zhang Xiaopeng, Chen Wei
- Cas9/sgRNA递送技术及其研究进展
- Advances of Cas9/sgRNA delivery system for gene editing
- 生物工程学报, 2021, 37(11): 3880-3889
- Chinese Journal of Biotechnology, 2021, 37(11): 3880-3889
- 10.13345/j.cjb.210040
-
文章历史
- Received: January 14, 2021
- Accepted: March 10, 2021
- Published: March 23, 2021
2. 军事医学研究院 生物工程研究所, 北京 100071
2. Beijing Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
Cas9蛋白和单一的向导RNA (Single guide RNA,sgRNA) 是近年来出现的颠覆性生物技术——规律成簇间隔的短回文重复(Clustered regularly interspersed short palindromic repeats,CRISPR)/Cas9基因编辑中最关键的两个生物大分子,Cas9蛋白和sgRNA组成的复合物能够对基因进行手术刀般的精确切割。与递呈病毒等需要在胞内转录、翻译基因的方法相比,直接递呈Cas9/sgRNA复合物,可以实现对基因编辑系统胞内含量和作用时间的定量调控,减少外源DNA整合突变以及基因持续表达导致的脱靶风险,增强基因编辑的特异性和安全性。然而,与其他蛋白类或RNA类生物大分子相似,Cas9/sgRNA胞内稳定性差,将其递送至细胞核发挥功能是一项巨大挑战。本文主要阐述了各Cas9/sgRNA递送系统的材料结构、生物学特点以及应用进展,并在此基础上展望了递呈载体的研究前景,为基因编辑系统向临床上发展和应用提供基础。
1 Cas9/sgRNA递送技术的研究价值 1.1 CRISPR/Cas9基因编辑系统为了保护自身免受外源遗传物质(如噬菌体、质粒) 的侵袭,细菌和古细菌进化出了一种RNA分子介导的获得性免疫系统,称为CRISPR[1]。2013年,研究者利用化脓性链球菌的Cas9蛋白首次在哺乳动物细胞中实现了RNA引导下的精确靶向和基因组序列修饰,为CRISPR/Cas9作为一种广泛应用的基因组编辑工具奠定了基础[2-3]。此外,研究者还确定了优化后的RNA结构,sgRNA使基因编辑系统的设计变得更简单[4]。近年来,CRISPR/Cas9技术的开发及其易用性极大地促进了基因组工程的发展,正在成为生物医学研究、药物发现、基因治疗等领域的宝贵工具。在实验室水平上,这项技术的实施很简单,仅仅需要设计与靶序列互补的20–30 bp长度的sgRNA[5]。
1.2 CRISPR/Cas9临床应用的潜在隐患CRISPR/Cas9系统在临床应用中可能存在的隐患包括其固有脱靶效应以及基因递呈方式所带来的风险。已有报道证实CRISPR/Cas9系统在人细胞系内会导致脱靶效应[6-8]。对于生物研究和临床应用来说,意外的编辑可能会引起不必要的突变和潜在的毒性[9],导致癌症或其他难以预知的危害。目前CRISPR/Cas9系统的递呈主要以递送编码基因的DNA序列来实现,即以重组病毒为载体或以质粒的形式递送[2-3, 10-12]。外源DNA的引入易引发基因组的永久性重组,造成对内源基因的潜在破坏,从而加剧了临床使用的安全隐患。此外,模板驱动的基因表达形式导致CRISPR/Cas9系统在细胞内持续表达,延长了与非特异位点的相互作用时间,可能导致脱靶效应的增强[7, 13]。因此,CRISPR/Cas9基因编辑技术广泛应用的关键之一在于需要安全有效的递送方法。
1.3 直接递送Cas9/sgRNA复合物的优势有限剂量的Cas9/sgRNA复合物短暂作用于基因组DNA就可以提供充分的临床效益[14]。原则上,Cas9蛋白可以被Cas9 mRNA替代,近期我国学者自主开发的类病毒体(Virus-like particle,VLP) 递送Cas9 mRNA实现了安全高效的体内基因编辑[15]。但mRNA极易受到核酸酶的降解,而Cas9/sgRNA为相对稳定的自组装复合物;且转染前很难检测Cas9 mRNA的功能,而Cas9蛋白的活性则比较容易在体外测试。因此,Cas9/sgRNA的递送成为CRISPR基因编辑技术向临床应用发展的一个重大突破方向。
目前已经发展了一些应用在Cas9/sgRNA复合物上的递送技术。除了物理方法外,大多依靠载体材料上的正电荷或局部正电结构,将载体黏合到带负电荷的细胞膜来实现Cas9/sgRNA复合物的跨膜传递。这些技术与质粒或病毒的递呈相比,具有非常独特的优势,具体体现在以下几个方面:由于递呈时避免了转录过程,可以更精确地控制给药时间,降低了脱靶效应;蛋白质和RNA不能被整合到基因组中,减少了诱发癌症的风险;由于合成材料的免疫原性通常较低,有潜力通过多剂量或反复给药提高疗效。表 1总结了近年来文献报道的基于Cas9/sgRNA递送的方法或载体,包括显微注射、电转、细胞穿透肽、脂质体、高分子、石墨烯和金颗粒等新型纳米合成材料等。
| Delivery forms | Common components | Delivery mechanisms | Applications | References |
| Microinjection | − | Mechanical force | Gonads and embryos of animals | [16-17] |
| Electroporation | − | Mechanical force | Human stem cells and primary cells | [18-24] |
| Cell-penetrating peptide | Arginine | Positive charge | Human stem cells and primary cells, mouse brain | [25-26] |
| Lipid | Lipid bilayer | Positive charge, membrane fusion | Only cell lines | [27-28] |
| DNA nanoclew | Palindromic sequences, polyethyleneimine | Positive charge, complementary base pairing | Only cell lines | [29] |
| Gold nanoparticle derivative | Arginine, cationic polymer | Positive charge, complementary base pairing | Human stem cells and primary cells, mouse muscle | [30-31] |
| Graphene derivative | Graphene oxide, polyethylene glycol, polyethyleneimine | Positive charge, π-stacking interaction | Only cell lines | [32] |
| Metal-organic framework and lipid | Imidazole-2-carboxaldehyde, Zn2+, Lipofectamine 2000 | − | Only cell lines | [33] |
| Dendritic polymer | G5 PAMAM, phenylboronic acid | Positive charge, cation-π interaction, nitrogen-boronate complexation | Only cell lines | [34] |
| Nanocapsule polymer | Imidazole, N, N’-bis(acryloyl)cystamine, polyethylene glycol | Positive charge, targeting ligand | Human stem cells, mouse retina and muscle | [35] |
物理方法主要包括显微注射和电转,利用设备将Cas9/sgRNA复合物直接递呈至细胞质或细胞核,能够迅速切割靶向DNA,且能在细胞中快速降解。物理方法能够广泛应用于不同的细胞类型。例如对于难转染的原代T细胞来说,目前只有电转被报道用于Cas9/sgRNA的递送和基因编辑功能的实现[21-24]。
Cho等[16]与Sung等[17]分别将Cas9/sgRNA复合物显微注射到秀丽隐杆线虫的性腺以及斑马鱼和小鼠的胚胎中,在新生动物中成功检测到了基因敲除。Kim等[18]通过电转的方式将Cas9/sgRNA递呈至人红白血病细胞系(K562),通过改变sgRNA靶向不同的位点,分别获得从16%至72%的编辑效率,平均效率为44%。电转Cas9/sgRNA至难用其他方式转染的人成纤维细胞和多能干细胞中,也能分别得到19%和23%的基因编辑效率。Lin等[19]利用电转进一步将Cas9/sgRNA和同源定向修复(Homology-directed repair,HDR) 模板DNA转入人胚肾细胞系(HEK293T)、成纤维细胞和多能干细胞中。他们发现,通过化学抑制剂使细胞周期同步,且加上Cas9/sgRNA的定时递送可以最大程度地提高HDR效率(在HEK293T细胞系中为33%),远比未经过细胞周期同步处理的细胞的HDR效率高;成纤维细胞和多能干细胞在经过细胞周期同步处理后得到HDR的效率分别为1.3%和2%,而未经过这一处理时检测不到HDR介导的DNA修复。Schumann等[20]通过电转将Cas9/sgRNA递呈至原代T细胞,成功实现了近40%的基因编辑效率;进一步引入HDR模板,产生了高达20%的基因敲入效率。这些研究为CRISPR/Cas9技术在人原代T细胞中的基因组工程治疗应用奠定了基础。
但基于机械作用的这些物理方法具有较大的细胞毒性且需要特定的设备,对于体内治疗来说通常是不实际的。
3 传统递送载体细胞穿透肽(Cell-penetrating peptide,CPP)和脂质体是最传统的两种药物递送载体,均呈阳离子属性,可通过静电相互作用与细胞膜融合并内吞入胞。前者本质上是由氨基酸组成的多肽,常用于递送融合蛋白;而后者具有与细胞膜类似的脂质双分子层结构,常用于递送核酸。生物相关的组成结构使得两种载体对细胞和机体的毒性较小。有研究人员利用这两种载体进行了Cas9/sgRNA复合物的递呈探索。
3.1 细胞穿透肽Park等[25]将Cas9和sgRNA负载到富含精氨酸(Arginine,R) 和亮氨酸(Leucine,L) 的两亲性多肽R7L10自组装形成的胶束状纳米材料中,将得到的纳米复合物注射到成年活体小鼠脑内,成功在其体内神经元中实现了45%的Bace1基因靶向敲除,缓解了阿尔茨海默病小鼠模型的β淀粉样蛋白相关的病理和认知缺陷,且并未产生脱靶效应,也没有提高基因组突变率。这种CPP载体结合机械注射的方法有望成为治疗神经系统疾病的一种新策略。
Ramakrishna等[26]设计了两种富含精氨酸、亮氨酸和甘氨酸(Glycine,G) 的CPP。其中一种CPP的一端连接有马来酰亚胺基团,通过基因改构,使Cas9蛋白的C端增加一个半胱氨酸(Cysteine,C) 残基,半胱氨酸中的巯基与CPP中的马来酰亚胺基可在中性pH环境下特异性共价结合,形成稳定的硫醚键。由于CPP富含带正电的精氨酸,可使与其通过硫醚键偶联的Cas9也带上正电荷;另一CPP可直接通过静电相互作用使sgRNA缩合成带正电荷的粒子。CPP的引入使Cas9和sgRNA两个大分子分别形成正电纳米粒子,从而实现Cas9和sgRNA在多种人细胞系的直接递送,并发挥有效的基因编辑功能。
但由于胞吞机制的限制,CPP进入细胞后易陷入内体(Endosome) 而被蛋白酶消化,使得这一体系在HEK293T细胞系递送一次产生的基因编辑效率仅为10%,3次递呈可将基因编辑效率提高至20%以上。此外,基于CPP的递送效率易受细胞的类型和状态影响。在宫颈癌细胞系(Hela)、人类胚胎癌细胞系(NCCIT)、原代细胞如人皮肤成纤维细胞和人胚胎细胞干细胞中,经过3次递呈后基因编辑效率仅分别为5.5%、2.7%、8.4%和2.3%。因此,这种效率较低的递送方法并不适合于广泛应用。
3.2 脂质体Zuris等[27]利用商业化脂质体RNAiMAX和Lipofectamine 2000实现了Cas9/sgRNA在细胞内的高效递送。其中,以Lipofectamine 2000为载体递送Cas9/sgRNA时,人骨肉瘤细胞系(U2OS) 中的基因敲除效率高达80%。此外,递送Cas9与多条sgRNA的混合物可实现多重基因组编辑。而递送Cas9/sgRNA和HDR模板的混合物时,基因组修饰效率达到11%。为了研究类脂的化学结构和活性的关系,Wang等[28]分别将12种不同的一级或二级胺与具有二硫键和14个碳的疏水尾的丙烯酸酯进行迈克尔加成反应,合成了12种阳离子生物可还原类脂。其中,以N-(3-氨丙基) 二乙醇胺为反应物合成的类脂8-O14B与Cas9/sgRNA形成的纳米复合物能在HEK细胞内介导70%的基因敲除效率。类脂为载体时的递送效率高于Lipofectamine 2000,这源于二硫键的整合设计能够促进纳米复合物在胞内还原环境中的内体逃逸。
虽然脂质体具有一定的转染能力,但其递呈效率高度依赖于细胞类型且常受到血清的抑制作用[36]。体内治疗时,脂质体与血浆组分接触无疑会影响其对靶细胞的作用,而人工合成的新型纳米材料有潜力克服这些问题。近期,已有研究者使用高分子、石墨烯、金颗粒等新型合成材料实现了Cas9/sgRNA复合物的递呈。
4 新型合成材料载体 4.1 DNA纳米笼Sun等[29]受到单链DNA与sgRNA碱基互补配对能产生可逆的强相互作用的启发,利用滚环扩增技术(Rolling circle amplification,RCA) 合成了与sgRNA部分互补的DNA纳米笼(Nanoclews,NCs),并在RCA的模板DNA中设计有能够驱动自组装的回文序列。通过基于碱基互补的氢键作用力将Cas9/sgRNA复合物负载至DNA NCs,又应用阳离子聚合物聚乙烯亚胺(Polyethyleneimine,PEI) 对体系进行涂层。PEI易质子化,能将Cas9/sgRNA/NC缩合成尺寸约56 nm的带正电纳米粒子,可黏合至带负电的细胞表面。共组装的纳米粒子通过胞吞进入细胞后,又能从内体中逃逸并释放到细胞质中,最终实现靶向的基因编辑。经研究发现,与0或23个碱基互补时相比,用来滚环扩增的模板DNA与sgRNA有12个碱基互补时,Cas9/sgRNA/NC-12/PEI实现的基因编辑效率最高(在U2OS细胞系中达到28%),这一结果可能与Cas9/sgRNA复合物与DNA NCs的结合和释放达到了平衡有关。
4.2 金纳米颗粒衍生物Mout等[30]在小分子表面修饰金纳米颗粒的多年研究基础上[37-39],设计出了一种将Cas9/sgRNA复合物跨膜运输至多种细胞实现基因编辑的新策略。这种策略对Cas9以及金纳米颗粒进行了精细的共设计,在Cas9的N端插入谷氨酸(Glutamic acid,E) 标签(E-tag),通过调节E-tag的长度(0–20),使修饰后的Cas9En具有带电量可控的局部负电荷,能够与带正电荷的精氨酸金纳米颗粒(Arginine gold nanoparticles,ArgNPs) 相互作用形成球状的纳米组装体。纳米组装体能够负载Cas9En和sgRNA,与细胞膜融合后,将Cas9En/sgRNA直接释放到细胞质而不被细胞器所捕获。这一跨膜运输机制在Hela细胞系中实现了90%的递送效率,基因编辑效率为30%。随着E-tag长度的增加,纳米组装体尺寸增大,Cas9E15和Cas9E20形成的组装体尺寸能达到400–500 nm,且递呈效果最好。但这一方法的限制在于需要对Cas9进行改构,使用的便利性降低。
Lee等[31]由金纳米颗粒出发设计了一种新的载体,命名为CRISPR-Gold,可以将Cas9/sgRNA和HDR供体DNA成功递送到多种难转染的原代细胞和干细胞中,HDR效率在3%–4%。CRISPR-Gold还能在活体小鼠肌肉组织中有效地诱导HDR,校正了小鼠中5.4%的肌营养不良蛋白基因,约为直接用Cas9/sgRNA和供体DNA治疗效果的18倍。CRISPR-Gold由硫醇修饰的单链DNA (5′ thiol modified single-stranded DNA,DNA-SH) 和金纳米颗粒(Gold nanoparticles,GNP) 偶联而成。DNA-SH可以与供体DNA通过碱基互补配对结合,随后与Cas9/sgRNA以及具有内体破坏性的阳离子高分子聚(N-(N-(2-氨基乙基)-2-氨基乙基) 天冬酰胺(poly(N-(N-(2- aminoethyl)-2-aminoethyl)aspartamide),PAsp(DET))复合。进入细胞后,CRISPR-Gold上的PAsp(DET)引发内体破裂并使CRISPR-Gold释放到细胞质中。重要的是,细胞质中还原性的谷胱甘肽(Glutathione,GSH) 可使硫醇键断裂,DNA从CRISPR-Gold的金核中解离,从而导致Cas9/sgRNA和供体DNA的释放。
4.3 石墨烯衍生物Yue等[32]对氧化石墨烯(Graphene oxide,GO)进行修饰设计了一种新的Cas9/sgRNA递送载体,在人胃腺癌细胞系(AGS) 实现了39%的基因编辑效率。该组利用氧化石墨烯上随机分布的羟基与氯乙酸在碱性条件下发生反应,生成α-取代羧基,从而使氧化石墨烯表面产生较多的羧基;然后在缩合剂1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)的存在下与聚乙二醇(Polyethylene glycol,PEG) 和PEI中的氨基偶联成酰胺,得到GO-PEG-PEI载体。在这一载体中,作为负载基体的GO是新型二维纳米材料石墨烯的衍生物,毒性较低,且巨大的比表面积使其负载量极高;作为一种生物相容性和稳定性良好的材料,GO早已成功运用在一些功能性蛋白的递呈和可控释放上[40]。PEG的修饰能够进一步增强GO的生物相容性和胶体的稳定性,再经过带正电的PEI修饰后,GO-PEG-PEI能够与带负电的sgRNA静电结合,且石墨烯平面本身能与Cas9中的芳香族氨基酸产生π-π堆积作用,从而形成稳定的GO-PEG-PEI/Cas9/sgRNA复合物,对极易降解的RNA具有一定的保护作用。形成的复合物可通过内吞作用进入细胞,然后基于PEI的质子海绵效应从内体中释放。
4.4 金属-有机骨架材料Yang等[33]基于金属-有机骨架(Metal-organic framework,MOF) 材料的思路,设计了一种三磷酸腺苷(Adenosine triphophate,ATP) 响应型的纳米级沸石咪唑骨架-90 (Zeolitic imidazole framework-90,ZIF-90) 作为Cas9递送的平台。咪唑-2-甲醛和Zn2+与Cas9反应自组装形成的ZIF-90/Cas9纳米颗粒有效地封装了Cas9。自组装纳米颗粒进入细胞后,由于生理环境中存在的ATP与ZIF-90中的Zn2+之间存在竞争性配位,纳米颗粒被降解,触发Cas9的释放;而sgRNA则另外通过Lipofectamine 2000递送。这一递送体系在Hela细胞系中的基因编辑效率为35%。鉴于疾病细胞中ATP通常会上调,ATP响应型的递送方法将可能为CRISPR/Cas9靶向治疗开辟新的机会。
4.5 纳米聚合物Liu等[34]报道了一种富含苯硼酸的树枝状高分子纳米载体(P4),能够同时结合阴离子和阳离子基团形成稳定的复合物,在递送各种大小和等电点的蛋白质时均取得了极高的效率。P4的合成以商品化的G5 PAMAM为骨架内核,后者是一种接枝率极高的树枝状大分子,与4-(溴甲基) 苯硼酸(4-(bromomethyl)phenylboronic acid,PBA) 反应可引入大量苯硼酸基团。PBA中的芳香环可以通过阳离子-π相互作用与蛋白质上的胍基或铵基结合;另一方面,蛋白质上的阴离子羧酸盐可以通过离子相互作用与G5 PAMAM骨架上的阳离子氨基结合;此外,PBA中的缺电子硼能通过氮-硼配位与蛋白质表面的氨基、咪唑等结合。正是由于这3种高亲和力的存在,P4作为Cas9/sgRNA递送载体在HEK293T细胞系中实现了40%的基因编辑效率。在该课题组关于树枝状大分子合理化设计的前期研究[41]中,还证明了苯基是促进膜融合的官能团,有利于复合物的内体逃逸,这也为设计P4时引入苯硼酸奠定了基础。
Chen等[35]在Cas9/sgRNA复合物表面引入阳离子单体、阴离子单体、含咪唑的单体、N, N’-双(丙烯酰)胱胺(N, N’-bis(acryloyl)cystamine,BAC) 交联剂以及与配体偶联的PEG,并引发原位自由基聚合反应,制备了包裹着Cas9/sgRNA的可生物降解的共价交联聚合物,称之为纳米胶囊(Nanocapsule,NC)。其中,阳离子和阴离子单体混合物通过静电相互作用吸附在Cas9/sgRNA周围,其他分子通过氢键和范德华力被吸引到Cas9/sgRNA表面。NC的设计性体现在以下多个方面:咪唑的质子海绵效应可促进内体逃逸;由于BAC交联剂能在富含GSH的环境中降解,胞质中存在的GSH可降解聚合物薄层结构,从而使Cas9/sgRNA释放到胞质中;外部水溶性的PEG壳可增加偶联部分的灵活设计性,可选择偶联靶向配体、CPP或成像探针等。NC能够在HEK293细胞系中实现79%的基因编辑效率,且在快速冷冻干燥处理后也能保持90%的生物学功能,从而允许长期储存和运输。对于难转染的胚胎干细胞,用CPP与NC偶联可以显著增强NC的细胞摄取水平,实现7%的基因编辑效率,比未偶联NC的编辑效率高3倍。另外,该组还评估了NC在小鼠视网膜色素上皮和肌肉的局部给药效果,发现也产生了一定的基因编辑。综合来看,NC最大的优势在于可简便地在结构里引入其他功能分子,实现在众多细胞系或组织中的基因编辑。但这一方法在面临多个靶基因时需要对每个Cas9/sgRNA复合物单独修饰,因此在应用至不同靶基因时具有一定的局限性。图 1展示了以上几类递呈工具的结构特点。
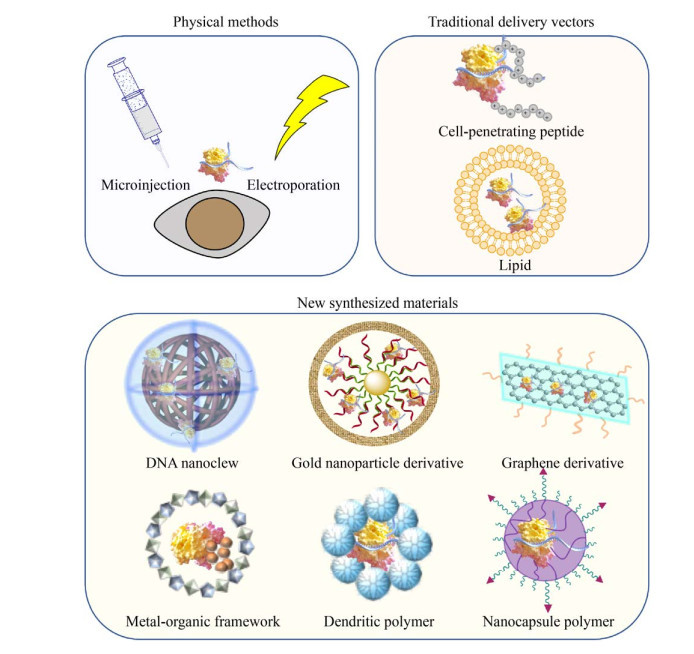
|
| 图 1 Cas9/sgRNA复合物的递送工具 Fig. 1 Cas9/sgRNA cargo delivery tools. |
| |
笔者课题组(数据尚未发表) 通过在载体蛋白表面原位引发单体聚合,合成了一种新型可降解纳米颗粒。其独特的化学结构使其可负载大量的Cas9/sgRNA,且能有效进入细胞,并在进入细胞后发生表面阳离子基团的自降解反应,导致Cas9/sgRNA释放,最终实现高效的基因编辑。这种方法其材料制备路线简单、绿色且生物相容性良好。我们已经利用这种新型Cas9/sgRNA递送系统成功在原代T细胞上实现了基因敲除,并且这一系统可以作为一种通用的平台,面向不同细胞、递送靶向不同基因的Cas9/sgRNA复合物,具有较为广阔的应用前景。
5 总结与展望截至2021年2月,在ClinicalTrials.gov网站注册使用CRISPR/Cas9系统的人体临床试验已有30余项,无论是实验室体外编辑细胞再输回患者体内,还是直接递送基因编辑系统到患者体内原位编辑,病毒和质粒仍是最主要的递送形式[42-43]。Cas9/sgRNA的直接递呈尚未应用至人的临床疾病治疗中,主要是由于Cas9/sgRNA递送技术发展相对滞后,且应用上还存在一些限制:1) 体内递送和编辑效率低是其临床转化的主要障碍;2) RNA在血清中的不稳定性和免疫原性导致其递送具有挑战性[44];3) 载体可能产生不可预知的毒性,如金纳米颗粒可在肝脏和脾脏内积聚较长时间并在多条通路上改变基因表达模式[15, 45];4) 用于临床的载体需要稳定制造工艺路线并进行产量优化。
CRISPR技术的奠基人、诺奖得主Jennifer A. Doudna提到“递送可能是体细胞基因编辑治疗最大的瓶颈”[46]。体内基因编辑治疗的临床应用领域期待着递送技术的突破,而直接递呈Cas9/sgRNA,由于其在安全性上颇具临床应用前景,近年来受到广泛关注,并发展了多种各具特色的递送系统。Cas9/sgRNA的递呈效率主要受限于Cas9/sgRNA与细胞膜融合性差以及Cas9/sgRNA易受蛋白酶和核酸酶干扰两个方面,这也是各个递送系统需要解决的共性问题。传统的电转、显微注射等物理方法和细胞穿透肽、脂质体等载体,在体外模型中都取得了一定的效果,但是体内应用受限较大。新型纳米材料可能是本研究领域的前景所在,但相关的研究仍较少,且常存在合成方法较为复杂等缺点。总的来看,设计递送载体应考虑多重因素,包括表面电荷、稳定性、高负载和可释放等,以实现蛋白和RNA的共负载、高效的细胞内吞、内体逃逸以及细胞核递送,从而实现高效而安全的基因组编辑,并进一步向临床治疗应用发展。
| [1] |
Mojica FJM, Díez-Villaseñor C, García-Martínez J, et al. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements. J Mol Evolut, 2005, 60(2): 174-182. DOI:10.1007/s00239-004-0046-3
|
| [2] |
Mali P, Yang LH, Esvelt KM, et al. RNA-guided human genome engineering via Cas9. Science, 2013, 339(6121): 823-826. DOI:10.1126/science.1232033
|
| [3] |
Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems. Science, 2013, 339(6121): 819-823. DOI:10.1126/science.1231143
|
| [4] |
Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 2012, 337(6096): 816-821. DOI:10.1126/science.1225829
|
| [5] |
Tyagi S, Kumar R, Das A, et al. CRISPR-Cas9 system: a genome-editing tool with endless possibilities. J Biotechnol, 2020, 319: 36-53. DOI:10.1016/j.jbiotec.2020.05.008
|
| [6] |
Pickar-Oliver A, Gersbach CA. The next generation of CRISPR-Cas technologies and applications. Nat Rev Mol Cell Biol, 2019, 20(8): 490-507. DOI:10.1038/s41580-019-0131-5
|
| [7] |
Fu YF, Foden JA, Khayter C, et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol, 2013, 31(9): 822-826. DOI:10.1038/nbt.2623
|
| [8] |
Tsai SQ, Zheng ZL, Nguyen NT, et al. Guide-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nat Biotechnol, 2015, 33(2): 187-197. DOI:10.1038/nbt.3117
|
| [9] |
Xue W, Chen SD, Yin H, et al. CRISPR-mediated direct mutation of cancer genes in the mouse liver. Nature, 2014, 514(7522): 380-384. DOI:10.1038/nature13589
|
| [10] |
Yin H, Song CQ, Dorkin JR, et al. Therapeutic genome editing by combined viral and non-viral delivery of CRISPR system components in vivo. Nat Biotechnol, 2016, 34(3): 328-333. DOI:10.1038/nbt.3471
|
| [11] |
Tabebordbar M, Zhu KX, Cheng JKW, et al. In vivo gene editing in dystrophic mouse muscle and muscle stem cells. Science, 2016, 351(6271): 407-411. DOI:10.1126/science.aad5177
|
| [12] |
Liang PP, Xu YW, Zhang XY, et al. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell, 2015, 6(5): 363-372. DOI:10.1007/s13238-015-0153-5
|
| [13] |
Pattanayak V, Lin S, Guilinger JP, et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol, 2013, 31(9): 839-843. DOI:10.1038/nbt.2673
|
| [14] |
Liu XJ, Zhang YP, Cheng C, et al. CRISPR-Cas9-mediated multiplex gene editing in CAR-T cells. Cell Res, 2017, 27(1): 154-157. DOI:10.1038/cr.2016.142
|
| [15] |
Ling SK, Yang SQ, Hu XD, et al. Lentiviral delivery of co-packaged Cas9 mRNA and a Vegfa-targeting guide RNA prevents wet age-related macular degeneration in mice. Nat Biomed Eng, 2021, 5(2): 144-156. DOI:10.1038/s41551-020-00656-y
|
| [16] |
Cho SW, Lee J, Carroll D, et al. Heritable gene knockout in Caenorhabditis elegans by direct injection of Cas9-sgRNA ribonucleoproteins. Genetics, 2013, 195(3): 1177-1180. DOI:10.1534/genetics.113.155853
|
| [17] |
Sung YH, Kim JM, Kim HT, et al. Highly efficient gene knockout in mice and zebrafish with RNA-guided endonucleases. Genome Res, 2014, 24(1): 125-131. DOI:10.1101/gr.163394.113
|
| [18] |
Kim S, Kim D, Cho SW, et al. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res, 2014, 24(6): 1012-1019. DOI:10.1101/gr.171322.113
|
| [19] |
Lin S, Staahl B, Alla RK, et al. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife, 2014, 3: e04766. DOI:10.7554/eLife.04766
|
| [20] |
Schumann K, Lin S, Boyer E, et al. Generation of knock-in primary human T cells using Cas9 ribonucleoproteins. Proc Natl Acad Sci USA, 2015, 112(33): 10437-10442. DOI:10.1073/pnas.1512503112
|
| [21] |
Hendel A, Bak RO, Clark JT, et al. Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells. Nat Biotechnol, 2015, 33(9): 985-989. DOI:10.1038/nbt.3290
|
| [22] |
Gomes-Silva D, Srinivasan M, Sharma S, et al. CD7-edited T cells expressing a CD7-specific CAR for the therapy of T-cell malignancies. Blood, 2017, 130(3): 285-296. DOI:10.1182/blood-2017-01-761320
|
| [23] |
Rupp LJ, Schumann K, Roybal KT, et al. CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells. Sci Rep, 2017, 7(1): 737. DOI:10.1038/s41598-017-00462-8
|
| [24] |
Seki A, Rutz S. Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells. J Exp Med, 2018, 215(3): 985-997. DOI:10.1084/jem.20171626
|
| [25] |
Park H, Oh J, Shim G, et al. In vivo neuronal gene editing via CRISPR-Cas9 amphiphilic nanocomplexes alleviates deficits in mouse models of Alzheimer's disease. Nat Neurosci, 2019, 22(4): 524-528. DOI:10.1038/s41593-019-0352-0
|
| [26] |
Ramakrishna S, Dad ABK, Beloor J, et al. Gene disruption by cell-penetrating peptide-mediated delivery of Cas9 protein and guide RNA. Genome Res, 2014, 24(6): 1020-1027. DOI:10.1101/gr.171264.113
|
| [27] |
Zuris JA, Thompson DB, Shu YL, et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nat Biotechnol, 2015, 33(1): 73-80. DOI:10.1038/nbt.3081
|
| [28] |
Wang M, Zuris JA, Meng FT, et al. Efficient delivery of genome-editing proteins using bioreducible lipid nanoparticles. Proc Natl Acad Sci USA, 2016, 113(11): 2868-2873. DOI:10.1073/pnas.1520244113
|
| [29] |
Sun WJ, Ji WY, Hall JM, et al. Self-assembled DNA nanoclews for the efficient delivery of CRISPR-Cas9 for genome editing. Angew Chem Int Ed, 2015, 54(41): 12029-12033. DOI:10.1002/anie.201506030
|
| [30] |
Mout R, Ray M, Tonga GY, et al. Direct cytosolic delivery of CRISPR/Cas9-ribonucleoprotein for efficient gene editing. ACS Nano, 2017, 11(3): 2452-2458. DOI:10.1021/acsnano.6b07600
|
| [31] |
Lee K, Conboy M, Park HM, et al. Nanoparticle delivery of Cas9 ribonucleoprotein and donor DNA in vivo induces homology-directed DNA repair. Nat Biomed Eng, 2017, 1: 889-901. DOI:10.1038/s41551-017-0137-2
|
| [32] |
Yue HH, Zhou XM, Cheng M, et al. Graphene oxide-mediated Cas9/sgRNA delivery for efficient genome editing. Nanoscale, 2018, 10(3): 1063-1071. DOI:10.1039/C7NR07999K
|
| [33] |
Yang XT, Tang Q, Jiang Y, et al. Nanoscale ATP-responsive zeolitic imidazole framework-90 as a general platform for cytosolic protein delivery and genome editing. J Am Chem Soc, 2019, 141(9): 3782-3786. DOI:10.1021/jacs.8b11996
|
| [34] |
Liu CY, Wan T, Wang H, et al. A boronic acid-rich dendrimer with robust and unprecedented efficiency for cytosolic protein delivery and CRISPR-Cas9 gene editing. Sci Adv, 2019, 5(6): eaaw8922. DOI:10.1126/sciadv.aaw8922
|
| [35] |
Chen G, Abdeen AA, Wang YY, et al. A biodegradable nanocapsule delivers a Cas9 ribonucleoprotein complex for in vivo genome editing. Nat Nanotechnol, 2019, 14(10): 974-980. DOI:10.1038/s41565-019-0539-2
|
| [36] |
Elouahabi A, Ruysschaert JM. Formation and intracellular trafficking of lipoplexes and polyplexes. Mol Ther, 2005, 11(3): 336-347. DOI:10.1016/j.ymthe.2004.12.006
|
| [37] |
Yang XC, Samanta B, Agasti SS, et al. Drug delivery using nanoparticle-stabilized nanocapsules. Angew Chem Int Ed, 2011, 50(2): 477-481. DOI:10.1002/anie.201005662
|
| [38] |
Jiang Y, Tang R, Duncan B, et al. Direct cytosolic delivery of siRNA using nanoparticle-stabilized nanocapsules. Angew Chem Int Ed, 2015, 54(2): 516-520.
|
| [39] |
Tang R, Jiang ZW, Ray M, et al. Cytosolic delivery of large proteins using nanoparticle-stabilized nanocapsules. Nanoscale, 2016, 8(42): 18038-18041. DOI:10.1039/C6NR07162G
|
| [40] |
Shen H, Liu M, He HX, et al. PEGylated graphene oxide-mediated protein delivery for cell function regulation. ACS Appl Mater Interfaces, 2012, 4(11): 6317-6323. DOI:10.1021/am3019367
|
| [41] |
Chang H, Lv J, Gao X, et al. Rational design of a polymer with robust efficacy for intracellular protein and peptide delivery. Nano Lett, 2017, 17(3): 1678-1684. DOI:10.1021/acs.nanolett.6b04955
|
| [42] |
Lu Y, Xue JX, Deng T, et al. Safety and feasibility of CRISPR-edited T cells in patients with refractory non-small-cell lung cancer. Nat Med, 2020, 26(5): 732-740. DOI:10.1038/s41591-020-0840-5
|
| [43] |
Maeder ML, Stefanidakis M, Wilson CJ, et al. Development of a gene-editing approach to restore vision loss in Leber congenital amaurosis type 10. Nat Med, 2019, 25(2): 229-233. DOI:10.1038/s41591-018-0327-9
|
| [44] |
Van Haasteren J, Li J, Scheideler OJ, et al. The delivery challenge: fulfilling the promise of therapeutic genome editing. Nat Biotechnol, 2020, 38(7): 845-855. DOI:10.1038/s41587-020-0565-5
|
| [45] |
Alkilany AM, Murphy CJ. Toxicity and cellular uptake of gold nanoparticles: what we have learned so far?. J Nanopart Res, 2010, 12(7): 2313-2333. DOI:10.1007/s11051-010-9911-8
|
| [46] |
Doudna JA. The promise and challenge of therapeutic genome editing. Nature, 2020, 578(7794): 229-236. DOI:10.1038/s41586-020-1978-5
|
 2021, Vol. 37
2021, Vol. 37




