中国科学院微生物研究所、中国微生物学会主办
文章信息
- 夏韬然, 邹伟, 刘晶
- Xia Taoran, Zou Wei, Liu Jing
- 微流控芯片技术在肺部炎性疾病研究和诊断中的进展
- Advances of using microfluidic chips for research and diagnosis of pulmonary inflammatory diseases
- 生物工程学报, 2021, 37(11): 3905-3914
- Chinese Journal of Biotechnology, 2021, 37(11): 3905-3914
- 10.13345/j.cjb.210025
-
文章历史
- Received: January 8, 2021
- Accepted: May 27, 2021
- Published: June 11, 2021
2. 大连干细胞与精准医学创新研究院,辽宁 大连 116023;
3. 辽宁省干细胞与精准医学前沿技术重点实验室,辽宁 大连 116023
2. Dalian Institute of Stem Cell and Precision Medicine Innovation, Dalian 116023, Liaoning, China;
3. Liaoning Key Laboratory of Stem Cell and Precision Medicine, Dalian 116023, Liaoning, China
众所周知,肺部炎性疾病是临床常见的多发病,通常由于细菌、病毒和真菌感染引起。早期肺炎常缺乏明显的呼吸系统症状,症状多不典型,病情进展快,难以快速诊断,有较高的发病率和死亡率。2015年,肺炎预估杀死了922 000名5岁以下的儿童,占该人群所有儿童死亡的15%,5岁以下的儿童和超过65岁的老年人因其较弱的免疫系统更容易发展为重型肺炎[1-2]。2019年暴发的新冠肺炎被世界卫生组织宣布为大流行疾病,人肺是SARS-CoV-2感染的主要目标,其特征是从轻度综合征到严重的肺损伤,最终到多器官衰竭。大多数患者症状轻微[3],许多严重的COVID-19病例发展为进行性呼吸衰竭,由于弥漫性肺泡损伤、炎症和肺炎而导致死亡[4-7]。笔者课题组也正在探究干细胞对新冠病毒的治疗作用并对体外扩增干细胞的功能有效性与移植安全性进行了评估[8],王佳一等综述了间充质干细胞治疗新型冠状病毒肺炎的研究进展及相关临床试验难点[9],包括临床试验方案设计、干细胞质量管理以及治疗中的伦理考量[10]。近日,一项二期临床试验就揭示了人脐带间充质干细胞对重症新冠患者肺损伤的影响[11]。
肺炎尤其是病毒性肺炎的研究通常需要建立能够模拟肺部炎症发生发展的体内和体外疾病模型。目前常用的模型有细胞模型、动物模型和人类器官模型[12-13],但是这些模型都有其局限性。与其他组织器官不同,肺部为气液双相交界状态,而单层细胞培养过于简单,无法在体内展现出人类器官特异性微环境的复杂结构和功能。动物模型由于其呼吸系统结构与人类的差异较大,吸入各种刺激因素多沉积在鼻甲及上呼吸道,不能进入肺部,无法有效模拟人类肺部感染后的病变且有耗时的过程和动物伦理问题[14]。人类器官如肺类器官可以提供多种细胞类型和更复杂的组织特定功能,但它们无法模拟肺的器官水平特征,例如组织-组织界面、上皮-内皮之间的串扰,以及免疫细胞宿主反应[15-16]。这些模型都不能概括上皮和内皮之间的正常功能耦合,不能分析在活跃的液体流动下循环免疫细胞的募集情况[17-19],给肺部炎性疾病的早期诊断与治疗带来无法回避的问题。因此,迫切需要开发替代的临床前研究模型,以更好地反映人体器官的病理生理学。近年来,微流控芯片不但具有精确流体控制、少量样品需求、快速反应、大规模集成和自动化等优势,也能重现活生物体的关键功能,使在体外重建3D人体器官型模型成为可能,逐渐成为临床诊断及疾病筛查的工具之一[20]。本文针对微流控芯片技术在肺部炎性疾病研究和诊断中的进展进行了综述,旨在为肺部炎性疾病的研究和诊断提供新思路。
1 微流控芯片概述 1.1 微流控芯片技术微流控芯片技术是一项以亚毫米规模的流体工程设计为特征,能将生物、化学等诸多领域的样品从制备、反应到分离检测等多种操作单元高度集成在一块芯片上的技术,在改善诊断学和生物学研究方面显示出了巨大的潜力[21]。相比构建模型的传统方法,具有便携性、高通量、可模拟在体微环境等优势,在研究疾病的发病机理、筛选药物等方面有着广阔的应用前景,已经发展成为了多学科交叉的崭新研究领域。笔者课题组前期通过可拆卸组装的微流体设备开发了3D多形性胶质母细胞瘤模型[22],该模型可以在体外复制胶质母细胞瘤的微环境,评估胶质母细胞瘤的侵袭性和药效。
1.2 微流控芯片四大技术及其运用微流控是一种精确控制和操控微尺度流体,以在微纳米尺度空间中对流体进行操控为主要特征的科学技术。目前微流控芯片常用的技术有分离技术、检测技术、微液滴技术和微流体控制及驱动技术。与传统分离模式相比,微流控芯片分离技术载体材料丰富,有石英、玻璃、硅和各种聚合物,分离易于实现,过程控制简单,可和其他操作单元灵活组合且应用范围更大。检测技术与传统检测技术相比有更高的要求,如灵敏度高、响应速度快、具有平行分析功能和便携式特征等。目前基于不同原理的很多检测技术都已经应用到微流控芯片的研究中,主要有光学检测、电化学检测和质谱等方法。微液滴操控包括微液滴生成和微液滴驱动,按生成方式可以将操控微液滴的方法分为被动法和主动法两大类。微流体操纵技术是微流控芯片技术中最重要的研究领域之一,通过各种机械或非机械力实现对流体的驱动和控制,可以将其分为机械和非机械驱动系统。图 1和表 1就微流控芯片四大技术的运用作了简单介绍。

|
| 图 1 微流控技术分类 Fig. 1 Classification of microfluidic technologies. |
| |
| Microfluidic technologies | Application in various fields |
| Detection technology | Used for sensitive and reliable semi quantitative analysis of HIV-1 p24[23] Used to screen and quantify cancer related extracellular vesicles[24] |
| Isolation technology | Used to isolate circulating tumor cells[25] Application of amino acid detection and separation[26] |
| Micro droplet technology | In situ dispersion and 3D printing of water droplets in PDMS[27] Movement of simulated charged drugs in extracellular matrix and triple negative breast cancer cells[28] |
| Microfluidic control and driving technology | Principle of micro fluid flow control system for OB1 MK3 |
“芯片肺”是近年来被生物医学研究者普遍关注的一种肺部疾病研究模型。它具有多功能微实验平台的特性,可以再现人肺泡毛细血管界面(即活肺的基本功能单元) 的关键结构、功能和机械性质,从器官水平模拟肺功能,体现组织-组织界面、上皮-内皮之间的串扰以及免疫细胞宿主反应,也可人为地改变某些条件使其更加接近肺在体或疾病的发展状态,故在疾病研究、药物测试和病毒学方面都具有潜在的应用价值[29-30]。
2.1 模拟肺结构和功能的“芯片肺”模型为了模拟肺的结构和生理功能,2012年Huh等构建的芯片将肺的两种细胞培养在膜的两侧,并在膜垂直方向的两侧连接了两个真空通道,由微泵和微阀精确控制(图 2)。在呼吸循环正常启动的过程当中,由于胸膜内压降低,引起肺泡扩张。当空气被吸入肺部时,毛细血管中的肺泡上皮和耦合的内皮被拉伸。由于侧通道连接到真空,引起压力降低导致中间通道扩张,从而拉伸多孔膜,随后拉伸整个肺泡-毛细管界面。这是最早报道的“芯片肺”模型,也为之后“芯片肺”的发展奠定了基础[31]。
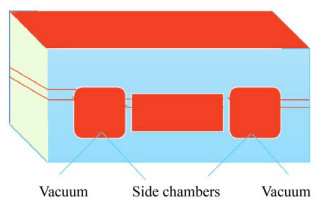
|
| 图 2 微型肺芯片模型 Fig. 2 Model of micro lung-on-a-chip. |
| |
为了模拟肺的小气道,2016年Benam等制作微流体设备(图 3),有一条类似于人类细支气管半径的上通道,一条平行的微血管下通道,中间由多孔聚酯膜隔开。将原代人气道上皮细胞培养在膜的顶端,直到两个通道的培养液融合。为了触发肺气道上皮细胞的分化,在5 d后去除了顶端培养液,并引入空气创建了气液界面。继续培养3–5周,将原代人肺微血管内皮细胞接种在多孔膜的对侧,并以相同的流速培养它们,直到融合形成组织-组织界面[32]。
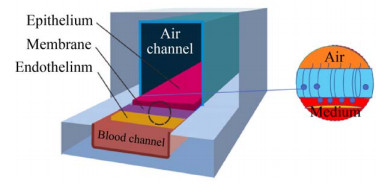
|
| 图 3 小气道肺芯片模型 Fig. 3 Small airway lung microarray model. |
| |
为了研究上皮和平滑肌细胞之间的相互作用,Mouhita等曾在已有的肺芯片基础上,开发了一种3层垂直堆叠的微流控芯片模型(图 4),该设备顶部为气流室,中间是悬浮水凝胶室和底部介质贮存器的3层垂直堆叠的聚甲基丙烯酸甲酯(Polymethyl methacrylate) 层,其设计的独特之处在于悬浮的水凝胶,利用它发现了Ⅰ型胶原蛋白和Matrigel的混合物可促进气道上皮细胞粘附和单层形成以及气道平滑肌细胞粘附和排列,建立了使气道上皮细胞-气道平滑肌细胞共培养超过31 d的最佳培养方案。该模型很好地模拟了肺气道上皮细胞、平滑肌细胞和细胞外基质之间的相互作用[33]。
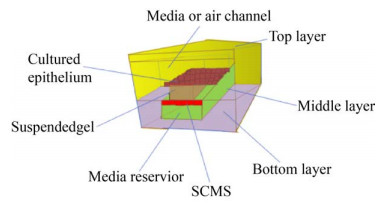
|
| 图 4 三层垂直堆叠的PMMA层 Fig. 4 PMMA layer with three layers stacked vertically. |
| |
肺部的炎症通常由细菌、病毒、真菌感染,当它们感染肺泡时,免疫细胞会被募集到肺泡并释放出炎性细胞因子,但是传统的模型不能反映循环免疫细胞的募集情况和对细胞因子分泌的协同作用。Benam等设计的小气道芯片能够在体外分析肺部炎症和药物反应,可以检测肺内皮和上皮对细胞因子分泌的协同作用,鉴定疾病恶化的新生物标志物并测量对抑制细胞因子诱导的循环中性白细胞在流动下募集的抗炎化合物的反应,这弥补了传统模型的不足[32]。Punde等利用微流控芯片用于研究蛋白质诱导的肺部炎症,该芯片可以监测嗜酸性粒细胞阳离子蛋白(Eosinophil cationic protein,ECP) 在肺部炎症中的作用。发现了ECP能诱导趋化因子CXCL-12在气道上皮细胞表达,进而刺激纤维细胞向上皮细胞迁移,揭示了CXCL12-CXCR4在肺炎中介导ECP诱导的纤维细胞外渗[34] (图 5)。

|
| 图 5 ECP在肺炎中可能的作用机制 Fig. 5 Possible mechanism of ECP in pneumonia. |
| |
肺水肿是指由于某种原因引起肺内组织液的生成和回流平衡失调,使大量组织液在很短时间内不能被肺淋巴和肺静脉系统吸收,积聚在肺泡、肺间质和细小支气管,这种组织液回流的特点在体外很难得到模拟。在2012年,Hh等就这一问题设计了一款肺芯片来模拟IL-2诱导的肺水肿。在膜的一侧接种肺微血管内皮细胞,在另一侧接种肺泡上皮细胞,它们创造了一个充满血管空间的培养液和一个充满空气的“肺泡”。通过拉伸薄膜来模拟呼吸运动,这样血管通道内相应浓度的IL-2可诱导液体渗漏至肺泡腔,减少了另外一个通道中的空气量和氧运输,同时血浆蛋白还进入到空气通道,导致空气空间中形成血凝块,从而更好地模拟肺部水肿的状态[35]。
2.2.3 模拟肺纤维化肺纤维化是以成纤维细胞增殖及大量细胞外基质聚集并伴炎症损伤、组织结构破坏为特征的一大类肺疾病的终末期改变,也就是正常的肺泡组织被损坏后经过异常修复导致结构异常。大多数“芯片肺”模型主要是单层上皮-内皮共培养,缺乏微脉管网络或间质成纤维细胞。为了解决这个难题,Joscelyn等设计了一种96孔格式的微血管化人肺芯片平台,该设备通过3D血管网络模拟了人类肺间质-气道界面,并将气管上皮细胞内的正常或患病的成纤维细胞封装在纤维蛋白-胶原水凝胶中,通过合并患有特发性肺纤维化供体的成纤维细胞或接受TGF-β1治疗的健康供体的成纤维细胞,成功地创建了纤维化的α平滑肌肌动蛋白阳性疾病表型,导致气管中的杯状细胞和纤毛细胞发生纤维化样转化[36] (图 6)。

|
| 图 6 96孔格式的肺芯片模型 Fig. 6 Lung-on-a-chip model in 96 well format. |
| |
急性肺损伤是由各种因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,病毒尤其是SARS-CoV-2是诱导急性肺损伤的重要因素之一。已有的SARS-CoV-2感染的动物模型鉴于物种差异,它们对SARS-CoV-2感染的靶器官或系统反应可能与人类个体明显不同。在此基础上,Zhang等模拟了SARS-CoV-2诱发的肺损伤的模型及后续芯片上的免疫反应,该模型可以在体外器官水平上模拟由SARS-CoV-2诱导的肺损伤和免疫反应(图 7)。SARS-CoV-2感染后,先天免疫反应和内皮细胞因子依赖性途径被激活,导致免疫细胞募集,内皮脱离和炎性细胞因子释放增加,这种器官芯片模型可以紧密反映人对SARS-CoV-2感染的相关反应,从而为COVID-19研究和药物开发提供了独特的平台[37]。Longlong等就利用SARS-CoV-2感染的芯片模型评估7种临床批准药物,发现了阿莫地喹和托瑞米芬能显著抑制假SARS-CoV-2病毒的进入[38]。
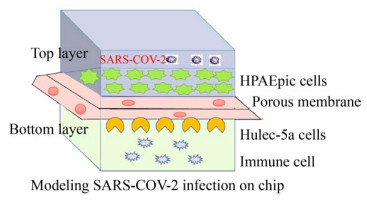
|
| 图 7 SARS-CoV-2诱发的肺损伤的模型 Fig. 7 A model of lung injury induced by SARS-CoV-2. |
| |
王琪等已经应用微流控芯片仿生模型研究肺癌发生及转移过程中肺癌细胞与成纤维细胞相互作用的分子机制。相较于传统的静态、二维的细胞模型很难用于模拟肿瘤微环境,微流控芯片的仿生模型不仅能模拟体内微环境,还可以实现肺癌转移的全过程。其研究结果有望为肺癌的治疗和转移找到新的靶点,并进一步探讨微流控芯片组织工程技术在肺癌与微环境相关研究中的应用价值[39]。
上述应用为微流控芯片在肺部疾病的研究提供了非常好的模型。
3 微流控芯片在临床肺炎诊断中的应用 3.1 用于细菌性肺炎的诊断细菌性肺炎是最常见的肺炎之一,主要是由肺炎链球菌、金黄色葡萄球菌、肺炎克雷伯杆菌、流感嗜血杆菌等感染所致,对儿童及老年人的健康威胁极大。细菌性肺炎的诊断依据主要是通过症状学和CT。而微流控芯片因其对液体自动化操控的优势相比较传统的诊断方式更加精确、快速和灵敏,具有较高的分析效率。
2014年,Luo等建立了一套微流控多重电化学技术系统实现了对细菌的实时定量,可用于区分3个重要的急性上呼吸道感染相关的细菌,即结核分枝杆菌、嗜血杆菌和肺炎克雷伯杆菌[40]。2017年,Huang等建立了一种基于微流控芯片的便携式核酸分析仪用于临床肺炎相关病原体的检测(图 8)。该系统可将样品自动离心分配到24个测试细胞,能够在1.45 μL的反应体系中识别多个临床肺炎相关病原体。在对229个肺炎患者痰培养样本的病原体检测中发现该系统与传统RT-PCR结果的重合率达到99.56%。通过基因测序对剩下0.44%的样本进行分析也证明该系统的结果完全正确[41]。

|
| 图 8 基于微流控芯片的便携式核酸分析仪 Fig. 8 Portable nucleic acid analyzer based on microfluidic chip. |
| |
病毒性肺炎是由上呼吸道病毒感染、向下蔓延所致的肺部炎症。新冠肺炎作为当下最重要的病毒性肺炎之一,诊断依据主要是通过症状、CT和核酸检测。实时荧光定量PCR法是目前检测SARS-CoV-2病毒基因最可靠的方法,但病毒浓度在感染后期变得很低,有时会出现假阴性的结果,因此特定的抗病毒抗体的血清学测试也很重要。为了补充标准的血清学检测,Funari等基于局域表面等离子体共振原理,研制了一种金纳米棒光学微流控传感平台(图 9)。该平台通过SARS-CoV-2刺突蛋白与抗体结合导致金属纳米结构周围的局部折射指数变化,能用于检测经过稀释后的人血浆中SARS-CoV-2刺突蛋白特异性抗体的存在和数量。该平台的检测极限为0.08 ng/mL,在临床相关浓度范围内,这使SARS-CoV-2定量诊断变得更容易、更便宜、更快速[42]。
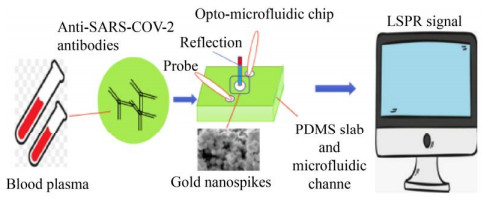
|
| 图 9 基于微流控芯片检测SARS-CoV-2刺突蛋白抗体 Fig. 9 Detection of SARS-CoV-2 spike protein antibody based on microfluidic chip. |
| |
近年来,微流控芯片因其具有精确流体控制、少量样品需求、快速反应、大规模集成和自动化的优势,已逐渐成为临床诊断及疾病筛查极具发展潜力的工具。目前很多诊断和检测的医疗设备都是基于微流控,其在肺部疾病的诊断和应用中具有很广阔的前景,如利用微流控灌溉培养原代或永生化的人类上皮细胞(有时位于气液界面以诱导上皮分化) 来模拟气道炎症疾病;能使用气道上皮和组织驻留的免疫细胞调节对呼吸道病原体和过敏原的免疫反应并改变血管细胞黏附分子机制;能检测肺内皮和上皮对细胞因子分泌的协同作用确定疾病恶化的新生物标志物;能测量对抑制细胞因子诱导的循环中性白细胞在流动下募集的抗炎化合物的反应。
生物工程器官芯片技术的快速发展,使得在微流控培养设备(如肠、心脏、肝脏和肺) 中重现活生物体不同器官的关键功能、在体外重建3D人体器官模型成为可能。当然也要看到微流控芯片在肺部的应用也具有一定的局限性,如充当隔膜的聚二甲基硅氧烷(Polydimethylsiloxane) 材料具有吸附疏水性分子的特性,可能对后续的药物测试、疾病研究和病毒学方面产生影响;目前还不能完全模拟肺的全部功能,如肺泡内液体的重吸收;不能实现肺脏和其他各个器官之间的联系等。未来的肺芯片将会更加接近人体生理环境,更加体现多器官水平的相互作用,更能实现肺芯片的标准化[43],广泛应用于临床诊断和治疗。
| [1] |
Van der Poll T, Opal SM. Pathogenesis, treatment, and prevention of pneumococcal pneumonia. Lancet, 2009, 374(9700): 1543-1556. DOI:10.1016/S0140-6736(09)61114-4
|
| [2] |
Walker CLF, Rudan I, Liu L, et al. Global burden of childhood pneumonia and diarrhoea. Lancet, 2013, 381(9875): 1405-1416. DOI:10.1016/S0140-6736(13)60222-6
|
| [3] |
Jin Y, Ji W, Yang H, et al. Endothelial activation and dysfunction in COVID-19: from basic mechanisms to potential therapeutic approaches. Signal Transduct Target Ther, 2020, 5(1): 293. DOI:10.1038/s41392-020-00454-7
|
| [4] |
Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5
|
| [5] |
Chan JFW, Yuan SF, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 2020, 395(10223): 514-523. DOI:10.1016/S0140-6736(20)30154-9
|
| [6] |
Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. Nature, 2020, 581(7809): 465-469. DOI:10.1038/s41586-020-2196-x
|
| [7] |
Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med, 2020, 8(4): 420-422. DOI:10.1016/S2213-2600(20)30076-X
|
| [8] |
刘晶, 宋琳, 邹伟, 等. 体外扩增间充质干细胞功能有效性与移植安全性评价研究进展. 生物工程学报, 2010, 26(12): 1629-1635. Liu J, Song L, Zou W, et al. Advances in efficacy and security of expanded mesenchymal stem cells in vitro. Chin J Biotech, 2010, 26(12): 1629-1635 (in Chinese). |
| [9] |
王佳一, 邹伟, 刘晶. 间充质干细胞治疗新型冠状病毒肺炎研究进展及相关临床试验难点. 生物工程学报, 2020, 36(10): 1970-1978. Wang JY, Zou W, Liu J. Mesenchymal stem cells in the treatment of COVID-19-progress and challenges. Chin J Biotech, 2020, 36(10): 1970-1978 (in Chinese). |
| [10] |
Alok S, AlZoubi Z. Rethinking on ethics and regulations in cell therapy as part of neurorestoratology. J Neurorestoratol, 2016, 1.
|
| [11] |
Shi L, Huang H, Lu X, et al. Effect of human umbilical cord-derived mesenchymal stem cells on lung damage in severe COVID-19 patients: a randomized, double-blind, placebo-controlled phase 2 trial. Signal Transduct Target Ther, 2021, 6(1): 58. DOI:10.1038/s41392-021-00488-5
|
| [12] |
Blanco-Melo D, Nilsson-Payant BE, Liu WC, et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell, 2020, 181(5): 1036-1045. e9. DOI:10.1016/j.cell.2020.04.026
|
| [13] |
Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell, 2020, 181(2): 271-280. e8. DOI:10.1016/j.cell.2020.02.052
|
| [14] |
Han Y, Duan X, Yang L, et al. Identification of SARS-CoV-2 inhibitors using lung and colonic organoids. Nature, 2021, 589(7841): 270-275. DOI:10.1038/s41586-020-2901-9
|
| [15] |
Jiang RD, Liu MQ, Chen Y, et al. Pathogenesis of SARS-CoV-2 in transgenic mice expressing human angiotensin-converting enzyme 2. Cell, 2020, 182(1): 50-58. e8. DOI:10.1016/j.cell.2020.05.027
|
| [16] |
Deng W, Bao L, Liu J, et al. Primary exposure to SARS-CoV-2 protects against reinfection in rhesus macaques. Science, 2020, 369(6505): 818-823. DOI:10.1126/science.abc5343
|
| [17] |
Didierlaurent A, Goulding J, Patel S, et al. Sustained desensitization to bacterial Toll-like receptor ligands after resolution of respiratory influenza infection. J Exp Med, 2008, 205(2): 323-329. DOI:10.1084/jem.20070891
|
| [18] |
Hammad H, Chieppa M, Perros F, et al. House dust mite allergen induces asthma via Toll-like receptor 4 triggering of airway structural cells. Nat Med, 2009, 15(4): 410-416. DOI:10.1038/nm.1946
|
| [19] |
Teijaro JR, Walsh KB, Cahalan S, et al. Endothelial cells are central orchestrators of cytokine amplification during influenza virus infection. Cell, 2011, 146(6): 980-991. DOI:10.1016/j.cell.2011.08.015
|
| [20] |
Xu C, Zhang M, Chen W, et al. Assessment of air pollutant PM2.5 pulmonary exposure using a 3D lung-on-chip model. ACS Biomater Sci Eng, 2020, 6(5): 3081-3090. DOI:10.1021/acsbiomaterials.0c00221
|
| [21] |
Sackmann EK, Fulton AL, Beebe DJ. The present and future role of microfluidics in biomedical research. Nature, 2014, 507(7491): 181-189. DOI:10.1038/nature13118
|
| [22] |
Ma JY, Li N, Wang YC, et al. Engineered 3D tumour model for study of glioblastoma aggressiveness and drug evaluation on a detachably assembled microfluidic device. Biomed Microdevices, 2018, 20(3): 1-16.
|
| [23] |
Liu D, Zhang Y, Zhu M, et al. Microfluidic-integrated multicolor immunosensor for visual detection of HIV-1 p24 antigen with the naked eye. Anal Chem, 2020, 92(17): 11826-11833. DOI:10.1021/acs.analchem.0c02091
|
| [24] |
Kang YT, Hadlock T, Jolly S, et al. Extracellular vesicles on demand (EVOD) chip for screening and quantification of cancer-associated extracellular vesicles. Biosens Bioelectron, 2020, 168: 112535. DOI:10.1016/j.bios.2020.112535
|
| [25] |
Chen H, Li Y, Zhang Z, et al. Immunomagnetic separation of circulating tumor cells with microfluidic chips and their clinical applications. Biomicrofluidics, 2020, 14(4): 041502. DOI:10.1063/5.0005373
|
| [26] |
袁会领, 董立兵, 涂然, 等. 液滴微流控芯片系统中微液滴特性表征及氨基酸检测应用. 生物工程学报, 2014, 30(1): 139-146. Yuan HL, Dong LB, Tu R, et al. Micro-dropleMicro-droplet characterization and its application for amino acid detection in droplet microfluidicsystem. Chin J Biotech, 2014, 30(1): 139-146 (in Chinese). |
| [27] |
Mea HJ, Delgadillo L, Wan J. On-demand modulation of 3D-printed elastomers using programmable droplet inclusions. Proc Natl Acad Sci USA, 2020, 117(26): 14790-14797. DOI:10.1073/pnas.1917289117
|
| [28] |
Moarefian M, Davalos RV, Tafti DK, et al. Modeling iontophoretic drug delivery in a microfluidic device. Lab a Chip, 2020, 20(18): 3310-3321. DOI:10.1039/D0LC00602E
|
| [29] |
Zhang M, Xu C, Jiang L, et al. A 3D human lung-on-a-chip model for nanotoxicity testing. Toxicol Res (Camb), 2018, 7(6): 1048-1060. DOI:10.1039/C8TX00156A
|
| [30] |
Kim HJ, Huh D, Hamilton G, et al. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip, 2012, 12(12): 2165-2174. DOI:10.1039/c2lc40074j
|
| [31] |
Huh D, Matthews BD, Mammoto A, et al. Reconstituting organ-level lung functions on a chip. Science, 2010, 328(5986): 1662-1668. DOI:10.1126/science.1188302
|
| [32] |
Benam KH, Villenave R, Lucchesi C, et al. Small airway-on-a-chip enables analysis of human lung inflammation and drug responses in vitro. Nat Methods, 2016, 13(2): 151-157. DOI:10.1038/nmeth.3697
|
| [33] |
Humayun M, Chow CW, Young EWK. Microfluidic lung airway-on-a-chip with arrayable suspended gels for studying epithelial and smooth muscle cell interactions. Lab Chip, 2018, 18(9): 1298-1309. DOI:10.1039/C7LC01357D
|
| [34] |
Punde TH, Wu WH, Lien PC, et al. A biologically inspired lung-on-a-chip device for the study of protein-induced lung inflammation. Integr Biol (Camb), 2015, 7(2): 162-169. DOI:10.1039/c4ib00239c
|
| [35] |
Huh D, Leslie DC, Matthews BD, et al. A human disease model of drug toxicity-induced pulmonary edema in a lung-on-a-chip microdevice. Sci Transl Med, 2012, 4(159): 159r.
|
| [36] |
Mejías JC, Nelson MR, Liseth O, et al. A 96-well format microvascularized human lung-on-a-chip platform for microphysiological modeling of fibrotic diseases. Lab a Chip, 2020, 20(19): 3601-3611. DOI:10.1039/D0LC00644K
|
| [37] |
Zhang M, Wang P, Luo RH, et al. Biomimetic human disease model of SARS-CoV-2-induced lung injury and immune responses on organ chip system. Adv Sci, 2021, 8(3): 2002928. DOI:10.1002/advs.202002928
|
| [38] |
Si L, Bai H, Rodas M, et al. A human- airway-on-a-chip for the rapid identification of candidate antiviral therapeutics and prophylactics. Nat Biomed Eng, 2021, 5(8): 815-829. DOI:10.1038/s41551-021-00718-9
|
| [39] |
许志赟. 应用微流控芯片仿生模型研究肺癌发生及转移过程中肺癌细胞与成纤维细胞相互作用的分子机制[D]. 大连: 大连医科大学, 2015. Xu ZY. Study on molecular mechanisms of stromal cells in microenvironment for lung cancer and metastasis with bionic organs-on-microfluidic chips[D]. Dalian: China: Dalian Medical University, 2015 (in Chinese). |
| [40] |
Luo J, Fang X, Ye D, et al. A real-time microfluidic multiplex electrochemical loop-mediated isothermal amplification chip for differentiating bacteria. Biosens Bioelectron, 2014, 60: 84-91. DOI:10.1016/j.bios.2014.03.073
|
| [41] |
Huang G, Huang Q, Xie L, et al. A rapid, low-cost, and microfluidic chip-based system for parallel identification of multiple pathogens related to clinical pneumonia. Sci Rep, 2017, 7(1): 6441. DOI:10.1038/s41598-017-06739-2
|
| [42] |
Funari R, Chu KY, Shen AQ. Detection of antibodies against SARS-CoV-2 spike protein by gold nanospikes in an opto-microfluidic chip. Biosens Bioelectron, 2020, 169: 112578. DOI:10.1016/j.bios.2020.112578
|
| [43] |
王木子. 肺疾病研究新技术——芯片肺. 国际儿科学杂志, 2020, 47(12): 828-831. Wang MZ. New technology of lung disease research: chip lung. Int J Ped, 2020, 47(12): 828-831 (in Chinese). |
 2021, Vol. 37
2021, Vol. 37




