中国科学院微生物研究所、中国微生物学会主办
文章信息
- 周宇杰, 王军宁, 吕芳, 赵艳红, 卢宇
- Zhou Yujie, Wang Junning, Lü Fang, Zhao Yanhong, Lu Yu
- 基于金属有机骨架的生物复合物抗逆性研究进展
- Advances in anti-adversity of biological composites based on metal-organic frameworks
- 生物工程学报, 2021, 37(11): 4015-4023
- Chinese Journal of Biotechnology, 2021, 37(11): 4015-4023
- 10.13345/j.cjb.210063
-
文章历史
- Received: January 20, 2021
- Accepted: April 21, 2021
- Published: May 18, 2021
2. 江苏省农业科学院 动物免疫工程研究所,江苏 南京 210014;
3. 江苏省食品质量安全重点实验室 国家重点实验室培育基地,江苏 南京 210014;
4. 扬州大学 江苏省重点动物传染病和人畜共患病防控创新中心,江苏 扬州 225009
2. Institute of Animal Immune Engineering, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China;
3. Cultivation Base of State Key Laboratory for Food Quality and Safety of Jiangsu Province, Nanjing 210014, Jiangsu, China;
4. Innovation Center for Prevention and Control of Key Animal Infectious Diseases and Zoonoses in Jiangsu Province, Yangzhou University, Yangzhou 225009, Jiangsu, China
生物活性物质[1]包括蛋白质、核酸和氨基酸等,其应用范围十分广泛,涵盖工业、农业、环境和生物医学等领域[2-4]。但是,生物活性物质普遍结构脆弱、重复性差、再利用率低,这些不稳定的问题限制了其实际应用[5]。为了解决上述问题,对生物活性物质进行涂层保护是诱人的策略之一,可以提高生物活性物质的抗逆性,有助于其对抗恶劣的外界环境(如极端温度、不适宜的pH、有机溶剂等),进而维持自身的生物活性[6-7]。固定生物活性物质的载体有很多,包括无机纳米颗粒、水凝胶和聚合物[8-9]等。其中,金属有机骨架(Metal-organic frameworks,MOFs) 作为固定生物活性物质的一类新兴载体受到了研究者的青睐,呈现出迅猛发展之势[10-13]。
MOFs最早是在1999年被Yaghi团队[14]提出的。它是金属离子/簇和有机配体通过配位键连接而成的晶体网状结构材料[15-16],广泛应用于催化、能量存储、传感、药物递送等领域[17-18]。MOFs作为固定生物活性物质的优选候选者,归功于其高生物活性的物质负载能力、良好的生物可降解性、较好的生物相容性、可调节的孔径和尺寸、多样性的功能和结构、大的比表面积等[11, 19-20]。迄今为止,可用于MOFs固定的生物活性的物质谱越来越广,本文主要涉及酶、核酸、细胞、病毒和细菌等[8, 21-23]。
值得一提的是,有许多优秀的综述总结了MOFs固定生物活性物质的研究进展[5, 22, 24-26]。然而到目前为止,尚缺乏重点介绍基于MOFs的生物复合物在抗逆性方面研究进展的综述。本文介绍了MOFs可以在抵抗高温、高压、变性试剂、胰酶消化和延长储存时间等方面提高生物活性物质的抗逆性(图 1)。最后,对基于MOFs的生物复合物提高生物活性物质抗逆性的应用前景进行了展望,期盼该领域有更加广阔的应用。

|
| 图 1 基于MOFs的不同生物复合物的抗逆性 Fig. 1 Anti-adversity of different MOFs-based biological composites. |
| |
蛋白质在高温、酸碱环境下和有机环境中容易失去生物活性。目前MOFs已用作于抗体、蛋白、酶等的保护涂层[27]。其中关于酶的应用最多,涉及酶的种类也多种多样,本文将重点对提高酶的抗逆性进行介绍。
1.1 MOFs包封单一酶 1.1.1 过氧化氢酶过氧化氢酶(Catalase,CAT) 存在于每个动物体内,能催化过氧化氢分解成氧和水,广泛应用于食品工业、纺织工业和美容业。
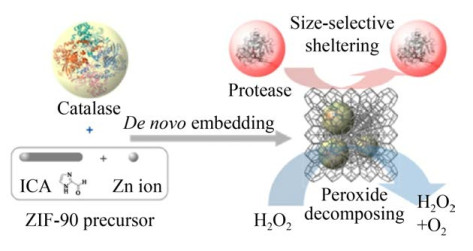
Shieh等[28]和Liao等[29]都使用从头合成法将CAT嵌入到ZIF-90 (沸石咪唑类金属有机骨架-90,Zeolitic imidazole framework-90) 中,合成了CAT@ZIF-90。前者将CAT@ZIF-90和CAT在蛋白酶K中孵育2 h,裸露CAT失去活性;而CAT@ZIF-90活性保持不变(图 2)。后者发现CAT@ZIF-90在变性试剂(尿素) 和高温(80 ℃)下,与裸露CAT相比,不但保持活性而且结构构象变化较小。2017年,Du等[30]通过原位自由基聚合技术将CAT包裹在聚合物纳米胶囊中,即过氧化氢酶纳米胶囊(Nanocapsules of CAT,nCAT),获得的nCAT@ZIF-8 (沸石咪唑类金属有机骨架-8,Zeolitic imidazole framework-8) 在65 ℃下孵育60 min后仍能保持其原有活性的78.79%;回收10次后,仍可保留原有活性的87.12%,贮藏28 d后仍保持原有活性的95.96%。而裸露CAT在65 ℃孵育60 min后活性仅保留5.774%;贮藏过程中活性损失约60%。2018年,Zhu等[31]用乳液法将CAT包埋在ZIF-8中,形成的复合物在65 ℃孵育60 min后仍能保持44.2%的活性,而裸露CAT残留率仅为6.6%;此外,合成复合物在5次循环后仍保持其80%的活性和原始形态。
脂肪酶广泛存在于动植物和微生物中,它能将甘油三酯水解成甘油和脂肪酸,主要应用于食品、药品、日用化工、皮革工业等。
2016年,He等[32]通过仿生矿化法将嗜热脂肪酶QLM包埋在ZIF-8中。未受保护的QLM在37 ℃和60 ℃条件下,5 d后的活力分别为原来的20.3%和6.0%;而QLM@ZIF-8在37 ℃下5 d没有失去任何催化活性,在60 ℃下5 d仍保持75.7%的活性。2020年,Rathod团队[33]用表面活性剂十二烷基硫酸钠(Sodium dodecyl sulfate,SDS) 活化黑曲霉脂肪酶,再用一锅法将活化的脂肪酶包埋在ZIF-8中,脂肪酶-SDS@ZIF-8在异丙醇中保持了80%的活性,而未受保护的脂肪酶几乎完全失活。同年,Zou等[34]通过固相反应合成了Fe3O4@ZIF-8@脂肪酶的结构,55 ℃下,裸露脂肪酶在5 h后失去了约50%的初始活力,而Fe3O4@ZIF-8@脂肪酶仅失去8.5%的初始活力;裸露脂肪酶在室温下存放8 d后失去了77%的初始活性,而Fe3O4@ZIF-8@脂肪酶则失去了20%的初始活性。此外,Chen等[35]通过沉淀交联法将皱纹假丝酵母脂肪酶AYS固定得到AYS@UiO-66-NH2 (具有伯胺基团的锆基MOF,zirconium-based MOF with a primary amine group),当温度从30 ℃提高到60 ℃,该生物复合物的催化活性始终保持在70%以上,而裸露的AYS在升温过程中催化活性从59.04%下降到46.99%;当pH从6.6提高到8.5时,复合物催化活性从72.57%降到70.02%;而裸露AYS的活性从57.84%急剧下降到36.97%。
1.2 MOFs同时包封多种酶除了固定单一酶,MOFs也可以同时固定多种酶。2015年,Wu等[36]报道了第一个在常温水溶液中通过共沉淀方法合成多酶结合MOFs的例子,将葡萄糖氧化酶(Glucose oxidase,GOx) 和辣根过氧化物酶(Horseradish peroxidase,HRP) 的级联模型酶体系包埋在ZIF-8中。GOx & HRP/ZIF-8在室温磷酸盐缓冲液(Phosphate buffered saline,PBS) 中孵育7 d保持了80%的活性,而裸露酶系统在2 d内损失了近50%的活性;GOx和HRP在37 ℃胰蛋白酶消化30 min后活性损失一半,而GOx & HRP/ZIF-8在相同条件下保持了几乎相同的活性;在EDTA质量分数为1 wt%的情况下,GOx & HRP/ZIF-8的活性保持在原来的95%,而裸露酶系统失去了原来的90%的活性。2019年,Song等[37]首次以HRP和GOx作为模型酶与合理设计的DNA支架网状结构进行交联,并成功将该多酶系统封装在ZIF-8中。得到的GOx & HRP@DNA/ZIF-8比GOx & HRP/ZIF-8效果要好,比未受保护的酶效果更好。GOx & HRP@DNA/ZIF-8在50 ℃、75 min能保持95%的活性,在60 ℃、90 min仍能保持89%的活性,分别是未受保护的酶和GOx & HRP@ZIF-8的4.1倍和2.2倍。此外,GOx & HRP@DNA/ZIF-8经胰蛋白酶消化后保持了几乎相同的原酶活性,经异丙醇和乙醇孵育后保留了大部分原酶活性;但在相同条件下未受保护的酶则失去大部分原有活性。Cheng等[38]以水凝胶为模板,采用模板乳化法制备了分层的微孔和介孔的锌基MOFs (Hierarchical zeolite imidazole frameworks-8,HZIF-8),用其同时包封HRP和GOx,裸露酶在65 ℃和95 ℃的温度下损失了80%和100%的活性,而GOx-HRP@HZIF-8仅有41.6%和72.5%的损失。
1.3 具有生物催化功能的MOFs包封酶有些MOFs不仅可以用作天然酶的保护涂层,自身还具有生物催化功能,用其包封酶得到的MOFs-生物复合材料具有协同作用,应用起来更显灵活[7]。笔者首次构筑了一种自身具有过氧化物模拟酶催化功能的双金属FeNi-MOF,并通过仿生矿化法用其封装GOx构建级联催化多酶反应体系检测葡萄糖[39]。此反应体系不仅维持了酶的生物活性还兼具催化功能,并且使酶的再回收利用成为可能:构筑的GOx/FeNi-MOF和裸露的GOx分别在超纯水中孵育7 d,持续定期监测酶活性,结果表明GOx/FeNi-MOF保留了95%的原有活性,相比之下,裸露酶只有30%的原有活性。Fe-MIL-88B-NH2[40]、MOF-545(Fe)[41]等MOFs拥有模拟酶催化活性也被报道用来包封GOx。此外,Ling等[42]通过后合成策略设计了GOx@Co-FeMOF生物复合材料用于级联催化反应体系,其中Co-FeMOF是由Co作结点、FeTCPP作链接器组成的,不仅具有过氧化物模拟酶性能还可用来催化氧化L-精氨酸产生NO。基于GOx@Co-FeMOF反应体系的稳定性通过5次循环后测定,结果表明反应体系的稳定性和催化活性良好。但是,目前拥有类酶活性的MOFs仍然面临活性不够高的问题,有一些方法可以改进其活性。例如,我们通过溶剂热法将具有类酶活性的MOFs的尺寸减小,得到了尺寸低于100 nm的胶体Zr-PorMOF,相比于微米尺寸的MOF,其催化活性和稳定性明显提升[43]。
2 提高核酸的抗逆性一切生物都含有核酸,它参与生长繁殖、遗传变异、肿瘤、代谢、病毒感染等,然而核酸在加热、酸、碱等条件下易变性,采用核酸与MOFs相结合的策略可以提高它的抗逆性。He等[44]首次使用纳米尺度的MOFs联合递送顺铂和聚集小干扰RNA片段(siRNA),通过沉默多药耐药基因使耐药卵巢癌细胞对顺铂治疗重新敏感来增强治疗效果。具体是将顺铂前体药物和多药耐药基因沉默siRNA分别通过封装和表面配位的方式负载到六角形的Uio NMOFs中。NMOFs保护siRNA免受核酸酶降解,增强siRNA的细胞摄取,并促进siRNA从核内体逃逸到耐顺铂卵巢癌细胞中的沉默多药耐药基因。2019年,Li等[45]分别通过仿生矿化和共沉淀的方法将质粒DNA表达的增强绿色荧光蛋白(Plasmid DNA expressing enhanced green fluorescent protein,pEGFP-C1) 包封在ZIF-8和ZIF-8-聚合物中,得到pEGFP-C1@ZIF-8和pEGFP-C1@ZIF-8-PEI125kD,可以抵抗脱氧核糖核酸酶Ⅰ的降解。
3 提高细胞的抗逆性细胞是生物体基本的结构和功能单位,MOFs作细胞的保护层可以保护细胞抵抗外环境中不利因素的影响,可以提高细胞的储存稳定性、抗真菌化学物质等的性能。
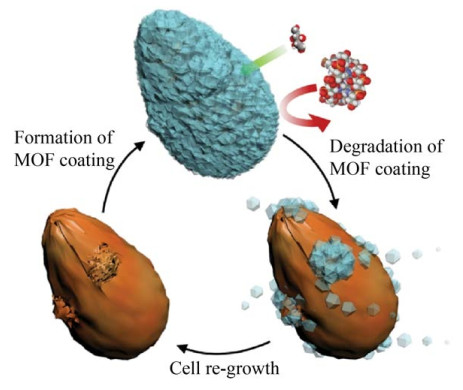
2016年,Liang等[46]首次证明可以在活的生命体表面形成MOF材料(ZIF-8)。将有ZIF-8涂层的酵母细胞培养在含有酵母提取物和葡萄糖的培养基中,然后向培养基中添加溶细胞酶,使用荧光指示剂(FDA) 对细胞活力进行24 h的监测,ZIF-8包被的酵母的荧光发射没有产生明显的变化(3 h和24 h分别损失5.3%和19%),而对于无保护的酵母,在3 h内荧光减少了95%;在抗真菌药(Filipin) 存在的条件下(选择的这种抗真菌药物的分子比ZIF-8的微孔略大) 培养24 h后,无保护的酵母几乎100%死亡,而有ZIF-8涂层的酵母细胞死亡少于10% (图 3)。一年后,该团队[47]为了能使细胞在贫营养环境中生存,又在酵母细胞上涂上一层β-半乳糖苷酶,然后在酶涂层上形成MOFs薄膜,这使细胞能够在模拟的极端贫营养环境中存活7 d以上,细胞活力下降不到30%,而无保护的酵母的存活率下降了99%。
利用MOFs固定病毒抗原可以使病毒抗原抵抗一些物理和化学上的伤害,这有助于进一步扩大病毒抗原在实际中的应用。
2017年,Jiang等[48]用基于MOFs的生物保存技术制备了生物等离子体纸基装置(Bioplasmonic paper-based device,BPDs),在室温和高温下均能保持一个月的稳定性。具有ZIF-8保护层的基于寨卡病毒非结构蛋白1 (ZIKV-NS1) 的BPDs在室温(20–23 ℃) 和60 ℃存放4周后,分别保持了近89%和78%的识别能力。而没有保护层的BPDs在这两种温度下都会迅速丧失大部分的生物识别能力。同年,Bhardwaj等[49]合成的MOF-噬菌体生物传感器在储存100 d之后,光致发光响应没有显著变化(小于3%),这说明基于MOF-噬菌体的生物传感器可在室温条件下长期稳定地储存。此外,Luzuriaga等和Li等[50-53]以烟草花叶病毒(TMV) 为病毒模板在其表面制备了MOFs壳,而且能从这种核壳复合材料中回收出完整的病毒颗粒。制备的TMV@ZIF-8经过100 ℃ 20 min后形态依旧不变,之后还进一步阐明了TMV@ZIF-8的完整性、生物安全性和整体复合物的免疫原性。
5 提高细菌的抗逆性细菌可应用于肿瘤治疗、生物成像等领域[54-55]。但是细菌往往会受到辐射、热和机械力的影响[46-47]。2018年,Ji等[21]报道了纳米厚度的单层锆基MOF (Zr6O4(OH)4(BTB)2(OH)6(H2O)6)膜均匀包裹厌氧菌的方法,在人工光合作用中用于细胞保护。该MOFs外壳保护的严格厌氧菌(热醋穆尔氏菌Moorella thermoacetica) 在21% O2环境中存活2 d,存活率仍高达76%±8%,与厌氧条件下83%±7%的存活率相当;而裸露的热醋穆尔氏菌的数量下降到50%±7%,死亡率增加了5倍。在2020年,Yan等[23]证明MOF工程菌是肿瘤靶向治疗递送的强大载体,采用一步原位合成法在大肠杆菌上涂上一层ZIF-8,并且涂层上共负载有光敏剂和化学药物,试验表明E. coli@ZIF-8/C & D即使在4 ℃储存2周仍保持高活性。
6 总结与展望近年来,MOFs作为固定生物活性物质的载体激发了广大科研工作者的研究热情,这是由于基于金属有机骨架的生物复合物在催化、传感和生物医药等领域有广阔的应用前景。在此,我们对近几年发表的基于金属有机骨架的生物复合物提高生物活性物质抗逆性的研究进展进行了总结。已报道的MOFs固定生物活性物质的种类多种多样,从酶、核酸等生物小分子扩大到细胞、病毒和细菌等生物物质。另外,有些MOFs材料本身具有功能性,如催化性能等,使其应用范围进一步拓宽,能够充分满足实际需求和科研人员丰富的想象力。基于MOFs的生物复合物在高温、高压、有机试剂、胰酶和长期储存等方面展现出良好的稳定性,为新型生物抗逆性材料的研制提供了技术支持和理论依据。
为了进一步提升基于金属有机骨架的生物复合物的抗逆性效果,加速其在各个领域的应用,以下几方面仍需进行深入研究:1) 提升包封效率,可以提高投入生物原料的利用率、降低生产成本;2) 进一步制备和发掘本身具有功能性的MOFs,促进更加智能的生物抗逆性材料的构建,同时拓宽其应用范围,达到协同应用的效果;3) 探究MOFs提高生物活性物质抗逆性的机理。今后,相信在生物、化学、物理等交叉学科科研工作者的共同努力下能够进一步提升基于MOFs的生物复合物的抗逆性,从而更好地推动MOFs技术在新型生物材料、疫苗和诊断试剂盒等领域的应用和产业化。
| [1] |
Dutta S, Kim J, Hsieh PH, et al. Nanoarchitectonics of biofunctionalized metal-organic frameworks with biological macromolecules and living cells. Small Methods, 2019, 3(11): 1900213. DOI:10.1002/smtd.201900213
|
| [2] |
Zeidan AA, Poulsen VK, Janzen T, et al. Polysaccharide production by lactic acid bacteria: from genes to industrial applications. FEMS Microbiol Rev, 2017, 41(supp_1): S168-S200. DOI:10.1093/femsre/fux017
|
| [3] |
Bilal M, Barcel-#243; D, Iqbal HMN. Persistence, ecological risks, and oxidoreductases-assisted biocatalytic removal of triclosan from the aquatic environment. Sci Total Environ, 2020, 735: 139194. DOI:10.1016/j.scitotenv.2020.139194
|
| [4] |
Jahanban-Esfahlan A, Seidi K, Jaymand M, et al. Dynamic DNA nanostructures in biomedicine: beauty, utility and limits. J Control Release, 2019, 315: 166-185. DOI:10.1016/j.jconrel.2019.10.003
|
| [5] |
Duan W, Zhao Z, An H, et al. State-of-the-art and prospects of biomolecules: incorporation in functional metal-organic frameworks. Top Curr Chem (Cham), 2019, 377(6): 34. DOI:10.1007/s41061-019-0258-z
|
| [6] |
Liang K, Ricco R, Doherty CM, et al. Biomimetic mineralization of metal-organic frameworks as protective coatings for biomacromolecules. Nat Commun, 2015, 6: 7240. DOI:10.1038/ncomms8240
|
| [7] |
Liang JY, Liang K. Biocatalytic metal-organic frameworks: prospects beyond bioprotective porous matrices. Adv Funct Mater, 2020, 2001648: 1-24.
|
| [8] |
Liang S, Wu XL, Xiong J, et al. Metal-organic frameworks as novel matrices for efficient enzyme immobilization: an update review. Coord Chem Rev, 2020, 406: 213149. DOI:10.1016/j.ccr.2019.213149
|
| [9] |
Park JH, Yang SH, Lee J, et al. Nanocoating of single cells: from maintenance of cell viability to manipulation of cellular activities. Adv Mater, 2014, 26(13): 2001-2010. DOI:10.1002/adma.201304568
|
| [10] |
Liang W, Xu H, Carraro F, et al. Enhanced activity of enzymes encapsulated in hydrophilic metal- organic frameworks. J Am Chem Soc, 2019, 141(6): 2348-2355. DOI:10.1021/jacs.8b10302
|
| [11] |
Ricc-#242; R, Liang WB, Li SB, et al. Metal-organic frameworks for cell and virus biology: a perspective. ACS Nano, 2018, 12(1): 13-23. DOI:10.1021/acsnano.7b08056
|
| [12] |
Poddar A, Conesa JJ, Liang K, et al. Encapsulation, visualization and expression of genes with biomimetically mineralized zeolitic imidazolate framework-8 (ZIF-8). Small, 2019, 15(36): 1902268. DOI:10.1002/smll.201902268
|
| [13] |
Sun YJ, Zheng LW, Yang Y, et al. Metal-organic framework nanocarriers for drug delivery in biomedical applications. Nano-Micro Lett, 2020, 12(1): 103. DOI:10.1007/s40820-020-00423-3
|
| [14] |
Li HL, Eddaoudi M, et al. Design and synthesis of an exceptionally stable and highly porous metal-organic framework. Nature, 1999, 402(6759): 276-279. DOI:10.1038/46248
|
| [15] |
Furukawa H, Cordova KE, O'Keeffe M, et al. The chemistry and applications of metal-organic frameworks. Science, 2013, 341(6149): 1230444. DOI:10.1126/science.1230444
|
| [16] |
Dong XY, Si Y, Yang JS, et al. Ligand engineering to achieve enhanced ratiometric oxygen sensing in a silver cluster-based metal-organic framework. Nat Commun, 2020, 11(1): 3678. DOI:10.1038/s41467-020-17200-w
|
| [17] |
Kumar S, Jain S, Nehra M, et al. Green synthesis of metal-organic frameworks: a state-of-the-art review of potential environmental and medical applications. Coord Chem Rev, 2020, 420: 213407. DOI:10.1016/j.ccr.2020.213407
|
| [18] |
Jeoung S, Kim S, Kim M, et al. Pore engineering of metal-organic frameworks with coordinating functionalities. Coord Chem Rev, 2020, 420: 213377. DOI:10.1016/j.ccr.2020.213377
|
| [19] |
Gkaniatsou E, Sicard C, Ricoux R, et al. Metal-organic frameworks: a novel host platform for enzymatic catalysis and detection. Mater Horiz, 2017, 4(1): 55-63. DOI:10.1039/C6MH00312E
|
| [20] |
Wang FM, Zhang Y, Liu ZW, et al. A biocompatible heterogeneous MOF-Cu catalyst for in vivo drug synthesis in targeted subcellular organelles. Angew Chem Int Ed, 2019, 58(21): 6987-6992. DOI:10.1002/anie.201901760
|
| [21] |
Ji Z, Zhang H, Liu H, et al. Cytoprotective metal-organic frameworks for anaerobic bacteria. Proc Natl Acad Sci USA, 2018, 115(42): 10582-10587. DOI:10.1073/pnas.1808829115
|
| [22] |
Doonan C, Riccò R, Liang K, et al. Metal-organic frameworks at the biointerface: synthetic strategies and applications. Acc Chem Res, 2017, 50(6): 1423-1432. DOI:10.1021/acs.accounts.7b00090
|
| [23] |
Yan SQ, Zeng XM, Wang Y, et al. Biomineralization of bacteria by a metal-organic framework for therapeutic delivery. Adv Healthc Mater, 2020, 9(12): 2000046. DOI:10.1002/adhm.202000046
|
| [24] |
谷娜, 李恒, 赵远. 金属有机骨架材料固定生物大分子的研究进展. 中国材料进展, 2017, 36(11): 833-839, 851. Gu N, Li H, Zhao Y. Recent advances in biomacromolecules immobilization by metal organic frameworks. Mater China, 2017, 36(11): 833-839, 851 (in Chinese). |
| [25] |
An HD, Li MM, Gao J, et al. Incorporation of biomolecules in metal-organic frameworks for advanced applications. Coord Chem Rev, 2019, 384: 90-106. DOI:10.1016/j.ccr.2019.01.001
|
| [26] |
Zhuang J, Young AP, Tsung CK. Integration of biomolecules with metal-organic frameworks. Small, 2017, 13(32): 1700880. DOI:10.1002/smll.201700880
|
| [27] |
Feng YF, Wang HR, Zhang SN, et al. Antibodies@MOFs: an in vitro protective coating for preparation and storage of biopharmaceuticals. Adv Mater, 2019, 31(2): 1805148. DOI:10.1002/adma.201805148
|
| [28] |
Shieh FK, Wang SC, Yen CI, et al. Imparting functionality to biocatalysts via embedding enzymes into nanoporous materials by a de novo approach: size-selective sheltering of catalase in metal-organic framework microcrystals. J Am Chem Soc, 2015, 137(13): 4276-4279. DOI:10.1021/ja513058h
|
| [29] |
Liao FS, Lo WS, Hsu YS, et al. Shielding against unfolding by embedding enzymes in metal-organic frameworks via a de novo approach. J Am Chem Soc, 2017, 139(19): 6530-6533. DOI:10.1021/jacs.7b01794
|
| [30] |
Du YJ, Gao J, Zhou LY, et al. Enzyme nanocapsules armored by metal-organic frameworks: a novel approach for preparing nanobiocatalyst. Chem Eng J, 2017, 327: 1192-1197. DOI:10.1016/j.cej.2017.07.021
|
| [31] |
Zhu G, Zhang M, Bu Y, et al. Enzyme-embedded metal-organic framework colloidosomes via an emulsion-based approach. Chem Asian J, 2018, 13(19): 2891-2896. DOI:10.1002/asia.201800976
|
| [32] |
He HM, Han HB, Shi H, et al. Construction of thermophilic lipase-embedded metal-organic frameworks via biomimetic mineralization: a biocatalyst for ester hydrolysis and kinetic resolution. ACS Appl Mater Interfaces, 2016, 8(37): 24517-24524. DOI:10.1021/acsami.6b05538
|
| [33] |
Vaidya LB, Nadar SS, Rathod VK. Entrapment of surfactant modified lipase within zeolitic imidazolate framework (ZIF)-8. Int J Biol Macromol, 2020, 146: 678-686. DOI:10.1016/j.ijbiomac.2019.12.164
|
| [34] |
Zou YL, Zhang YT, Liu XY, et al. Solvent-free synthetic Fe3O4@ZIF-8 coated lipase as a magnetic-responsive pickering emulsifier for interfacial biocatalysis. Catal Lett, 2020, 150(12): 3608-3616. DOI:10.1007/s10562-020-03240-w
|
| [35] |
Chen J, Sun BZ, Sun CR, et al. Immobilization of lipase AYS on UiO-66-NH2 metal-organic framework nanoparticles as a recyclable biocatalyst for ester hydrolysis and kinetic resolution. Sep Purif Technol, 2020, 251: 117398. DOI:10.1016/j.seppur.2020.117398
|
| [36] |
Wu XL, Ge J, Yang C, et al. Facile synthesis of multiple enzyme-containing metal-organic frameworks in a biomolecule-friendly environment. Chem Commun, 2015, 51(69): 13408-13411. DOI:10.1039/C5CC05136C
|
| [37] |
Song JY, He WT, Shen H, et al. Construction of multiple enzyme metal-organic frameworks biocatalyst via DNA scaffold: a promising strategy for enzyme encapsulation. Chem Eng J, 2019, 363: 174-182. DOI:10.1016/j.cej.2019.01.138
|
| [38] |
Cheng KP, Svec F, Lv Y, et al. Hierarchical micro- and mesoporous Zn-based metal-organic frameworks templated by hydrogels: their use for enzyme immobilization and catalysis of Knoevenagel reaction. Small, 2019, 15(44): 1902927. DOI:10.1002/smll.201902927
|
| [39] |
Wang JN, Bao MY, Wei TX, et al. Bimetallic metal-organic framework for enzyme immobilization by biomimetic mineralization: constructing a mimic enzyme and simultaneously immobilizing natural enzymes. Anal Chim Acta, 2020, 1098: 148-154. DOI:10.1016/j.aca.2019.11.039
|
| [40] |
Xu W, Jiao L, Yan H, et al. Glucose oxidase-integrated metal-organic framework hybrids as biomimetic cascade nanozymes for ultrasensitive glucose biosensing. ACS Appl Mater Interfaces, 2019, 11(25): 22096-22101. DOI:10.1021/acsami.9b03004
|
| [41] |
Zhong X, Xia H, Huang WQ, et al. Biomimetic metal-organic frameworks mediated hybrid multi-enzyme mimic for tandem catalysis. Chem Eng J, 2020, 381: 122758. DOI:10.1016/j.cej.2019.122758
|
| [42] |
Ling PH, Qian CH, Gao F, et al. Enzyme-immobilized metal-organic framework nanosheets as tandem catalysts for the generation of nitric oxide. Chem Commun, 2018, 54(79): 11176-11179. DOI:10.1039/C8CC05068F
|
| [43] |
Wang JN, Wei TX, Liu YC, et al. Colloidal-sized zirconium porphyrin metal-organic frameworks with improved peroxidase-mimicking catalytic activity, stability and dispersity. Analyst, 2020, 145(8): 3002-3008. DOI:10.1039/C9AN02418B
|
| [44] |
He C, Lu K, Liu D, et al. Nanoscale metal-organic frameworks for the co-delivery of cisplatin and pooled siRNAs to enhance therapeutic efficacy in drug-resistant ovarian cancer cells. J Am Chem Soc, 2014, 136(14): 5181-5184. DOI:10.1021/ja4098862
|
| [45] |
Li YT, Zhang K, Liu PR, et al. Encapsulation of plasmid DNA by nanoscale metal-organic frameworks for efficient gene transportation and expression. Adv Mater, 2019, 31(29): 1901570. DOI:10.1002/adma.201901570
|
| [46] |
Liang K, Richardson JJ, Cui JW, et al. Metal-organic framework coatings as cytoprotective exoskeletons for living cells. Adv Mater, 2016, 28(36): 7910-7914. DOI:10.1002/adma.201602335
|
| [47] |
Liang K, Richardson JJ, Doonan CJ, et al. An enzyme-coated metal-organic framework shell for synthetically adaptive cell survival. Angew Chem Int Ed, 2017, 56(29): 8510-8515. DOI:10.1002/anie.201704120
|
| [48] |
Jiang Q, Chandar YJ, Cao S, et al. Rapid, point-of-care, paper-based plasmonic biosensor for zika virus diagnosis. Adv Biosyst, 2017, 1(9): 1700096. DOI:10.1002/adbi.201700096
|
| [49] |
Bhardwaj N, Bhardwaj SK, Mehta J, et al. MOF-bacteriophage biosensor for highly sensitive and specific detection of Staphylococcus aureus. ACS Appl Mater Interfaces, 2017, 9(39): 33589-33598. DOI:10.1021/acsami.7b07818
|
| [50] |
Luzuriaga MA, Welch RP, Dharmarwardana M, et al. Enhanced stability and controlled delivery of MOF-encapsulated vaccines and their immunogenic response in vivo. ACS Appl Mater Interfaces, 2019, 11(10): 9740-9746. DOI:10.1021/acsami.8b20504
|
| [51] |
Li S, Dharmarwardana M, Welch RP, et al. Investigation of controlled growth of metal-organic frameworks on anisotropic virus particles. ACS Appl Mater Interfaces, 2018, 10(21): 18161-18169. DOI:10.1021/acsami.8b01369
|
| [52] |
Li S, Dharmarwardana M, Welch RP, et al. Template-directed synthesis of porous and protective core-shell bionanoparticles. Angew Chem Int Ed, 2016, 55(36): 10691-10696. DOI:10.1002/anie.201604879
|
| [53] |
Li SB, Gassensmith JJ. Synthesis of metal-organic frameworks on tobacco mosaic virus templates. Methods Mol Biol, 2018, 1798: 95-108.
|
| [54] |
Fan JX, Peng MY, Wang H, et al. Engineered bacterial bioreactor for tumor therapy via Fenton-like reaction with localized H2O2 generation. Adv Mater, 2019, 31(16): 1808278. DOI:10.1002/adma.201808278
|
| [55] |
Min JJ, Kim HJ, Park JH, et al. Noninvasive real-time imaging of tumors and metastases using tumor-targeting light-emitting Escherichia coli. Mol Imaging Biol, 2008, 10(1): 54-61. DOI:10.1007/s11307-007-0120-5
|
 2021, Vol. 37
2021, Vol. 37