中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈凡, 王伟, 顾大勇, 聂勇波, 肖正勤, 黄开瑜, 马宏伟, 何建安, 杨凡
- Chen Fan, Wang Wei, Gu Dayong, Nie Yongbo, Xiao Zhengqin, Huang Kaiyu, Ma Hongwei, He Jianan, Yang Fan
- 改性聚二甲基硅氧烷(iPDMS) 蛋白芯片在肿瘤相关抗原自身抗体筛查中的应用
- Application of iPDMS protein microarray in screening of tumor-associated antigen autoantibodies
- 生物工程学报, 2021, 37(11): 4075-4082
- Chinese Journal of Biotechnology, 2021, 37(11): 4075-4082
- 10.13345/j.cjb.210017
-
文章历史
- Received: January 7, 2021
- Accepted: April 14, 2021
- Published: April 26, 2021
2. 东莞市长安医院检验科, 广东 东莞 523843;
3. 深圳大学第一附属医院检验科深圳市第二人民医院检验科, 广东 深圳 518035;
4. 中国科学院苏州纳米技术与纳米仿生研究所, 江苏 苏州 215123
2. Department of Laboratory Medicince, Dongguan Chang'an Hospital, Dongguan 523843, Guangdong, China;
3. Department of Laboratory Medicince, The First Affiliated Hospital of Shenzhen University, Shenzhen Second People's Hospital, Shenzhen 518035, Guangdong, China;
4. Suzhou Institute of Nano-Tech and Nano-Bionics, Chinese Academy of Sciences, Suzhou 215123, Jiangsu, China
肿瘤的早期筛查对肿瘤的防治尤为重要,当前肿瘤的早期筛查主要是对一些特异性肿瘤标志物的检测,如癌胚抗原(CEA) 和甲胎蛋白(AFP)等,但并非所有的肿瘤都有特异性标志物,而且当前的特异性标志物的检测费用也比较昂贵,不适合大规模早期筛查。一些常见的肿瘤标志物等可能不具有肿瘤特异性,不能有效地对肿瘤进行筛查和早期诊断。患者在疾病症状发展之前,血清中一些肿瘤相关抗原(Tumor-associated antigens,TAAs) 的自身抗体的血清水平已经增加,并且与癌症发病率相关[1-4],如鼻咽癌[5]、卵巢癌[6]、结肠癌[7]、肺癌[8-10]、前列腺癌[11]和乳腺癌[12]等,因此对自身抗体的检测可以预警早期肿瘤。但TAAs众多,当前的化学发光免疫学检测方法价格昂贵,难以做到对多种肿瘤的快速筛查。
蛋白质芯片(Protein microarray) 是高通量、高灵敏度、易于操作、实用性高的蛋白质研究工具,为检测肿瘤抗原自身抗体提供了很好的研究手段[13]。本研究使用iPDMS作为支撑材料,设计了20种肿瘤相关标志物的微阵列,构建了iPDMS蛋白芯片,利用iPDMS蛋白芯片对临床常见肿瘤患者的自身抗体进行筛查,并结合生物学信息手段进行分析,探讨其潜在的临床价值。
1 材料与方法 1.1 材料聚二甲基硅氧烷(PDMS) 及其前体A购自美国DowCorning公司;溴(Br) 引发剂、poly (OEGMA) 高分子层购自美国Sigma-Aldrich公司;交联剂以及各种抗原购自美国Raybiotech Life公司。AFP单克隆抗体以及抗原原料均购自美国Fitzgerald Industries International公司。抗原HGFR、TNFRSF8、IL2Rα、VEGFR1 CEACAM1、ERBB2、RET购自美国Fitzgerald Industries International公司。抗原EGFR、SLAMF7、VEGFR3、CTLA4、CD38、CD20、C-KIT、CD2、VEGF121、IL1R1、IL6R、PD1、CD19购自日本Fujirebio Diagnostics公司。
1.2 研究对象收集2019年11月–2020年10月期间深圳市第二人民医院肿瘤病例683例,其中男性380例,女性303例,平均年龄(55±6.5) 岁,所有病例经病理组织确诊,排除硬皮病、类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病。收集同期深圳市第二人民医院体检中心体检健康者192例,女性94例,男性98例,平均年龄(51±8.5) 岁,体检健康对照组和肿瘤组一般资料的差异无统计学意义(P > 0.05)。本研究经伦理委员会批准(批号:20200601018-FS01),患者均通告知情权。收集健康对照者及肿瘤患者清晨空腹静脉血3 mL,常温静置30 min,然后在4 000 r/min离心5 min,在2 h内完成标本实验检测。对于不能及时检测的样本,可分装血清标本后保存于–76 ℃冰箱中备用。
1.3 iPDMS膜的制备iPDMS膜的具体制备方法见前期研究[14],概括而言,厚度1 mm的iPDMS膜,在真空烤箱中(HE-ZK-300) 80 ℃下交联2 h而获得,随后通过引发聚合(SIP) 反应进行表面修饰得到可以直接使用的iPDMS薄膜。
1.4 iPDMS蛋白微阵列的制备蛋白质微阵列在iPDMS薄膜上的点样方法如前期研究所示[14],制备好的微阵列如暂不使用,氮气密封后在4 ℃保存。
1.5 芯片稳定性及灵敏度检测将iPDMS蛋白质芯片用氮气封装后,置于4 ℃保存。参考我们之前的研究[14],用AFP抗原稀释后点样,检测相应的单克隆抗体,用最低检测限(Limit of detection,LOD) 值来表示试验敏感度。每月抽取一块芯片检测,连续监测6个月,观察信号的变化情况,以确定芯片的稳定性。
1.6 蛋白芯片的设计利用上述新型的固体支撑材料iPDMS,设计了20种肿瘤相关表面标志的微阵列。蛋白微阵列按5×5设计,除了靶标检测样点之外,还包括阳性质控点和阴性质控点。蛋白芯片设计如图 1所示,20种肿瘤相关抗原的点样如图 2所示,其中人IgG为阳性对照点,Buffer为阴性对照点。

|
| 图 1 蛋白芯片设计示意图 Fig. 1 Protein microarray design. |
| |
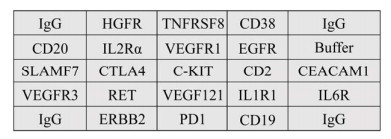
|
| 图 2 20种肿瘤抗原点样分布阵列 Fig. 2 Twenty tumor antigen arrays. |
| |
设计20种肿瘤相关靶蛋白的微阵列组成iPDMS蛋白芯片,用于常见肿瘤的筛查。具体操作参考前期研究方案[14]。
1.8 iPDMS蛋白芯片的诊断价值肿瘤组募集临床上常见的8种肿瘤患者合计683例,其中淋巴瘤16例,白血病54例,直结肠癌79例,肝癌68例,胃癌69例,肺癌152例,卵巢癌44例,乳腺癌201例,对照组192例。用iPDMS蛋白芯片对肿瘤组和对照组进行血清学筛查,统计阳性血清学反应。对有差异的抗原抗体以灵敏度为纵坐标、1-特异度为横坐标作ROC曲线分析。
1.9 结果分析方法所得图像利用GenePix Pro 6.0软件进行处理分析,采集635nm波长处每一个信号点的信号值(即平均化学发光强度) 以及芯片的背景信号值。将采集的信号值(平均化学发光强度) 转化为信噪比(Signal to noise ratio,SNR) 形式,SNR值的大小反映了与蛋白芯片中特定蛋白结合的信号强弱,代表了血清中的相应抗体水平。
样点信噪比:
由于iPDMS的背景接近于机器噪音,检测指标的化学敏感性很高。用AFP作为参比检测,LOD仅为750 pg/mL,完全能够满足临床检测的需求。将iPDMS芯片保存在4 ℃,每隔1个月检测一次,连续监测半年,结果发现,在4 ℃保存半年后,检测信号没有明显下降,检测AFP时LOD为810 pg/mL,说明iPDMS芯片在4 ℃下可以储存放置至少半年,具有较好的稳定性。
2.2 对照组和肿瘤组血清学筛查结果对比血清学检测结果发现,iPDMS蛋白质芯片的背景噪音控制在合理范围内,PB点的平均SNR值约为(0.45±0.1) (blank±3std),取SNR=1为截断值,则SNR > 1为阳性血清学反应(图 3)[16]。结果表明,肿瘤患者血清中存在针对2种蛋白的高表达的自身抗体,分别是VEGFR1和VEGF121。在常见的8种肿瘤的相关抗原血清筛查中,肿瘤组的VEGFR1和VEGF121的自身抗体响应SNR值都高于健康对照组,差异有统计学意义(P < 0.05) (图 4)。
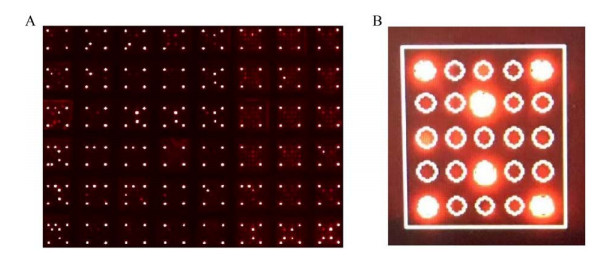
|
| 图 3 iPDMS芯片结果成像图 Fig. 3 Imaging results of the iPDMS microarray. (A) Microarray image (48 hole reaction plate). (B) An image of a single microarray. |
| |
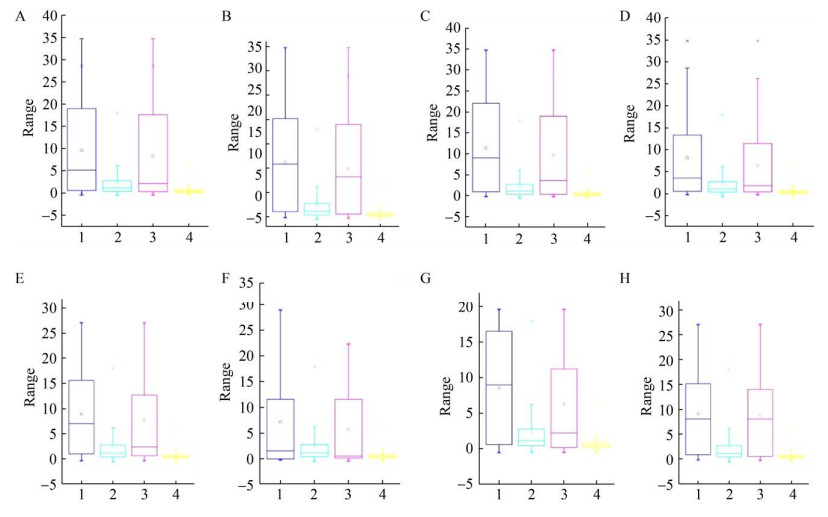
|
| 图 4 VEGFR1和VEGF121在8种肿瘤患者和对照组之间的SNR分布图 Fig. 4 SNR profiles of VEGFR1and VEGF121 between eight types of cancer patients and control groups. (A) Breast cancer. (B) Lung cancer. (C) Colon cancer. (D) Gastric cancer. (E) Liver cancer. (F) Leukemia. (G) Lymphoma. (H) Ovarian cancer. 1: VEGFR1 for patients group; 2: VEGFR1 for control group; 3: VEGF121 for patients group; 4: VEGF121 for control group. |
| |
为评估肿瘤患者血清中高表达的自身抗体的诊断价值,分别对这2种蛋白差异表达的自身抗体作ROC曲线分析,以1-特异度为横坐标、灵敏度为纵坐标作ROC曲线,对比2种蛋白的曲线下面积(Area under the curve,AUC) 可以看出,VEGFR1的曲线下面积最大(AUC=0.846,95% 可信区间为0.822–0.871),诊断最优;VEGF121的曲线下面积AUC=0.760,95%可信区间为0.729–0.791,也有一定的诊断意义(图 5)。
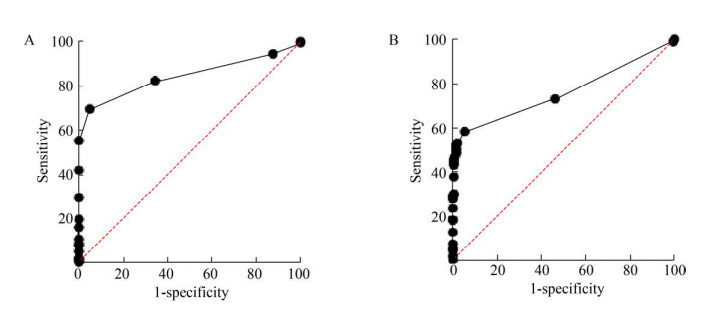
|
| 图 5 二种差异表达的肿瘤相关的自身抗体的ROC曲线 Fig. 5 ROC curves of two differentially expressed tumor-associated autoantibodies. (A) ROC curve of VEGFR1 autoantibody. (B) ROC curve of VEGF121 autoantibody. |
| |
为评估不同种类肿瘤患者血清中高表达的自身抗体的诊断价值,分别对这2种蛋白差异表达的自身抗体作ROC曲线分析,以1-特异度为横坐标、灵敏度为纵坐标作ROC曲线,对比2种蛋白的曲线下面积(Area under the curve,AUC)。结果表明,在8种常见肿瘤中,VEGFR1和VEGF121自身抗体的检测,与健康对照组相比具有诊断意义(图 6)。
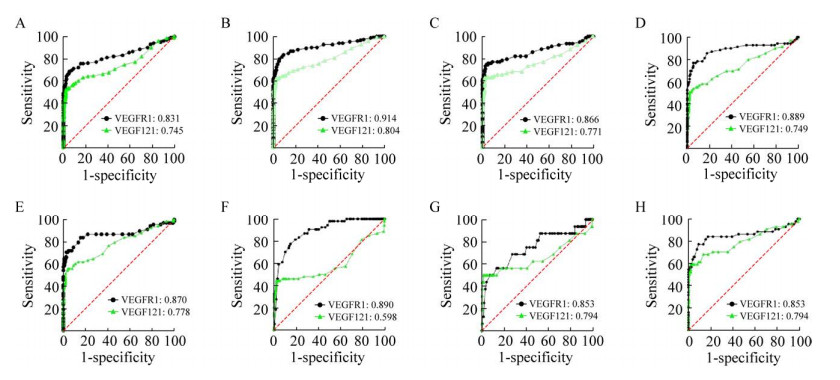
|
| 图 6 二种差异表达的肿瘤相关的自身抗体在8种不同肿瘤中的ROC曲线 Fig. 6 ROC curves of two differentially expressed tumor-related autoantibodies in eight different tumors. (A) Breast cancer. (B) Lung cancer. (C) Colon cancer. (D) Gastric cancer. (E) Liver cancer. (F) Leukemia. (G) Lymphoma. (H) Ovarian cancer. |
| |
随着当前生物技术的发展,已经衍生出各种寻找肿瘤相关自身抗体的技术,包括噬菌体显示、多重亲和蛋白分析(Mapping)、cDNA表达克隆(SEREX) 和重组血清蛋白质组分析(SERPA)[17-19]。这些方法和技术均可以用于肿瘤相关抗原自身抗体的筛选及鉴定,但这些技术存在操作烦琐、价格昂贵等问题,难以用于对肿瘤大范围早期筛查。蛋白质芯片具有高通量检测、快速、廉价等优点,在医学诊断中越来越受到关注[20]。常用的蛋白质芯片基底材料存在非特异性吸附,造成背景“噪音”,影响检测的特异性和灵敏度。iPDMS硅橡胶材料表面带有聚乙二醇侧链的高分子刷层,极大地降低了非特异性吸附[15, 21-22]。这种材料易于制备、成本低廉、具有合适的比表面积及优秀的表面化学性质,同时还能够可控地调节表面修饰状态,是一种非常理想的微阵列基底材料[16, 23]。
Lu等[24]建立了iPDMS芯片检测系统应用于疟疾的临床分型,并已经形成用于疟疾诊断的试剂盒。我们项目组得到了中国科学院苏州纳米技术与纳米仿生研究所的技术支持,在其基础上应用iPDMS为支撑介质的新型芯片,采用蛋白微阵列技术筛查肿瘤相关抗原的自身抗体。本研究首先成功构建了iPDMS蛋白芯片,并验证了其检测的灵敏度和稳定性,具有临床诊断的使用价值。然后设计了20种肿瘤相关抗原的微阵列(图 1,图 2),并成功运用iPDMS蛋白芯片对683例常见肿瘤患者和192例健康对照者的血清进行了筛查,通过对常见的8种肿瘤对比分析,发现了有差异的两种肿瘤相关抗原自身抗体——VEGFR1和VEGF121 (图 3,图 4),并且通过分析证实了VEGFR1和VEGF121自身抗体在8种常见肿瘤检测中的诊断价值(图 5,图 6)。国内外关于肿瘤自身抗体筛查常常采用ELISA技术进行检测,本研究采用的iPDMS蛋白芯片其检测灵敏度可达到750 pg/mL,远高于ELISA技术,可用于超微量抗体水平的检测。
由于人体免疫系统存在复杂的调节机制,加之肿瘤的致病机制复杂,一些有诊断意义的自身抗体不一定是针对肿瘤相关抗原,还存在一些其他抗原的自身抗体,如由于炎症反应、免疫耐受失衡、新的抗原表位和细胞死亡而产生的自身抗体等。对这些自身抗体的检测,有助于进一步提高肿瘤早期诊断的准确性。尽管本研究筛选到了2种有早期诊断价值的自身抗体,但由于分析样本有限,难以直接将2种自身抗体用于常见肿瘤的早期诊断。下一步工作应该扩大样本的检测量,对更多的肿瘤相关抗原进行筛选,期望发现其他有诊断价值的自身抗体,然后结合多种自身抗体进行联合检测,提高肿瘤诊断的特异性和灵敏性,实现真正意义上的早期诊断。总之,本研究建立的iPDMS蛋白质芯片,具有很好的检测灵敏度和稳定性,在肿瘤早期检测时具有高通量、价格低廉、快速等特点,为临床进行肿瘤早期大范围筛查奠定了基础。
| [1] |
Atak A, Mukherjee S, Jain R, et al. Protein microarray applications: autoantibody detection and posttranslational modification. Proteomics, 2016, 16(19): 2557-2569. DOI:10.1002/pmic.201600104
|
| [2] |
Nesterova M, Johnson N, Cheadle C, et al. Autoantibody biomarker opens a new gateway for cancer diagnosis. Biochim Biophys Acta, 2006, 1762(4): 398-403. DOI:10.1016/j.bbadis.2005.12.010
|
| [3] |
Zhang JB, Cao M, Chen J, et al. Serum anti-TOPO48 autoantibody as a biomarker for early diagnosis and prognosis in patients with esophageal squamous cell carcinoma. Clin Res Hepatol Gastroenterol, 2018, 42(3): 276-284. DOI:10.1016/j.clinre.2017.09.007
|
| [4] |
Tan EM, Zhang J. Autoantibodies to tumor-associated antigens: reporters from the immune system. Immunol Rev, 2008, 222: 328-340. DOI:10.1111/j.1600-065X.2008.00611.x
|
| [5] |
Lin LH, Xu YW, Huang LS, et al. Serum proteomic-based analysis identifying autoantibodies against PRDX2 and PRDX3 as potential diagnostic biomarkers in nasopharyngeal carcinoma. Clin Proteomics, 2017, 14: 6. DOI:10.1186/s12014-017-9141-5
|
| [6] |
Chatterjee M, Mohapatra S, Ionan A, et al. Diagnostic markers of ovarian cancer by high-throughput antigen cloning and detection on arrays. Cancer Res, 2006, 66(2): 1181-1190. DOI:10.1158/0008-5472.CAN-04-2962
|
| [7] |
Scanlan MJ, Chen YT, Williamson B, et al. Characterization of human colon cancer antigens recognized by autologous antibodies. Int J Cancer, 1998, 76(5): 652-658. DOI:10.1002/(SICI)1097-0215(19980529)76:5<652::AID-IJC7>3.0.CO;2-P
|
| [8] |
Gnjatic S, Wheeler C, Ebner M, et al. Seromic analysis of antibody responses in non-small cell lung cancer patients and healthy donors using conformational protein arrays. J Immunol Methods, 2009, 341(1/2): 50-58.
|
| [9] |
Diesinger I, Bauer C, Brass N, et al. Toward a more complete recognition of immunoreactive antigens in squamous cell lung carcinoma. Int J Cancer, 2002, 102(4): 372-378. DOI:10.1002/ijc.10714
|
| [10] |
Chapman CJ, Thorpe AJ, Murray A, et al. Immunobiomarkers in small cell lung cancer: potential early cancer signals. Clin Cancer Res, 2011, 17(6): 1474-1480. DOI:10.1158/1078-0432.CCR-10-1363
|
| [11] |
Wang XJ, Yu JJ, Sreekumar A, et al. Autoantibody signatures in prostate cancer. N Engl J Med, 2005, 353(12): 1224-1235. DOI:10.1056/NEJMoa051931
|
| [12] |
Disis ML, Calenoff E, McLaughlin G, et al. Existent T-cell and antibody immunity to HER-2/neu protein in patients with breast cancer. Cancer Res, 1994, 54(1): 16-20.
|
| [13] |
Nam MJ, Madoz-Gurpide J, Wang H, et al. Molecular profiling of the immune response in colon cancer using protein microarrays: occurrence of autoantibodies to ubiquitin C-terminal hydrolase L3. Proteomics, 2003, 3(11): 2108-2115. DOI:10.1002/pmic.200300594
|
| [14] |
王伟. 蛋白质芯片在肿瘤标志物筛查中的应用以及利用SELEX技术筛选CD20/486的ssDNA适配体的研究[D]. 广州: 南方医科大学, 2019. Wang W. CD20/486 ssDNA aptamers by SELEX and its application in tumor markers protein microarray construction[D]. Guangzhuo: Southern Medical University, 2019 (in Chinese). |
| [15] |
Ma H, Wu Y, Yang X, et al. Integrated poly(dimethysiloxane) with an intrinsic nonfouling property approaching "absolute" zero background in immunoassays. Anal Chem, 2010, 82(15): 6338-6342. DOI:10.1021/ac101277e
|
| [16] |
祁松楠. iPDMS微阵列技术应用于非小细胞肺癌诊疗的研究[D]. 苏州: 苏州大学, 2015. Qi SN. iPDMS based microarray technology apply to the clinical research of non-small cell lung cancer[D]. Suzhou: Soochow University, 2015 (in Chinese). |
| [17] |
Zhong L, Peng X, Hidalgo GE, et al. Identification of circulating antibodies to tumor-associated proteins for combined use as markers of non-small cell lung cancer. Proteomics, 2004, 4(4): 1216-1225. DOI:10.1002/pmic.200200679
|
| [18] |
Zhang JY, Casiano CA, Peng XX, et al. Enhancement of antibody detection in cancer using panel of recombinant tumor-associated antigens. Cancer Epidemiol Biomarkers Prev, 2003, 12(2): 136-143.
|
| [19] |
Gunawardana CG, Diamandis EP. High throughput proteomic strategies for identifying tumour- associated antigens. Cancer Lett, 2007, 249(1): 110-119. DOI:10.1016/j.canlet.2007.01.002
|
| [20] |
陈凡, 何建安, 董瑞玲, 等. SPR蛋白质芯片在输入性疟疾筛查中的应用. 生物工程学报, 2021, 37(7): 1-8. Chen F, He JA, Dong RL, et al. Application of SPR protein chip in screening for imported malaria. Chin J Biotech, 2021, 37(7): 1-8 (in Chinese). |
| [21] |
Wu Y, Huang Y, Ma H. A facile method for permanent and functional surface modification of poly(dimethylsiloxane). J Am Chem Soc, 2007, 129(23): 7226-7227. DOI:10.1021/ja071384x
|
| [22] |
Blümmel J, Perschmann N, Aydin D, et al. Protein repellent properties of covalently attached PEG coatings on nanostructured SiO2-based interfaces. Biomaterials, 2007, 28(32): 4739-4747. DOI:10.1016/j.biomaterials.2007.07.038
|
| [23] |
Huang M, Ma Q, Liu X, et al. Initiator integrated poly(dimethysiloxane)-based microarray as a tool for revealing the relationship between nonspecific interactions and irreproducibility. Anal Chem, 2015, 87(14): 7085-7091. DOI:10.1021/acs.analchem.5b00694
|
| [24] |
Lu Y, Li Z, Teng H, et al. Chimeric peptide constructs comprising linear B-cell epitopes: application to the serodiagnosis of infectious diseases. Sci Rep, 2015, 5: 13364. DOI:10.1038/srep13364
|
 2021, Vol. 37
2021, Vol. 37




