中国科学院微生物研究所、中国微生物学会主办
文章信息
- 滕洪明, 崔莹, 王樱洁, 逄越, 李庆伟
- Teng Hongming, Cui Ying, Wang Yingjie, Pang Yue, Li Qingwei
- 尿液蛋白富集方法的比较
- Comparison of methods for enriching urine proteins
- 生物工程学报, 2021, 37(11): 4102-4110
- Chinese Journal of Biotechnology, 2021, 37(11): 4102-4110
- 10.13345/j.cjb.210090
-
文章历史
- Received: January 28, 2021
- Accepted: June 1, 2021
- Published: June 11, 2021
2. 辽宁师范大学 七鳃鳗研究中心, 辽宁 大连 116081
2. Lamprey Research Center, Liaoning Normal University, Dalian 116081, Liaoning, China
尿液可以无创、大量获取,不受稳态调节的影响,在一定程度上反映机体的生理和病理状态,对规模化筛选泌尿系统癌症诊断标记物和治疗靶点的发现均有重大意义[1]。针对一些疾病,尿液中标记物比在血液中具有更好的诊断意义,如尿液中的血管抑素(Angiostation) 与肾病、融合素-α (ADAM12) 与乳腺癌相关等[2-3]。因此,对人尿液蛋白质进行深入鉴定和研究,有利于发现多种疾病的诊断生物标记物,这为疾病的临床诊断及治疗靶点提供了新的工具分子。
尿液蛋白组学标志物的研究,一方面依赖于技术和生物信息的发展,另一方面在于尿液样本的规范处理[4-8]。尿液蛋白质的稳定性受多种因素影响,主要包括:膀胱中蛋白质水解作用、尿液样本储存过程、尿量、尿液pH值、受检者年龄、健康程度和饮食等[9-12]。
尿蛋白主要富集方法有超滤、抽滤、丙酮沉淀和硫酸铵沉淀等富集方法[13-16]。为建立标准化尿液蛋白富集流程,在临床患者体内尿液代谢水平开展研究工作,本研究针对尿液蛋白富集常用方法——超滤法、硝酸纤维素膜富集法和硫酸铵沉淀法富集尿蛋白方法的对比研究,综合分析富集效率、富集蛋白种类及重复性等因素,以优化并建立尿蛋白质组学研究中样本处理及蛋白富集的标准流程。
1 材料与方法 1.1 实验样本健康志愿者5例和膀胱癌患者5例,每人取30 mL尿液,采集的样本需在2 h之内处理。采集样本信息如表 1所示。
| Groups | Healthy volunteers-1 | Healthy volunteers-2 | Bladder cancer |
| Number | 5 | 5 | 5 |
| Male/female | 2/3 | 3/2 | 3/2 |
| Ages | 22.50±3.28 | 70.35±5.65 | 72.40±7.74 |
仪器:抽滤装置及真空泵、水平离心机、涡旋仪、4 ℃离心机、磁力搅拌器、酶标仪。
耗材:2 L烧杯、透析袋、透析夹、50 mL离心管(高压)、2 mL离心管(高压)、96孔板、硝酸纤维素膜、高压无菌500 mL广口瓶。
试剂:丙酮、硫酸铵饱和溶液、RIPA蛋白裂解液(强)、Cocktail磷酸酶抑制剂、蛋白酶抑制剂苯甲基磺酰氟PMSF、BCA试剂盒、磷酸盐缓冲溶液(PBS,20×)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、胰酶。
饱和硫酸铵溶液:称取250 g硫酸铵粉末,溶于500 mL水,于65 ℃水浴中促溶,置4 ℃冰箱过夜,第2天观察烧杯底部有明显结晶,取上清使用。
1.3 实验方法 1.3.1 超滤选取截流分子量10 kDa的超滤管,加入PBS 5 mL清洗,7 500×g离心5 min,弃去液体。加入10 mL原尿,7 500×g离心至截留部分剩余200–300 μL液体。为了避免流下去的液体含有蛋白导致样本丢样,先将流下去的液体收集起来。向上层截留柱内部加入10 mL原尿,混匀后,7 500×g离心至截留部分剩余200–300 μL液体。重复上述步骤,取出最后一次截流的200–300 μL液体,以PBS作为空白对照,检测蛋白浓度。超滤管中的废液弃去,加入20%乙醇保存,置于4 ℃待用[12]。
1.3.2 硝酸纤维素膜富集法10 mL尿液加入1/2体积的磷酸盐缓冲液稀释,混匀后将样本倒入含有1层硝酸纤维素膜和4层滤纸的抽滤装置中,调节真空泵压力使样本逐滴滴下,直到过滤完成。取出硝酸纤维素膜,晾干,封装于真空袋中,置于−80 ℃冰箱保存。将吸附有尿蛋白的硝酸纤维素膜裁剪,置于2 mL离心管中,依次加入1.7 mL丙酮和250 μL 0.5%碳酸氢铵水溶液,强烈振荡10 min,4 ℃放置1 h。14 000× g离心15 min,弃上清,室温放置30 min,晾干。加入400 μL RIPA蛋白裂解液吹打后强烈振摇10 min后重悬。14 000× g离心15 min后取上清,分装后,可长期保存于−80 ℃冰箱[13]。
1.3.3 饱和硫酸铵沉淀法采用硫酸铵沉淀蛋白质,降低高丰度白蛋白,每管10 mL尿液中按1︰1体积加入硫酸铵饱和溶液(用注射器缓慢滴入)。混匀尿液与硫酸铵,放于4 ℃冰箱中静置过夜。水平离心3 500 r/min,离心15 min。将上清弃掉(留5 mL左右上清样品进行透析,作为对照)。加入2 mL水复溶沉淀,50 mL离心管中的沉淀两管混合成一管。将2 mL沉淀转移至透析袋中,透析24 h,每隔8 h换一次透析液(1×PBS)。分装时,使用透析袋液体充分冲洗透析袋,每管分装0.5 mL,−80 ℃过夜。置于冷冻干燥机中冻干10 h,以冻干粉状态保存[14]。
尿蛋白为干粉状,溶解前先离心,每管加入200 μL RIPA蛋白裂解液,冰上放置30 min,每10 min涡旋振荡一次,时长约为8 s。使用4 ℃离心机12 000 r/min离心30 min,取上清。实验技术路线如图 1所示。

|
| 图 1 饱和硫酸铵处理尿液样本实验方法流程图 Fig. 1 Schematic diagram of using saturated ammonium sulfate for treating urine. |
| |
采用BCA试剂盒检测尿蛋白浓度。根据BCA试剂盒说明书准备标准品,水稀释的BSA标准蛋白,质量梯度为0、1、2、3、4、5 µg,依次加入96孔板。将待测样本使用水稀释10倍。配置BCA工作液,每孔200 μL加入标准品和待测样本,置于37 ℃恒温箱孵育30 min。采用酶标仪测量562 nm波长检测吸光度,根据标准曲线,统计检测样本的蛋白浓度。
1.3.5 考马斯亮蓝染色取相同体积尿蛋白进行10% SDS-PAGE,置于考马斯亮蓝R250染料中于摇床上染色过夜,经脱色液脱色后采集图像,对尿液样本前期处理方法进行评价。
1.3.6 质谱鉴定蛋白质分子将1 mg健康志愿者和膀胱癌患者的尿蛋白酶解,进行质谱鉴定。加入200 μL 10 mmol/L DTT,于37 ℃烘箱中变性4 h,12 000 r/min离心10 min除去DTT,再加入200 μL 50 mmol/L IAA,室温避光放置30 min,12 000 r/min离心10 min除去IAA。加入200 μL 50 mmol/L NH4HCO3溶液,12 000 r/min离心10 min,重复清洗5次后,更换新的套管,加入200 μL 50 mmol/L NH4HCO3溶液和胰酶(Trypsin,1︰50),于37 ℃烘箱中酶切16 h,收集肽段,质谱鉴定均重复3次实验[17]。
1.3.7 韦恩图通过韦恩图在线网站软件分析不同组别质谱鉴定分子间的差异,网址为:http://bioinformatics.psb.ugent.be/cgi-bin/liste/Venn/calculate_venn.htpl。
1.3.8 统计分析所有统计应用SPSS 20.0软件进行分析。计量资料采用ANOVA检验进行方差齐性分析,方差齐性采用t-test,方差不齐采用矫正t-test。设定双侧检验P < 0.05、P < 0.01、P < 0.001,差异具有统计学意义。统计方式采用单因素方差分析t-test。
2 结果与分析 2.1 实验方法尿蛋白富集效率的比较本实验分别采用超滤、硝酸纤维素膜富集法和饱和硫酸铵沉淀方法富集尿液蛋白,并将最终富集的尿蛋白体积归一到200 μL。通过BCA试剂盒检测蛋白浓度和质谱鉴定低丰度蛋白的深度评估蛋白富集效率。采用3种方法富集的健康志愿者尿总蛋白,5例样本混合后,各上样30 μg,进行SDS-PAGE分离蛋白,通过考马斯亮蓝染色结果分析蛋白条带差异,评估3种实验方法沉淀尿蛋白丰度差异。结果显示:在富集的尿蛋白终体积一致时,3种方法富集尿蛋白浓度如图 2所示,采用超滤法回收的蛋白浓度显著高于硝酸纤维素膜富集法和饱和硫酸铵沉淀法。硝酸纤维素膜富集法和硫酸铵沉淀法富集的蛋白浓度没有显著差异。考马斯亮蓝染色结果分析显示:将分离的蛋白按照分子量划分为4个区域:分子量大于99.7 kDa为A区,分子量介于99.7 kDa和66.4 kDa之间为B区,分子量66.4 kDa位置为C区,分子量介于66.4 kDa和44.3 kDa之间为D区。硫酸铵沉淀方法在保证D区域球蛋白存在的条件下,可沉淀降低A区域高丰度的白蛋白,如图 3所示。因此,饱和硫酸铵沉淀富集尿蛋白可排除尿液中高丰度蛋白的干扰,富集低丰度蛋白,可优化后续质谱对尿液标志物分子的鉴定条件。

|
| 图 2 BSA检测正常人和膀胱癌患者尿液样本蛋白浓度 Fig. 2 BCA measured protein concentrations in urine samples from healthy volunteers and bladder cancer patients. ***P < 0.001. |
| |
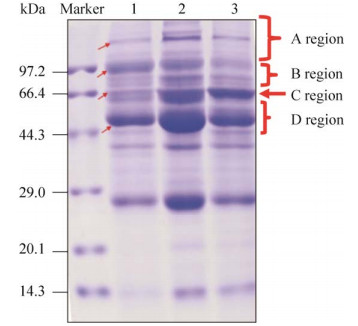
|
| 图 3 SDS-PAGE分离蛋白考马斯亮蓝染色图 Fig. 3 SDS-PAGE separation of urine protein staining by CBB. 1: ammonium sulfate precipitation; 2: ultrafiltration; 3: membrane enrichment. |
| |
在C区分别切取3种方法富集尿蛋白的SDS-PAGE胶,酶解,进行质谱鉴定,对该区域的肽段比较分析。通过韦恩图分析C区质谱鉴定结果显示(表 2):超滤法和硝酸纤维素膜富集法分别鉴定出2种相同的蛋白。饱和硫酸铵沉淀方法与超滤法和硝酸纤维素膜富集法鉴定出1个共同蛋白,是尿调素蛋白(UMOD),除此之外,饱和硫酸铵可以降低尿液中高丰度的白蛋白,鉴定出7种独有的低丰度蛋白分子。
| Methods | No. | Proteins | No. of Peptides | MW (kDa) | Coverage (%) | Score |
| Ultrafiltration | 1 | Uromodulin [Homo sapiens] | 18 | 69.7 | 16.60 | 686.49 |
| 2 | Albumin [Homo sapiens] | 9 | 69.3 | 14.00 | 377.15 | |
| Member enrichment | 1 | Uromodulin [Homo sapiens] | 14 | 69.7 | 13.40 | 432.72 |
| 2 | Albumin [Homo sapiens] | 9 | 69.3 | 14.00 | 377.15 | |
| Saturated sulfate amine | 1 | Uromodulin [Homo sapiens] | 12 | 69.7 | 14.10 | 893.28 |
| 2 | Ig aalpha1 bur [Homo sapiens] | 5 | 50.6 | 8.70 | 604.67 | |
| 3 | Ig alpha-1 chain C region-gorilla (fragment) | 5 | 37.7 | 15.90 | 540.05 | |
| 4 | Kininogen-1 isoform 2 precursor [Homo sapiens] | 5 | 65.8 | 10.30 | 468.51 | |
| 5 | Epidermal cytokeratin 2 [Homo sapiens] | 5 | 64.1 | 7.80 | 463 | |
| 6 | VASN protein [Homo sapiens] | 4 | 98.2 | 7.00 | 424.53 | |
| 7 | E-cadherin [Homo sapiens] | 4 | 97.5 | 6.60 | 422.73 | |
| 8 | Unnamed protein product [Homo sapiens] | 2 | 59.5 | 3.90 | 420.81 |
采用硫酸铵方法富集尿蛋白明确健康志愿者和膀胱癌患者肽段的差异,探究该方法鉴定生物标志物的应用潜能。本研究收集膀胱癌易感年龄阶段45–75岁之间的健康志愿者-2样本5例,使用质谱分别鉴定采用硫酸铵富集健康志愿者-2和膀胱癌患者各5例尿蛋白样本的C区域的蛋白。如表 3所示,相对于22.50±3.28岁的正常志愿者,70.35±5.65岁的正常志愿者质谱鉴定的C区域肽段数量为15个,与低龄正常组存在3个肽段的交集。健康志愿者-2和膀胱癌患者C区域共有的蛋白分子为尿液中高丰度蛋白UMOD。相对于健康志愿者-2,膀胱癌患者在C区域具有22个独有的蛋白分子(表 3–4),值得注意的是与膀胱癌相关的标志物基质金属蛋白酶-16 (MMP-16) 在膀胱癌C区域中检测的肽段数为22个。收集患者样本中,存在一例膀胱癌伴随偶发性前列腺癌的患者,在患者的鉴定结果中显示与前列腺癌相关标志物前列腺酸性磷酸酶(PPAP) 检测的肽段数为11个,增加了与疾病相关的标志物蛋白分子的敏感性。
| No. | Proteins | No. of Peptides | MW (kDa) | Coverage (%) | Score |
| 1 | Uromodulin [Homo sapiens] | 16 | 69.7 | 28.90 | 537.39 |
| 2 | Alpha-amylase [Homo sapiens] | 9 | 57.7 | 20.00 | 488.94 |
| 3 | Alpha-amylase 2B precursor [Homo sapiens] | 9 | 57.7 | 20.00 | 458.08 |
| 4 | Kininogen-1 isoform 2 precursor [Homo sapiens] | 10 | 65.8 | 20.70 | 417.58 |
| 5 | Epidermal cytokeratin 2 [Homo sapiens] | 6 | 64.1 | 16.60 | 383.43 |
| 6 | IgG1 [Homo sapiens] | 9 | 49.2 | 24.60 | 305.03 |
| 7 | Immunoglobulin lambda heavy chain [Homo sapiens] | 8 | 52.7 | 17.40 | 282.44 |
| 8 | Ig gamma 2 H chain, BUR [human, peptide mutant, 348 aa] | 9 | 38.7 | 19.80 | 264.95 |
| 9 | Immunoglobulin heavy chain constant region [Homo sapiens] | 9 | 35.9 | 22.70 | 261.3 |
| 10 | Recombinant IgG4 heavy chain [Homo sapiens] | 8 | 42.9 | 19.30 | 228.27 |
| 11 | Cytokeratin 9 [Homo sapiens] | 4 | 62.1 | 10.10 | 208.17 |
| 12 | Kininogen-1 isoform 2 precursor [Homo sapiens] | 4 | 47.9 | 7.70 | 185.52 |
| 13 | Integrin beta [Homo sapiens] | 7 | 70 | 5.40 | 149.15 |
| 14 | Ig heavy chain Ⅴ-Ⅲ region (ART) - human (fragments) [Homo sapiens] | 4 | 23.7 | 21.60 | 141.26 |
| 15 | This CDS feature is included to show the translation of the Corresponding V_region. Presently translation qualifiers on V_region features are illegal, partial [Homo sapiens] | 2 | 13.8 | 15.00 | 121.01 |
| No. | Proteins | No. of Peptides | MW (kDa) | Coverage (%) | Score |
| 1 | Isoform short of matrix metalloproteinase-16 [Homo sapiens] | 21 | 52.5 | 26.10 | 893.28 |
| 2 | cDNA FLJ45746 fis, clone KIDNE2018727, highly similar to uromodulin [Homo sapiens] | 11 | 47.3 | 23.80 | 604.67 |
| 3 | Prostatic acid phosphatase [Homo sapiens] | 11 | 44.5 | 16.80 | 540.05 |
| 4 | Putative uncharacterized protein DKFZp564P0562 (Fragment) [Homo sapiens] | 7 | 152.0 | 14.20 | 468.51 |
| 5 | Putative coiled-coil domain-containing protein 26 [Homo sapiens] | 9 | 13.2 | 24.90 | 463 |
| 6 | TrypsinⅠ(Fragment) [Homo sapiens] | 9 | 9.2 | 31.70 | 460.1 |
| 7 | cDNA FLJ60097, highly similar to tubulin alpha-ubiquitous chain [Homo sapiens] | 9 | 33.4 | 26.10 | 434.42 |
| 8 | Isoform 2 of lysine-specific demethylase 4A [Homo sapiens] | 10 | 54.7 | 25.80 | 424.53 |
| 9 | ANP32A protein [Homo sapiens] | 8 | 14.8 | 24.20 | 422.73 |
| 10 | Tubulin beta chain (Fragment) [Homo sapiens] | 9 | 16.5 | 20.10 | 420.81 |
| 11 | Prostaglandin E2 receptor EP1 [Homo sapiens] | 9 | 41.8 | 6.07 | 392.27 |
| 12 | Integrin beta [Homo sapiens] | 8 | 70.0 | 28.50 | 370.91 |
| 13 | cDNA FLJ58286, highly similar to actin, cytoplasmic 2 [Homo sapiens] | 8 | 37.3 | 43.60 | 370.35 |
| 14 | Nucleoprotein TPR [Homo sapiens] | 10 | 267.1 | 22.50 | 352.23 |
| 15 | GCN1 general control of amino-acid synthesis 1-like 1 (Yeast), isoform CRA_b [Homo sapiens] | 7 | 266.7 | 64.60 | 295.48 |
| 16 | Very large A-kinase anchor protein [Homo sapiens] | 9 | 330.4 | 5.05 | 264.43 |
| 17 | HCG27868, isoform CRA_g [Homo sapiens] | 6 | 27.6 | 21.30 | 223.58 |
| 18 | Cleavage and polyadenylation-specificity factor subunit 6 [Homo sapiens] | 4 | 52.2 | 10.00 | 198.57 |
| 19 | Nebulin [Homo sapiens] | 2 | 772.4 | 9.50 | 149.85 |
| 20 | Isoform 2 of protein canopy homolog 3 [Homo sapiens] | 3 | 5.8 | 9.90 | 97.41 |
| 21 | cDNA FLJ39264 fis, clone OCBBF2009603, highly similar to Staphylococcal nuclease domain-containing protein 1 [Homo sapiens] | 8 | 101.2 | 5.60 | 93.6 |
| 22 | Isoform 2 of calmodulin-regulated spectrin-associated protein 2 [Homo sapiens] | 5 | 165.0 | 27.90 | 82.3 |
| 23 | 28S ribosomal protein S36, mitochondrial [Homo sapiens] | 3 | 11.5 | 25.30 | 77.91 |
尿液样本本身复杂度高,高丰度蛋白多,检测低丰度的疾病标记物存在难度[18]。而减少高丰度蛋白的干扰,更容易深入发现和鉴定癌症特异性的候选标记蛋白质,这是尿蛋白质组急需解决的问题。尿蛋白质组研究中尿液蛋白富集方法的选择直接影响后期的蛋白质鉴定。目前,常用的尿蛋白富集方法包括超滤法、硝酸纤维素膜富集法和饱和硫酸铵沉淀法等方法。Mbeunkui等[19]尝试用经典的三氯乙酸(TCA) 沉淀和10 kDa超滤法浓缩分泌蛋白,2种方法均可行但效果欠佳。标准的TCA沉淀法蛋白质产率低,本底高,尿素溶液中沉淀物的再溶解困难。同时,作者也测试了分子量截断柱(10 kDa) 浓缩蛋白质,但在离心过程中存在柱阻塞和低分子量蛋白质丢失的问题。Wang等[20]比较尿纤维素膜富集蛋白和直接冷冻法两种尿蛋白富集保存方法在时间、空间、电费、蛋白质降解程度和样品处理方便性等方面的差异。与直接冷冻法相比,硝酸纤维素膜法在储存空间、电费和临床方便性等方面均有明显优势。而直接冷冻法在供货时间和成本上均优于尿硝酸纤维素膜富集法。与直接冷冻法相比,使用尿硝酸纤维素膜富集和保存尿蛋白具有更高的成本效益。但是,硝酸纤维素膜富集的方法中需要大量使用丙酮,丙酮属于易燃和有毒试剂,增加了实验的难度,限制了批量处理样本。
本文采用饱和硫酸铵沉淀方法富集健康志愿者和膀胱癌患者的尿蛋白,该方法在保证高效率回收蛋白的同时,可成功地降低高丰度白蛋白的影响,使更多低丰度蛋白得以富集。相对于超滤法和硝酸纤维素膜富集法纯化健康志愿者尿蛋白,饱和硫酸铵法沉淀尿蛋白结果稳定可靠,可提高鉴定蛋白分子的效率,相对较安全,并适合大量样本的处理。本研究使用的饱和硫酸铵沉淀通过饱和硫酸铵沉淀富集尿液蛋白,提高质谱鉴定灵敏度,试图作为尿液疾病标志物筛选,确定标准化流程,统一富集尿液蛋白的处理方法。
Clark等[7]使用的C4-TIP方法,是一种简单的自动化策略,利用反相树脂富集尿蛋白质组。该作者首先确定了以牛胎蛋白为标准蛋白,在C4末端进行蛋白质分离和蛋白酶酶解的最佳条件。将C4-TIP方法应用于尿蛋白组学,使用LC-MS/MS鉴定了总共813个蛋白组,其中C4-TIP方法鉴定的蛋白质与超滤制备方法鉴定的蛋白质相比,显示出相似的基因本体(GO) 细胞成分分配分布。最后,作者评估了C4-TIP方法的重复性,发现所有TIP中识别的共享蛋白质具有很高的斯皮尔曼等级相关性。总之,作者证明,C4-TIP方法是一种简单、可靠的方法,可用于临床环境下的尿液蛋白质组的高通量质谱分析。
从幼儿和一些成年患者身上收集尿液比从健康成年人那里收集尿液更具挑战性。Qin等[16]提出了一种使用绒毛纸浆尿布收集尿液的方法。然后,尿蛋白被洗脱并吸附到一块硝酸纤维素膜上,该膜可以干燥并储存在真空袋中。SDS-PAGE和LC-MS/ MS分析表明,该方法重现性好,与丙酮沉淀法得到的蛋白质相似。使用这种简单而经济的方法,可以收集和保存婴儿、幼儿和有特殊需要患者的尿样,甚至可以用于大规模的生物标记物研究。
年龄差异是影响尿液蛋白质组的因素。Jin等[21]证明在阿尔茨海默氏症(AD) 患者中,随着年龄逐渐增加,阿尔茨海默病相关神经线蛋白(AD7c- NTP) 在AD和轻度认知障碍(MCI) 患者的脑区、脑脊液(CSF) 和尿液中的水平显著升高,已被确定为一种生物标志物。Afkarian等[22]使用健康对照组的尿液来标准化iTRAQ (相对和绝对定量的等压标签),以检测蛋白酶抑制剂、起始蛋白和iTRAQ标记量、蛋白质提取方法以及白蛋白和免疫球蛋白G (IgG) 的耗竭。该实验观察随着正常人年龄逐渐增加,白蛋白和IgG显著升高,会加深蛋白质组的覆盖面。综上所述,年龄差异可引起尿蛋白质组的差异。膀胱癌的易感年龄阶段为45–75岁,本实验收集5例年龄为70.35±5.65岁正常志愿者-2尿液,对比分析正常人不同年龄阶段尿液蛋白鉴定肽段数量的差异以及相同年龄阶段,正常人和膀胱癌患者C区域质谱鉴定肽段差异。明确不同年龄阶段的正常人尿液,以及相同年龄阶段的正常人和膀胱癌患者蛋白质组存在的差异。饱和硫酸铵富集尿蛋白的方法适用于疾病标志物的筛查。
Chen等[23]报道MMP-16在膀胱癌中高表达,可促进膀胱癌的迁移和侵袭,因此,MMP-16有潜力成为膀胱癌诊断和治疗靶点。本研究表 4证明质谱鉴定的膀胱癌的生物标志物MMP-16在膀胱癌C区域中检测的肽段数为22个。PPAP,一种非特异性酪氨酸磷酸酶,在酸性条件下(pH 4–6) 催化多种底物去磷酸化,包括烷基、芳基和酰基正磷酸盐单酯和磷酸化蛋白,具有脂质磷酸酶活性。Potluri等[24]证明PPAP蛋白的含量随疾病的临床阶段而变化。作者表明,PPAP蛋白的含量最大的差异是去势敏感型和抗去势疾病患者之间的差异。与其他组的男性相比,抗阉割疾病患者鉴定到更多与核酸结合和基因调控相关的蛋白质,该蛋白可能是前列腺癌早期诊断和转移的生物标志物,依据该指标在血清和尿液中的相对含量可用于判断前列腺癌的进展情况,实现准确的分期和诊断。综上所述,对比分析采用超滤法和硝酸纤维素膜法在保证蛋白富集效率的情况下,使用饱和硫酸铵方法蛋白富集效率高,操作简单,有一定临床标志物筛选的潜能。
本研究存在的局限性是随机获得的膀胱癌肿瘤患者尿液样本例数少,而且尿液样本在储存、研磨及蛋白提取过程中受到环境的影响,这也可能造成有效蛋白成分的丢失,这也直接影响了蛋白电泳结果与质谱分析结果。
总之,本方法建立后已应用于临床膀胱癌样品检测,结果表明,质谱鉴定膀胱肿瘤患者尿蛋白灵敏度显著高于正常对照组(P < 0.01),并且可以成功降低高丰度白蛋白的干扰。在尿蛋白质组学的质谱研究和尿蛋白标志物筛选中具有很大的潜力。
| [1] |
郇宇航, 秦伟伟, 高友鹤. 尿液蛋白生物标志物验证时要考虑的因素. 中国科学: 生命科学, 2018, 48(2): 171-187. Huan YH, Qin WW, Gao YH. Factors to consider in the verification of urine biomarkers. Sci Sin Vitae, 2018, 48(2): 171-187 (in Chinese). |
| [2] |
Wu T, Du Y, Han J, et al. Urinary angiostatin—a novel putative marker of renal pathology chronicity in lupus nephritis. Mol Cell Proteomics, 2013, 12(5): 1170-1179. DOI:10.1074/mcp.M112.021667
|
| [3] |
Pories SE, Zurakowski D, Roy R, et al. Urinary metalloproteinases: noninvasive biomarkers for breast cancer risk assessment. Cancer Epidemiol Biomarkers Prev, 2008, 17(5): 1034-1042. DOI:10.1158/1055-9965.EPI-07-0365
|
| [4] |
Zuiverloon TCM, Beukers W, van der Keur KA, et al. Combinations of urinary biomarkers for surveillance of patients with incident nonmuscle invasive bladder cancer: the European FP7 UROMOL project. J Urol, 2013, 189(5): 1945-1951. DOI:10.1016/j.juro.2012.11.115
|
| [5] |
Thomas CE, Sexton W, Benson K, et al. Urine collection and processing for protein biomarker discovery and quantification. Cancer Epidemiol Biomarkers Prev, 2010, 19(4): 953-959. DOI:10.1158/1055-9965.EPI-10-0069
|
| [6] |
Rosen EM, Mínguez-Alarcón L, Meeker JD, et al. Urinary oxidative stress biomarker levels and reproductive outcomes among couples undergoing fertility treatments. Hum Reprod, 2019, 34(12): 2399-2409. DOI:10.1093/humrep/dez228
|
| [7] |
Clark DJ, Hu Y, Schnaubelt M, et al. Simple tip-based sample processing method for urinary proteomic analysis. Anal Chem, 2019, 91(9): 5517-5522. DOI:10.1021/acs.analchem.8b05234
|
| [8] |
Thongboonkerd V. Practical points in urinary proteomics. J Proteome Res, 2007, 6(10): 3881-3890. DOI:10.1021/pr070328s
|
| [9] |
Weissenbacher A, Huang HL, Surik T, et al. Urine recirculation prolongs normothermic kidney perfusion via more optimal metabolic homeostasis—a proteomics study. Am J Transplant, 2021, 21(5): 1740-1753. DOI:10.1111/ajt.16334
|
| [10] |
Yamada H, Shirata N, Makino S, et al. MAGI-2 orchestrates the localization of backbone proteins in the slit diaphragm of podocytes. Kidney Int, 2021, 99(2): 382-395. DOI:10.1016/j.kint.2020.09.027
|
| [11] |
Guo WJ, Bläsius FM, Greven J, et al. Hematological and chemical profiles in a porcine model of severe multiple trauma. Eur Surg Res, 2020, 61(2/3): 83-94.
|
| [12] |
Zhong ZX, Tan JX, Tang Y, et al. Goodpasture syndrome manifesting as nephrotic-range proteinuria with anti-glomerular basement membrane antibody seronegativity. Medicine, 2020, 99(39): e22341. DOI:10.1097/MD.0000000000022341
|
| [13] |
Chen QG, Chen L, Zhong QH, et al. Optimization of urinary small extracellular vesicle isolation protocols: implications in early diagnosis, stratification, treatment and prognosis of diseases in the era of personalized medicine. Am J Transl Res, 2020, 12(10): 6302-6313.
|
| [14] |
王小蓉, 李逊斗, 贾露露, 等. 硝酸纤维膜和丙酮沉淀尿蛋白质保存方法的比较. 生物工程学报, 2014, 30(6): 982-989. Wang XR, Li XD, Jia LL, et al. Comparison of two urinary protein preparation methods: nitrocellulose membrane preservation and acetone precipitation. Chin J Biotech, 2014, 30(6): 982-989 (in Chinese). |
| [15] |
Noori R, Perwez M, Mazumder JA, et al. Development of low-cost paper-based biosensor of polyphenol oxidase for detection of phenolic contaminants in water and clinical samples. Environ Sci Pollut Res Int, 2020, 27(24): 30081-30092. DOI:10.1007/s11356-020-09331-w
|
| [16] |
Qin W, Du Z, Gao Y. Collection and preservation of urinary proteins, using a fluff pulp diaper. Sci China Life Sci, 2018, 61(6): 671-674. DOI:10.1007/s11427-016-9060-2
|
| [17] |
Retmana IA, Beijnen JH, Sparidans RW. Chromatographic bioanalytical assays for targeted covalent kinase inhibitors and their metabolites. J Chromatogr B Analyt Technol Biomed Life Sci, 2021, 1162: 122466. DOI:10.1016/j.jchromb.2020.122466
|
| [18] |
Omenn GS, States DJ, Adamski M, et al. Overview of the HUPO plasma proteome project: results from the pilot phase with 35 collaborating laboratories and multiple analytical groups, generating a core dataset of 3 020 proteins and a publicly-available database. Proteomics, 2005, 5(13): 3226-3245. DOI:10.1002/pmic.200500358
|
| [19] |
Mbeunkui F, Fodstad O, Pannell LK. Secretory protein enrichment and analysis: an optimized approach applied on cancer cell lines using 2D LC-MS/MS. J Proteome Res, 2006, 5(4): 899-906. DOI:10.1021/pr050375p
|
| [20] |
Wang MM, Liu XJ, Jia LL, et al. Comparison of cost-effectiveness between urimem and direct freezing for urinary protein preservation. Sheng Wu Gong Cheng Xue Bao, 2014, 30(7): 1128-1133.
|
| [21] |
Jin H, Wang R. Alzheimer-associated neuronal thread protein: research course and prospects for the future. J Alzheimer's Dis, 2021, 80(3): 963-971. DOI:10.3233/JAD-201273
|
| [22] |
Afkarian M, Bhasin M, Dillon ST, et al. Optimizing a proteomics platform for urine biomarker discovery. Mol Cell Proteomics, 2010, 9(10): 2195-2204. DOI:10.1074/mcp.M110.000992
|
| [23] |
Chen MF, Zeng F, Qi L, et al. Transforming growth factor-β1 induces epithelial-mesenchymal transition and increased expression of matrix metalloproteinase-16 via miR-200b downregulation in bladder cancer cells. Mol Med Rep, 2014, 10(3): 1549-1554. DOI:10.3892/mmr.2014.2366
|
| [24] |
Potluri H, Ng TL, Newton M, et al. Antibody profiling of prostate cancer patients reveals differences in antibody signatures among disease stages and following treatment. J Immunother Cancer, 2020, 8(Suppl 3): A16. DOI:10.1136/jitc-2020-SITC2020.0016
|
 2021, Vol. 37
2021, Vol. 37




