显微注射法制备转基因家蝇技术的建立
王蓝晨
,
杨阳
,
尚小丽
,
王兵
,
袁林
,
朱贵明
生物工程学报  2021, Vol. 37 2021, Vol. 37 Issue (2): 655-662 Issue (2): 655-662
|

家蝇属于完全变态昆虫,是世界大部分地区最常见、数量最多的一种昆虫[1-2]。其生活史包括:卵、幼虫(蝇蛆)、蛹和成虫4个时期。家蝇及其幼虫数量大、繁殖快、成本低、养殖技术简单,已实现大规模的人工饲养。家蝇体内富含丰富的蛋白质以及必需的营养物质,例如多不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs)、矿物质和维生素等[3-6],是一种具有开发前景的昆虫资源。
转基因昆虫是利用转座子等载体将目的片段插入昆虫基因组中使其表达特定基因,从而利用该基因控制昆虫繁殖,并调节昆虫的生命周期[7]。目前转基因昆虫被广泛应用于多个领域,例如害虫防治、生物制药、疾病动物模型等。迄今为止,成功构建的转基因昆虫模型有果蝇、家蚕、蜜蜂、地中海的果蝇、埃及伊蚊、冈比亚按蚊,斯氏按蚊等[8-10]。作为生物反应器的产业化昆虫主要有家蚕和蜜蜂,可大规模生产具有重要商业价值的外源蛋白[11-13],目前该领域的研究已相当成熟。由于昆虫独特的生物学优势和转基因技术的发展,越来越多的国内外研究人员开始探索使用昆虫作为生物反应器来生产高附加值的蛋白质。
显微注射法是一种通过显微操作仪在解剖镜或显微镜下将外源物质、细胞核或细胞注入到受体中的生物微操作技术[14],此技术应用广泛、可靠性强、效果较好[15-16]。转座子是一种可以改变宿主细胞基因组中插入位置的移动遗传因子,改变插入位置的过程称为转座[10, 17-18],piggyBac转座子可以准确切出并转座到生物体的染色体中,是一种广泛作用于鳞翅目等多种昆虫的基因表达载体。目前piggyBac已在多种昆虫转基因中得到应用,例如果蝇和家蚕,它已被用作高效、稳定的转基因载体[19-22]。但果蝇较家蝇体积、重量小,潜在附加值可能会受到一定程度的影响。目前关于具体的家蝇相关的显微注射技术来探讨其基因功能的报道较少见,而基于显微注射的原理和在其他昆虫中的成功案例如家蚕[23-26],认为该技术理论上是可以在家蝇中实现的。
本研究以资源昆虫家蝇为材料,使用微注射技术平台将含有报告基因EGFP的piggyBac转座子导入早期家蝇卵内,获得稳定表达报告基因的表型个体;初步建立基于显微注射的家蝇功能基因组研究技术平台,建立家蝇生物反应器,为后续家蝇基因功能的研究提供一定参考价值,也可为蝇类及其他小型昆虫的基因功能研究提供新的技术体系。
1 材料与方法 1.1 材料研究所用家蝇饲养、保种于本实验室昆虫房,培养条件为温度25-28 ℃,湿度70%,光照周期12L︰12D。家蝇幼虫饲料的配制:麦麸︰水=65︰35,家蝇成虫饲料的配制:白糖与奶粉1︰1混匀,饮用水为ddH2O。
实验试剂:转座子载体PiggyBac-[3×P3]-EGFP与pHA3PIG辅助质粒由本实验室保存。上海晨光文具海绵双面胶,小号毛笔,CLOROX (高乐氏) 浓缩漂白水,QIAGEN Endofree Plasmid Maxi Kit、DNA marker、2×Taq PCR MasterMixⅡ购于天根生化科技(北京) 有限公司;氯化钠、酵母粉及胰蛋白胨购于Oxoid公司;琼脂糖购于Biosharp公司;石蜡油购于北京索莱宝科技有限公司;DRUMMOND硼硅酸盐玻璃毛细管,Bio-Rad GelDoc XR+凝胶成像系统,美国DRUMMOND显微注射器Nanoject Ⅲ Auto-Nanoliter Injecto,P-2000激光微电极拉制仪(sutter拉针仪),解剖显微镜(Olympus)、倒置荧光显微镜(Olympus)、NanoDrop微量分光光度计(Thermo ScientificTM)、玻片、二氧化碳购于贵阳同辉气体有限公司。引物合成由生工生物工程(上海) 股份有限公司完成。
1.2 方法 1.2.1 显微注射用玻璃毛细管针的制作本文使用仪器与手工2种拉制方法。仪器拉制使用P-2000激光微电极拉制仪对DRUMMOND硼硅酸盐玻璃毛细管进行拉制,使用断针仪对玻璃毛细管进行高温熔断,而后使用磨针仪在显微镜下摸索适用于家蝇卵注射的针尖角度;手工拉制的操作方法为两手水平持针,放置酒精灯外焰2 s后快速向两边拉针,以防针尖弯曲,清洗消毒备用,该方法简单但需多次练习。
1.2.2 家蝇卵卵壳的处理配制65%的湿麦麸,在家蝇产卵高峰期(每日14:00-17:00) 收集30 min内接到的新鲜卵块,使用温度为28 ℃的1×PBS溶液清洗表面附着的麦麸,用镊子将单只虫卵分离计数,采用CLOROX (高乐氏) 浓缩漂白水(主要成分为次氯酸钠和氢氧化钠) 对家蝇卵进行漂洗,室温控制在28 ℃。将卵置于浓缩漂白水中,本实验设置4组时间梯度,作用时间分别为20、35、50、70 s,每组家蝇卵20枚,重复3次。然后用ddH2O冲洗。将处理过的家蝇卵依次排列在双面泡沫胶板上,再将泡沫胶固定在玻片上,使用小号毛笔在固定好的虫卵上涂适量的石蜡油,防止表面水分蒸发。
1.2.3 注射用质粒显微注射缓冲液的配制:5 mmol/L KOH、0.5 mmol/L NaH2PO4、0.1 mol/L NaOH调节至pH 7.2后过滤除菌。使用试剂盒(QIAGEN) 提取PiggyBac-[3×P3]-EGFP与辅助质粒pHA3PIG,进行1︰1混合,NanoDrop微量分光光度计测量注射质粒终浓度约为1 600 ng/μL。使用Nanoject Ⅲ高精度微量注射器的FILL模式吸取石蜡油,后吸取注射用混合质粒,观察钢针与玻璃毛细管针之间的油水界面,遵循系统提示音进行操作。
1.2.4 家蝇卵显微注射及后续饲养将玻片置于载物台上,将聚焦面调节到针尖与虫卵处于同一接触面上,寻找合适的角度和力度轻轻刺破虫卵,使用注射器的INJECT模式按照排列顺序依次注射,每只卵的注射量为200-500 pL。注射过程中观察家蝇卵表面的突起程度,有无外渗情况。注射时要检查注射针的通畅度,防止造成管堵塞。在熟练掌握整套系统运行后,1 h内约可注射800只去掉卵壳的家蝇卵。注射后的虫卵连同载玻片置于65%的湿麦麸中待其发育。注射后的家蝇卵相较于野生型家蝇卵孵化时间明显延长,在整个幼虫期应尽量减少翻动,并及时补充麦麸中的水分。
1.2.5 荧光筛查及PCR检测待家蝇羽化后使用CO2对待鉴定的家蝇进行麻醉,在倒置荧光显微镜下观察家蝇眼部及其他部位EGFP的表达情况,筛选表达荧光的阳性个体(G0代),将G0代转基因雌、雄成虫分别与野生家蝇杂交保种。根据PiggyBac-[3×P3]-EGFP质粒中EGFP基因序列设计引物,提取未表达绿色荧光的注射家蝇(对照组) 与转基因家蝇G0代(实验组) 的基因组DNA与RNA,分别进行PCR与RT-PCR检测。RNA的内参上游引物为5′-CTTG AACGGTAAACTCACTGGTATGG-3′,下游引物为5′-TGGAGACGACTTCTTCATCGGTGTAG-3′;检测EGFP上游引物为5′-GGTCGCCACCATGGT GAGCAAG-3′,下游引物为5′-GTACAAGTAAAGC GGCCGCGA-3′,预扩增片段大小为750 bp。反应体系:20 µL,加1 µL DNA/cDNA (约50 ng/µL) 作为模板,10 µL 2×Taq PCR MasterMixⅡ,引物各1 µL (10 µmol/L),7 µL ddH2O。反应程序:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸5 min,1%的琼脂糖凝胶电泳检测。
2 结果与分析 2.1 显微注射法制备转基因家蝇整套平台显微注射法制备转基因家蝇需要的主要仪器设备和耗材由解剖显微镜(Olympus)、DRUMMOND显微注射器Nanoject Ⅲ、玻片、泡沫双面胶及硼硅酸盐玻璃微量注射针组成。泡沫双面胶以EVA泡棉为基材,柔软性好、防震、防滑、抗压力性强,用来固定家蝇卵,以防卵在玻片上来回滑动。
2.2 毛细管针的拉制使用拉针仪对玻璃微量注射针进行处理,熔断温度设置在62.5 ℃,使用磨针仪在镜下将针尖与砂轮轻轻接触形成约45角,调节砂轮转速。打磨后使用含水的1 mL注射器检测通畅程度。仪器拉制的针头内径约为1 μm,手工拉制的注射针内径则会更小(图 1)。手工拉制针头没有仪器拉制得直,但其极少出现针头堵塞的情况,消毒后可直接使用。

|
| 图 1 两种玻璃微量注射针的比较 Fig. 1 Comparison of two glass microinjection needles. (A) Instrument processing glass microinjection needle. (B) Handling glass microinjection needles. |
| |
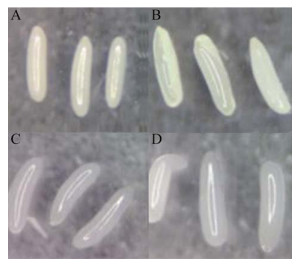
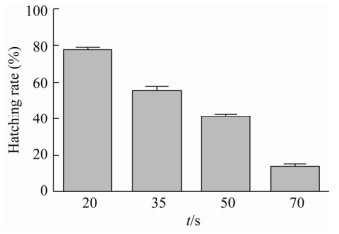
经漂白水处理后的家蝇卵形态出现变化(图 2:A-D),孵化时间明显延长,孵化率也不同,经过验证表明,漂白水作用20 s时孵化率为77%,随着作用时间的增加,孵化率逐步降低,作用70 s时卵孵化率仅为13% (图 3)。为保证充分去除卵壳同时孵化率又达到一定水平,本研究中选择漂白水作用35 s组进行卵壳处理,家蝇的孵化率约为55%。
|
| 图 2 漂白水处理家蝇卵的形态改变 Fig. 2 Morphological changes of housefly eggs treated with bleach. (A) Bleach treatment of egg shells for 20 s. (B) Bleach treatment of egg shells for 35 s. (C) Bleach treatment of egg shells for 50 s. (D) Bleach reatment of egg shells for 70 s. |
| |
|
| 图 3 漂白水对家蝇卵孵化率的影响 Fig. 3 Effect of bleaching water on hatchability of housefly eggs. |
| |
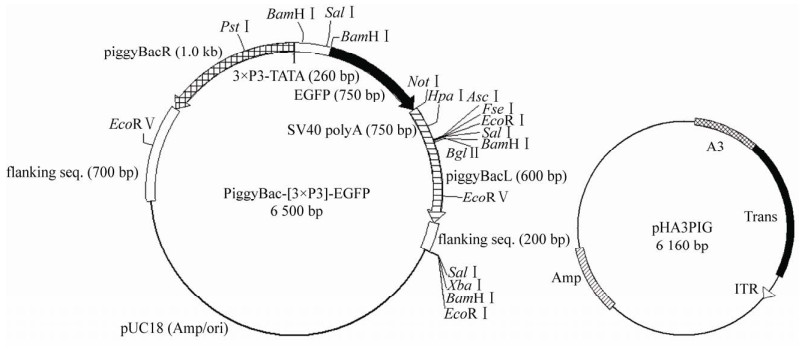
大量提取注射用转座子载体PiggyBac-[3×P3]- EGFP与辅助质粒pHA3PIG (图 4),乙醇沉淀浓缩,最后使用配制的缓冲液溶解,NanoDrop测量浓度并进行电泳检测。
|
| 图 4 注射用质粒图谱 Fig. 4 Plasmid map for injection. |
| |
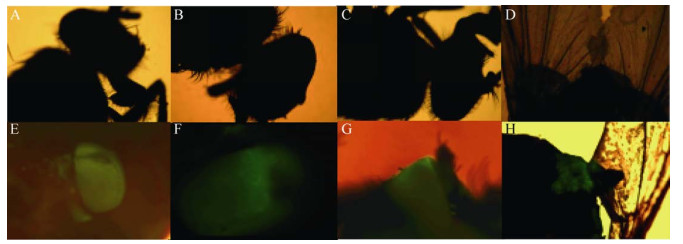
由于piggBac转座子载体上带有3×P3特异性眼部表达启动子,在家蝇羽化后,复眼部会发出明显的绿色荧光。在该技术平台下,注射每批次100只可筛选到3-5只眼部有明显绿色荧光的家蝇。将注射后眼部未表达绿色荧光蛋白的家蝇设为对照组(图 5),A、B、C表示对照组家蝇在镜下不同角度的复眼荧光的观察,D图为对照组家蝇其他组织部位的观察;E、F、G实验组家蝇在镜下不同角度的复眼荧光的况观察,H图为其他组织部位亦可有绿色荧光的分布表达。
|
| 图 5 家蝇荧光蛋白镜下观察 Fig. 5 Detection of housefly fluorescent protein under microscope. (A-D: under fluorescence) Detection of each part of housefly in control group. (E-H: under fluorescence) Detection of each part of housefly in test group. |
| |
在倒置荧光显微镜下已观察到家蝇眼部带有明显的绿色荧光,说明表达载体已成功转入家蝇体内,收集注射后但未表达绿色荧光的家蝇(对照组) 与带有绿色荧光蛋白的转基因家蝇(实验组),设置阴性对照,提取家蝇总DNA与RNA,检测家蝇体内EGFP基因的表达及转录情况。结果表明(图 6),眼部有荧光的家蝇(实验组),体内在DNA与RNA水平均检测到EGPF,大小为750 bp,表明该技术成功实现了外源基因在家蝇体内的表达。
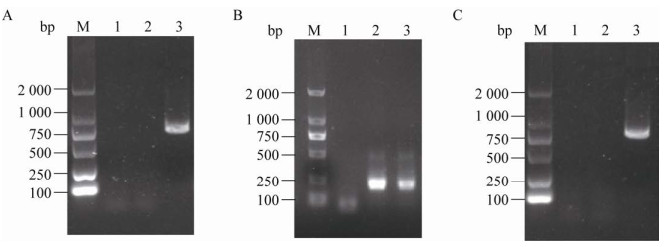
|
| 图 6 EGFP在家蝇中的整合情况及其表达 Fig. 6 The integration and expression of EGFP in housefly. (A) Expression of EGFP in housefly DNA. M: DNA marker D2000; 1: negative control; 2: control housefly DNA; 3: test group housefly DAN. (B) Housefly internal control expression. M: DNA marker D2000; 1: negative control; 2: control housefly internal control; 3: test group housefly internal control. (C) Expression of EGFP in housefly RNA. M: DNA marker D2000; 1: negative control; 2: control housefly RNA; 3: test group housefly RNA. |
| |
昆虫纲是动物界中种类最多的类群,种群数量庞大,在生长条件、时间、行为和环境等因素上出现显著的差异。因此,转基因昆虫模型的制备和筛选并没有统一标准。转基因技术的环节为重组DNA,具体涉及到目的基因的取得、基因的转移、产物的表达等过程。根据外源基因导入的方法和对象的不同,常用方法主要有显微注射法、逆转录病毒感染法、胚胎干细胞法及精子载体法、电穿孔法、基因枪法等[10, 20-22]。目前转基因技术的研究已广泛渗透到遗传学、发育生物学、遗传学、发育生物学、医学、畜牧兽医学等各个不同学科领域,而且已构建了大量的转基因动物模型用于发育及基因的表达调控、疾病的发病机理等基础研究。同时通过转基因动物方法制造生物反应器,以获得人类需要的某些生物活性蛋白质[27]。
转基因技术中关键参数的摸索以及如何获得稳定的转基因品系都是需要克服的问题。本研究中选取家蝇作为研究对象,在基因导入过程中出现家蝇卵壳坚硬、大小和极方向不明显等问题,解决这些问题是转基因家蝇构建过程中的一个关键步骤。参照果蝇卵壳的软化步骤[28],使用含有次氯酸钠的漂白水处理后,外壳被完全或部分移除,基因导入会相对容易。若卵壳漂洗过度,整个胚胎就会非常脆弱,即使注射成功卵在后期仍不能正常发育;卵壳漂洗时间不够,则会影响操作的进行,甚至破坏注射用的玻璃微量注射针。与此同时,注射针头拉制的过程中,仪器拉制的针头直但会出现针头堵塞情况,而手工拉制的不易堵塞且针尖直径更小,所以制备便于注射且创伤性小的注射针头也十分重要。
至今P因子和piggyBac联手己插入诱变了70%以上的果蝇基因。piggyBac转座系统已成为在昆虫中使用最广的转座子,它已被证明能够在5个目(鳞翅目、双翅目、膜翅目、鞘翅目和直翅目) 的20多种昆虫中转座[29-30]。本文将携带EGFP的转座子载体导入家蝇卵中,待家蝇羽化后观察EGFP在家蝇中表达。对转基因阳性个体进行PCR和RT-PCR的鉴定。结果显示在家蝇眼部出现明显的绿色荧光,阳性个体中可以扩增出EGFP片段。但转基因阳性个体体质差、抗病性弱、易感性强、对生存环境要求较高、生长发育明显滞后于野生型家蝇,并出现了不同程度的畸形、死亡、蛹化异常等问题,这些问题都会影响到转基因家蝇品系的建立。本研究在家蝇水平优化了显微注射技术,成功使EGFP基因在大家蝇体内表达,对家蝇基因功能的研究具有重大意义和应用价值。
随着科学技术尤其是转基因技术的不断进步与发展,期望转基因家蝇能够在未来作为一种真正实现安全转基因的昆虫甚至动物范本,通过不断消除转基因生物的安全隐患,推动安全转基因技术的多元化发展及转基因经济昆虫的产业化开发。
| [1] |
Sohal RS, Agarwal S, Dubey A, et al. Protein oxidative damage is associated with life expectancy of houseflies. Proc Natl Acad Sci USA, 1993, 90(5): 7255-7259. DOI:10.1073/pnas.90.15.7255
|
| [2] |
吴青华, 田河, 苏立申, 等. 家蝇幼虫及其产品开发利用研究进展. 饲料工业, 2006, 27(16): 63-64. Wu QH, Tian H, Su LS, et al. Research progress on the development and utilization of housefly larvae and their products. Feed Ind, 2006, 27(16): 63-64 (in Chinese). DOI:10.3969/j.issn.1001-991X.2006.16.021 |
| [3] |
孙红霞. 高蛋白蝇蛆养殖及生态循环综合利用. 技术与市场, 2006(5): 20. Sun HX. High-protein fly maggot breeding and ecological recycling comprehensive utilization. Technology and Market, 2006(5): 20 (in Chinese). |
| [4] |
马惠钦, 裴素俭. 用做饲料的昆虫资源. 应用昆虫学报, 1999, 36(5): 303-306. Ma HQ, Pei SJ. Insect resources used as feed. Chin Bull Entomol, 1999, 36(5): 303-306 (in Chinese). |
| [5] |
沈晓昆. 蝇蛆养殖-解决动物蛋白饲料短缺的有效途径. 饲料研究, 1999(2): 18-20. Shen XK. Fly maggot breeding-an effective way to solve the shortage of animal protein feed. Feed Research, 1999(2): 18-20 (in Chinese). |
| [6] |
王建军, 王常春, 韩召军. piggyBac转座子及其在转基因昆虫中的应用. 昆虫知识, 2009, 46(5): 665-672. Wang JJ, Wang CC, Han ZJ. Advances on piggyBac transposon and its applications in insect transgenesis. Chin Bull Entomol, 2009, 46(5): 665-672 (in Chinese). |
| [7] |
李颖, 王红育. 家蝇及其幼虫的营养价值与开发利用. 中国食物与营养, 2009(11): 24-26. Li Y, Wang HY. Nutritional value of houseflies and larva and its research and development. Food Nutr China, 2009(11): 24-26 (in Chinese). DOI:10.3969/j.issn.1006-9577.2009.11.008 |
| [8] |
何鹏兴, 叶海燕, 郑哲民. 转基因昆虫的研究进展. 陕西师范大学继续教育学报(西安), 2005, 22(S1): 293-296. He PX, Ye HY, Zheng ZM. Research progress of transgenic insects. Contemporary Teacher Education, 2005, 22(S1): 293-296 (in Chinese). |
| [9] |
周秀娟, 牛长缨, 雷朝亮. 转基因昆虫的应用研究进展. 应用昆虫学报, 2008, 45(3): 368-373. Zhou XJ, Niu CY, Lei CL. The application of transgenic insect technology. Chin Bull Entomol, 2008, 45(3): 368-373 (in Chinese). DOI:10.3969/j.issn.0452-8255.2008.03.006 |
| [10] |
杨阳. 多不饱和脂肪酸在家蝇幼虫体内的富集及Fat1转基因家蝇的制备[D]. 2019. Yang Y. Enrichment of polyunsaturated fatty acids in Musca domestica larvae and preparation of Fat1 Transgenic Musca domestica[D]. Guiyang: Guizhou Medical University, 2019 (in Chinese). |
| [11] |
Maeda S, Kawai T, Obinata M, et al. Production of human α-interferon in silkworm using a baculovirus vector. Nature, 1985, 315(6020): 592-594. DOI:10.1038/315592a0
|
| [12] |
Choudary PV, Kamita SG, Maeda S. Expression of foreign genes in Bombyx mori larvae using baculovirus vectors//Richardson CD, Ed. Baculovirus Expression Protocols. Totowa, NJ: Humana Press, 1995, 39: 243.
|
| [13] |
张叶军. 转基因昆虫的应用前景. 农药市场信息, 2012(11): 23-24. Zhang YJ. The application prospects of genetically modified insects. Pesticide Market News, 2012(11): 23-24 (in Chinese). |
| [14] |
沙珍霞, 陈松林, 刘洋, 等. 显微注射技术在制备鱼类嵌合体和转基因海水鱼上的应用. 渔业科学进展, 2005, 26(3): 86-90. Sha ZX, Chen SL, Liu Y, et al. Progress on the application of microinjection technique in fish cell transplantation and in transgenic marine fish. Marine Fisher Res, 2005, 26(3): 86-90 (in Chinese). DOI:10.3969/j.issn.1000-7075.2005.03.014 |
| [15] |
Rembold M, Lahiri K, Foulkes NS, et al. Transgenesis in fish: efficient selection of transgenic fish by co-injection with a fluorescent reporter construct. Nat Protocols, 2006, 1(3): 1133-1139. DOI:10.1038/nprot.2006.165
|
| [16] |
Grabher C, Henrich T, Sasado T, et al. Transposon-mediated enhancer trapping in medaka. Gene, 2003, 322: 57-66. DOI:10.1016/j.gene.2003.09.009
|
| [17] |
唐丽莉, 陈斌, 何正波, 等. piggyBac转座子及其转基因昆虫的应用. 安徽农业科学, 2010, 38(6): 2809-2811, 2814. Tang LL, Chen B, He ZB, et al. Application of piggyBac transposons and its transgenic insects. J Anhui Agric Sci, 2010, 38(6): 2809-2811, 2814 (in Chinese). DOI:10.3969/j.issn.0517-6611.2010.06.020 |
| [18] |
Xu X, Bi HL, Wang YH, et al. Disruption of the ovarian serine protease (Osp) gene causes female sterility in Bombyx mori and Spodoptera litura. Pest Manag Sci, 2020, 76(4): 1245-1255. DOI:10.1002/ps.5634
|
| [19] |
Bonizzoni M, Gomulski LM, Malacrida AR, et al. Highly similar piggyBac transposase-like sequences from various Bactrocera(Diptera, Tephritidae) species. Insect Mol Biol, 2010, 16(5): 645-650. DOI:10.1111/j.1365-2583.2007.00756.x
|
| [20] |
Handler AM, Ii RAH. Germline transformation of Drosophila melanogaster with the piggyBac transposon vector. Insect Mol Biol, 1999, 8(4): 449-457. DOI:10.1046/j.1365-2583.1999.00139.x
|
| [21] |
周文林, 王崇龙, 刘波, 等. piggyBac转座子介导的家蚕细胞转基因研究初探. 蚕业科学, 2007, 33(1): 30-35. Zhou WL, Wang CL, Liu B, et al. The elementary transgene research of Silkworm cells mediated by transposon piggyBac. Sci Sericult, 2007, 33(1): 30-35 (in Chinese). DOI:10.3969/j.issn.0257-4799.2007.01.006 |
| [22] |
Cary LC, Goebel M, Corsaro BG, et al. Transposon mutagenesis of baculoviruses: analysis of Trichoplusia ni transposon IFP2 insertions within the FP-locus of nuclear polyhedrosis viruses. Virology, 1989, 172(1): 156-169. DOI:10.1016/0042-6822(89)90117-7
|
| [23] |
Zeng WH, Liu RP, Zhang TY, et al. BmYki is transcribed into four functional splicing isoforms in the silk glands of the silkworm Bombyx mori. Gene, 2018, 646: 39-46. DOI:10.1016/j.gene.2017.12.047
|
| [24] |
Kurihara H, Sezutsu H, Tamura T, et al. Production of an active feline interferon in the cocoon of transgenic silkworms using the fibroin H-chain expression system. Biochem Biophys Res Commun, 2007, 355(4): 976-980. DOI:10.1016/j.bbrc.2007.02.055
|
| [25] |
Ogawa S, Tomita M, Shimizu K, et al. Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. J Biotechnol, 2007, 128(3): 531-544. DOI:10.1016/j.jbiotec.2006.10.019
|
| [26] |
Xu HF, O'Brochta DA. Advanced technologies for genetically manipulating the silkworm Bombyx mori, a model Lepidopteran insect. Proc Roy Soc B: Biol Sci, 2015, 282(1810): 20150487. DOI:10.1098/rspb.2015.0487
|
| [27] |
刘厚奇, 张远强, 周国民. 医学发育生物学. 科学出版社, 2004. Liu HQ, Zhang YQ, Zhou GM. Medical Developmental Biology. Beijing: Science Press, 2004 (in Chinese). |
| [28] |
马三垣, 徐汉福, 段建平, 等. 家蚕转基因技术中若干因素对转基因效率的影响. 昆虫学报, 2009, 52(6): 595-603. Ma SY, Xu HF, Duan JP, et al. Effect of several factors on the transformation efficiency in the transgenic technology of silkworm, Bombyxmori. Acta Entomol.Sin, 2009, 52(6): 595-603 (in Chinese). DOI:10.3321/j.issn:0454-6296.2009.06.001 |
| [29] |
Häcker U, Nystedt S, Barmchi M P, et al. piggyBac-based insertional mutagenesis in the presence of stably integrated P elements in Drosophila. Proc Natl Acad Sci USA, 2003, 100(13): 7720-7725. DOI:10.1073/pnas.1230526100
|
| [30] |
Brutnell TP, Conrad LJ. Transposon tagging using Activator(Ac) in maize//Grotewold E, Ed. Plant Functional Genomics. Totowa, NJ: Humana Press, 2003, 236: 157.
|