
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王明, 栾韬, 赵建志, 李洪兴, 鲍晓明
- Wang Ming, Luan Tao, Zhao Jianzhi, Li Hongxing, Bao Xiaoming
- 酿酒酵母转化木糖生产化学品的研究进展
- Progress in studies on production of chemicals from xylose by Saccharomyces cerevisiae
- 生物工程学报, 2021, 37(3): 1042-1057
- Chinese Journal of Biotechnology, 2021, 37(3): 1042-1057
- 10.13345/j.cjb.200708
-
文章历史
- Received: November 3, 2020
- Accepted: February 4, 2021
- Published: February 9, 2021
2. 山东大学 生命科学学院 微生物技术国家重点实验室,山东 青岛 266237
2. State Key Laboratory of Microbial Technology, School of Life Science, Shandong University, Qingdao 266237, Shandong, China
木质纤维素类生物质是地球上储量最大的可再生资源,以其为原料经微生物转化生产生物燃料和化学品,是实现由石化资源到可再生生物质资源利用转变的重要路径。木质纤维素的糖组分主要是葡萄糖(占比60%–70%),其次为木糖(占比30%–40%)[1]。目前,大多数研究集中在以更容易利用的葡萄糖为底物,改造微生物底盘细胞从头建立合成途径以及提高目标化学品的产量[2-3]。而作为木质纤维素中第二丰富的糖类,木糖利用的相关研究之前主要集中微生物生产二代燃料乙醇上,近年来才逐渐转移到各种化学品的合成[4-5]。
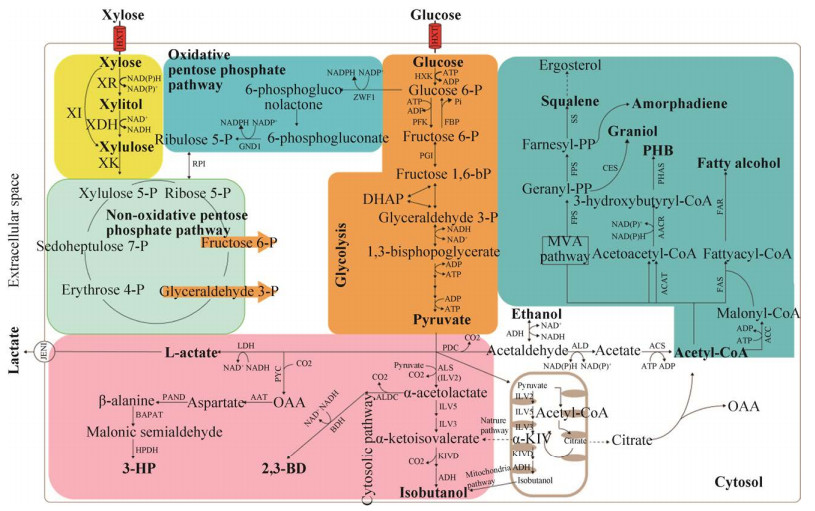
酿酒酵母Saccharomyces cerevisiae是传统的乙醇发酵菌,对粗放工业生产环境中的逆境环境如低pH、高渗透压、高乙醇浓度及某些抑制物等具有较高的耐受性,是用于工业化生产的理想底盘细胞。同时,作为单细胞真核模式微生物,酿酒酵母具有易培养、生长周期短和分子遗传操作简便等优良特点,使其成为了解真核生物系统的主要实验模型之一[6]。然而,天然的酿酒酵母不能有效利用木糖。经过多年对酿酒酵母底物利用范围的研究,已经在细胞内建立了木糖代谢途径且极大地提高了其木糖利用能力[7-12] (图 1)。近年来,随着合成生物学技术的快速崛起,结合经典的代谢工程等手段,许多化学品如萜类、脂肪醇等化合物的合成途径都成功地在酿酒酵母中构建[3, 13-14] (图 1)。同时,重组酿酒酵母的木糖代谢特征较葡萄糖存在较大差别,这也为以木糖为底物获得更高产量的化学品提供了优势[15-18]。另外,鉴于木糖在木质纤维素类生物质中含量丰富,因此实现木糖到化学品的高效转化是实现木质纤维素水解产物生物转化过程经济可行性的前提之一。为此,本文着重综述了酿酒酵母以木糖为底物合成除乙醇以外附加值较高的生物燃料和化学品的研究进展。
|
| 图 1 酿酒酵母中木糖代谢图以及利用木糖合成生物燃料和化学品的合成途径 Fig. 1 The diagram of xylose metabolism in S. cerevisiae and the synthetic pathways of using xylose to produce biofuels and chemicals. |
| |
酿酒酵母转化木糖合成化学品的研究始于以木质纤维素糖组分中木糖为底物生产乙醇,以期将葡萄糖和木糖共发酵用于二代燃料乙醇的生产。历经30余年的持续研究,工程酿酒酵母菌株已具备了比较好的木糖代谢能力且效率越来越接近葡萄糖的代谢效率。最新研究进展显示,包括笔者课题组在内的多个研究团队所构建的木糖利用重组酿酒酵母菌株的糖醇转化率可达到理论值的90%以上[9-11]。总得来说,对酿酒酵母木糖代谢途径的工程改造主要从以下几方面展开。
1.1 木糖转运系统改造早期的研究表明,酿酒酵母对木糖的转运是非特异性地通过葡萄糖转运蛋白完成的,其中,Gal2p和Hxt7p对木糖的转运效率较高,但远不及其对葡萄糖的亲和力,且受到葡萄糖的强烈抑制。要实现酿酒酵母对木糖及葡萄糖的高效利用,其糖转运的理想状态是木糖和葡萄糖的转运通路各行其道、各司其职[19]。近年来,对同源或异源转运蛋白的工程改造,筛选得到了一些木糖专一性转运蛋白,且对提高酿酒酵母木糖利用有着积极作用。即便如此,酿酒酵母对木糖的转运能力都远不及葡萄糖[9, 20-22]。
1.2 木糖利用异源上游途径的建立相比木糖转运蛋白,在酿酒酵母中建立木糖上游代谢途径的研究开展得更早。目前,木糖分解代谢途径主要分为3个,包括XR/XDH或XI途径、Dahms或Weimberg途径以及木糖-1-磷酸酯(Xylulose-1-phosphate,X-1-P) 或核糖-1-磷酸酯(Ribulose-1-phosphate,R-1-P) 途径。Dahms和Weimberg途径主要存在于假单胞菌属Pseudomonas和新月柄杆菌Caulobacter crescentus中,均包括由xylB、xylC和xylD催化的从木糖转化为中间体2-酮-3-脱氧木糖酸酯的3步酶促反应,2-酮-3-脱氧木糖酸酯随后经Weimberg途径进一步形成三羧酸(TCA)循环中间产物α-酮戊二酸,或者经Dahms途径形成丙酮酸和乙醇醛,最终丙酮酸在中心碳代谢中直接转化为乙酰辅酶A,而乙醇醛进一步代谢为2-磷酸甘油酸进入糖酵解过程[23]。很多研究将Dahms途径在大肠杆菌Escherichia coli中异源表达用于合成乙醇酸和乙二醇,得益于E. coli天然含有一种编码能催化Dahms途径最后一步的醛缩酶基因。与此同时,Weimberg途径经5个酶促步骤将木糖直接转化为α-酮戊二酸,而不会产生CO2,因此这是许多TCA循环中间体衍生产品的潜在途径[24]。然而,由于Fe-S簇在酵母细胞质中合成效率低下,导致木糖酸脱水酶(Xylonate dehydratase,xylD) 活性低,当将C. crescentus xylB基因异源表达在酿酒酵母中,会积累大量的木糖酸盐,导致Dahms和Weimberg途径都无法在酿酒酵母中得到良好的表征[25-26]。近年来,通过评估不同的木糖酸脱氢酶,或者将其靶向线粒体表达或通过FRA2缺失改变Fe-S簇代谢等策略提高了木糖酸脱水酶在酿酒酵母中的表达活性[25, 27]。除此之外,在E. coli中也建立了两条新的木糖代谢途径——X-1-P和R-1-P途径[28-29]。这两条途径都能较大程度地绕过内源磷酸戊糖(Pentose phosphate pathway,PPP) 途径直接裂解木糖,因而具有合成二碳化合物的优势。其中X-1-P途径将木糖异构化为木酮糖,随后将其磷酸化为木酮糖-1-磷酸,然后进行醛解生成乙醇醛和磷酸二羟丙酮(Dihydroxyacetone phosphate,DHAP)。而R-1-P途径中的木糖也异构化为木酮糖,但随之通过差向异构化形成核糖,再进行磷酸化和随后的醛解生成乙醇醛和DHAP。这两条途径也被引入到酿酒酵母中用于合成二碳化合物[30-31]。在酿酒酵母中从木糖到木酮糖的转化过程,主要通过XR-XDH途径,即由木糖还原酶(Xylose reductase,XR) 与木糖醇脱氢酶(Xylitol dehydrogenase,XDH),和短程的木糖异构酶(Xylose isomerase XI) 途径完成。XR-XDH途径的相关外源基因主要是树干毕赤酵母Pichia stipitis来源的,但由于XR和XDH辅酶偏好性不同,造成NAD+缺乏或NADPH过量,导致氧化还原代谢失衡,造成木糖醇等中间产物的积累,难以提高糖醇转化率。虽然开展了大量包括调整XR/XDH活性比例、改变辅因子的偏好性及调控细胞内NADH/NADPH的比例的辅酶工程研究,但仍然没能有效克服这一缺陷[19, 32-36]。而XI途径因其无需辅酶参与且仅一步即可完成从木糖到木酮糖的转化,但由于能够在酿酒酵母中高活性表达的木糖异构酶(XI) 基因的筛选过程困难重重,使得XI途径在酿酒酵母中的建立远远晚于XR-XDH途径。目前XI途径成为二代燃料乙醇生产酿酒酵母菌株使用的主要木糖代谢途径,其主要源于牛瘤胃宏基因组、厌氧真菌Piromyces sp.、梭状芽胞杆菌Clostridium phytofermentans和瘤胃真菌Orpinomyces等,且通过定向进化技术提高活性后,再表达于酿酒酵母中进行适应性进化,或增加xylA的拷贝数,均能使酿酒酵母展现出更好的木糖代谢能力[19, 37-40]。
1.3 内源性代谢节点的改造木糖转化为木酮糖,再经过PPP途径进入糖酵解和乙醇发酵主代谢途径。为了提高木糖利用率,理性改造的主要节点是强化PPP途径等内源性下游途径、弱化旁支途径及能源消耗节点等。此外,菌株在木糖条件下进行长期适应性进化的非理性育种措施,可以提高木糖代谢能力。进而通过反向代谢工程研究,也发现了一些内源性代谢节点[19, 41-42]。
1.4 全局调控因子的挖掘与应用酵母通过调节特定转录和代谢反应的多种信号途径感知并响应一系列葡萄糖浓度,这种对葡萄糖的严格调节反应使酵母成为少数通过高糖酵解通量将葡萄糖快速转化为乙醇的生物之一[43]。但如何全局上重新编程酿酒酵母的代谢网络,使木糖快速有效地转化为乙醇或其他生物燃料,仍然是极具挑战性的问题。直到近几年,通过基因组测序、组学分析以及系统生物学工具,在酿酒酵母中鉴定出了一些对细胞利用木糖生长具有积极作用的全局调节靶点,如CYC8、ISU1、SSK2、GCR2、IRA2和HOG1,它们单独或依赖上位遗传相互作用参与己糖转运蛋白调控、糖酵解基因转录,上调PPP途径以及呼吸作用等,从而刺激金属依赖性的XI活性、Fe-S簇的生物合成或蛋白激酶的信号传导,以此调控木糖代谢效率[43-47]。
2 酿酒酵母葡萄糖与木糖的代谢差异 2.1 糖转运酿酒酵母对不同碳源的代谢生理特征有很大不同,首先表现在糖由胞外向胞内的转运过程。一般来说,葡萄糖和木糖共享同一套转运系统,但糖转运效率因碳源不同而不尽相同,研究表明木糖的存在会引起酿酒酵母糖转运系统的重排[48-50]。当碳源由葡萄糖变为木糖时,无论氧水平充足与否,高葡萄糖浓度诱导编码的低亲和力葡萄糖转运蛋白基因HXT1和HXT3的转录水平显著降低,而高亲和力转运蛋白基因HXT6和HXT7的转录水平被强烈诱导表达。此外,木糖也能够诱导低亲和力转运蛋白基因HXT2 (有氧条件) 和中等亲和力转运蛋白基因HXT5 (限氧条件) 的高水平表达。木糖代谢时,参与半乳糖代谢的Gal2基因的转录水平明显提高,其编码的蛋白已被证实是多功能糖转运蛋白,可同时转运半乳糖、木糖以及葡萄糖[50]。然而,上述大部分蛋白为己糖转运蛋白,其对木糖的转运效率较低,且受到葡萄糖的强烈抑制,从而影响了木糖代谢效率[19]。因此,研究者们陆续开展了异源木糖转运蛋白的筛选、表达及改造等工作,并取得了阶段性进展。例如,Jiang等[51]在里氏木霉Trichoderma reesei中鉴定出比Gal2p更具有木糖转运活性的新转运蛋白Xltr1p,定点突变后的Xltr1pN326F完全失去了其葡萄糖转运能力,但是保留了木糖摄取活性。包括笔者课题组在内的多个研究组,也成功得到了源于季也蒙酵母Meyerozyma guilliermondii的转运蛋白突变子Mgt05196N360F和酿酒酵母内源转运蛋白的点突变子Gal2N376F和Hxt36N367F,都是能完全解除葡萄糖抑制的木糖专一性转运蛋白突变子[20-21, 52]。
2.2 磷酸戊糖途径酿酒酵母在进行葡萄糖代谢时,大部分碳源直接经糖酵解途径进入中心碳代谢过程,仅有小部分碳源进入PPP途径用于合成细胞生长所必需的辅因子NADPH,以及5-磷酸核糖(Ribose 5-phosphate,R5P) 和4-磷酸赤藓糖(Erythrose 4-phosphate,E4P)等关键中间代谢物。由此可见,大部分葡萄糖流向乙醇的合成,而PPP途径代谢通量处于较低水平[50, 53-54]。当木糖为唯一碳源时,PPP途径的非氧化阶段是木糖进入细胞中心碳代谢的必经之路,而木糖代谢物5-磷酸木酮糖(D-xylulose 5-phosphate,X5P) 又是进入该途径的入口中间产物,因此其代谢通量比葡萄糖为唯一碳源时高出很多[53]。木糖代谢时PPP途径代谢通量的增加使得R5P、E4P和景天庚酮糖-7-磷酸(Sedoheptulose 7-phosphate,S7P) 等中间代谢物的合成量增加[50]。然而,Matsushika等[55]研究发现转醛酶基因TAL1的表达水平不会因碳源的转变而发生变化,却因此会导致S7P的积累,进一步影响了木糖代谢效率。包括笔者课题组在内的多项研究表明,过表达TAL1可以有效提高酿酒酵母的木糖代谢效率[7, 9, 56]。
木糖代谢无需经过PPP途径氧化阶段,因此理论上PPP途径氧化阶段的代谢通量处于较低水平。然而,有研究发现,含XR-XDH途径的酿酒酵母代谢木糖时,PPP途径氧化阶段的代谢通量处于较高水平。推测其原因,可能是由于XR-XDH途径的引入造成了胞内辅因子不平衡和木糖代谢绕开PPP途径氧化阶段导致NADPH供给不足,迫使细胞提高PPP途径氧化阶段通量来缓解这些问题。然而,木糖代谢时,该途径通量处于较高水平,在一定程度上会造成碳源流失,从而导致乙醇转化率的降低[53-54]。从另外一个角度考虑,胞内辅因子的不平衡可能有益于利用木糖合成某些非乙醇化学品,因为这些化学品的合成需要大量的氧化还原力[18, 57]。而将木糖一步转化为木酮糖的XI途径无需辅因子参与且路径更短,减少了碳流失,可以获得更高的乙醇产率[9, 11-12]。
2.3 糖酵解和糖异生与葡萄糖相比,酿酒酵母进行木糖代谢时糖酵解处于较低水平,这无疑成为影响木糖代谢效率的潜在瓶颈[50, 53, 58-59]。当葡萄糖为碳源时,无论供氧充足与否,细胞都处于强糖酵解状态,糖异生途径、TCA循环和乙醛酸循环中的基因处于被阻遏表达状态,丙酮酸只有少量进入TCA循环进行呼吸代谢,而大部分流向发酵产物乙醇,并且细胞的生长受到抑制,该现象被称为Crabtree效应[60-62],因此葡萄糖被称为发酵性碳源。当以木糖为碳源时,糖酵解途径中的代谢产物谱发生了很大的变化[50]。木糖经PPP途径非氧化阶段产生果糖6-磷酸(Fructose 6-phosphate,F6P) 和3-磷酸甘油醛(Glyceraldehyde-3-phosphate,GAP),然后进入糖酵解途径继续代谢。研究发现,除磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP) 外,其他糖酵解中间产物的含量均处于较低水平,PEP的积累则也说明细胞处于碳饥饿的糖酵解模式[50, 63]。作为激活Crabtree效应的重要代谢物,1, 6-二磷酸果糖(Fructose-1, 6-diphosphate,F1, 6P) 含量较低证明Crabtree效应处于不完全激活状态[64],同时,转录组数据分析显示,木糖代谢过程中,糖酵解途径下游的GPM2 (编码磷酸甘油酸变位酶)、ENO2 (编码烯醇化酶) 和PYK1 (编码丙酮酸激酶) 等基因的表达水平下降[50, 65]。总之,糖酵解途径的活跃程度是影响木糖代谢效率的关键因素之一。
作为典型的非发酵性碳源,发酵产物乙醇可以激活糖异生途径,使得细胞的整体代谢特征呈现Crabtree-negative状态。乙醇利用阶段,参与糖异生过程的果糖1, 6-双磷酸酶(Fructose 1, 6-bisphosphatase,FBP1) 和异柠檬酸裂解酶(Isocitrate lyase,ICL1) 受葡萄糖的抑制作用被解除。然而,有研究发现,木糖可以阻止该过程的发生[66]。虽然在木糖条件下,糖异生相关的磷酸烯醇式丙酮酸激酶(Phosphoenolpyruvate carboxykinase,PCK1)、FBP1和ICL1的表达水平有所提高,但与乙醇为碳源相比,无论是木糖还是乙醇/木糖混合物条件,FBP1和ICL1活性均处于较低水平。然而,与葡萄糖条件相比,木糖条件下上述两种酶的活性水平仍然高得多(约20–30倍),这表明木糖不能完全抑制这些酶的活性[66-67]。结合前面所述的木糖条件下低糖酵解水平特征,木糖代谢时细胞可能处于葡萄糖阻遏和解葡萄糖阻遏中间的状态。因此,木糖可能是介于发酵性和非发酵性碳源之间的“半发酵性碳源”。
2.4 能量及乙酰辅酶A代谢葡萄糖即使在有氧条件下也能严格调节酿酒酵母线粒体中呼吸能量代谢相关基因的转录,例如TCA循环和氧化磷酸化[50, 58]。与此相反,即使是在完全厌氧条件下,木糖也不会引起酿酒酵母的发酵反应[55]。且在木糖代谢期间,TCA循环和呼吸作用相关的许多基因被上调,同时,Hap4p作为诱导呼吸作用相关基因表达的转录激活因子,其转录水平在木糖代谢过程中也大幅提升,呼吸作用基因的上调使TCA循环和呼吸作用的途径中间产物的水平升高也促进了ATP合成[55, 60]。
木糖代谢也改变了酿酒酵母中乙酰辅酶A合成相关基因的转录水平[55, 60]。在葡萄糖代谢中,由于碳通量趋向于流向乙醇发酵,同时乙醇再氧化的醇脱氢酶基因ADH2和乙酰辅酶A合成酶基因ACS1受到强烈抑制,以及呼吸能量代谢效率低下,无法满足乙酰辅酶A合成需要的大量ATP,因此乙酰辅酶A的合成受到了限制[50, 68]。相反,木糖不会引起呼吸能量代谢相关基因的抑制,反而增强了ADH2和ACS1以及编码调节这两个基因的转录因子Adr1p和Cat8p的转录水平,同时,编码细胞质醛脱氢酶基因ALD2、ALD3和线粒体醛脱氢酶基因ALD4,以及葡萄糖可抑制的线粒体乙酰辅酶A水解酶基因ACH1的表达也都被上调,这表明与葡萄糖相比,木糖生长过程中细胞中乙酰辅酶A的浓度可能会更高[55, 60]。
3 利用木糖合成化学品和生物燃料酿酒酵母被赋予木糖代谢能力后,碳源由葡萄糖向木糖的转化会促使细胞固有的代谢网络发生变化。相比于葡萄糖,细胞以木糖为碳源时,糖酵解途径代谢活性降低,同时非发酵代谢途径的相关基因表达水平升高,因此,在转录组和代谢组学上的差异预示流向乙醇合成的碳源减少,而这表明木糖的代谢特征可能有利于生产乙醇以外的生物基化学品[50, 60-61] (表 1)。
| Chemical | Xylose pathway | Metabolic engineering approach | Performance on xylose | Performance on glucose | Reference |
| 1-hexadecanol | S. stipitis XR-XDH-XK | ΔRPD3, Overexpression of ACC1, T. alba FAR and Y. lipolytica ACL | fed-batch: 1.20 g/L, 0.08 g/g xylose | fed-batch: > 1.11g/L, < 0.01g/g glucose | [15] |
| Squalene | S. stipitis XR-XDH-XK | Overexpression of tHMG1 and ERG10 | (149.50±4.50) mg/L fed-batch: 532.00 mg/L | (18.70± 1.00) mg/L | [16] |
| Amorphadiene | S. stipitis XR-XDH-XK | Overexpression of tHMG1, ERG10 and A. annua ADS, Down-regulation of ERG9 | (254.30±6.20) mg/L | (120.20± 4.30) mg/L | [16] |
| Lactic acid | S. stipitis XR-XDH-XK | Overexpression of R. ryzae LDH | 0.69 g/g xylose | 0.22 g/g glucose | [17] |
| 3-hydroxypropionic acid | S. stipitis XR-XDH-XK (evolution) | Overexpression of PYC1, PYC2, Triboleum castanium panD and E. coli ydfG (NADPH-dependent dehydrogenase) | (1.84±0.23) g/L | (1.00±0.06) g/L | [18] |
| poly-3-D- hydroxybutyrate | S. stipitis XR-XDH-XK | Overexpression of PPP genes and C. necator PhaA, PhaC1 andA. vinosum PhaB | 131.00 mg/L | [57] | |
| S. stipites mtXR-XDH-XK | Overexpression of PPP genes and C. necator PhaA, PhaC1 andA. vinosum PhaB | 252.00 mg/L | [57] | ||
| S. stipitis XR-XDH-XK | Overexpression of PPP genes and C. necator PhaA, PhaC1 and PhaB | 101.70 mg/L | [77] | ||
| Isobutanol | S. stipitis XR-XDH-XK | ΔBAT1, ΔALD6, ΔPHO13 Overexpression of ILV2, ILV3 and ILV5, Mitochondrial overexpression ofL. lactis Kivd and AdhARE1 | (2.05±0.21) g/L fed-batch: 3.10± 0.18 g/L | (1.07±0.01) g/L | [71] |
| S. stipitis XR-XDH-XK | Overexpression of ILV2, ILV3 and ILV5, Mitochondrial overexpression of L. lactis Kivd and AdhARE1 | (872.00±6.80) mg/L fed-batch: 2.60 g/L | (156.00± 2.10) mg/L | [75] | |
| p-coumaric acid | S. stipitis XR-XDH-XK (evolution) | ΔARO10, Δpdc5, expressed E. coli aroL and Flavobacterium johnsoniae TAL, overexpressed feedback-resistant ARO4 andARO7 | Batch: (242.00± 5.00) mg/L | (5.35±0.32) mg/L | [76] |
| 2, 3-Butanediol | S. stipitis XR-XDH-XK | Δpdc1, Δpdc5, mtMTH1 Overexpression of BDH1, B. subtilis AlsS and AlsD | fed-batch: 43.60 g/L | [78] | |
| S. stipitis XR-XDH-XK mtXR | Δpdc1, Δpdc5, mtMTH1 Overexpression of BDH1, B. subtilis AlsS, AlsD, L. lactis NoxE andC. tropicalis PDC1 | fed-batch: 96.80 g/L | [79] |
乙酰辅酶A是许多高值化合物合成的重要前体。其中,以萜类和脂肪类化合物为代表的高值化合物研究最为广泛,这些化合物广泛应用于食品、化妆品、化工及新能源等工业领域。如前所述,酿酒酵母中木糖代谢特征有益于细胞内乙酰辅酶A的积累,这无疑为以乙酰辅酶A为前体的化合物的合成奠定了基础[15-16]。萜类化合物是以乙酰辅酶A为起始反应物,经甲羟戊酸(Mevalonic acid,MVA) 途径或甲基赤藓糖磷酸(Methylerythritol phosphate,MEP) 途径,在不同萜类合成酶作用下合成的。Kwak等[16]在含有XR-XDH途径的木糖利用菌株SR7中过表达内源乙酰辅酶A乙酰基转移酶(Acetoacetyl-CoA thiolase, ERG10) 以及MVA途径关键限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,tHMG1),进一步增强了萜类化合物合成的代谢通量,使木糖条件下三萜鲨烯的产量相比同等葡萄糖条件下提高了8倍。类似的代谢工程策略应用到倍半萜紫穗槐二烯(青蒿酸前体) 合成中,同时弱化鲨烯合成酶的表达以重新分配倍半萜通用前体法尼烯焦磷酸(Farnesyl pyrophosphate,FPP) 的代谢流向,显著提高了产物产量[16]。因此,酿酒酵母木糖代谢更利于萜类化合物的生物合成,可能是由于木糖的“半发酵碳源”的代谢特征解除了葡萄糖对参与乙醇再氧化合成乙酰辅酶A途径(例如ADH2、ALD3、ALD6、ACS1) 以及呼吸能量代谢相关基因的表达抑制,使得胞内乙酰辅酶A和ATP的合成量增加,满足了萜类化合物合成过程中对乙酰辅酶A和能量的需求[16]。笔者课题组测定了酿酒酵母在以葡萄糖或木糖为唯一碳源时胞内乙酰辅酶A的含量,发现其在木糖条件下的含量是葡萄糖条件下的2倍。单独表达单萜香叶醇合成酶(tVoGES),相同发酵条件下,以木糖为唯一碳源,香叶醇产量提高了1倍。我们进一步过表达MVA途径中的限速酶及香叶醇合成酶-香叶基焦磷酸合成酶融合体用于提高单萜直接前体香叶基焦磷酸的合成通量,使得香叶醇的产量提高到75.6 mg/L,仍然比葡萄糖条件下高出1倍,这也说明木糖代谢时高乙酰辅酶A含量是产物产量提高的根本原因(未发表的数据)。
脂肪醇是另外一种以乙酰辅酶A为前体的重要化合物。以棕榈醇为例,Feng等[69]和Guo等[15]研究了工程酿酒酵母以葡萄糖或木糖为碳源合成脂肪醇。首先,研究者在酿酒酵母中过表达异源仓鸮Tyto alba脂酰辅酶A还原酶(Fatty acyl-CoA reductase,FAR)、内源乙酰辅酶A羧化酶(Acetyl-CoA carboxylase,ACC1) 以及来源于解脂耶氏酵母Yarrowia lipolytica的柠檬酸裂解酶(ATP-dependent citrate lyase,ACL),同时敲除磷脂合成途径中的负调控因子RPD3,以此来提高前体乙酰辅酶A的积累。然后,研究者将木糖代谢上游的XR-XDH途径引入上述菌株中,通过启动子工程从整体上对木糖利用途径进行优化以提高细胞木糖代谢能力。以木糖为唯一碳源,分批补料发酵中棕榈醇的产率相比葡萄糖为碳源提高了8倍,由0.01 g/g提高到0.08 g/g。推测其原因是,木糖存在时细胞内TCA循环代谢通量的升高促进了中间产物柠檬酸的积累,经引入的异源柠檬酸裂解酶途径裂解为乙酰辅酶A。除此之外,葡萄糖代谢时,由于葡萄糖可以与蛋白激酶Snf1p充分相互作用,Snf1p可以下调ACC1的表达并促进β-氧化过程,造成脂肪酰辅酶A的损耗,而木糖可以解除上述调控作用,进一步增加乙酰辅酶A的积累,从而提高目标产物的产量[69]。
3.2 以丙酮酸为前体合成有机酸(醇)类丙酮酸是细胞中心碳代谢过程中的重要中间产物。木糖代谢时酿酒酵母细胞整体呈现Crabtree-negative的特征,这预示着丙酮酸不会大量流向乙醇合成,为以丙酮酸为前体的有机酸(醇) 类化合物的生物合成提供了有利条件。作为化工领域的重要平台化学品,3-羟基丙酸(3-hydroxypropionic acid,3-HP) 和乳酸广泛用于高吸水性聚合物、塑料或油漆等大宗化工产品的生产。在3-HP生物合成中,Kildegaard等[18]首次将异源3-HP合成途径引入木糖利用酿酒酵母中,构建了以β-丙氨酸为中间体经5步催化反应由丙酮酸到3-HP的合成途径,主要参与酶包括丙酮酸羧化酶(Pyruvate carboxylase,PYC1、PYC2)、来源于蜡样芽胞杆菌Bacillus cereus的β-丙氨酸-丙酮酸氨基转移酶(β-alanine-pyruvate aminotransferase,BcBAPAT)、来源于Triboleum castaneum的天冬氨酸1-脱羧酶(Aspartate 1-decarboxylas,TcPAND) 以及来源于E. coli的NADPH依赖性型3-羟基丙酸脱氢酶(NADPH-dependent 3-hydroxypropionate dehydrogenase,EcYdfG)。重组酿酒酵母菌株木糖条件下的3HP产量达到(1.84±0.23) g/L,相比葡萄糖条件提高了85%。另一种以丙酮酸前体合成化合物——乳酸,乳酸一般由乳酸菌生产,但在发酵过程中随着乳酸的积累,发酵液pH值越来越低,影响菌体的生长,从而阻碍了产物产量的进一步提高。相比于乳酸菌,酿酒酵母能够耐受更低的pH值,因此被认为是理想的乳酸生产替代菌株。Turner等[17]在木糖利用酿酒酵母SR8中仅过表达来源于米根霉Rhizopus oryzae的乳酸脱氢酶(Lactate dehydrogenase,LDH),木糖条件下乳酸产量为0.6 g/g,是葡萄糖条件下的3倍,显现出较高的工业应用潜力。上述两种化合物的产量在木糖条件下明显优于葡萄糖条件,主要归因于细胞代谢木糖时呈现的Crabtree-negative代谢特征,此时丙酮酸脱羧酶(Pyruvate decarboxylase,PDC) 活性较低,致使胞内丙酮酸积累。另外,PYC和LDH对丙酮酸的亲和力高于PDC,进一步促使丙酮酸流向目标产物的合成[17, 70]。
丙酮酸是线粒体中TCA循环正常运转的关键代谢物。酿酒酵母在代谢木糖时,丙酮酸由胞质到线粒体的运输量和TCA循环代谢通量明显增强,而且线粒体活性显著高于代谢葡萄糖时,这为作为先进生物燃料的异丁醇的生物合成奠定了基础[50, 71]。传统的合成路线是以丙酮酸为前体合成缬氨酸,经内源降解和异源合成途径完成异丁醇的合成。然而,仅对参与异丁醇合成的酶进行简单过表达并没有明显提高产物产量,分析其原因可能是由于细胞内缬氨酸合成(线粒体) 和降解(细胞质) 的反应区间不同造成的[72-74]。Lane等[75]将参与异丁醇合成的细胞质途径定位到木糖利用菌株的线粒体中,包括乙酰乳酸合酶(Acetolactate synthase,ILV2)、酮醇酸还原异构酶(Ketol-acid reductoisomerase,ILV5)、二羟酸脱水酶(Dihydroxyacid dehydratase,ILV3)、醇脱氢酶(Alcohol dehydrogenase,AdhARE1) 及来源于乳酸乳球菌Lactococcus lactis的α-酮异戊酸脱羧酶(α-ketoisovalerate decarboxylase,Kivd),该策略将异丁醇合成的完整途径集中到同一反应区间,同时充分利用木糖代谢时TCA循环高活性特征,将异丁醇的产量显著提高到了2.6 g/L。Zhang等[71]采用了相同的策略将异丁醇合成定位到线粒体中,除此之外,还通过敲除BAT1 (编码线粒体支链氨基酸转氨酶)、ALD6 (编码胞质醛脱氢酶) 和PHO13 (编码碱性磷酸酶) 进一步优化代谢途径,最终使得异丁醇得到大幅度提高,达到3.1 g/L。
3.3 芳香族化合物芳香族化合物作为合成高分子材料(例如功能塑料和纤维、食品和饲料添加剂、保健食品和药物) 的基础原料具有广泛的工业和商业应用。为了避免葡萄糖培养时产生的Crabtree效应,以及使更多的碳通量流向生物质和芳香族氨基酸(AAAD) 产物。Gheorghe等[76]首次以木糖为唯一碳源合成芳香族氨基酸衍生物对香豆酸,除了在木糖利用酿酒酵母中引入来源于E. coli的莽草酸激酶Ⅱ(Shikimate kinaseⅡ,aroL) 和约氏黄杆菌Flavobacterium johnsoniae来源的酪氨酸解氨酶(Tyrosine ammonia-lyase,TAL),同时过表达抗反馈型的DAHP合酶和分支酸突变酶提高芳香族氨基酸途径的总碳通量以及敲除ARO10和PDC5以减少副产物形成。获得的重组酿酒酵母菌株与在葡萄糖(5.35 mg/L) 条件下生产相比,木糖条件下细胞生长速率虽然较低,但对香豆酸的产量却提高了45倍,达到了242 mg/L。转录组学数据显示己糖转运和乙醛酸途径相关基因被上调,并且呼吸作用也得到增强,这些生物学特征都符合木糖代谢时整体细胞的代谢特点。同时木糖代谢时细胞进行呼吸代谢而不是发酵代谢,生物量的提高以及明显减少的溢流代谢等有利于产物对香豆酸的合成。
3.4 存在的问题木糖代谢途径的引入会使酿酒酵母细胞内代谢网络发生重排,这可能为某些化合物的高效合成提供了有利条件。例如,前面提到的萜类、脂肪醇以及有机酸类等化合物,它们以木糖为碳源时的产量会更高。然而,新代谢途径的引入是否会引起胞内辅因子不平衡是研究者关注的重要方面。因为不同目标化合物合成过程中对辅因子的需求不尽相同,因此,辅因子的代谢对产物的合成至关重要。在以木糖为碳源合成聚羟基丁酸酯(Polyhydroxybutyrate,PHB) 的过程中,由于XR-XDH木糖代谢途径中XR的辅因子通常偏好NADPH,XDH则偏好NAD+,而PHB的合成需要大量NAD+,XR-XDH途径辅因子偏好性不一致必然导致细胞内氧化还原不平衡,从而影响了PHB的合成,使得PHB的最高产量仅为101.7 mg/L[77]。通过表达NADH依赖型的乙酰乙酰辅酶A还原酶(AvAAR) 和NADH偏好性的XR突变体,改善了辅因子不平衡的问题,显著提高PHB产量至360 mg/L[57]。同样的,在2, 3-丁二醇(2, 3-butanediol,2, 3-BD) 合成过程中,通过改变XR的辅酶偏好性,并引入电子吸收反应来氧化过量的NADH产生NAD+,使得2, 3-BD在木糖为碳源时的产量达到了葡萄糖为碳源时的水平[78-79]。除辅因子不平衡问题以外,木糖代谢过程中上下游途径通量的适配度也是影响目标产物合成量的关键因素。其中,催化木酮糖磷酸化为木酮糖-5-磷酸的木酮糖激酶(Xylulose kinase,XK) 是关键限速节点,在酿酒酵母中过表达XK后提高了木糖代谢效率。然而,后续研究发现单个限速节点的调控会引起下游产物的积累。研究者通过加强PPP途径的非氧化阶段中转酮酶(Transketolase,TKL)、转醛酶(Transketolase,TAL)、5-磷酸核酮糖差向异构酶(Ribulose phosphate epimerase,RPE) 和5-磷酸核酮糖异构酶(Ribulose phosphate isomerase,RKI) 的表达,进一步提高了木糖的代谢效率[7, 9]。虽然,局部的理性代谢调控在一定程度上提高了木糖代谢效率,但是木糖代谢途径与目标产物合成途径的高效衔接以及高度适配是最终实现产物高产的根本。对细胞复杂代谢网络的全局调控是解决上述问题的重要措施之一,例如,相关基因转录调控因子、蛋白质修饰系统以及糖代谢信号途径等。研究报道,Gcr2是一种糖酵解基因转录激活因子,可与RAP1和GCR1形成复合体调节糖酵解途径中大多数基因的表达。该激活因子缺失后可增加戊糖磷酸途径的代谢通量和细胞对氧化应激的抵抗力,从而提高了菌株的木糖利用速率和细胞生长[46]。酿酒酵母细胞中己糖和戊糖的转运共用一套蛋白系统,转运效率的高低亦是影响糖代谢速率的重要因素。调节因子Cyc8的失活使得内源己糖转运蛋白(HXTs) 表达量增加,在提高己糖转运速率的同时,也为木糖的转运提供了有利条件[45]。众所周知,细胞内的代谢反应是由蛋白(酶)催化完成的,而蛋白的功能除了受自身结构的影响,翻译后修饰(Post-translational modification,PTM) 过程也是影响其功能的重要因素。PTM系统是生命体中广泛存在的重要调控机制,主要包括磷酸化、甲基化、酰基化等修饰过程。PTM能够通过酶活性调节,改变亚细胞定位、与分子伴侣间相互作用、蛋白质稳定性及其与DNA结合能力等方式,赋予其修饰蛋白质全新的功能和性质[80]。除此之外,糖代谢信号途径是影响糖代谢速率的重要方面。Sato等研究发现Fe-S簇和信号传导之间存在相互作用,鉴定了ISU1、Ssk2和IRA2等靶点,通过对这些靶点进行单独或组合遗传操作改变胞内铁离子浓度激活HOG1途径、刺激PKA激酶等促进木糖的有氧呼吸和发酵代谢[43]。另外,Wu等通过操纵cAMP磷酸二酯酶基因的表达模拟葡萄糖感应系统,在一定程度上提高了酿酒酵母的木糖代谢速率[81]。虽然研究者从细胞全局调控层面着眼,在调控因子、蛋白修饰系统及糖代谢信号等方面鉴定得到了部分有效作用靶点,但是具体调控机制仍然存在很多未知,且对具有全局调控功能的生物元件挖掘不够。在目前取得的研究基础上,期望未来从局部到全局调控着手进一步揭示酿酒酵母木糖的代谢调控机制,优化细胞整体代谢网络,平衡细胞生长与产物合成,最大限度地提高微生物细胞工厂的产能。
4 总结与展望作为木质纤维素类生物质中仅次于葡萄糖含量第二丰富的糖,木糖如何高效转化为高附加值化学品越来越受到研究者们的关注。虽然从木糖x转运、辅因子工程、下游途径加强及适配等方面开展了大量的工作,显著提高了木糖的代谢效率。但是,木糖的利用仍存在一些瓶颈问题,其代谢效率还有很大的提升空间,未来的研究工作可从以下几个方面开展。首先,对于辅因子不平衡的XR-XDH途径来说,未来可以从蛋白质工程、XR/XDH活性比例调节或者引入外源的电子传递链等方面着手,使得辅因子不平衡最小化。另一方面,通过新型合成途径作为氧化NADH的电子受体,辅因子的不平衡也可能作为驱动力实现廉价原料(如乙酸盐或CO2) 的利用以合成特定产物。对XI途径来说,蛋白表达量不足及其酶活性较低依然是制约该途径木糖转化效率的重要因素。后续研究可以从密码子优化、基因表达量控制以及蛋白质定向进化等方面着手,进一步提高XI途径的催化效率。其次,在提高酿酒酵母木糖代谢效率的同时,应用动态调控策略实现生物量和目标产物之间的物质能量的优化分配、从蛋白质翻译后修饰提高人工途径与底盘细胞的适配度、多层次多功能的级联调控以及菌株对产物的耐受性能等理性调控策略进一步提高目标产物的产能[82-85]。另外,可采用非理性的育种手段,如适应性进化、常压室温等离子体(Atmospheric and room temperature plasma,ARTP) 诱变、基因组重排等,结合高通量筛选策略选育得到高性能菌株,再通过反向代谢工程、组学等技术,挖掘有效的代谢调控元件,进一步指导代谢工程改造,最大限度地提高细胞的生产性能。
除此之外,木质纤维素的利用过程中必须解决的另外一个问题是菌株对各种抑制物的耐受性。木质纤维素水解过程中产生的各种抑制物,如乙酸、5-羟基甲基糠醛(HMF)、糠醛和酚类等通过不同的机制影响细胞的糖代谢效率和产物得率。在过去的10年里,有很多理性策略如相关氧化还原酶基因的遗传操作,转录因子、嘌呤生物合成途径表达的调节,和非理性策略如随机诱变、适应性进化工程以及基因组重组,已经一定程度地提高了酿酒酵母对单个抑制物的耐受性。然而,这些单个抑制物抗性很难集中到同一菌株中,导致细胞对多重抑制物的耐受能力有限。另外,研究发现,菌株在提高耐受性的同时,会发生糖(尤其是木糖) 代谢效率下降的现象。因此,构建多种重抑制物耐受性高且能够高效利用葡萄糖和木糖合成高价值化学品的菌株是木质纤维素能够经济、高效转化的前提条件。
总之,随着生物技术和合成生物学技术的快速发展,更多有效、理性、智能的工程化策略应用到利用木糖的微生物细胞工厂的高效构建过程中,以期在未来可再生木质纤维素类生物质的高值转化中发挥重要的作用。
| [1] |
Hou J, Qiu CX, Shen Y, et al. Engineering of Saccharomyces cerevisiae for the efficient co-utilization of glucose and xylose. FEMS Yeast Res, 2017, 17(4): fox034.
|
| [2] |
Chen XL, Gao C, Guo L, et al. DCEO biotechnology: tools to design, construct, evaluate, and optimize the metabolic pathway for biosynthesis of chemicals. Chem Rev, 2018, 118(1): 4-72. DOI:10.1021/acs.chemrev.6b00804
|
| [3] |
Hu YT, Zhu ZW, Nielsen J, et al. Engineering Saccharomyces cerevisiae cells for production of fatty acid-derived biofuels and chemicals. Open Biol, 2019, 9(5): 190049. DOI:10.1098/rsob.190049
|
| [4] |
Zhang GC, Liu JJ, Kong Ⅱ, et al. Combining C6 and C5 sugar metabolism for enhancing microbial bioconversion. Curr Opin Chem Biol, 2015, 29: 49-57. DOI:10.1016/j.cbpa.2015.09.008
|
| [5] |
Harner NK, Wen X, Bajwa PK, et al. Genetic improvement of native xylose-fermenting yeasts for ethanol production. J Ind Microbiol Biotechnol, 2015, 42(1): 1-20. DOI:10.1007/s10295-014-1535-z
|
| [6] |
Kwak S, Jin YS. Production of fuels and chemicals from xylose by engineered Saccharomyces cerevisiae: a review and perspective. Microb Cell Fact, 2017, 16: 82. DOI:10.1186/s12934-017-0694-9
|
| [7] |
Peng BY, Shen Y, Li XW, et al. Improvement of xylose fermentation in respiratory-deficient xylose-fermenting Saccharomyces cerevisiae. Metab Eng, 2012, 14(1): 9-18. DOI:10.1016/j.ymben.2011.12.001
|
| [8] |
Shen Y, Chen X, Peng BY, et al. An efficient xylose-fermenting recombinant Saccharomyces cerevisiae strain obtained through adaptive evolution and its global transcription profile. Appl Microbiol Biotechnol, 2012, 96(4): 1079-1091. DOI:10.1007/s00253-012-4418-0
|
| [9] |
Li HX, Shen Y, Wu ML, et al. Engineering a wild-type diploid Saccharomyces cerevisiae strain for second-generation bioethanol production. Bioresour Bioprocess, 2016, 3: 51. DOI:10.1186/s40643-016-0126-4
|
| [10] |
Kim SR, Skerker JM, Kong Ⅱ, et al. Metabolic engineering of a haploid strain derived from a triploid industrial yeast for producing cellulosic ethanol. Metab Eng, 2017, 40: 176-185. DOI:10.1016/j.ymben.2017.02.006
|
| [11] |
Tran PHN, Ko JK, Gong G, et al. Improved simultaneous co-fermentation of glucose and xylose by Saccharomyces cerevisiae for efficient lignocellulosic biorefinery. Biotechnol Biofuels, 2020, 13: 12. DOI:10.1186/s13068-019-1641-2
|
| [12] |
Liu TT, Huang SC, Geng AL. Recombinant diploid Saccharomyces cerevisiae strain development for rapid glucose and xylose co-fermentation. Fermentation, 2018, 4(3): 59. DOI:10.3390/fermentation4030059
|
| [13] |
Zhao JZ, Bao XM, Li C, et al. Improving monoterpene geraniol production through geranyl diphosphate synthesis regulation in Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 2016, 100: 4561-4571. DOI:10.1007/s00253-016-7375-1
|
| [14] |
Jiang GZ, Yao MD, Wang Y, et al. Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae. Metab Eng, 2017, 41: 57-66. DOI:10.1016/j.ymben.2017.03.005
|
| [15] |
Guo WH, Sheng JY, Zhao HM, et al. Metabolic engineering of Saccharomyces cerevisiae to produce 1-hexadecanol from xylose. Microb Cell Fact, 2016, 15: 24. DOI:10.1186/s12934-016-0423-9
|
| [16] |
Kwak S, Kim SR, Xu HQ, et al. Enhanced isoprenoid production from xylose by engineered Saccharomyces cerevisiae. Biotechnol Bioeng, 2017, 114(11): 2581-2591. DOI:10.1002/bit.26369
|
| [17] |
Turner TL, Zhang GC, Kim SR, et al. Lactic acid production from xylose by engineered Saccharomyces cerevisiae without PDC or ADH deletion. Appl Microbiol Biotechnol, 2015, 99(19): 8023-8033. DOI:10.1007/s00253-015-6701-3
|
| [18] |
Kildegaard KR, Wang Z, Chen Y, et al. Production of 3-hydroxypropionic acid from glucose and xylose by metabolically engineered Saccharomyces cerevisiae. Metab Eng Commun, 2015, 2: 132-136. DOI:10.1016/j.meteno.2015.10.001
|
| [19] |
汪城墙, 李洪兴, 徐丽丽, 等. 酿酒酵母戊糖转运蛋白及C6/C5共代谢菌株的研究进展. 生物工程学报, 2018, 34(10): 1543-1555. Wang CQ, Li HX, Xu LL, et al. Progress in research of pentose transporters and C6/C5 co-metabolic strains in Saccharomyces cerevisiae. Chin J Biotechnol, 2018, 34(10): 1543-1555 (in Chinese). |
| [20] |
Wang CQ, Bao XM, Li YW, et al. Cloning and characterization of heterologous transporters in Saccharomyces cerevisiae and identification of important amino acids for xylose utilization. Metab Eng, 2015, 30: 79-88. DOI:10.1016/j.ymben.2015.04.007
|
| [21] |
Farwick A, Bruder S, Schadeweg V, et al. Engineering of yeast hexose transporters to transport D-xylose without inhibition by D-glucose. Proc Natl Acad Sci USA, 2014, 111(14): 5159-5164. DOI:10.1073/pnas.1323464111
|
| [22] |
Wang M, Yu CZ, Zhao HM. Directed evolution of xylose specific transporters to facilitate glucose-xylose co-utilization. Biotechnol Bioeng, 2016, 113(3): 484-491. DOI:10.1002/bit.25724
|
| [23] |
Li XW, Chen Y, Nielsen J. Harnessing xylose pathways for biofuels production. Curr Opin Biotechnol, 2019, 57: 56-65. DOI:10.1016/j.copbio.2019.01.006
|
| [24] |
Bator I, Wittgens A, Rosenau F, et al. Comparison of three xylose pathways in Pseudomonas putida KT2440 for the synthesis of valuable products. Front Bioeng Biotechnol, 2020, 7: 480. DOI:10.3389/fbioe.2019.00480
|
| [25] |
Salusjärvi L, Toivari M, Vehkomäki ML, et al. Production of ethylene glycol or glycolic acid from D-xylose in Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 2017, 101(22): 8151-8163. DOI:10.1007/s00253-017-8547-3
|
| [26] |
Toivari M, Nygård Y, Kumpula EP, et al. Metabolic engineering of Saccharomyces cerevisiae for bioconversion of D-xylose to D-xylonate. Metab Eng, 2012, 14(4): 427-436. DOI:10.1016/j.ymben.2012.03.002
|
| [27] |
Wasserstrom L, Portugal-Nunes D, Almqvist H, et al. Exploring D-xylose oxidation in Saccharomyces cerevisiae through the Weimberg pathway. AMB Express, 2018, 8(1): 33. DOI:10.1186/s13568-018-0564-9
|
| [28] |
Cam Y, Alkim C, Trichez D, et al. Engineering of a synthetic metabolic pathway for the assimilation of (D)-xylose into value-added chemicals. ACS Synth Biol, 2015, 5(7): 607-618.
|
| [29] |
Pereira B, Li ZJ, De Mey M, et al. Efficient utilization of pentoses for bioproduction of the renewable two-carbon compounds ethylene glycol and glycolate. Metab Eng, 2016, 34: 80-87. DOI:10.1016/j.ymben.2015.12.004
|
| [30] |
Uranukul B, Woolston BM, Fink GR, et al. Biosynthesis of monoethylene glycol in Saccharomyces cerevisiae utilizing native glycolytic enzymes. Metab Eng, 2019, 51: 20-31. DOI:10.1016/j.ymben.2018.09.012
|
| [31] |
Chomvong K, Bauer S, Benjamin DI, et al. Bypassing the pentose phosphate pathway: towards modular utilization of xylose. PLoS ONE, 2016, 11(6): e0158111. DOI:10.1371/journal.pone.0158111
|
| [32] |
Ghosh A, Zhao HM, Price ND. Genome-scale consequences of cofactor balancing in engineered pentose utilization pathways in Saccharomyces cerevisiae. PLoS ONE, 2017, 6(11): e27316.
|
| [33] |
Lee SH, Kodaki T, Park YC, et al. Effects of NADH-preferring xylose reductase expression on ethanol production from xylose in xylose-metabolizing recombinant Saccharomyces cerevisiae. J Biotechnol, 2012, 158(4): 184-191. DOI:10.1016/j.jbiotec.2011.06.005
|
| [34] |
Krahulec S, Klimacek M, Nidetzky B. Analysis and prediction of the physiological effects of altered coenzyme specificity in xylose reductase and xylitol dehydrogenase during xylose fermentation by Saccharomyces cerevisiae. J Biotechnol, 2012, 158(4): 192-202. DOI:10.1016/j.jbiotec.2011.08.026
|
| [35] |
Zhang GC, Liu JJ, Ding WT. Decreased xylitol formation during xylose fermentation in Saccharomyces cerevisiae due to overexpression of water-forming NADH oxidase. Appl Environ Microbiol, 2012, 78(4): 1081-1086. DOI:10.1128/AEM.06635-11
|
| [36] |
Xia PF, Zhang GC, Walker B, et al. Recycling carbon dioxide during xylose fermentation by engineered Saccharomyces cerevisiae. ACS Synth Biol, 2017, 6(2): 276-283. DOI:10.1021/acssynbio.6b00167
|
| [37] |
Hou J, Shen Y, Jiao CL, et al. Characterization and evolution of xylose isomerase screened from the bovine rumen metagenome in Saccharomyces cerevisiae. J Biosci Bioeng, 2016, 121(2): 160-165. DOI:10.1016/j.jbiosc.2015.05.014
|
| [38] |
Lee SM, Jellison T, Alper HS. Directed evolution of xylose isomerase for improved xylose catabolism and fermentation in the yeast Saccharomyces cerevisiae. Appl Environ Microbiol, 2012, 78(16): 5708-5716. DOI:10.1128/AEM.01419-12
|
| [39] |
Zhou H, Cheng JS, Wang BL, et al. Xylose isomerase overexpression along with engineering of the pentose phosphate pathway and evolutionary engineering enable rapid xylose utilization and ethanol production by Saccharomyces cerevisiae. Metab Eng, 2012, 14(6): 611-622. DOI:10.1016/j.ymben.2012.07.011
|
| [40] |
Hoang PTN, Ko JK, Gong G, et al. Genomic and phenotypic characterization of a refactored xylose-utilizing Saccharomyces cerevisiae strain for lignocellulosic biofuel production. Biotechnol Biofuels, 2018, 11: 268. DOI:10.1186/s13068-018-1269-7
|
| [41] |
Diao LY, Liu YM, Qian FH, et al. Construction of fast xylose-fermenting yeast based on industrial ethanol-producing diploid Saccharomyces cerevisiae by rational design and adaptive evolution. BMC Biotechnol, 2013, 13: 110. DOI:10.1186/1472-6750-13-110
|
| [42] |
Xu HQ, Kim S, Sorek H, et al. PHO13 deletion-induced transcriptional activation prevents sedoheptulose accumulation during xylose metabolism in engineered Saccharomyces cerevisiae. Metab Eng, 2016, 34: 88-96. DOI:10.1016/j.ymben.2015.12.007
|
| [43] |
Sato TK, Tremaine M, Parreiras LS, et al. Directed evolution reveals unexpected epistatic interactions that alter metabolic regulation and enable anaerobic xylose use by Saccharomyces cerevisiae. PLoS Genet, 2016, 12(10): e1006372. DOI:10.1371/journal.pgen.1006372
|
| [44] |
Osiro KO, Borgström C, Brink DP, et al. Exploring the xylose paradox in Saccharomyces cerevisiae through in vivo sugar signalomics of targeted deletants. Microb Cell Fact, 2019, 18: 88. DOI:10.1186/s12934-019-1141-x
|
| [45] |
Nijland JG, Shin HY, Boender LGM, et al. Improved xylose metabolism by a CYC8 mutant of Saccharomyces cerevisiae. Appl Environ Microbiol, 2017, 83(11): e00095-17.
|
| [46] |
Shin M, Kim SR. Metabolic changes induced by deletion of transcriptional regulator GCR2 in xylose-fermenting Saccharomyces cerevisiae. Microorganisms, 2020, 8(10): 1499. DOI:10.3390/microorganisms8101499
|
| [47] |
Dos Santos LV, Carazzolle MF, Nagamatsu ST, et al. Unraveling the genetic basis of xylose consumption in engineered Saccharomyces cerevisiae strains. Sci Rep, 2016, 6: 38676. DOI:10.1038/srep38676
|
| [48] |
Gonçalves DL, Matsushika A, De Sales BB, et al. Xylose and xylose/glucose co-fermentation by recombinant Saccharomyces cerevisiae strains expressing individual hexose transporters. Enzyme Microb Technol, 2014, 63: 13-20. DOI:10.1016/j.enzmictec.2014.05.003
|
| [49] |
Sharma NK, Behera S, Arora R, et al. Xylose transport in yeast for lignocellulosic ethanol production: Current status. J Biosci Bioeng, 2018, 125(3): 259-267. DOI:10.1016/j.jbiosc.2017.10.006
|
| [50] |
Kwak S, Jo JH, Yun EJ, et al. Production of biofuels and chemicals from xylose using native and engineered yeast strains. Biotechnol Adv, 2019, 37(2): 271-283. DOI:10.1016/j.biotechadv.2018.12.003
|
| [51] |
Jiang Y, Shen Y, Gu LC, et al. Identification and characterization of an efficient D-xylose transporter in Saccharomyces cerevisiae. J Agric Food Chem, 2020, 68(9): 2702-2710. DOI:10.1021/acs.jafc.9b07113
|
| [52] |
Nijland JG, Shin HY, De Jong RM, et al. Engineering of an endogenous hexose transporter into a specific D-xylose transporter facilitates glucose-xylose co-consumption in Saccharomyces cerevisiae. Biotechnol Biofuels, 2014, 7: 168. DOI:10.1186/s13068-014-0168-9
|
| [53] |
Fiaux J, Cakar ZP, Sonderegger M, et al. Metabolic-flux profiling of the yeasts Saccharomyces cerevisiae and Pichia stipitis. Eukaryot Cell, 2003, 2(1): 170-180. DOI:10.1128/EC.2.1.170-180.2003
|
| [54] |
Gombert AK, Dos Santos MM, Christensen M, et al. Network identification and flux quantification in the central metabolism of Saccharomyces cerevisiae under different conditions of glucose repression. J Bacteriol, 2001, 183(4): 1441-1451. DOI:10.1128/JB.183.4.1441-1451.2001
|
| [55] |
Matsushika A, Goshima T, Hoshino T. Transcription analysis of recombinant industrial and laboratory Saccharomyces cerevisiae strains reveals the molecular basis for fermentation of glucose and xylose. Microb Cell Fact, 2014, 13: 16. DOI:10.1186/1475-2859-13-16
|
| [56] |
Kuyper M, Hartog MMP, Toirkens MJ, et al. Metabolic engineering of a xylose-isomerase- expressing Saccharomyces cerevisiae strain for rapid anaerobic xylose fermentation. FEMS Yeast Res, 2005, 5(4/5): 399-409.
|
| [57] |
De Las Heras AM, Portugal-Nunes DJ, Rizza N, et al. Anaerobic poly-3-D-hydroxybutyrate production from xylose in recombinant Saccharomyces cerevisiae using a NADH-dependent acetoacetyl-CoA reductase. Microb Cell Fact, 2016, 15: 197. DOI:10.1186/s12934-016-0598-0
|
| [58] |
Matsushika A, Nagashima A, Goshima T, et al. Fermentation of xylose causes inefficient metabolic state due to carbon/energy starvation and reduced glycolytic flux in recombinant industrial Saccharomyces cerevisiae. PLoS ONE, 2013, 8(7): e69005. DOI:10.1371/journal.pone.0069005
|
| [59] |
Brink DP, Borgström C, Tueros FG, et al. Real-time monitoring of the sugar sensing in Saccharomyces cerevisiae indicates endogenous mechanisms for xylose signaling. Microb Cell Fact, 2016, 15: 183. DOI:10.1186/s12934-016-0580-x
|
| [60] |
Salusjärvi L, Kankainen M, Soliymani R, et al. Regulation of xylose metabolism in recombinant Saccharomyces cerevisiae. Microb Cell Fact, 2008, 7: 18. DOI:10.1186/1475-2859-7-18
|
| [61] |
Souto-Maior AM, Runquist D, Hahn-Hägerdal B. Crabtree-negative characteristics of recombinant xylose-utilizing Saccharomyces cerevisiae. J Biotechnol, 2009, 143(2): 119-123. DOI:10.1016/j.jbiotec.2009.06.022
|
| [62] |
Zampar GG, Kümmel A, Ewald J, et al. Temporal system-level organization of the switch from glycolytic to gluconeogenic operation in yeast. Mol Syst Biol, 2013, 9(1): 651. DOI:10.1038/msb.2013.11
|
| [63] |
Bergdahl B, Heer D, Sauer U, et al. Dynamic metabolomics differentiates between carbon and energy starvation in recombinant Saccharomyces cerevisiae fermenting xylose. Biotechnol Biofuels, 2012, 5: 34. DOI:10.1186/1754-6834-5-34
|
| [64] |
Rosas-Lemus M, Uribe-Alvarez C, Chiquete-Félix N, et al. In Saccharomyces cerevisiae fructose-1, 6-bisphosphate contributes to the Crabtree effect through closure of the mitochondrial unspecific channel. Arch Biochem Biophys, 2014, 555-556: 66-70. DOI:10.1016/j.abb.2014.05.027
|
| [65] |
Wahlbom CF, Otero RRC, Van Zyl WH, et al. Molecular analysis of a Saccharomyces cerevisiae mutant with improved ability to utilize xylose shows enhanced expression of proteins involved in transport, initial xylose metabolism, and the pentose phosphate pathway. Appl Environ Microbiol, 2003, 69(2): 740-746. DOI:10.1128/AEM.69.2.740-746.2003
|
| [66] |
Belinchón MM, Gancedo JM. Xylose and some non-sugar carbon sources cause catabolite repression in Saccharomyces cerevisiae. Arch Microbiol, 2003, 180(4): 293-297. DOI:10.1007/s00203-003-0593-9
|
| [67] |
Salusjärvi L, Pitkänen JP, Aristidou A, et al. Transcription analysis of recombinant Saccharomyces cerevisiae reveals novel responses to xylose. Appl Biochem Biotechnol, 2006, 128(3): 237-261. DOI:10.1385/ABAB:128:3:237
|
| [68] |
Nielsen J. Synthetic biology for engineering acetyl coenzyme A metabolism in yeast. mBio, 2014, 5(6): e02153.
|
| [69] |
Feng XY, Lian JZ, Zhao HM. Metabolic engineering of Saccharomyces cerevisiae to improve 1-hexadecanol production. Metab Eng, 2015, 27: 10-19. DOI:10.1016/j.ymben.2014.10.001
|
| [70] |
Branson JP, Nezic M, Jitrapakdee S, et al. Kinetic characterization of yeast pyruvate carboxylase isozyme Pyc1 and the Pyc1 mutant, C249A. Biochemistry, 2004, 43(4): 1075-1081. DOI:10.1021/bi035575y
|
| [71] |
Zhang YF, Lane S, Chen JM, et al. Xylose utilization stimulates mitochondrial production of isobutanol and 2-methyl-1-butanol in Saccharomyces cerevisiae. Biotechnol Biofuels, 2019, 12: 223. DOI:10.1186/s13068-019-1560-2
|
| [72] |
Brat D, Boles E. Isobutanol production from D-xylose by recombinant Saccharomyces cerevisiae. FEMS Yeast Res, 2013, 13(2): 241-244. DOI:10.1111/1567-1364.12028
|
| [73] |
Promdonkoy P, Siripong W, Downes JJ, et al. Systematic improvement of isobutanol production from D-xylose in engineered Saccharomyces cerevisiae. AMB Expr, 2019, 9: 160. DOI:10.1186/s13568-019-0885-3
|
| [74] |
Chen X, Nielsen KF, Borodina I, et al. Increased isobutanol production in Saccharomyces cerevisiae by overexpression of genes in valine metabolism. Biotechnol Biofuels, 2011, 4: 21. DOI:10.1186/1754-6834-4-21
|
| [75] |
Lane S, Zhang YF, Yun EJ, et al. Xylose assimilation enhances the production of isobutanol in engineered Saccharomyces cerevisiae. Biotechnol Bioeng, 2020, 117(2): 372-381. DOI:10.1002/bit.27202
|
| [76] |
Borja GM, Rodriguez A, Campbell K, et al. Metabolic engineering and transcriptomic analysis of Saccharomyces cerevisiae producing p-coumaric acid from xylose. Microb cell fact, 2019, 18: 191. DOI:10.1186/s12934-019-1244-4
|
| [77] |
Sandström AG, De Las Heras AM, Portugal-Nunes D, et al. Engineering of Saccharomyces cerevisiae for the production of poly-3-D-hydroxybutyrate from xylose. AMB Expr, 2015, 5: 14. DOI:10.1186/s13568-015-0100-0
|
| [78] |
Kim SJ, Seo SO, Park YC, et al. Production of 2, 3-butanediol from xylose by engineered Saccharomyces cerevisiae. J Biotechnol, 2014, 192: 376-382. DOI:10.1016/j.jbiotec.2013.12.017
|
| [79] |
Kim SJ, Sim HJ, Kim JW, et al. Enhanced production of 2, 3-butanediol from xylose by combinatorial engineering of xylose metabolic pathway and cofactor regeneration in pyruvate decarboxylase-deficient Saccharomyces cerevisiae. Bioresour Technol, 2017, 245: 1551-1557. DOI:10.1016/j.biortech.2017.06.034
|
| [80] |
尤迪, 叶邦策. 从翻译后修饰角度解析人工合成途径与底盘细胞的适配性. 合成生物学, 2020, 1(2): 212-225. You D, Ye BC. Compatibility between synthetic pathway and chassis cells from the viewpoint of post-translational modifications. Synth Biol J, 2020, 1(2): 212-225 (in Chinese). |
| [81] |
Wu ML, Li HX, Wei S, et al. Simulating extracellular glucose signals enhances xylose metabolism in recombinant Saccharomyces cerevisiae. Microorganisms, 2020, 8(1): 100. DOI:10.3390/microorganisms8010100
|
| [82] |
高教琪, 周雍进. 甲醇生物转化的机遇与挑战. 合成生物学, 2020, 1(2): 158-173. Gao JQ, Zhou YJ. Advances in methanol bio-transformation. Synth Biol J, 2020, 1(2): 158-173 (in Chinese). |
| [83] |
于政, 申晓林, 孙新晓, 等. 动态调控策略在代谢工程中的应用研究进展. 合成生物学, 2020, 1(4): 440-453. Yu Z, Shen XL, Sun XX, et al. Application of dynamic regulation strategies in metabolic engineering. Synth Biol J, 2020, 1(4): 440-453 (in Chinese). |
| [84] |
Zhang MM, Xiong L, Tang YJ, et al. Enhanced acetic acid stress tolerance and ethanol production in Saccharomyces cerevisiae by modulating expression of the de novo purine biosynthesis genes. Biotechnol Biofuels, 2019, 12: 116. DOI:10.1186/s13068-019-1456-1
|
| [85] |
张克俞, 张明明, 赵心清, 等. 关键基因过表达提高酿酒酵母抑制剂耐受性及乙醇发酵性能. 应用与环境生物学报, 2018, 24(3): 541-546. Zhang KY, Zhang MM, Zhao XQ, et al. Improvement of inhibitor stress tolerance and ethanol fermentation of Saccharomyces cerevisiae by overexpression of novel key genes. Chin J Appl Environ Biol, 2018, 24(3): 541-546 (in Chinese). |
 2021, Vol. 37
2021, Vol. 37




