
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈玥, 周景文, 陈坚
- Chen Yue, Zhou Jingwen, Chen Jian
- 维生素C生物合成相关脱氢酶研究进展
- Progress in vitamin C biosynthesis related dehydrogenases
- 生物工程学报, 2021, 37(6): 1827-1844
- Chinese Journal of Biotechnology, 2021, 37(6): 1827-1844
- 10.13345/j.cjb.200449
-
文章历史
- Received: July 24, 2020
- Accepted: October 28, 2020
2. 江南大学 未来食品科学中心,江苏 无锡 214122
2. Science Center for Future Foods, Jiangnan University, Wuxi 214122, Jiangsu, China
维生素C (Vitamin C,VC) 又称抗坏血酸(L-ascorbic acid,L-AA),是人体必需的一种维生素,广泛应用于食品制药等领域,全球市场在10万t/年以上[1]。维生素C是天然产物生物合成的典型案例。目前,几乎所有的维生素C都是通过生物发酵法生产获得。研究较多的维生素C的生物合成路线主要有山梨糖途径和葡萄糖酸途径(图 1)。

|
| 图 1 维生素C主要的生物合成路线 Fig. 1 The main pathways for the biosynthesis of vitamin C. 1: L-sorbose pathway; 2: D-gluconate pathway; 3: L-idonate pathway; 4: L-gulonate pathway. |
| |
山梨糖途径以中间产物山梨糖为标志。目前工业上主要使用的“二步发酵法”,即是采用山梨糖途径。在这一途径中,氧化葡萄糖酸杆菌Gluconobacter oxydans中的山梨醇脱氢酶(Sorbitol dehydrogenase,SLDH) 将D-山梨醇氧化生成L-山梨糖,然后通过巨大芽孢杆菌Bacillus megaterium (俗称大菌)和普通生酮基古龙酸菌Ketogulonicigenium vulgare (俗称小菌) 的混菌发酵,利用小菌中的山梨糖脱氢酶(Sorbose dehydrogenase,SDH或SSDH) 和山梨酮脱氢酶(Sorbosone dehydrogenase,SNDH) 将L-山梨糖氧化生成维生素C的前体物质2-酮基-L-古龙酸(2-keto-L-gulonic acid,2-KLG)[2]。
1.2 葡萄糖酸途径“新二步发酵法”采用的则是葡萄糖酸途径,该途径以中间产物2, 5-二酮基-D-葡萄糖酸为标志,先通过草生欧文氏菌Erwinea herbicola中的葡萄糖脱氢酶(Glucose dehydrogenase,GDH)、葡萄糖酸脱氢酶(Gluconic acid dehydrogenase,GADH) 和2-酮基-D-葡萄糖酸脱氢酶(2-keto-D- gluconic acid dehydrogenase,2-GADH) 将D-葡萄糖顺序氧化生成D-葡萄糖酸、2-酮基-D-葡萄糖酸(2-KGA) 和2, 5-二酮基-D-葡萄糖酸(2, 5-DKGA)[3-4],然后通过谷氨酸棒状杆菌Corynebacterium glutamicum中的2, 5-二酮基-D-葡萄糖酸还原酶(2, 5-diketo-D-gluconic acid reductase,2, 5-DKGR) 将2, 5-二酮基-D-葡萄糖酸还原生成2-酮基-L-古龙酸[5-6]。
1.3 其他途径维生素C的生物合成还有其他一些途径。由于产量和转化率远不及经典的二步发酵法和新二步发酵法,相关研究较少。
1.3.1 艾杜糖途径在醋酸菌等细菌中存在L-艾杜糖途径(L-idonic acid pathway),D-葡萄糖被氧化成D-葡萄糖酸,随后被氧化脱氢形成5-酮基-D-葡萄糖酸,5-酮基-D-葡萄糖酸在细胞内被还原为L-艾杜糖酸,然后L-艾杜糖酸可被进一步氧化生成2-酮基-L-古龙酸[7]。
1.3.2 古龙酸途径与L-艾杜糖酸途径不同的是,在L-古龙酸途径(L-gulonic acid pathway) 中,5-酮基-D-葡萄糖酸不是被还原生成L-艾杜糖酸,而是被还原生成L-古龙酸,进而被氧化生成2-酮基-L-古龙酸[7]。
1.3.3 植物中的维生素C合成途径在植物中,维生素C的合成途径从D-葡萄糖开始,通过6-磷酸-葡萄糖等9步反应,直接生成维生素C[1]。整个途径只有最后两步反应涉及脱氢酶,分别是L-半乳糖脱氢酶催化L-半乳糖生成L-半乳糖内酯,然后L-半乳糖内酯脱氢酶催化L-半乳糖内酯生成维生素C。
1.3.4 动物中的维生素C合成途径在动物中,维生素C的合成途径从D-葡萄糖开始,通过6-磷酸-葡萄糖等8步反应,直接生成维生素C[1]。动物中维生素C合成途径的最后两步反应和植物相同,不同的是,在动物中维生素C的合成还额外需要一个UDP-葡萄糖脱氢酶参与反应。
2 维生素C生物合成相关脱氢酶的特点维生素C生物合成的山梨糖途径和葡萄糖酸途径中,共有7种关键脱氢酶参与了2-酮基-L-古龙酸的合成,分别是山梨醇脱氢酶、山梨糖脱氢酶、山梨酮脱氢酶、葡萄糖脱氢酶、葡萄糖酸脱氢酶、2-酮基-D-葡萄糖酸脱氢酶、2, 5-二酮基-D-葡萄糖酸还原酶。这些酶的详细信息如表 1所示。根据这些关键脱氢酶的蛋白序列,通过SMART网站对其结构信息进行了分析[41],其结果如图 2所示。
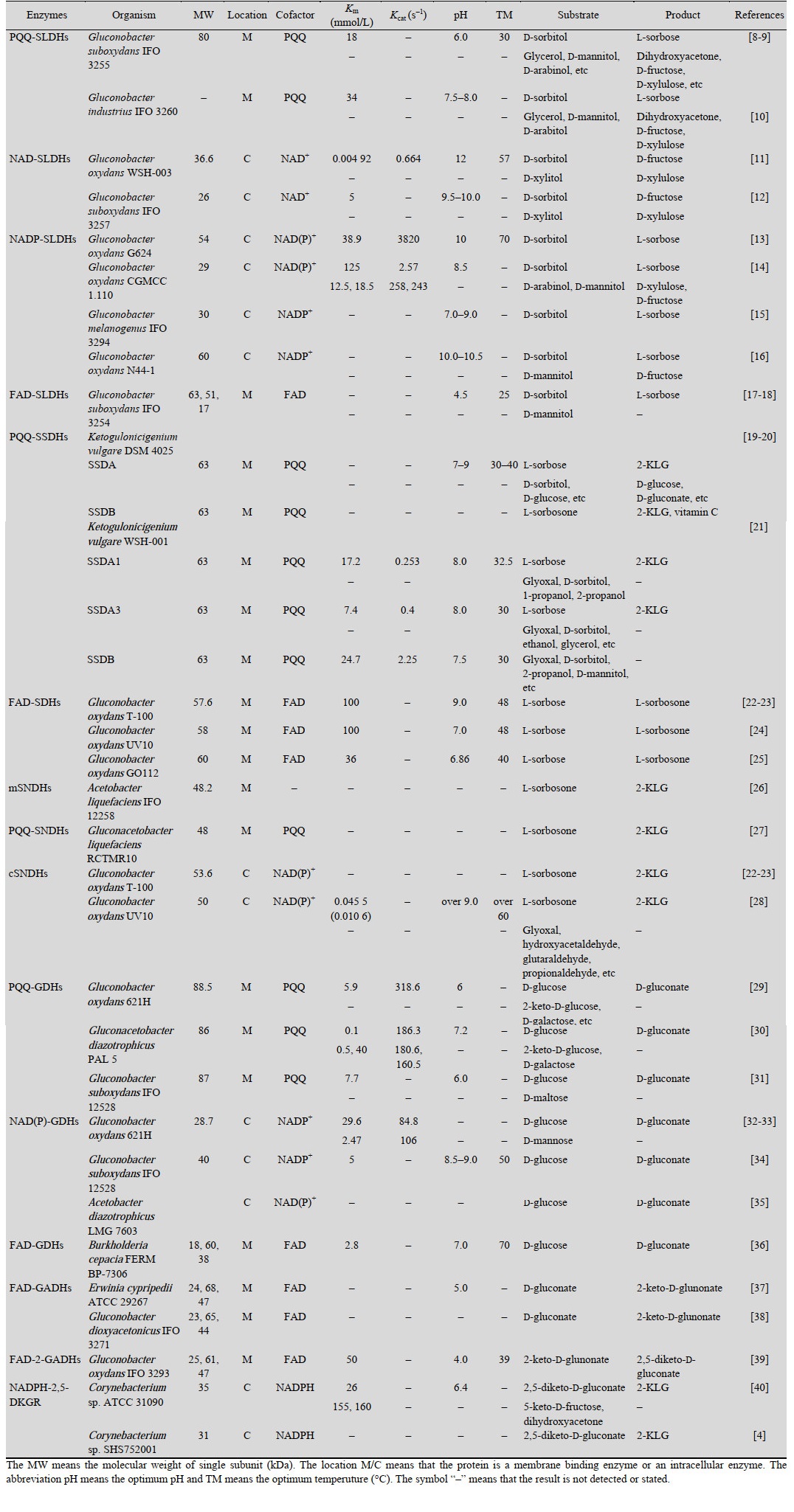
|

|
| 图 2 维生素C合成关键酶的结构预测 Fig. 2 The structure prediction of related dehydrogenases in the biosynthesis of vitamin C. The prediction was conducted by the website SMART. The dehydrogenases listed were PQQ-SLDH (GenBank Accession No. AB065091), NAD-SLDHs (GenBank Accession No. JH668179), NADP-SLDHs (GenBank Accession No. KU535615), FAD-SLDHs (GenBank Accession No. AB039821), PQQ-SSDA1 (GenBank Accession No. AB092515), PQQ-SSDA2 (GenBank Accession No. AB092516), PQQ-SSDA3 (GenBank Accession No. AB092517), PQQ-SSDB (GenBank Accession No. AB092518), FAD-SDHs (GenBank Accession No. AR008349), mSNDHs (GenBank Accession No. D28511), PQQ-SNDHs (GenBank Accession No. LC373924), cSNDH (GenBank Accession No. AR008350), PQQ-GDHs (GenBank Accession No. CP000009), NADP-GDH (GenBank Accession No. CP000009), FAD-GDHs (GenBank Accession No. CP013431), FAD-GADHs (GenBank Accession No. U97665), FAD-2-GADHs (GenBank Accession No. AB985494), NADPH-2, 5-DKGR-A (GenBank Accession No. M12799) and NADPH-2, 5-DKGR-B (GenBank Accession No. M21193), respectively. |
| |
山梨糖途径有3个脱氢酶参与,分别是山梨醇脱氢酶、山梨糖脱氢酶和山梨酮脱氢酶。如图 3所示,山梨糖途径中相关脱氢酶分布大多位于细胞膜上,以PQQ (Pyrroloquinoline quinone) 为辅因子,具有较高的催化效率。但同时,山梨糖途径中的脱氢酶也普遍具有底物专一性差、电子传递途径复杂等特点。

|
| 图 3 山梨糖途径相关脱氢酶分布示意图 Fig. 3 The location of related dehydrogenases in L-sorbose pathway. |
| |
氧化葡萄糖酸杆菌中发挥主要作用的山梨醇脱氢酶是位于细胞膜上的PQQ依赖的山梨醇脱氢酶(PQQ-SLDHs)[8, 42]。该酶由两个亚基组成,最早在1985年由Ameyama等纯化得到[10],由基因sldBA编码[43]。小亚基sldB负责山梨醇脱氢酶在膜上的定位,大亚基sldA包含一个信号肽序列,主要负责D-山梨醇到L-山梨糖的催化功能。除此以外,氧化葡萄糖酸杆菌的细胞膜上还存在一种FAD (Flavin adenine dinucleotide) 依赖的山梨醇脱氢酶(FAD-SLDHs)[44],FAD-SLDHs也催化D-山梨醇生成L-山梨糖,由3个亚基组成:小亚基sldS、大亚基sldL和一个细胞色素c亚基sldC[45]。
普通生酮基古龙酸菌(小菌) 来源的山梨糖脱氢酶是一种膜结合的以PQQ为辅因子的山梨糖脱氢酶(PQQ-SDHs),因为该酶具有山梨糖脱氢酶和山梨酮脱氢酶的双重活性,能够在体外添加PQQ和电子受体PMS的情况下,直接催化L-山梨糖生成2-酮基-L-古龙酸,而不积累L-山梨酮[19, 21],因此该酶也被称作PQQ依赖的山梨糖-山梨酮脱氢酶(PQQ-SSDHs)。在普通生酮基古龙酸菌DSM 4025基因组中,一共有4个ssdh,分别为ssda1 (GenBank登录号:AB092515.1)、ssda2 (GenBank登录号:AB092516.1)、ssda3 (GenBank登录号:AB092517.1) 和ssdb (GenBank登录号:AB092518.1),均位于细胞膜上[46-47]。在普通生酮基古龙酸菌WSH-001基因组(GenBank登录号:CP002018.1) 中发现有5个ssdh,分别是位于基因组上的KVU_2159 (ssda1)、KVU_2142 (ssda2)、KVU_0203 (ssda3) 和KVU_1366 (ssdb),以及位于内源质粒(GenBank登录号:CP002020.1) 上的KVU_PA0245 (ssda1)[48-49],这5个PQQ-SSDHs均属于膜结合蛋白。在普通生酮基古龙酸菌WSH-001基因组中还存在另外2个山梨酮脱氢酶GSNDH (Glucose/sorbosone dehydrogenase) 和SNDH (Sorbosone dehydrogenase),通过序列预测发现这2个山梨酮脱氢酶具有疏水跨膜结构,可能是膜结合蛋白[21, 49]。与普通生酮基古龙酸菌来源的山梨糖脱氢酶不同,在氧化葡萄糖酸杆菌UV10[24]和氧化葡萄糖酸杆菌T-100[23]中,还存在一种膜结合的山梨糖脱氢酶SDH。此外,还有少量其他来源的膜结合山梨酮脱氢酶(SNDH) 的报道,如Shinjoh等在1994年发现液化醋杆菌Acetobacter liquefaciens中的膜结合的山梨酮脱氢酶(mSNDH)[26],Yakushi等在2020年发现一种PQQ依赖的膜结合山梨酮脱氢酶(PQQ-mSNDH)[27]。
在氧化葡萄糖酸杆菌中,存在2种胞内的山梨醇脱氢酶,分别是NAD (Nicotinamide adenine dinucleotide) 依赖的山梨醇脱氢酶(NAD-SLDHs)[50]和NADP (Nicotinamide adenine dinucleotide phosphate) 依赖的山梨醇脱氢酶(NADP-SLDHs)[51]。其中,NAD-SLDHs可催化D-山梨醇生成D-果糖,NADP-SLDHs又被称作L-山梨糖还原酶,在胞内催化D-山梨醇生成L-山梨糖。同时,在氧化葡萄糖酸杆菌UV10[28]和氧化葡萄糖酸杆菌T-100[23]中,都分离得到一种胞内的NAD(P) 依赖的山梨酮脱氢酶(cSNDH),且二者在催化性质上很类似[23]。
2.1.2 山梨糖途径脱氢酶的底物专一性不高氧化葡萄糖酸杆菌来源的PQQ-SLDHs也被称为甘油脱氢酶,主要氧化具有R构型的2号碳位置的羟基,能氧化多种多元醇,如阿拉伯糖醇、山梨醇、甘露醇、赤藓糖醇和核糖醇等生成相对应的酮或糖[43]。同时,该酶也催化D-葡萄糖酸生成5-酮基-D-葡萄糖酸[9]。普通生酮基古龙酸菌来源的PQQ-SSDHs也具有广泛的底物谱。如普通生酮基古龙酸菌DSM 4025来源的SSDA1、SSDA2和SSDA3除了正常催化L-山梨糖生成L-山梨酮或者2-酮基-L-古龙酸外,也可以催化D-山梨醇生成D-葡萄糖或者L-古洛糖[46],而SSDB可以催化D-山梨醇生成L-山梨糖[47]。王盼盼等使用显色法对普通生酮基古龙酸菌WSH-001来源的PQQ-SSDHs和SNDHs进行了底物谱分析[21],结果发现WSH-001中的PQQ-SSDHs能催化D-山梨醇、L-山梨糖、乙二醛、甲醇、乙醇、甘油、1-丙醇、2-丙醇、D-甘露醇、肌醇、D-木糖醇、D-葡萄糖、D-半乳糖、D-甘露糖、D-木糖、D-鼠李糖、D-果糖、D-葡萄糖酸盐、D-葡萄糖醛酸、δ-葡萄糖酸内酯等底物,SSDA1、SSDA1-P、SSDA2和SSDB的最适底物是乙二醛,而SSDA3的最适底物是1-丙醇,其中SSDA3对于L-山梨糖的催化活性高于其余的PQQ-SSDHs。造成这些PQQ依赖的膜脱氢酶底物专一性不高的原因,一个可能的解释是这些PQQ依赖的脱氢酶大部分拥有半开放式的底物结合口袋,只要底物分子靠近这个口袋就可以催化反应,而不像其他脱氢酶,底物结合口袋在脱氢酶的内部,需要底物完全进入底物结合口袋才可以进行催化作用[52]。弱氧化葡萄糖酸杆菌IFO 3257来源的NAD-SLDHs可以分别催化D-山梨醇或木糖醇生成L-山梨糖或D-木酮糖[12]。来源于WSH-001的2个山梨酮脱氢酶GSNDH和SNDH在底物谱上非常相似,都能同乙二醛、D-葡萄糖、D-半乳糖、D-甘露糖、D-木糖、D-鼠李糖和D-乳糖发生反应,而不与D-山梨醇、L-山梨糖、D-果糖反应[21]。而且,这两个山梨酮脱氢酶都被报道可以催化L-山梨酮直接合成维生素C[47]。氧化葡萄糖酸杆菌UV10[28]和氧化葡萄糖酸杆菌T-100[23]来源的cSNDH都属于乙醛脱氢酶家族,可以催化乙二醛、戊二醛、乙醛、丙醛等底物,但其最适底物都为L-山梨酮。
特殊的是,氧化葡萄糖酸杆菌UV10[28]、T-100[20]和WSH-004[72]来源的FAD依赖的山梨糖脱氢酶(FAD-SDHs),则与普通生酮基古龙酸菌来源的PQQ-SSDHs不同,具有很高的底物专一性,只与L-山梨糖发生反应,而不与葡萄糖、山梨醇、果糖等反应。这种很高的底物专一性,对于利用其构建一步发酵菌株,具有重要意义。
2.1.3 山梨糖途径脱氢酶的辅因子多数是PQQ氧化葡萄糖酸杆菌来源的PQQ-SLDHs是催化D-山梨醇生成L-山梨糖的主要的脱氢酶[8, 42],普通生酮基古龙酸菌来源的PQQ-SSDHs、GSNDH及SNDH是糖酸转化过程中最关键的脱氢酶[49],二者都以PQQ为辅因子。同时Yakushi等也报道了一种氧化葡萄糖酸杆菌来源的PQQ-mSNDH[27]。
氧化葡萄糖酸杆菌细胞膜上存在FAD-SLDHs,该酶不是D-山梨醇到L-山梨糖转化的关键酶,且只在高浓度的D-山梨醇存在时发挥作用[44-45]。氧化葡萄糖酸杆菌细胞膜中还存在FAD-SDHs[23-24],这是少数氧化葡萄糖酸杆菌能够产2-KLG的关键酶。此外,氧化葡萄糖酸杆菌细胞内的NAD-SLDHs[50]和NADP-SLDHs[51]分别以NAD+和NADP+为辅因子,cSNDH[23, 28]以NAD(P)+为辅因子。
2.1.4 脱氢酶电子传递途径复杂山梨糖途径中大部分脱氢酶的电子传递都与呼吸链偶联[53-54],研究发现这些脱氢酶的电子传递途径以及脱氢酶与呼吸链的偶联方式存在很大差异。Ameyama等发现,在氧化葡萄糖酸杆菌中,PQQ- SLDHs将电子传递给泛醌[55],最终可能传递给细胞色素bo3末端氧化酶[44],而FAD-SLDHs则是最终将电子传递给细胞色素C (Cytochrome c551)[17]或者氰化物不敏感的末端氧化酶(Cyanide-insensitive terminal oxidase,CIO)[44]。韩晓东等通过对普通生酮基古龙酸菌Y25来源的PQQ-SSDHs晶体结构的解析,发现其下游电子传递载体是cytochrome c551,可能进而将电子传递给cytochrome c552,最终传递给细胞色素c氧化酶[56]。常用电子传递载体吩嗪硫酸甲酯(Phenazine methosulfate,PMS) 和二氯酚靛酚(2, 6-dichlorophenol indophenol,DCIP) 对大部分脱氢酶都具有促进作用,如氧化葡萄糖酸杆菌UV10来源的FAD-SDHs,在电子传递载体PMS存在的条件下,可以直接催化L-山梨糖生成L-山梨酮,而不需要添加其他辅因子[24]。王盼盼等通过对普通生酮基古龙酸菌WSH-001中的PQQ-SSDHs进行研究,发现PMS或者DCIP对于SSDA1和SSDA3的活性有促进作用,铁氰化钾(K3[Fe(CN)6]) 能够提高SSDA1和SSDA3的酶活,却对SSDA1-P、SSDA2和SSDB的活性有抑制作用[21]。综上,虽然对于山梨糖途径中相关脱氢酶的电子传递途径作了许多研究,但是对于其中关键脱氢酶特别是山梨糖脱氢酶电子传递途径的研究还有待深入。同时,如何协调山梨糖途径中相关脱氢酶与呼吸链的偶联以及这些脱氢酶电子传递途径的复杂性,也是后续代谢改造提高2-酮基-L-古龙酸产量不可避免的问题。
2.2 葡萄糖酸途径葡萄糖酸途径有4个酶参与,分别是葡萄糖脱氢酶、葡萄糖酸脱氢酶、2-酮基-D-葡萄糖酸脱氢酶和2, 5-二酮基-D-葡萄糖酸还原酶。如图 4所示,该途径中大部分脱氢酶位于细胞膜上,主要以FAD为辅因子,具有催化活性高和底物特异性高等特点。脱氢反应中的电子主要传递给泛醌。同时,葡萄糖酸途径中PQQ-GDHs结构与PQQ-SLDHs类似,由一个负责定位小亚基和一个负责催化的大亚基组成,都以PQQ为辅因子。

|
| 图 4 葡萄糖酸途径中相关脱氢酶分布示意图 Fig. 4 The location of dehydrogenases in gluconate pathway. |
| |
葡萄糖酸途径中的前3个酶,葡萄糖脱氢酶、葡萄糖酸脱氢酶和2-酮基-D-葡萄糖酸脱氢酶均位于细胞膜上。其中,细胞膜上的PQQ依赖的葡萄糖脱氢酶(PQQ-GDHs) 相对于胞内的NAD为辅因子的葡萄糖脱氢酶(NAD-GDHs) 具有更高的活性[35]。除此,Inose等发现了细胞膜上以FAD为辅因子的葡萄糖脱氢酶(FAD-GDHs)[36],包含小亚基(S)、大亚基(L) 和一个细胞色素c亚基(C)。细胞膜上以FAD为辅因子的葡萄糖酸脱氢酶(FAD-GADHs) 与FAD-SLDHs类似,也由3个亚基组成,包括1个共价结合FAD的大亚基、1个结合3个血红素c的细胞色素亚基和1个对脱氢酶的跨膜[38]和活性[57]必不可少的小亚基。细胞膜上以FAD为辅因子的2-酮基-D-葡萄糖酸脱氢酶(FAD-2-GADH) 在基因结构上与FAD-GADHs类似,也是由3个亚基组成[39]。
2, 5-二酮基-D-葡萄糖酸还原酶(NADPH- 2, 5-DKGR) 是胞内酶,共有两种,分别是由Anderson等[3]和Jeffrey等[40]从谷氨酸棒状杆菌中发现的2, 5-DKGRⅠ (或2, 5-DKGR-A) 和Grindley等[4]发现的2, 5-DKGR Ⅱ (或2, 5-DKGR-B)。二者都在胞内催化2, 5-二酮基-D-葡萄糖酸还原生成2-KLG。
2.2.2 葡萄糖酸途径的脱氢酶底物专一性很高相比于山梨糖途径,葡萄糖酸途径中大部分脱氢酶具有很高的底物专一性,可以避免山梨糖途径中不同脱氢酶对同一底物的竞争问题。因此该途径中脱氢酶可以在一个菌株中同时表达,而不用考虑山梨糖途径中脱氢酶的底物特异性冲突等问题。葡萄糖酸途径中高底物专一性的脱氢酶主要来源于FAD依赖的脱氢酶,如Yamaoka等发现的FAD- GADHs只与D-葡萄糖酸反应,不与其他糖醇和有机酸反应[58]。Shinagawa等发现的FAD-2-GADH只与2-酮基-D-葡萄糖酸反应,不与其他底物反应[39]。
同时,Attwood等发现的PQQ-GDHs能够与麦芽糖[31]、L-阿拉伯糖、D-阿洛糖、杜拉糖和纤维二糖[59]等反应,但是在己糖中PQQ-GDHs只与葡萄糖反应[31]。Miller等发现2, 5-DKGR底物特异性不高,能与底物5-酮基-D-果糖和二羟基丙酮反应,但不与D-果糖、L-山梨糖、5-酮基-D-葡萄糖酸、2-酮基-L-古龙酸、2-酮基-D-葡萄糖酸、丙酮酸或羟基丙酮酸反应[40]。
2.2.3 脱氢酶的辅因子多数是FAD细胞膜上的脱氢酶多以PQQ或者FAD为辅因子,与山梨糖途径中大部分脱氢酶以PQQ为辅因子不同,葡萄糖酸途径中大多数脱氢酶以FAD为辅因子。FAD-GADHs[58]和FAD-2-GADH[39]这两个酶都以FAD作为辅因子,在第一步反应中除了PQQ依赖的PQQ-GDHs外,也存在FAD-GDHs以FAD作为辅因子[36]。
除此,还有胞内的葡萄糖脱氢酶NAD(P)- GDHs以NAD(P)为辅因子[34-35]。而2, 5-DKGR则严格以NADPH为辅因子,以NADH作为辅因子不发生反应[3-4, 40]。
2.2.4 脱氢酶电子传递链类似FAD-GDHs[36]、FAD-GADHs[58]和FAD-2- GADH[39]这几个酶都以FAD作为辅因子,在电子传递上也非常类似,都是先传递电子到辅酶Q,然后传递给泛醇氧化酶(Ubiquinol oxidases,UOX) 或者氰化物不敏感氧化酶(Cyanide-insensitive oxidase,CIO)[58]。PQQ-GDHs似乎可以直接将电子传递给呼吸链甚至电极上[60]。
3 维生素C生物合成相关脱氢酶的应用和改造 3.1 山梨糖途径中相关脱氢酶的应用和改造山梨糖途径中,来源于氧化葡萄糖酸杆菌的PQQ-SLDHs具有很高的活性[8, 42],因此第一步中D-山梨醇到L-山梨糖的转化可以在16 h内达到95%以上[61]。而主要的限速步骤还是在L-山梨糖到2-KLG,即糖酸转化效率上。在之前的研究中,有大量的工作集中在过量表达或者敲除相关脱氢酶上面。
3.1.1 过量表达氧化葡萄糖酸杆菌来源的PQQ-SLDHs普通生酮基古龙酸菌天然利用D-山梨醇生产L-山梨糖的能力很低,因此考虑在普通生酮基古龙酸菌中过表达来自氧化葡萄糖酸杆菌的PQQ-SLDHs,以增强D-山梨醇到L-山梨糖的合成。傅术琳等在普通生酮基古龙酸菌DSM 4025中过表达来自氧化葡萄糖酸杆菌的PQQ-SLDHs,发现2-KLG产量并没有明显提高,但是山梨醇到L-山梨糖的转化以及到2-KLG的转化率有提高,说明氧化葡萄糖酸杆菌来源的PQQ-SLDHs在普通生酮基古龙酸菌中发挥了活性,但是可能PQQ-SLDHs与普通生酮基古龙酸菌细胞膜上电子传递载体不匹配,PQQ-SLDHs没有能够发挥出在氧化葡萄糖酸杆菌中的催化活性[20]。
3.1.2 过量表达普通生酮基古龙酸菌来源的PQQ-SSDHs和(G)SNDH因为大部分氧化葡萄糖酸杆菌都能高效利用D-山梨醇产L-山梨糖,但是基本不能利用L-山梨糖产2-KLG,所以最初的构想是把普通生酮基古龙酸菌中的山梨糖脱氢酶PQQ-SSDHs和山梨酮脱氢酶(G)SNDH在氧化葡萄糖酸杆菌中异源表达,构建能够产2-KLG的一步菌株。高丽丽等通过在氧化葡萄糖酸杆菌WSH-003中组合表达普通生酮基古龙酸菌WSH-001来源的PQQ-SSDHs和(G)SNDH,可以实现单菌一步从D-山梨醇发酵产2-KLG,其中最高的组合KVU_0203和KVU_0095能够达到39.2 g/L[2]。虽然后面课题组作了进一步改造和优化,如不同启动子增强PQQ供给[62]、发酵培养基和发酵过程的优化[63]等,最终产量仍然无法与二步发酵法媲美,可能过表达的PQQ-SSDHs与氧化葡萄糖酸杆菌的PQQ- SLDHs竞争底物D-山梨醇[64]。
异源表达普通生酮基古龙酸菌来源的PQQ- SSDHs和山梨酮脱氢酶(G)SNDH存在许多问题。普通生酮基古龙酸菌的电子呼吸链与新的宿主细胞不一致,表达的PQQ-SSDHs在新宿主可能出现降解现象,如在氧化葡萄糖酸杆菌中就存在部分降解现象,导致普通生酮基古龙酸菌的PQQ-SSDHs在氧化葡萄糖酸杆菌中表达达不到理想的效果[65]。而将普通生酮基古龙酸菌的PQQ- SSDHs在大肠杆菌[66-67]、氧化葡萄糖酸杆菌[68]、乙酸钙不动杆菌[69]、脱氮副球菌[70]等宿主中表达,均发现不能达到在普通生酮基古龙酸菌中的强催化活性。
3.1.3 过量表达氧化葡萄糖酸杆菌的SDH和SNDH虽然大部分氧化葡萄糖酸杆菌都拥有山梨酮-山梨糖脱氢酶(Sndh-sdh) 基因簇,但是只有少数的氧化葡萄糖酸杆菌被报道产2-KLG,如氧化葡萄糖酸杆菌UV10[28]、氧化葡萄糖酸杆菌T-100[23]和氧化葡萄糖酸杆菌WSH-004[71]等。Saito等在氧化葡萄糖酸杆菌G624中过表达氧化葡萄糖酸杆菌T-100来源的sdh-sndh,可以将2-KLG产量提高到16 g/L[23],进一步更换启动子和阻断L-艾杜糖酸途径后,产量达到130 g/L[22],是迄今报道的最高产量。侯伟等在氧化葡萄糖酸杆菌621H中过表达氧化葡萄糖酸杆菌H763来源的sndh-sdh,通过对发酵液进行薄层层析检测,发现能够产2-KLG[72]。
3.1.4 阻断山梨糖途径中副产物途径在氧化葡萄糖酸杆菌中有多个山梨醇脱氢酶,其中胞内NADP依赖的山梨醇脱氢酶NADP-SLDHs[51]又被称作L-山梨糖还原酶,因为其主要显示出L-山梨糖还原酶的活性。将山梨糖还原酶以及其他胞内山梨糖代谢酶敲除可以有效提高从L-山梨糖到2-KLG的转化率[73]。2-KLG在氧化葡萄糖酸杆菌[22, 74]或者普通生酮基古龙酸菌中[75-76]可能存在降解途径生成L-艾杜糖酸,将该途径去除能够有利于2-KLG的积累。
3.2 葡萄糖酸途径中相关脱氢酶的应用和改造葡萄糖酸途径以2, 5-二酮基-D-葡萄糖酸为中间产物,通过野生菌筛选和代谢改造,已经获得能够高产2, 5-二酮基-D-葡萄糖酸的工程菌株[77-79]。因此,葡萄糖酸途径的关键问题是2, 5-二酮基-D-葡萄糖酸到2-KLG的转化过程。围绕这个问题,大量工作集中在2, 5-二酮基-D-葡萄糖酸还原酶的辅因子改造和阻止2, 5-二酮基-D-葡萄糖酸的降解上。
3.2.1 2, 5-二酮基-D-葡萄糖酸还原酶(2, 5-DKGR) 的辅因子供给无论是Anderson等[3]和Jeffrey等[40]从谷氨酸棒状杆菌中发现的2, 5-DKGRⅠ (或者2, 5-DKGR-A),还是Hardy等[4]发现的2, 5-DKGR Ⅱ (或者2, 5-DKGR-B),都严格以NADPH为辅因子。Banta等[80]通过改造得到NADH依赖的2, 5-DKGR,但其活性更偏好NADPH。2, 5-DKGR对于NAD(P)H的依赖使得细胞需要提供和消耗大量的NAD(P)H。而在细胞内,通常NADPH的含量低于NADH,更是远远低于NADP+。要将2, 5-二酮基-D-葡萄糖酸尽量转化为2-KLG需要大量的NADH或NADPH,不然通过2, 5-二酮基-D-葡萄糖酸还原酶的逆反应,积累的2-KLG也可能逆向生成2, 5-二酮基-D-葡萄糖酸。由于NADH和NADPH十分昂贵,不宜直接添加到发酵培养基中,大量的NA(P)DH只能通过辅因子再生改造来提供。有一种思路是将葡萄糖酸途径中第一步PQQ-GDHs部分用NADP-GDHs替代,可以促进NADPH的再生过程,但是这样会降低D-葡萄糖酸的利用效率,延长发酵周期,同时D-葡萄糖酸在胞内还可以通过Entner-Doudoroff pathway等途径[81]被进一步利用,从而整个发酵过程的转化率也会降低。
3.2.2 中间产物2, 5-二酮基-D-葡萄糖酸的降解细菌中存在许多还原酶能够将2, 5-二酮基-D-葡萄糖酸还原成其他副产物,如欧文氏菌中存在两个2-酮基醛糖还原酶,可以同时催化还原2, 5-二酮基-D-葡萄糖酸、2-酮基-L-古龙酸和2-酮基-D-葡萄糖酸的第二位酮基[82]。Yum等在酮体短杆菌也发现2-酮基醛糖还原酶[37]。除了生物酶降解,2, 5-二酮基-D-葡萄糖酸自身稳定性较差[78],对热和碱均敏感。新二步发酵法中,第一步通过欧文氏菌转化得到的2, 5-二酮基-D-葡萄糖酸需要在40 ℃以下的温度中进行除菌和纯化分离以防止其降解,在生产工艺上造成不便。
4 总结与展望通过对维生素C生物合成中山梨糖途径和葡萄糖酸途径中脱氢酶的回顾,我们发现山梨糖途径中普通生酮基古龙酸菌中脱氢酶普遍拥有催化活性高但底物专一性不强的特点,而葡萄糖酸途径中的脱氢酶普遍专一性高,但辅因子再生和中间产物的降解是一个急需解决的问题。普通生酮基古龙酸菌中的PQQ-SSDHs可以竞争利用底物D-山梨醇,这个问题可以通过结构生物学和酶工程等技术对底物结合口袋进行理性设计和改造,获得底物专一性高的PQQ-SSDHs。或者通过代谢调控策略,将D-山梨醇这个底物和PQQ-SSDHs在时空上分开,比如改造更强的山梨醇脱氢酶PQQ-SLDHs或者筛选时序启动子等将PQQ-SSDHs推迟表达,这样可以使氧化葡萄糖酸杆菌尽快将D-山梨醇利用产生L-山梨糖,然后L-山梨糖才与PQQ-SSDHs反应生成2-KLG。同时,因为氧化葡萄糖酸杆菌来源的FAD-SDHs拥有很高的底物特异性,但是酶活不高,可以通过过表达FAD-SDHs或者进行突变筛选和理性设计获得更高活性的FAD-SDHs来提高糖酸转化率[83]。葡萄糖酸途径中的2, 5-二酮基-D-葡萄糖酸转化需要大量NADH或者NADPH,用NADP-GDHs替代PQQ-GDHs,可以促进NADPH的再生过程,但是这样会降低D-葡萄糖酸的利用效率和转化率,需要全局考虑细胞的代谢和辅因子调控过程。结合结构生物学和酶工程等技术,或许也可以通过理性设计和筛选获得不依赖NAD(P)H的2, 5-二酮基-D-葡萄糖酸还原酶。在后续研究工作中,不管是山梨糖途径还是葡萄糖酸途径,都需要结合结构生物学、酶工程和代谢工程等策略,来提高生物技术合成2-KLG的产量、转化率和生产强度。
| [1] |
Wang PP, Zeng WZ, Xu S, et al. Current challenges facing one-step production of L-ascorbic acid. Biotechnol Adv, 2018, 36(7): 1882-1899. DOI:10.1016/j.biotechadv.2018.07.006
|
| [2] |
Gao LL, Hu YD, Liu JC, et al. Stepwise metabolic engineering of Gluconobacter oxydans WSH-003 for the direct production of 2-keto-L-gulonic acid from D-sorbitol. Metab Eng, 2014, 24: 30-37. DOI:10.1016/j.ymben.2014.04.003
|
| [3] |
Anderson S, Marks CB, Lazarus R, et al. Production of 2-keto-L-gulonate, an intermediate in L-ascorbate synthesis, by a genetically modffied Erwinia herbicola. Science, 1985, 230(4722): 144-149. DOI:10.1126/science.230.4722.144
|
| [4] |
Grindley JF, Payton MA, Van De Pol H, et al. Conversion of glucose to 2-keto-L-gulonate, an intermediate in L-ascorbate synthesis, by a recombinant strain of Erwinia citreus. Appl Environ Microbiol, 1988, 54(7): 1770-1775. DOI:10.1128/aem.54.7.1770-1775.1988
|
| [5] |
Hancock RD, Viola R. The use of micro-organisms for L-ascorbic acid production: current status and future perspectives. Appl Microbiol Biotechnol, 2001, 56(5/6): 567-576.
|
| [6] |
Kaswurm V, Van Hecke W, Kulbe KD, et al. Engineering of a bi-enzymatic reaction for efficient production of the ascorbic acid precursor 2-keto-L-gulonic acid. Biochem Eng J, 2013, 79: 104-111. DOI:10.1016/j.bej.2013.07.010
|
| [7] |
Miki T, Hasegawa T, Sahashi Y. Studies on 5-keto-D-gluconate obtained by fermentation relating to L-ascorbic acid. Ⅰ. Catalytic reduction of 5-keto-D-gluconate to L-idonate. J Vitaminol (Kyoto), 1960, 6(3): 205-210. DOI:10.5925/jnsv1954.6.205
|
| [8] |
Miyazaki T, Tomiyama N, Shinjoh M, et al. Molecular cloning and functional expression of D-sorbitol dehydrogenase from Gluconobacter suboxydans IFO3255, which requires pyrroloquinoline quinone and hydrophobic. Biosci Biotechnol Biochem, 2002, 66(2): 262-270. DOI:10.1271/bbb.66.262
|
| [9] |
Matsushita K, Fujii Y, Ano Y, et al. 5-keto-D-gluconate production is catalyzed by a quinoprotein glycerol dehydrogenase, major polyol dehydrogenase, in Gluconobacter species. Appl Environ Microbiol, 2003, 69(4): 1959-1966. DOI:10.1128/AEM.69.4.1959-1966.2003
|
| [10] |
Ameyama M, Shinagawa E, Matsushita K, et al. Solubilization, purification and properties of membrane-bound glycerol dehydrogenase from Gluconobacter industrius. Agric Biol Chem, 1985, 49(4): 1001-1010.
|
| [11] |
Liu L, Zeng WZ, Du GC, et al. Identification of NAD-dependent xylitol dehydrogenase from Gluconobacter oxydans WSH-003. ACS Omega, 2019, 4(12): 15074-15080. DOI:10.1021/acsomega.9b01867
|
| [12] |
Adachi O, Toyama H, Theeragool G, et al. Crystallization and properties of NAD-dependent D-sorbitol dehydrogenase from Gluconobacter suboxydans IFO 3257. Biosci Biotechnol Biochem, 1999, 63(9): 1589-1595. DOI:10.1271/bbb.63.1589
|
| [13] |
Kim TS, Patel SKS, Selvaraj C, et al. A highly efficient sorbitol dehydrogenase from Gluconobacter oxydans G624 and improvement of its stability through immobilization. Sci Rep, 2016, 6: 33438. DOI:10.1038/srep33438
|
| [14] |
Cheng HR, Jiang N, Shen A, et al. Molecular cloning and functional expression of D-arabitol dehydrogenase gene from Gluconobacter oxydans in Escherichia coli. FEMS Microbiol Lett, 2005, 252(1): 35-42. DOI:10.1016/j.femsle.2005.08.023
|
| [15] |
Adachi O, Ano Y, Moonmangmee D, et al. Crystallization and properties of NADPH-dependent L-sorbose reductase from Gluconobacter melanogenus IFO 3294. Biosci Biotechnol Biochem, 1999, 63(12): 2137-2143. DOI:10.1271/bbb.63.2137
|
| [16] |
Sugisawa T, Hoshino T, Fujiwara A. Purification and properties of NADPH-linked L-sorbose reductase from Gluconobacter melanogenus N44-1. Agric Biol Chem, 1991, 55(8): 2043-2049.
|
| [17] |
Shinagawa E, Ameyama M. D-sorbitol dehydrogenase from Gluconobacter suboxydans, membrane-bound. Methods Enzymol, 1982, 89: 141-145.
|
| [18] |
Shinagawa E, Matsushita K, Adachi O, et al. Purification and characterization of D-sorbitol dehydrogenase from membrane of Gluconobacter suboxydans var. α. Agric Biol Chem, 1982, 46(1): 135-141.
|
| [19] |
Asakura A, Hoshino T. Isolation and characterization of a new quinoprotein dehydrogenase, L-sorbose/L-sorbosone dehydrogenase. Biosci Biotechnol Biochem, 1999, 63(1): 46-53. DOI:10.1271/bbb.63.46
|
| [20] |
Sugisawa T, Miyazaki T, Hoshino T. Microbial production of L-ascorbic acid from D-sorbitol, L-sorbose, L-gulose, and L-sorbosone by Ketogulonicigenium vulgare DSM 4025. Biosci Biotechnol Biochem, 2005, 69(3): 659-662. DOI:10.1271/bbb.69.659
|
| [21] |
Wang PP, Zeng WZ, Du GC, et al. Systematic characterization of sorbose/sorbosone dehydrogenases and sorbosone dehydrogenases from Ketogulonicigenium vulgare WSH-001. J Biotechnol, 2019, 301: 24-34. DOI:10.1016/j.jbiotec.2019.05.010
|
| [22] |
Saito Y, Ishii Y, Hayashi H, et al. Direct fermentation of 2-keto-L-gulonic acid in recombinant Gluconobacter oxydans. Biotechnol Bioeng, 1998, 58(2/3): 309-315.
|
| [23] |
Saito Y, Ishii Y, Hayashi H, et al. Cloning of genes coding for L-sorbose and L-sorbosone dehydrogenases from Gluconobacter oxydans and microbial production of 2-keto-L-gulonate, a precursor of L-ascorbic acid, in a recombinant G. oxydans strain. Appl Environ Microbiol, 1997, 63(2): 454-460. DOI:10.1128/aem.63.2.454-460.1997
|
| [24] |
Sugisawa T, Hoshino T, Nomura S, et al. Isolation and characterization of membrane-bound L-sorbose dehydrogenase from Gluconobacter melanogenus UV10. Agric Biol Chem, 1991, 55(2): 363-370.
|
| [25] |
Zhang W, Yan B, Wang J, et al. Purification and characterization of membrane-bound L-sorbose dehydrogenase from Gluconobacter oxydans GO112. Enzyme Microb Technol, 2006, 38(5): 643-648. DOI:10.1016/j.enzmictec.2005.07.016
|
| [26] |
Shinjoh M, Sugisawa T, Masuda S, et al. Efficient conversion of L-sorbosone to 2-keto-L-gulonic acid by Acetobacter liquefaciens strains. J Ferment Bioeng, 1994, 78(6): 476-478. DOI:10.1016/0922-338X(94)90051-5
|
| [27] |
Yakushi T, Takahashi R, Matsutani M, et al. The membrane-bound sorbosone dehydrogenase of Gluconacetobacter liquefaciens is a pyrroloquinoline quinone-dependent enzyme. Enzyme Microb Technol, 2020, 137: 109511. DOI:10.1016/j.enzmictec.2020.109511
|
| [28] |
Hoshino T, Sugisawa T, Fujiwara A. Isolation and characterization of NAD(P)-dependent L-sorbosone dehydrogenase from Gluconobacter melanogenus UV10. Agric Biol Chem, 1991, 55(3): 665-670.
|
| [29] |
Meyer M, Schweiger P, Deppenmeier U. Effects of membrane-bound glucose dehydrogenase overproduction on the respiratory chain of Gluconobacter oxydans. Appl Microbiol Biotechnol, 2013, 97(8): 3457-3466. DOI:10.1007/s00253-012-4265-z
|
| [30] |
Sará-Páez M, Contreras-Zentella M, Gómez-Manzo S, et al. Purification and characterization of the membrane-bound quinoprotein glucose dehydrogenase of Gluconacetobacter diazotrophicus PAL 5. Protein J, 2015, 34(1): 48-59. DOI:10.1007/s10930-014-9596-4
|
| [31] |
Ameyama M, Shinagawa E, Matsushita K, et al. D-glucose dehydrogenase of Gluconobacter suboxydans: solubilization, purification and characterization. J Ind Eng Chem, 1981, 45(4): 851-861.
|
| [32] |
Rauch B, Pahlke J, Schweiger P, et al. Characterization of enzymes involved in the central metabolism of Gluconobacter oxydans. Appl Microbiol Biotechnol, 2010, 88(3): 711-718. DOI:10.1007/s00253-010-2779-9
|
| [33] |
Prust C, Hoffmeister M, Liesegang H, et al. Complete genome sequence of the acetic acid bacterium Gluconobacter oxydans. Nat Biotechnol, 2005, 23(2): 195-200. DOI:10.1038/nbt1062
|
| [34] |
Adachi O, Matsushita K, Shinagawa E, et al. Crystallization and characterization of NADP- dependent D-glucose dehydrogenase from Gluconobacter suboxydans. Agric Biol Chem, 1980, 44(2): 301-308.
|
| [35] |
Attwood MM, Van Dijken JP, Pronk JT. Glucose metabolism and gluconic acid production by Acetobacter diazotrophicus. J Fermentat Bioeng, 1991, 72(2): 101-105. DOI:10.1016/0922-338X(91)90317-A
|
| [36] |
Inose K, Fujikawa M, Yamazaki T, et al. Cloning and expression of the gene encoding catalytic subunit of thermostable glucose dehydrogenase from Burkholderia cepacia in Escherichia coli. Biochim Biophys Acta, 2003, 1645(2): 133-138. DOI:10.1016/S1570-9639(02)00534-4
|
| [37] |
Yum DY, Lee YP, Pan JG. Cloning and expression of a gene cluster encoding three subunits of membrane-bound gluconate dehydrogenase from Erwinia cypripedii ATCC 29267 in Escherichia coli. J Bacteriol, 1997, 179(21): 6566-6572. DOI:10.1128/jb.179.21.6566-6572.1997
|
| [38] |
Toyama H, Furuya N, Saichana I, et al. Membrane-bound, 2-keto-D-gluconate-yielding D-gluconate dehydrogenase from "Gluconobacter dioxyacetonicus" IFO 3271: molecular properties and gene disruption. Appl Environ Microbiol, 2007, 73(20): 6551-6556. DOI:10.1128/AEM.00493-07
|
| [39] |
Shinagawa E, Matsushita K, Adachi O, et al. Purification and characterization of 2-keto-D- gluconate dehydrogenase from Gluconobacter melanogenus. Agric Biol Chem, 1981, 45(5): 1079-1085.
|
| [40] |
Miller JV, Estell DA, Lazarus RA. Purification and characterization of 2, 5-diketo-D-gluconate reductase from Corynebacterium sp. J Biol Chem, 1987, 262(19): 9016-9020. DOI:10.1016/S0021-9258(18)48039-8
|
| [41] |
Letunic I, Bork P. 20 years of the SMART protein domain annotation resource. Nucleic Acids Res, 2018, 46(D1): D493-D496. DOI:10.1093/nar/gkx922
|
| [42] |
Hoshino T, Sugisawa T, Shinjoh M, et al. Membrane-bound D-sorbitol dehydrogenase of Gluconobacter suboxydans IFO 3255—enzymatic and genetic characterization. Biochim Biophys Acta, 2003, 1647(1/2): 278-288.
|
| [43] |
Sugisawa T, Hoshino T. Purification and properties of membrane-bound D-sorbitol dehydrogenase from Gluconobacter suboxydans IFO 3255. Biosci Biotechnol Biochem, 2002, 66(1): 57-64. DOI:10.1271/bbb.66.57
|
| [44] |
Soemphol W, Adachi O, Matsushita K, et al. Distinct physiological roles of two membrane-bound dehydrogenases responsible for D-sorbitol oxidation in Gluconobacter frateurii. Biosci Biotechnol Biochem, 2008, 72(3): 842-850. DOI:10.1271/bbb.70720
|
| [45] |
Toyama H, Soemphol W, Moonmangmee D, et al. Molecular properties of membrane-bound FAD-containing D-sorbitol dehydrogenase from thermotolerant Gluconobacter frateurii isolated from Thailand. Biosci Biotechnol Biochem, 2005, 69(6): 1120-1129. DOI:10.1271/bbb.69.1120
|
| [46] |
Asakura A, Hoshino T. Alcohol/aldehyde dehydrogenase from Gluconobacter oxydans DSM 4025 FERM BP-3812: US, 5437989. 1995-08-01.
|
| [47] |
Pappenberger G, Hohmann H. Industrial production of L-ascorbic acid (vitamin C) and D-isoascorbic acid//Zorn H, Czermak P, Eds. Biotechnology of Food and Feed Additives. Berlin, Heidelberg: Springer, 2013: 143-188.
|
| [48] |
Liu LM, Li Y, Zhang J, et al. Complete genome sequence of the industrial strain Ketogulonicigenium vulgare WSH-001. J Bacteriol, 2011, 193(21): 6108-6109. DOI:10.1128/JB.06007-11
|
| [49] |
Gao LL, Du GC, Zhou JW, et al. Characterization of a group of pyrroloquinoline quinone-dependent dehydrogenases that are involved in the conversion of L-sorbose to 2-keto-L-gulonic acid in Ketogulonicigenium vulgare WSH-001. Biotechnol Prog, 2013, 29(6): 1398-1404. DOI:10.1002/btpr.1803
|
| [50] |
Soemphol W, Saichana N, Yakushi T, et al. Characterization of genes involved in D-sorbitol oxidation in thermotolerant Gluconobacter frateurii. Biosci Biotechnol Biochem, 2012, 76(8): 1497-1505. DOI:10.1271/bbb.120227
|
| [51] |
Soemphol W, Toyama H, Moonmangmee D, et al. L-sorbose reductase and its transcriptional regulator involved in L-sorbose utilization of Gluconobacter frateurii. J Bacteriol, 2007, 189(13): 4800-4808. DOI:10.1128/JB.01895-06
|
| [52] |
Toyama H, Mathews FS, Adachi O, et al. Quinohemoprotein alcohol dehydrogenases: structure, function, and physiology. Arch Biochem Biophys, 2004, 428(1): 10-21. DOI:10.1016/j.abb.2004.03.037
|
| [53] |
Richhardt J, Luchterhand B, Bringer S, et al. Evidence for a key role of cytochrome bo3 oxidase in respiratory energy metabolism of Gluconobacter oxydans. J Bacteriol, 2013, 195(18): 4210-4220. DOI:10.1128/JB.00470-13
|
| [54] |
李野, 厉学, 张怡轩. 酮古龙酸菌与呼吸链偶联的2-KGA代谢途径研究进展. 微生物学报, 2014, 54(10): 1101-1108. Li Y, Li X, Zhang YX. 2-KGA metabolism coupling respiratory chain in Ketogulonigenium vulgare-a review. Acta Microbiol Sin, 2014, 54(10): 1101-1108 (in Chinese). |
| [55] |
Ameyama M, Matsushita K, Ohno Y, et al. Existence of a novel prosthetic group, PQQ, in membrane-bound, electron transport chain-linked, primary dehydrogenases of oxidative bacteria. FEBS Lett, 1981, 130(2): 179-183. DOI:10.1016/0014-5793(81)81114-3
|
| [56] |
Han XD, Xiong XH, Jiang DQ, et al. Crystal structure of L-sorbose dehydrogenase, a pyrroloquinoline quinone-dependent enzyme with homodimeric assembly, from Ketogulonicigenium vulgare. Biotechnol Lett, 2014, 36(5): 1001-1008. DOI:10.1007/s10529-013-1446-5
|
| [57] |
Yamaoka H, Ferri S, Sode MFK. Essential role of the small subunit of thermostable glucose dehydrogenase from Burkholderia cepacia. Biotechnol Lett, 2004, 26(22): 1757-1761. DOI:10.1007/s10529-004-4582-0
|
| [58] |
Shinagawa E, Matsushita K, Adachi O, et al. D-gluconate dehydrogenase, 2-keto-D-gluconate yielding, from Gluconobacter dioxyacetonicus: purification and characterization. Agric Biol Chem, 1984, 48(6): 1517-1522.
|
| [59] |
Matsushita K, Toyama H, Yamada M, et al. Quinoproteins: structure, function, and biotechnological applications. Appl Microbiol Biotechnol, 2002, 58(1): 13-22. DOI:10.1007/s00253-001-0851-1
|
| [60] |
Fusco G, Göbel G, Zanoni R, et al. Polymer-supported electron transfer of PQQ-dependent glucose dehydrogenase at carbon nanotubes modified by electropolymerized polythiophene copolymers. Electrochim Acta, 2017, 248: 64-74. DOI:10.1016/j.electacta.2017.07.105
|
| [61] |
Hu YD, Wan H, Li JH, et al. Enhanced production of L-sorbose in an industrial Gluconobacter oxydans strain by identification of a strong promoter based on proteomics analysis. J Ind Microbiol Biotechnol, 2015, 42(7): 1039-1047. DOI:10.1007/s10295-015-1624-7
|
| [62] |
陈吉铭, 堵国成, 陈坚, 等. 普通生酮基古龙酸菌2-酮基-L-古龙酸合成途径在氧化葡萄糖酸杆菌中的整合表达与强化. 食品与生物技术学报, 2016, 35(6): 611-616. Chen JM, Du GC, Chen J, et al. Integration and enhancement of 2-keto-L-gulonic acid synthesis pathway in Gluconobactero xydans from Ketogulonicigenium vulgare. Food Sci Biotechnol, 2016, 35(6): 611-616 (in Chinese). DOI:10.3969/j.issn.1673-1689.2016.06.008 |
| [63] |
杨燕花, 吕永坤, 陈吉铭, 等. 2-酮基-L-古龙酸一步发酵生产菌株发酵过程优化. 食品与发酵工业, 2016, 42(7): 60-64. Yang YH, Lyu YK, Chen JM, et al. Bioprocess optimization for the production of 2-keto-L-gulonic acid by a one-step fermentation strain. Food Ferment Ind, 2016, 42(7): 60-64 (in Chinese). |
| [64] |
Chen S, Jia N, Ding MZ, et al. Comparative analysis of L-sorbose dehydrogenase by docking strategy for 2-keto-L-gulonic acid production in Ketogulonicigenium vulgare and Bacillus endophyticus consortium. J Ind Microbiol Biotechnol, 2016, 43(11): 1507-1516. DOI:10.1007/s10295-016-1829-4
|
| [65] |
高书颖, 张惟材, 汪建华, 等. 山梨糖脱氢酶和氨甲酰化酶的融合表达. 生物技术通讯, 2005, 16(2): 144-146. Gao SY, Zhang WC, Wang JH, et al. Fusion expression of sorbose dehydrogenase and N-carbamoylase. Lett Biotechnol, 2005, 16(2): 144-146 (in Chinese). DOI:10.3969/j.issn.1009-0002.2005.02.009 |
| [66] |
韦娜, 陈惠鹏, 张惟材. SDH-SV2C-L4融合蛋白的表达及山梨糖脱氢酶活性检测. 生物技术通讯, 2011, 22(3): 354-357. Wei N, Chen HP, Zhang WC. Expression of the fusion protein SDH-SV2C-L4 and detection of its SDH activity. Lett Biotechnol, 2011, 22(3): 354-357 (in Chinese). DOI:10.3969/j.issn.1009-0002.2011.03.011 |
| [67] |
高书颖, 张惟材, 汪建华, 等. 山梨糖脱氢酶基因在大肠杆菌染色体上整合及表达. 微生物学报, 2005, 45(1): 139-141. Gao SY, Zhang WC, Wang JH, et al. Integration and expression of sdh gene in Escherichia coli. Acta Microbiol Sin, 2005, 45(1): 139-141 (in Chinese). DOI:10.3321/j.issn:0001-6209.2005.01.032 |
| [68] |
赵岩, 张惟材, 陈惠鹏. 利用转座系统在葡糖杆菌中表达山梨糖脱氢酶. 生物技术通讯, 2007, 18(5): 727-730. Zhao Y, Zhang WC, Chen HP. Expression of sorbose dehydrogenase in Gluconobacter with Tn5 transposon. Lett Biotechnol, 2007, 18(5): 727-730 (in Chinese). DOI:10.3969/j.issn.1009-0002.2007.05.001 |
| [69] |
熊向华, 陈伟, 汪建华, 等. 山梨糖脱氢酶在乙酸钙不动杆菌中的表达. 生物技术通讯, 2010, 21(6): 783-786. Xiong XH, Chen W, Wang JH, et al. Expression of sorbose dehydrogenase in Acinetobacter calcoaceticus. Lett Biotechnol, 2010, 21(6): 783-786 (in Chinese). DOI:10.3969/j.issn.1009-0002.2010.06.008 |
| [70] |
朱斌, 熊向华, 汪建华, 等. 山梨糖脱氢酶在脱氮副球菌中的表达. 生物技术通讯, 2012, 23(2): 204-206. Zhu B, Xiong XH, Wang JH, et al. Expression of sorbose dehydrogenase in Paracoccus denitrificans. Lett Biotechnol, 2012, 23(2): 204-206 (in Chinese). |
| [71] |
Chen Y, Liu L, Shan XY, et al. High-throughput screening of a 2-keto-L-gulonic acid-producing Gluconobacter oxydans strain based on related dehydrogenases. Front Bioeng Biotechnol, 2019, 7: 385. DOI:10.3389/fbioe.2019.00385
|
| [72] |
侯伟, 熊向华, 陈微微, 等. 氧化葡糖杆菌sndh-sdh基因簇的克隆表达. 生物技术通讯, 2012, 23(3): 389-392. Hou W, Xiong XH, Chen WW, et al. Cloning, expression and activity analysis of sndh-sdh gene cluster of Gluconobacter oxydans. Lett Biotechnol, 2012, 23(3): 389-392 (in Chinese). DOI:10.3969/j.issn.1009-0002.2012.03.019 |
| [73] |
Wang EX, Ding MZ, Ma Q, et al. Reorganization of a synthetic microbial consortium for one-step vitamin C fermentation. Microb Cell Fact, 2016, 15: 21. DOI:10.1186/s12934-016-0418-6
|
| [74] |
Hoshino T, Sugisawa T, Tazoe M, et al. Metabolic pathway for 2-keto-L-gulonic acid formation in Gluconohacter melanogenus IFO 3293. Agric Biol Chem, 1990, 54(5): 1211-1218.
|
| [75] |
蒋宇扬, 郭振勇, 靳素英, 等. 维生素C发酵中2-酮-L-古龙酸还原酶的研究. 生物工程学报, 1998, 14(3): 339-341. Jiang YY, Guo ZY, Jin SY, et al. Study on 2-keto-L-gulonate reductase in vitamin C fermentation. Chin J Biotech, 1998, 14(3): 339-341 (in Chinese). DOI:10.3321/j.issn:1000-3061.1998.03.019 |
| [76] |
蒋宇扬, 郭振勇, 张成刚. 2-酮-L-古龙酸还原酶分离纯化及其理化、酶学性质的研究. 生物工程学报, 1997, 13(4): 400-405. Jiang YY, Guo ZY, Zhang CG. Study on the purification of 2-keto-L-gulonate reductase and its physical, chemical and enzymic properties. Chin J Biotech, 1997, 13(4): 400-405 (in Chinese). |
| [77] |
Stroshane RM, Perlman D. Fermentation of glucose by Acetobacter melanogenus. Biotechnol Bioeng, 1977, 19(4): 459-465. DOI:10.1002/bit.260190403
|
| [78] |
Sonoyama T, Tani H, Matsuda K, et al. Production of 2-keto-L-gulonic acid from D-glucose by two-stage fermentation. Appl Environ Microbiol, 1982, 43(5): 1064-1069. DOI:10.1128/aem.43.5.1064-1069.1982
|
| [79] |
Qazi GN, Parshad R, Verma V, et al. Diketo- gluconate fermentation by Gluconobacter oxydans. Enzyme Microb Technol, 1991, 13(6): 504-507. DOI:10.1016/0141-0229(91)90010-8
|
| [80] |
Banta S, Anderson S. Verification of a novel NADH-binding motif: combinatorial mutagenesis of three amino acids in the cofactor-binding pocket of Corynebacterium 2, 5-diketo-D-gluconic acid reductase. J Mol Evol, 2002, 55(6): 623-631. DOI:10.1007/s00239-002-2345-x
|
| [81] |
Richhardt J, Bringer S, Bott M. Role of the pentose phosphate pathway and the Entner-Doudoroff pathway in glucose metabolism of Gluconobacter oxydans 621H. Appl Microbiol Biotechnol, 2013, 97(10): 4315-4323. DOI:10.1007/s00253-013-4707-2
|
| [82] |
陈策实, 尹光琳. 棒状杆菌2, 5-DKG还原酶基因在欧文氏菌中的表达. 生物工程学报, 1999, 15(2): 3-5. Chen CS, Yin GL. Expression of 2, 5-DKG reductase Ⅰ gene from Corynebacterium in Erwinia SCB125. Chin J Biotech, 1999, 15(2): 3-5 (in Chinese). |
| [83] |
Shan XY, Liu L, Zeng WZ, et al. High throughput screening platform for a FAD-dependent L-sorbose dehydrogenase. Front Bioeng Biotech, 2020, 8: 194. DOI:10.3389/fbioe.2020.00194
|
 2021, Vol. 37
2021, Vol. 37




