中国科学院微生物研究所、中国微生物学会主办
文章信息
- 高萍, 陈宇娴, 柯崇榕, 杨欣伟, 黄建忠
- Gao Ping, Chen Yuxian, Ke Chongrong, Yang Xinwei, Huang Jianzhong
- 新型靶向化合物——植物大麻素的生物合成途径及研究进展
- New targeted compounds—biosynthesis of phytocannabinoids
- 生物工程学报, 2021, 37(6): 1968-1985
- Chinese Journal of Biotechnology, 2021, 37(6): 1968-1985
- 10.13345/j.cjb.200453
-
文章历史
- Received: July 24, 2020
- Accepted: November 11, 2020
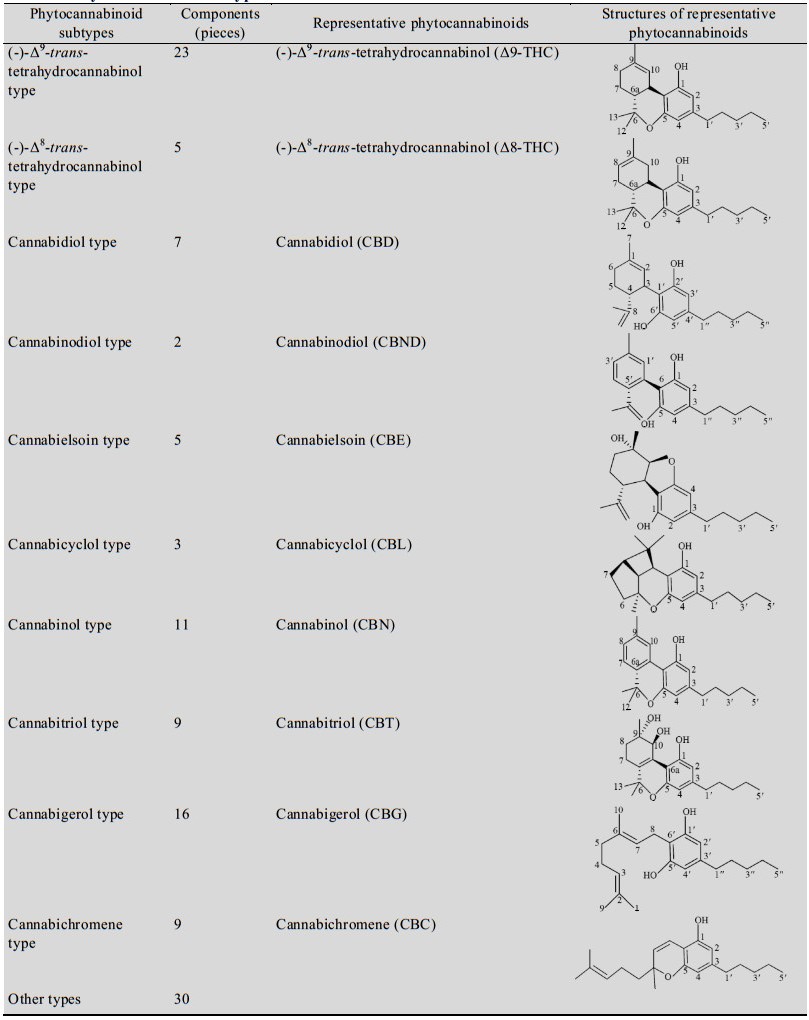
大麻Cannabis sativa L.,大麻科大麻属,雌雄异株,是一年生草本植物[1]。几个世纪以来,大麻一直被用作草药[2]。中国草药简编《本草纲目》中记载大麻用于治疗风湿病、疟疾和便秘[3]。公元前1000年,大麻在印度被用于治疗神经、呼吸、胃肠道和各种传染病[4]。20世纪中期,由于大麻具有精神活性,对使用者会产生许多急性和慢性不良反应(抑郁、焦虑和大麻戒断症等),因此大麻在许多国家被禁止使用。植物大麻素是雌性大麻腺毛内由脂肪酸和异戊二烯为前体经过混合生物合成途径合成的一系列次生代谢产物,也是大麻中主要的活性成分。迄今为止,从大麻中共分离出120多种植物大麻素,它们的母核结构相似(图 1);根据其异戊烯残基、间苯二酚核和侧链之间的差异可以将其分为11种亚型(表 1)[5]。1940年和1965年,大麻中主要药理活性成分——大麻二酚(Cannabidiol,CBD)[6]和Δ9-四氢大麻酚(Δ9-tetrahydrocannabinol,Δ9-THC)[7]的成功分离,填补了大麻在科学研究领域的空白。随后,在1990年和1993年分别发现Δ9-THC和CBD的生物学效应由两种G蛋白偶联受体——1型和2型大麻素受体(Cannabinoid receptor type 1 or 2,CB1/2) 介导[8]。CB1/2编码基因的发现使得人们对刺激CB1/2的天然代谢产物和负责它们合成和降解的酶产生了浓厚的兴趣,从此一种全新的内源性脂质信号系统——内源性大麻素系统(Endocannabinoid system,ECS) 逐渐被人们了解[9]。2016年,美国的23个州通过了医用大麻合法化法案,其中有8个州和哥伦比亚特区将娱乐大麻合法化[10]。在英国、德国、加拿大、西班牙、瑞典、荷兰、丹麦、捷克共和国、奥地利和以色列等国家正式批准大麻和大麻制品的治疗用途合法[11-12]。政策的改变让这种古老的植物得到了复兴,但是人们对药用大麻素的临床使用一直存在很大的争议,而这些争议的核心在于目前的大麻素类药物是否达到现代医学要求的质量和安全标准。
内源性大麻素系统(Endocannabinoid system,ECS) 是人体中帮助维持体内平衡的重要分子系统,由内源性大麻素受体(CB1/2)、内源性大麻素配体(内源性大麻素) 和负责内源性大麻素合成和降解的酶组成[13] (图 2)。该系统参与众多生理过程和功能,包括疼痛[14]、血压[15]、细胞增殖、分化和存活[16]、能量平衡[17]、食欲控制[18]、情绪调节[19]、神经发生[20]和神经退行性疾病[21-22]等。因此,ECS已经成为研究能量代谢类疾病(肥胖和代谢异常、厌食症)、疼痛和炎症、中枢神经系统疾病(多发性硬化症、帕金森氏症、左旋多巴诱发的运动障碍、亨廷顿氏舞蹈症、阿尔茨海默氏症、癫痫、精神分裂症、失眠症、恶心和呕吐、毒品和酒精障碍等)、心血管和呼吸系统疾病(高血压、动脉粥样硬化、哮喘)、眼睛疾病(青光眼和视网膜病变)、癌症、肠胃和肝脏疾病(炎症性肠病、肝炎、肝硬化)、肌肉骨骼疾病(关节炎、骨质疏松症) 等的潜在靶点[23-25]。

|
| 图 2 内源性大麻素系统及其潜在的治疗靶点 Fig. 2 Endocannabinoid systems and their potential therapeutic targets. CB1: type-1 cannabinoid receptors; CB2: type-2 cannabinoid receptors; 2-AG: 2-arachidonoylglycerol; AEA: N-arachidonoylethanolamine; DAG: diacylglycerol; NAPE: N-acylphosphatidylethanolamine; DAGL: diacylglycerol lipase; NAPE-PLD: N-acylphosphatidylethanolamine- hydrolyzing phospholipase D; FAAH: fatty acid amide hydrolase; MAGL: monoacylglycerol lipase. |
| |
CB1和CB2是目前主要研究的ECS受体蛋白,是G蛋白偶联受体[26-27]。内源性大麻素与CB1/2结合导致CB1/2构象改变,CB1/2招募G蛋白和其他细胞信号分子,从而介导细胞内信号传导[28]。CB1是脑内最丰富的内源性大麻素结合受体,大量分布在中枢神经系统,同时也分布在许多周围器官和组织中(比如免疫系统、消化系统、生殖系统、心脏、肺、肾上腺细胞等)[29-30];CB2主要分布在免疫细胞内,起免疫调节和细胞因子活化作用。研究表明,ECS中的蛋白表达水平在多种病理状态下上升或者下降,这些现象说明在特定的病理条件下需要上调或者下调ECS介导的信号通路[24]。比如ECS的CB1/2及其内源性配体在肿瘤细胞中过度表达,进而影响肿瘤的生长、迁移和侵袭[31];甘油一酯酶(Monoacylglycerol lipase,MAGL) 的过度表达会导致焦虑样行为的增加[32],而MAGL和脂肪酰胺水解酶(Fatty acid amide hydrolase,FAAH) 的抑制则会产生抗焦虑作用[33-34],这些研究提示花生酰基甘油(2-arachidonoylglycerol,2-AG) 和N-花生四烯酰乙醇胺(N-arachidonoylethanolamine,AEA) 信号的变化在焦虑症的发生机制中起关键作用。
最初,ESC蛋白靶向药物设计思路主要从抑制CB1/2活性出发,比如2008年被禁止使用的药物Rimonabant,其设计思路是通过抑制CB1活性来降低食欲和脂肪堆积,从而治疗肥胖症[35]。但是由于ESC存在多向效应,使用Rimonabant的患者产生了严重的精神性副反应(抑郁和焦虑)[36]。Rimonabant的失败使研究者将设计思路调整为激活CB1/2活性,以期能避免抑制CB1/2活性导致的人体ECS失衡[37]。目前,一系列通过激活CB1/2活性来发挥作用的药物已经在一些国家成功上市(表 2)[38]。其中,Δ9-THC就是一种CB1/2激动剂,通过ECS参与对食欲、炎症、痛觉、情绪和能量代谢等生理功能的调节[2, 12, 39]。Δ9-THC是MarinolⓇ (Dronabinol) 的活性成分,研究发现其在中枢神经系统被大麻素受体激活后直接作用于大脑中的呕吐和食欲控制中枢,因此被美国食品和药物管理局(FDA) 批准用于治疗成人获得性免疫缺陷症患者厌食相关的体重减轻[40-41]。CesametⓇ (Nabilone) 的活性成分是一种合成大麻素,与Δ9-THC具有相似的功能,被用于治疗癌症化疗引起的恶心和呕吐[42]。Δ9-THC对CB1的亲和力较高导致其具有精神活性,临床试验发现服用MarinolⓇ和CesametⓇ的患者出现了困倦、头晕、口干、兴奋和乏力性头痛、睡眠障碍等不良反应[42-43]。而CBD既是CB2受体的弱激动剂,也是CB1受体的负变构调节剂,Δ9-THC与CBD的组合使用能减轻Δ9-THC引起的精神性副反应[44-46]。比如用于缓解多发性硬化症痉挛、神经性疼痛和晚期癌症患者疼痛的喷雾剂SativexⓇ (Δ9-THC和CBD的比例为1:1) 虽然导致了头晕、疲劳、嗜睡、恶心、乏力和眩晕等副作用,却不会损害患者的认知能力[47-48]。根据目前的研究结果,CBD在治疗糖尿病、创伤应激症、癌症、焦虑、癫痫、精神分裂、阿尔茨海默病、帕金森病和左旋多巴所致的运动障碍等病症中具有极大的潜力[49-54]。2018年,FDA已批准纯植物衍生CBD的液体药物制剂Epidiolex用于治疗两种罕见的儿童癫痫:Lennox-Gastaut综合征和Dravet综合征[46, 55-56]。
| Brand name | Cannabinoid component | Indications | Dosage form | Countries |
| CesametⓇ (Nabilone) | Δ9-THC analogue | Nausea and vomiting induced by chemotherapy | Capsules | UK, Ireland, USA, Canada, Germany, Australia |
| EpidiolexⓇ | Pure plant-derived CBD | Dravet syndrome and Lennox-Gastaut syndrome | Solution | USA |
| SativexⓇ (Nabiximos) | Nabiximols (Cannabis sativa extracts including mainly Δ9-THC and CBD at a ratio of 1:1) | MS spasticity, symptomatic relief of neuropathic pain in MS, pain in patients with advanced cancer | Spray | Canada, Mexico and several European countries |
| MarinolⓇ | Δ9-THC | Anorexia related to weight loss inpatients with AIDS; nausea and vomiting induced by chemotherapy | Capsules | UK, Ireland, USA, Canada |
| SyndrosⓇ | Δ9-THC | Anorexia related to weight loss in patients with AIDS; nausea and vomiting induced by chemotherapy | Solution | USA |
最近有报道指出,植物大麻素(Δ9-THC和CBD) 与相关萜类化合物联合使用,能增强Δ9-THC/CBD对人类细胞的生物活性,这一发现为进一步研究制定预期治疗效果的特定组合奠定了基础,并将影响大麻药物的医疗使用和发展[57]。现阶段,人们对许多微量植物大麻素以及它们的衍生物的研究也正在进行,比如大麻酚(Cannabinol,CBN)、大麻萜酚(Cannabigerol,CBG)、大麻环萜酚(Cannabichromene,CBC) 和次大麻二酚(Cannabidivarin,CBDV) 等。2019年Citti等首次报道了两个新的CBD和Δ9-THC同系物的分离,命名为Δ9-THCP (Δ9-tetrahydrocannabiphorol)和CBDP (Cannabidiphorol)。这两个新发现的化合物的分子结构中烷基侧链延长到7个脂肪型碳原子,而Δ9-THC和CBD仅有5个脂肪型碳原子;其中,Δ9-THCP对CB1/CB2受体的亲和力显著提高,即对CB1受体的亲和力是Δ9-THC的33倍,对CB2受体的亲和力是Δ9-THC的5–10倍,提示Δ9-THCP可以更有效地发挥作用[58]。Δ9-THCV (Δ9-tetrahydrocannabivarin) 也是新发现的Δ9-THC的天然类似物,其烷基侧链只有3个脂肪型碳原子;虽然Δ9-THCV与Rimonabant都是CB1/CB2的反向激动剂,但Δ9-THCV不具有Rimonabant样的副作用,在肥胖症和Ⅱ型糖尿病治疗中有很大潜力[59]。以上研究表明,大麻素烷基侧链的长度对其生物活性有着重要影响;随着色谱分离技术和光谱分析技术的发展,将有更多的新型微量大麻素被鉴定分离出来,并被广泛应用于治疗领域。
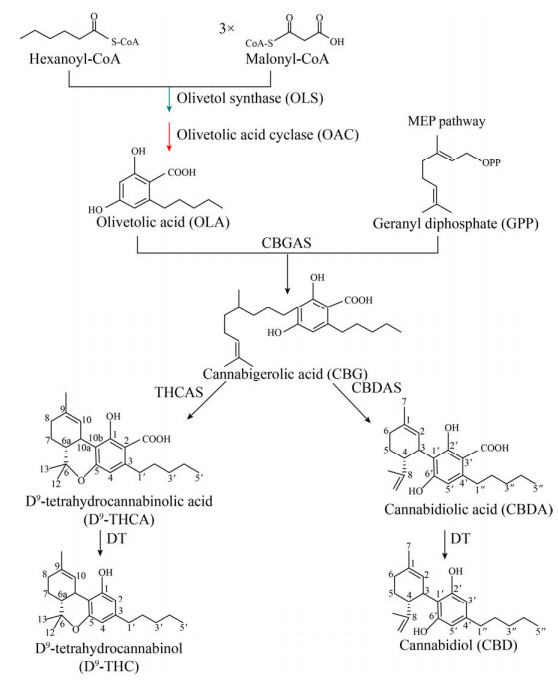
2 植物大麻素的生物合成途径在新鲜的大麻植物(Cannabis plants) 中,大麻素被合成并累积为大麻酸,例如Δ9-四氢大麻酚酸(Δ9-tetrahydrocannabinolic acid,Δ9-THCA) 和大麻二酸(Cannabidiolic acid,CBDA),随后在储存和吸食过程中通过非酶促脱羧成中性形式大麻素。植物大麻素生物合成途径分为3个催化步骤:(1) 聚酮合成(Polyketide formation);(2) 异戊烯化(Prenylation);(3) 氧化环化(Oxidative cyclization) (图 3)[60]。橄榄醇合成酶(Olivetol synthase,OLS)催化己酰-CoA (Hexanoyl-CoA) 与三分子丙二酰-CoA (Malonyl-CoA) 顺序缩合生成线性四酮-CoA中间体,之后橄榄酸环化酶(Olivetolic acid cyclase,OAC) 催化线性四酮-CoA中间体环化生成芳香基化合物橄榄酸(Olivetolic acid,OLA)[61-62];大麻萜酚酸合成酶(Cannabigerolic acid synthase,GBGAS) 催化焦磷酸香叶酯(Geranyl diphosphate,GPP,C10) 和OLA发生异戊烯化反应缩合生成大麻萜酚酸(Cannabigerolic acid,CBGA)[63-64];新型FAD依赖氧化酶——Δ9-四氢大麻酚合成酶(Δ9-tetrahydrocannabinolic acid synthase,THCAS) 和大麻二酚合成酶(Cannabidiolic acid synthase,CBDAS) 催化CBGA单萜部分氧化环化,分别转化为Δ9-THCA和CBDA[65];最后Δ9-THCA和CBDA分别通过非酶脱羧过程(在干燥和贮存过程中,温度、光照等外界因素都可能引起Δ9-THCA和CBDA脱羧) 转化为中性形式的Δ9-THC和CBD。最近有研究证实,一些杜鹃花属植物(Rhododendron) 可产生CBC型大麻素;一些开花植物(蜡菊Helichrysum umbraculigerum、紫穗槐Amorphafruticose L.) 可产生具有大麻素主链的生物活性化合物;苔藓(Liverworts) 可产生含双苄基主链的大麻素类化合物;此外,少数真菌(地花菌属Albatrellus、冬青卫矛内生真菌Cylindrocarpon olidum) 生产灰叶酸(Grifolic acid)和大麻二十二烷酸(Cannabiorcichromenic acid),这为识别大麻素生物合成途径潜在基因及其在合适的异源宿主中的表达提供了新的依据[66]。在大麻素的生物合成过程中,通过结合不同种类植物大麻素合成的模块,基于跨物种模块的组合及GBGAS,可在异源宿主中生产新的天然植物大麻素,同时合成途径中酶的混配、糖基化、卤化等也可使植物大麻素的功能进一步多样化[66]。
|
| 图 3 大麻素生物合成途径 Fig. 3 Biosynthetic pathway of cannabinoids. |
| |
橄榄酸(Olivetolic acid,OLA) 是Ⅲ型聚酮合成酶的产物[67],在大麻素生物合成过程中提供大麻素聚酮核部分,也是大麻素生物合成过程中的第一个关键节点。为了实现大麻素的完全生物合成,首先要在微生物宿主中构建OLA合成途径,该途径主要由橄榄醇合成酶(Olivetol synthase,OLS) 和橄榄酸环化酶(Olivetolic acid cyclase,OAC) 组成(图 4)[61],除了生成目标产物,还有极少量的途径副产物戊二乙酸内酯(Pentyl diacetic acid lactone,PDAL) 和己酰三乙酸内酯(Hexanoyl triacetic acid lactone,HTAL) 生成,进一步的研究证实PDAL和HTAL是在缺乏橄榄酸环化酶催化时,由线性三酮中间体和四酮中间体分别通过自发乳糖化生成。2009年,Taura等从C. sative L.中克隆了一个OLS编码基因;该基因编码的OLS属于Ⅲ型聚酮合成酶,能够以己酰-CoA和丙二酰-CoA为底物生产橄榄醇[62]。橄榄醇成环是OLA合成过程中第二个关键步骤。2012年,Gagne等通过转录组实验在雌性C. sative L.的腺毛中发现了OAC,该酶催化C2-C7分子内羟醛缩合以形成OLA;该酶为二聚体α+β桶(DABB) 蛋白,类似于链霉菌Streptomyces中的聚酮环化酶(Polyketide cyclase enzyme),是唯一已知的植物聚酮化合物环化酶;同时,该作者利用OLS和OAC,在酵母体内重构了OLA的生物合成途径,在培养基中产生了0.48 mg/L OLA[61]。2016年,Yang等解析了C. sative L.中OAC的结构并提出了该酶的作用机制,即OLS水解释放的四酮-CoA中间体被OAC活性位点的空腔结合后,活性中心酸碱催化位点Tyr72激活了His78的亲核攻击,从底物C2处抽离了一个质子,产生烯醇中间体,随后烯醇中间体通过酮类/烯醇互变异构化对C7羰基碳进行亲核攻击,再由C7羰基氧从被质子化的His78中相继抽离质子,促进了C2-C7醛环化,最后OAC释放出与辅酶A连接的环化产物,该产物立即发生芳构化作用和裂解辅酶A连键,以非酶促和自发的方式形成OLA[68]。

|
| 图 4 橄榄酸合成途径 Fig. 4 Biosynthetic pathway of OLA. |
| |
目前,针对OLA的异源生物合成已经处于优化阶段。2018年,Tan等将橄榄酸合成途径关键酶(OLS和OAC)、乙酰-CoA羧化酶(Acetyl-CoA carboxylase,ACC)、β氧化逆转途径的关键酶(r-BOX) 和长链脂肪酸酰基-CoA合成酶(Fatty acyl-CoA synthetase,FadD) 组合表达,在删除了乙酰-CoA合成的竞争途径和消耗途径的工程大肠杆菌JST10(DE3) 中产生了26.2 mg/L OLA;对其发酵条件进行优化后,该工程菌的橄榄酸产量高达80 mg/L[69]。2020年,Kearsey等提出OLS活性位点的水活化模式是影响不同环化机制催化结果的重要因素,而非之前提出的“aldol switch”共识序列;同时,该作者在大肠杆菌DH5α菌株中引入了诱导型启动子(TetR) 控制的OLS和OAC双酶质粒,在TB培养基20 ℃条件下合成了20 µg/L OLA,而在TB培养基中添加20 µg/mL cerulenin (脂肪酸生物合成酶Fab F抑制剂) 后产生了70 µg/L OLA[70];最后,作者还发现橄榄酸在异源微生物体内合成后在一定时间内会发生不同程度的降解,而其降解原因和机制目前还不可知。综上所述,OLA的大量累积是继续高效合成大麻素的基础,但是如何平衡最大限度的OLA的合成和微生物宿主的正常生长,也是一个亟待解决的挑战。
2.2 异戊烯化的前体— —单萜合成途径焦磷酸香叶酯(Geranyl diphosphate,GPP)是一种类异戊二烯化合物,在大麻素生物合成中提供单萜部分。GPP由两种C5萜类化合物骨架异戊烯基二磷酸(Isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(Dimethylallyl diphosphate,DMAPP) 缩合形成[71]。IPP和DMAPP生物合成主要有两条途径:甲羟戊酸途径(MVA pathway) 和非甲羟戊酸途径(MEP pathway)。MVA途径主要在大多数真核生物、真菌和植物细胞质中起作用,起始于乙酰-CoA (Acetyl-CoA) 共缩合形成的乙酰乙酰-CoA;MEP途径则主要存在于许多细菌、藻类和植物叶绿体中,以丙酮酸(Pyruvate,Pyr) 和甘油醛-3-磷酸(Glyceraldehyde 3-phosphate,GAP) 缩合形成1-脱氧-D-木糖-5-磷酸(1-deoxy- D-xylulose 5-phosphate,DXP) 为起始点[72]。MEP途径虽然具有较高的理论质量产率(30.2%),但是Pyr和GAP前体供应的不平衡会影响其实际产量;而相比于MEP,MVA途径需要较低的辅因子量[73]。2019年Bowie等报道了一个由糖酵解模块、MVA合成模块和辅因子调控模块组成的无细胞酶平台,该平台从葡萄糖合成GPP后,再利用异戊二烯模块与OLA反应,合成超过1 g/L的CBGA[74]。但是这套系统在实际实施中受到许多限制,比如需要超过20种酶来完成整个反应,而且产生的过量NAD(P)H辅因子需要氧气清除(再氧化),这都增加了途径的复杂性和成本。在微生物体内,MVA途径和MEP途径的产出受到多个因素的制约:(1) 中心碳代谢提供的前体(Acetyl-CoA、GAP和Pyr) 和辅助因子(NADPH和ATP) 的通量;(2) 途径中的限速酶以及中间产物对酶反馈抑制的影响;(3) 旁路途径通量的流失等。目前,已经尝试了许多代谢工程策略,包括在不同的微生物宿主中引入或改造MVA/MEP的途径[75-76]、过表达途径限速酶[77-78]、突变解除中间产物对酶的反馈抑制[72, 79]、敲除负调控因子和切断旁路途径[80-81]等,以期提高类异戊二烯的产量。在大麻素生物合成相关研究中,研究者主要通过在酿酒酵母Saccharomyces cerevisiae中上调MVA途径(如内源性法尼酰焦磷酸合成酶ERG12、ERG8、ERG19和异戊烯焦磷酸异构酶IDI1的编码基因) 和引入突变型内源性法尼酰焦磷酸合成酶ERG20F69W/N127W来实现GPP池的积累[82]。由于代谢工程策略面临多基因表达引起的代谢负担和中间产物的积累等问题,替代途径的研究已经成为提高GPP通量的主要策略。2018年Chatzivasileiou等报道了一条异戊醇利用途径(Isopentenol utilization pathway,IUP),这一途径以易获得的底物(异戊二烯或丙烯醇) 为起始底物,以来源于S. cerevisiae的胆碱激酶(Choline kinase,ScCK) 和MVA途径自身的异戊基激酶(Isopentenyl phosphate kinase,IPK) 依次催化两步磷酸化反应合成IPP和DMAPP,并且其中的代谢流足以满足所有被测试的下游途径[83]。2020年Valliere等进一步更新了合成大麻素的无细胞系统,这套新系统利用上述的异戊醇替代途径合成GPP,再与芳香族聚酮化合物模块产生的OLA反应,最终利用异戊烯醇、丙二酸和己酸等价格低廉的底物产生约0.5 g/L的CBGA[84]。因此,利用新的替代途径与中心碳代谢途径分离,并与OLA合成途径整合,应该能够在不影响微生物宿主正常生长的情况下为下游大麻素的合成提供足够的单萜部分前体池。
2.3 芳香族异戊烯转移酶催化异戊烯基转移大麻萜酚酸(Cannabigerolic acid,CBGA) 能够作为中心前体被催化形成不同类型的大麻素,由OLA和GPP经GBGAS催化缩合而成。1998年Fellermeier等在C. sative L.的幼叶提取物中鉴定了GBGAS的催化活性;发现GBGAS以GPP或者NPP (Nerylpyrophosphate) 为供体,并以OLA为专一异戊烯基受体,OLA的脱羧产物橄榄醇则不被该酶所接受[85]。2011年Page等从C. sative L.中克隆了一个异戊烯基转移酶(Cannabis GOT,CsPT1),其编码序列与定位于高等植物质体的异戊烯基转移酶具有相似性,可催化OLA和GPP缩合生成CBGA和副产物5-香叶基橄榄酸酯(5-geranyl olivetolate);但由于其底物的非特异性,CsPT1被认为是大麻素合成途径中不确定的一个环节,未被应用于CBGA的生产[86]。在植物中,GBGAS一般被认为是膜整合蛋白,定位于质体的膜中,要让该酶发挥充分作用,正确折叠和定位以及细胞内分隔问题都必须考虑。因此,其他来源可溶性的GBGAS代替大麻中的膜整合蛋白是一种可行策略。NphB是来自链霉菌Streptomyces sp. CL19022的可溶性异戊烯基转移酶,能够催化来自GPP的香叶基转移到含羟基的芳香族受体中,具有混杂的催化活性和区域选择性[87]。Zirpel等在S. cerevisiae和毕赤酵母Pichia (Komagataella) pastoris中分别表达了可溶性的NphB,但是由于细胞内NphB活性太低以及NphB混杂的底物催化活性,外源投喂OLA和GPP生成了少量的CBGA和大量的副产物2-O-香叶基橄榄酸(2-O-geranyl olivetolic acid,2-O-GOA)[88]。以上研究提示,细胞质pH水平和NphB在细胞区室中的转运效率、底物的可获得性和极性可能都是限制NphB催化水平的因素,而前体供应不足会极大地限制下游生物合成,因此通过定向突变优化NphB活性和产物特异性是解决该问题的主要任务。Gonzalez和Bowie这两个团队对NphB活性位点进行了基于结构的功能重新设计(NphB-G286S和NphB-Y288A,G286S),以提高其催化活性和区域选择性[63, 74]。另一方面,Keasling团队通过生物信息学的方法对CsPT1进行相似性分析,挖掘了数种植物的转录组或基因组,通过对比不同基因在不同组织的表达量,寻找能催化利用OA和GPP生成CBGA的关键酶,最终在C. sative L.的转录组中挖掘出了一个编码香叶基转移酶(CsPT4) 的基因并将其引入GPP和OA的高产菌株,生产了136 mg/L的CBGA[82]。由于CBGAS是大麻素直接合成过程中的第一个酶,负责生成大麻素的碳骨架,NphB和CsPT4的发现和应用是异源大麻素生物合成和代谢工程控制植物中大麻素含量的宝贵工具。
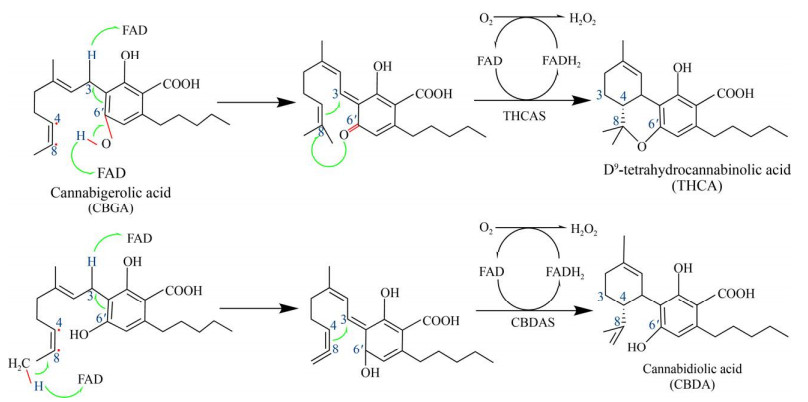
2.4 CBGA单萜部分氧化环化大麻素生物合成的最后一步为中心前体CBGA单萜部分立体选择性氧化环化。1995年,Taura等首次在C. sative L.中识别了一个氧化还原酶,命名为Δ9-四氢大麻酚合成酶(Δ9-tetrahydrocannabinolic acid synthase,THCAS)。THCAS是第一个被识别的大麻素合成酶,催化CBGA单萜部分氧化环化生成Δ9-THCA,Δ9-THCA是精神活性大麻的主要大麻素成分(> 85%),在腺毛的储存腔中合成[89-90]。1996年,Taura等又在C. sative L.中分离纯化出了大麻二酚合成酶(Cannabidiolic acid synthase,CBDAS),CBDAS是继THCAS识别后的第2个大麻素合成酶,催化CBGA氧化环化生成CBDA,CBDA是纤维型大麻的主要大麻素成分(> 85%)[91-92]。CBDAS与THCAS这两个氧化环化酶存在许多共同点[91, 93-95]:首先,CBDAS肽链一级结构与THCAS有83.9%的相似性,而且它们都存在翻译后修饰,成熟THCAS至少有6个可能的糖基化位点,而成熟CBDAS有7个可能的糖基化位点;其次,它们都是FAD依赖性氧化酶,具有共同的黄素蛋白结合序列(Arg-Ser-Gly- Gly-His114),其中His114残基是FAD共价结合位点;第三,它们的作用机制非常相似,THCAS通过两个共价键(C-N,C-S) 结合一分子的FAD,与底物结合时FAD从CBGA的苄基获得一个氢负离子,THCAS从CBGA酚羟基上获得一个质子,同时失去一个氢负离子和一个质子的CBGA单萜部分的C4和C8分别接近C3和O6',然后立体选择性环化生成有3个环的Δ9-THCA,氢负离子从还原的FAD转移到氧分子中,形成过氧化氢,并在下一个循环中重新还原FAD,而CBDAS催化机制中唯一的区别就是从CBGA的末端甲基群中提取一个质子而不是CBGA的苄基(图 5)[94, 96]。
一般来说,次生代谢产物和中间产物具有细胞毒性,在微生物细胞异源合成时,将大麻素合成酶与微生物细胞天然靶向序列融合表达,将大麻素合成酶定位于液泡或者排出细胞可以降低大麻素和过氧化氢对细胞的损伤。虽然大肠杆菌由于其便于操作、分子生物学工具容易获得,是目前应用最多的微生物宿主,但是由于包涵体的形成,在大肠杆菌中表达THCAS无功能活性,所以在原核宿主中表达真核酶还需要解决很多问题,比如mRNA和蛋白质的稳定性、翻译后修饰以及包涵体的形成等[97-98]。目前,酵母细胞是大麻素异源生物合成的主要宿主。Zirpel等在P. pastoris中成功表达了用液泡蛋白酶A的靶向序列替换了THCAS的N端分泌信号肽的重组THCAS,利用全细胞催化将1 mmol/L CBGA成功转化为0.36 g/L Δ9-THCA[99],之后该团队又将NphB和THCAS联合在P. pastoris中表达,并成功地将OLA和GPP转化成Δ9-THCA[88]。Lange等用S. cerevisiae 的α交配因子信号肽序列替换了THCAS的天然信号肽,将重组THCAS基因整合到P. pastoris MutS KM71 KE1基因组中,在分批补料发酵方式下转化150 µmol/L CBGA产生20 µmol/L Δ9-THCA[100]。若在P. pastoris MutSKM71 KE1中表达THCAS,随后通过单步色谱法进行分离,并将其应用在己烷/水两液相装置中,可以以毫克规模合成Δ9-THCA[97]。2019年,Keasling团队以具有完整己酰辅酶A合成途径和OLA合成途径的S. cerevisiae为宿主,表达THCAS后该菌株以半乳糖为唯一碳源发酵生产了2.3 mg/L THCA,而在表达CBDAS后,CBDA的产量仅为4.2 µg/L;在增加THCAS和CBDAS基因拷贝数之后,Δ9-THCA的产量达到了8.0 mg/L,而CBDA的产量没有明显变化,这一现象说明重组CBDAS在酵母细胞内催化活性较低[82]。THCAS和CBDAS作用机制的阐明,有助于利用理性设计和酶的定向进化等技术对合成酶进行优化,通过实现Δ9-THCA和CBDA的有效合成和提高前体利用水平,能够促进大麻素规模化生物合成进程。同时,CBGA氧化环化过程中FAD循环再生释放过氧化氢会损伤大麻素合成酶活性,将大麻素合成酶与过氧化氢酶组合表达或许可以克服这一障碍。
3 植物大麻素规模化生产策略随着对Δ9-THC和CBD应用价值的深度发掘和药用Δ9-THC和CBD标准化制剂需求量增加,Δ9-THC和CBD在制药工业中实现规模化生产迫在眉睫。目前,Δ9-THC和CBD的主要来源是从大麻中直接提取,但从提取物中获得的每一类化合物的数量不仅取决于提取方法,还取决于植物的种植位置、年龄、提取的组织和生长条件[1, 101]。同时,大麻素含量高的大麻品种在种植上仍受到政策限制,通过育种方法培育产生特定种类化合物的大麻植株需要巨大的财政和科学努力[102]。其次,提取物中成分复杂,需要进一步对粗提物富集和分离纯化,过程烦琐,大规模生产收益低,产物不具备优良的市场竞争力[103]。虽然植物组织培养技术的发展为大麻素的潜在高产提供了机会,但是次生代谢产物的合成受到植物器官和组织的发育阶段以及控制该阶段的基因影响,而且需要一个有效的策略进行植物组织再生诱导[104]。一直以来,THC类和CBD的化学合成方法的核心步骤是从易得化合物中获得芳香族部分,然后采用不同的方法引入或者构建环己基部分[105]。然而,化学合成步骤往往十分繁琐,并且合成途径中产生的杂质难以分离。由于生物活性物质往往具有结构依赖性,化学合成并不能有效生产特定结构的生物活性化合物,这些因素极大地限制了大麻素类化合物的规模化生产[105]。也有研究者提出合成生物化学是大麻素规模化生产的有力方法,然而在细胞外大规模地构建包含数十种酶、相关辅因子和无数代谢物的高度复杂的系统是一个巨大的挑战[73, 83, 106];而且THCAS和CBDAS水溶性极低,催化过程中又涉及过氧化氢的氧化还原,同时GBGAS又是一种膜结合蛋白,采用无细胞合成系统规模化生产Δ9-THC和CBD面临成本和效益问题[99]。近年来,在分子水平对生命系统进行重新设计和改造思路的实现使得合成生物学成为制药工业的新起之秀。2019年,Keasling团队在S. cerevisiae中引入及改造了近20个来自不同物种的基因,实现了天然大麻素以及非天然大麻素的完全生物合成。该研究也充分证实了将植物来源的酶转化到微生物细胞中生产Δ9-THCA和CBDA,然后通过非酶脱羧反应转化为中性形式的Δ9-THC和CBD是具有极大潜力的替代途径[82]。然而,这一途径的实现要考虑表达异源蛋白质的现代分子生物学工具(比如载体、启动子和信号肽) 和宿主的遗传背景[107],需要使中心代谢的碳通量有效转移到产品合成途径上来,同时需要解决次级代谢酶的低表达水平以及产物毒性对细胞的损伤等多方面的问题[74]。尽管最后CBDA的产量仅有4.2 µg/L,但这一里程碑式的研究为未来更广泛的大麻素合成研究提供了借鉴,也为植物大麻素类新药的研发提供了新的策略。
4 总结与展望近年来,大麻素类化合物Δ9-THC和CBD生物合成所涉及的所有关键酶基因和特征的阐明,为利用生物技术、分子生物学和合成生物学相结合的方法构建微生物细胞工厂生产这些化合物奠定了基础。未来通过优化微生物宿主耐受性、完善异源生物合成途径、增加前体供给和降低副产物积累、发酵放大及培养条件优化等构建稳定高效的微生物细胞工厂可以彻底改变药用大麻素的生产现状。此外,微生物发酵生产可以支持新大麻素的设计。光谱技术和分析技术的发展使得我们可以更好地鉴定和分离新的微量大麻素,对这些极具前景的化合物的研究最终可能产生新的更好的药物。
| [1] |
Żuk-Gołaszewska K, Gołaszewski J. Cannabis sativa L. — cultivation and quality of raw material. J Elementol, 2018, 23(3): 971-984.
|
| [2] |
Ben Amar M. Cannabinoids in medicine: a review of their therapeutic potential. J Ethnopharmacol, 2006, 105(1/2): 1-25.
|
| [3] |
Brand EJ, Zhao ZZ. Cannabisin Chinese medicine: are some traditional indications referenced in ancient literature related to cannabinoids?. Front Pharmacol, 2017, 8: 108.
|
| [4] |
Zuardi AW. History of cannabis as a medicine: a review. Braz J Psychiatry, 2006, 28(2): 153-157. DOI:10.1590/S1516-44462006000200015
|
| [5] |
Elsohly MA, Radwan MM, Gul W, et al. Phytochemistry of Cannabis sativa L.. Prog Chem Org Nat Prod, 2017, 103: 1-36.
|
| [6] |
Adams R, Hunt M, Clark JH. Structure of cannabidiol, a product isolated from the marihuana extract of Minnesota wild hemp. I. J Am Chem Soc, 1940, 62(1): 196-200. DOI:10.1021/ja01858a058
|
| [7] |
Mechoulam R, Gaoni Y. A total synthesis of Dl-Δ1-tetrahydrocannabinol, the active constituent of hashish. J Am Chem Soc, 1965, 87(14): 3273-3275.
|
| [8] |
Pertwee RG. Cannabinoid pharmacology: the first 66 years. Brit J Pharmacol, 2006, 147(S1): S163-S171. DOI:10.1038/sj.bjp.0706406
|
| [9] |
Piomelli D. More surprises lying ahead. The endocannabinoids keep us guessing. Neuropharmacology, 2014, 76: 228-234. DOI:10.1016/j.neuropharm.2013.07.026
|
| [10] |
Hill KP, Palastro MD. Medical cannabisfor the treatment of chronic pain and other disorders: misconceptions and facts. Pol Arch Intern Med, 2017, 127(11): 785-789.
|
| [11] |
Belackova V, Stefunkova M. Interpreting the Czech drug decriminalization: the glass is half full-Response to Cerveny, J., Chomynova, P., Mravcik, V. & van Ours, J.C. (2017). Cannabis decriminalization and the age of onset of cannabis use. Int J Drug Policy, 2018, 52: 102-105. DOI:10.1016/j.drugpo.2017.10.010
|
| [12] |
Belackova V, Wilkins C. Consumer agency in cannabis supply—Exploring auto-regulatory documents of the cannabissocial clubs in Spain. Int J Drug Policy, 2018, 54: 26-34. DOI:10.1016/j.drugpo.2017.12.018
|
| [13] |
Di Marzo V, Piscitelli F. The endocannabinoid system and its modulation by phytocannabinoids. Neurotherapeutics, 2015, 12(4): 692-698. DOI:10.1007/s13311-015-0374-6
|
| [14] |
Guindon J, Hohmann AG. The endocannabinoid system and pain. Cns Neurol Disord Drug Targets, 2009, 8(6): 403-421. DOI:10.2174/187152709789824660
|
| [15] |
Cunha P, Romão AM, Mascarenhas-Melo F, et al. Endocannabinoid system in cardiovascular disorders——new pharmacotherapeutic opportunities. J Pharm Bioallied Sci, 2011, 3(3): 350-360. DOI:10.4103/0975-7406.84435
|
| [16] |
Galve-Roperh I, Chiurchiù V, Díaz-Alonso J, et al. Cannabinoid receptor signaling in progenitor/stem cell proliferation and differentiation. Prog Lipid Res, 2013, 52(4): 633-650. DOI:10.1016/j.plipres.2013.05.004
|
| [17] |
Pagotto U, Marsicano G, Cota D, et al. The emerging role of the endocannabinoid system in endocrine regulation and energy balance. Endocr Rev, 2006, 27(1): 73-100. DOI:10.1210/er.2005-0009
|
| [18] |
Di Marzo V, Matias I. Endocannabinoid control of food intake and energy balance. Nat Rev Neurosci, 2005, 8(5): 585-589. DOI:10.1038/nn1457
|
| [19] |
Poleszak E, Wośko S, Slawińska K, et al. Cannabinoids in depressive disorders. Life Sci, 2018, 213: 18-24. DOI:10.1016/j.lfs.2018.09.058
|
| [20] |
Oddi S, Scipioni L, Maccarrone M. Endocannabinoid system and adult neurogenesis: a focused review. Curr Opin Pharmacol, 2020, 50: 25-32. DOI:10.1016/j.coph.2019.11.002
|
| [21] |
Fernández-Ruiz J. The biomedical challenge of neurodegenerative disorders: an opportunity for cannabinoid-based therapies to improve on the poor current therapeutic outcomes. Brit J Pharmacol, 2019, 176(10): 1370-1383. DOI:10.1111/bph.14382
|
| [22] |
Giacovazzo G, Bisogno T, Piscitelli F, et al. Different routes to inhibit fatty acid amide hydrolase: do all roads lead to the same place?. Int J Mol Sci, 2019, 20(18): 4503. DOI:10.3390/ijms20184503
|
| [23] |
Pacher P, Mechoulam R. Is lipid signaling through cannabinoid 2 receptors part of a protective system?. Prog Lipid Res, 2011, 50(2): 193-211. DOI:10.1016/j.plipres.2011.01.001
|
| [24] |
Pacher P, Bátkai S, Kunos G. The endocannabinoid system as an emerging target of pharmacotherapy. Pharmacol Rev, 2006, 58(3): 389-462. DOI:10.1124/pr.58.3.2
|
| [25] |
Marzo D, Vincenzo. Targeting the endocannabinoid system: to enhance or reduce?. Nat Rev Drug Discov, 2008, 7(5): 438-455. DOI:10.1038/nrd2553
|
| [26] |
Bouaboula M, Perrachon S, Milligan L, et al. A selective inverse agonist for central cannabinoid receptor inhibits mitogen-activated protein kinase activation stimulated by insulin or insulin-like growth factor 1. Evidence for a new model of receptor/ligand interactions. J Biol Chem, 1997, 272(35): 22330-22339. DOI:10.1074/jbc.272.35.22330
|
| [27] |
Console-Bram L, Marcu J, Abood ME. Cannabinoid receptors: nomenclature and pharmacological principles. Prog Neuro-Psychopharmacol Biol Psychiatry, 2012, 38(1): 4-15. DOI:10.1016/j.pnpbp.2012.02.009
|
| [28] |
Cunningham CW. Plant-based modulators of endocannabinoid signaling. J Nat Prod, 2019, 82(3): 636-646. DOI:10.1021/acs.jnatprod.8b00874
|
| [29] |
Yin AQ, Wang F, Zhang X. Integrating endocannabinoid signaling in the regulation of anxiety and depression. Acta Pharmacol Sin, 2019, 40(3): 336-341. DOI:10.1038/s41401-018-0051-5
|
| [30] |
Esteban PF, Garcia-Ovejero D, Paniagua-Torija B, et al. Revisiting CB1 cannabinoid receptor detection and the exploration of its interacting partners. J Neurosci Meth, 2020, 337: 108680. DOI:10.1016/j.jneumeth.2020.108680
|
| [31] |
Dariš B, Verboten MT, Knez Z, et al. Cannabinoids in cancer treatment: therapeutic potential and legislation. Bosn J Basic Med Sci, 2019, 19(1): 14-23. DOI:10.17305/bjbms.2018.3532
|
| [32] |
Guggenhuber S, Romo-Parra H, Bindila L, et al. Impaired 2-AG signaling in hippocampal glutamatergic neurons: aggravation of anxiety-like behavior and unaltered seizure susceptibility. Int J Neuropsychopharmacol, 2015, 19(2): 1-13.
|
| [33] |
Lomazzo E, Bindila L, Remmers F, et al. Therapeutic potential of inhibitors of endocannabinoid degradation for the treatment of stress-related hyperalgesia in ananimal model ofchronic pain. Neuropsy Chopharmacol, 2015, 40(2): 488-501. DOI:10.1038/npp.2014.198
|
| [34] |
Ivy D, Palese F, Vozella V, et al. Cannabinoid CB2 receptors mediate the anxiolytic-like effects of monoacylglycerol lipase inhibition in a rat model of predator-induced fear. Neuropsychopharmacology, 2020, 45(8): 1330-1338. DOI:10.1038/s41386-020-0696-x
|
| [35] |
Ducobu J, Sternon J. Rimonabant (Acomplia), specific inhibitor of the endocannabinoid system. Rev Med Brux, 2005, 26(3): 165-168.
|
| [36] |
Reddy NN, Rao NP, Venkatasubramanian G, et al. Rimonabant-induced catatonia in schizophrenia: a case report. Obes Res Clin Pract, 2009, 3(4): 237-239. DOI:10.1016/j.orcp.2009.04.002
|
| [37] |
Stasiulewicz A, Znajdek K, Grudzień M, et al. A guide to targeting the endocannabinoid system in drug design. Int J Mol Sci, 2020, 21(8): 2778. DOI:10.3390/ijms21082778
|
| [38] |
Fraguas-Sánchez AI, Torres-Suárez AI. Medical use of cannabinoids. Drugs, 2018, 78(16): 1665-1703. DOI:10.1007/s40265-018-0996-1
|
| [39] |
Andre CM, Hausman JF, Guerriero G. Cannabis sativa: the plant of the thousand and one molecules. Front Plant Sci, 2016, 7: 19.
|
| [40] |
Par Pharmaceutical Companies, Inc. . Par Pharmaceutical Receives Final Approval to Market Generic Marinol CⅢ Dronabinol Capsules. Website: http://www.parpharm.com, 2008.
|
| [41] |
May MB, GlodeAE. Dronabinolforchemotherapy- induced nausea and vomiting unresponsive to antiemetics. Cancer Manag Res, 2016, 8: 49-55.
|
| [42] |
Pergolizzi JV Jr, Taylor R, LeQuang JA, et al. Concise review of the management of iatrogenic emesis using cannabinoids: emphasis on nabilone for chemotherapy-induced nausea and vomiting. Cancer Chemother Pharmacol, 2017, 79(3): 467-477. DOI:10.1007/s00280-017-3257-1
|
| [43] |
Badowski ME, Yanful PK. Dronabinol oral solution in the management of anorexia and weight loss in AIDS and cancer. Ther Clin Risk Manag, 2018, 14: 643-651. DOI:10.2147/TCRM.S126849
|
| [44] |
Englund A, Morrison PD, Nottage J, et al. Cannabidiol inhibits THC-elicited paranoid symptoms and hippocampal-dependent memory impairment. J Psychopharmacol, 2013, 27(1): 19-27. DOI:10.1177/0269881112460109
|
| [45] |
Freeman AM, Petrilli K, Lees R, et al. How does cannabidiol (CBD) influence the acute effects of delta-9-tetrahydrocannabinol (THC) in humans? A systematic review. Neurosci Biobehav Rev, 2019, 107: 696-712. DOI:10.1016/j.neubiorev.2019.09.036
|
| [46] |
MacCallum CA, Russo EB. Practical considerations in medical cannabis administration and dosing. Eur J InternMed, 2018, 49: 12-19.
|
| [47] |
Collin C, Ehler E, Waberzinek G, et al. A double-blind, randomized, placebo-controlled, parallel-group study of Sativex, in subjects with symptoms of spasticity due to multiple sclerosis. Neurol Res, 2010, 32(5): 451-459. DOI:10.1179/016164109X12590518685660
|
| [48] |
Schoedel KA, Chen N, Hilliard A, et al. A randomized, double-blind, placebo-controlled, crossover study to evaluate the subjective abuse potential and cognitive effects of nabiximols oromucosal spray in subjects with a history of recreational cannabis use. Hum Psychopharmacol, 2011, 26(3): 224-236.
|
| [49] |
Singh J, Neary JP. Neuroprotection following concussion: the potential role for cannabidiol. Can J Neurol Sci, 2020, 47(3): 289-300. DOI:10.1017/cjn.2020.23
|
| [50] |
Thompson KJ, Tobin AB. Crosstalk between the M1 muscarinic acetylcholine receptor and the endocannabinoid system: a relevance for Alzheimer's disease?. Cell Signal, 2020, 70: 109545. DOI:10.1016/j.cellsig.2020.109545
|
| [51] |
Junior NCF, Dos-Santos-Pereira M, Guimaraes FS, et al. Cannabidiol and cannabinoid compounds as potential strategies for treating Parkinson's disease and L-DOPA-induced dyskinesia. Neurotox Res, 2020, 37(1): 12-29. DOI:10.1007/s12640-019-00109-8
|
| [52] |
Han QW, Yuan YH, Chen NH. The therapeutic role of cannabinoid receptors and its agonists or antagonists in Parkinson's disease. Prog Neuro-Psychopharmacol Biol Psychiatry, 2020, 96: 109745. DOI:10.1016/j.pnpbp.2019.109745
|
| [53] |
Muthumalage T, Rahman I. Cannabidiol differentially regulates basal and LPS-induced inflammatory responses in macrophages, lung epithelial cells, and fibroblasts. Toxicol Appl Pharmacol, 2019, 382: 114713. DOI:10.1016/j.taap.2019.114713
|
| [54] |
Jadoon KA, Ratcliffe SH, Barrett DA, et al. Efficacy and safety of cannabidiol and tetrahydrocannabivarin on glycemic and lipid parameters in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled, parallel group pilot study. Diabetes Care, 2016, 39(10): 1777-1786. DOI:10.2337/dc16-0650
|
| [55] |
Wise J. European drug agency approves cannabis-based medicine for severe forms of epilepsy. BMJ, 2019, 366: l5708.
|
| [56] |
Friedman D, French JA, Maccarrone M. Safety, efficacy, and mechanisms of action of cannabinoids in neurological disorders. Lancet Neurol, 2019, 18(5): 504-512. DOI:10.1016/S1474-4422(19)30032-8
|
| [57] |
Namdar D, Voet H, Ajjampura V, et al. Terpenoids and phytocannabinoids co-produced in Cannabis Sativa strains show specific interaction for cell cytotoxic activity. Molecules, 2019, 24(17): 3031. DOI:10.3390/molecules24173031
|
| [58] |
Citti C, Linciano P, Russo F, et al. A novel phytocannabinoid isolated from Cannabis sativa L. with an in vivo cannabimimetic activity higher than Δ9-tetrahydrocannabinol: Δ9-tetrahydrocannabiphorol. Sci Rep, 2019, 9: 20335. DOI:10.1038/s41598-019-56785-1
|
| [59] |
Abioye A, Ayodele O, Marinkovic A, et al. Δ9-tetrahydrocannabivarin (THCV): acommentary on potential therapeutic benefit for the management of obesity and diabetes. J Cannabis Res, 2020, 2(5): 91-104.
|
| [60] |
Taura F, Tanaya R, Sirikantaramas S. Recent advances in cannabinoid biochemistry and biotechnology. Sci Asia, 2019, 45(5): 399-407. DOI:10.2306/scienceasia1513-1874.2019.45.399
|
| [61] |
Gagne SJ, Stout JM, Liu EW, et al. Identification of olivetolic acid cyclase from Cannabis sativa reveals a unique catalytic route to plant polyketides. Proc Natl Acad Sci USA, 2012, 109(31): 12811-12816. DOI:10.1073/pnas.1200330109
|
| [62] |
Taura F, Tanaka S, Taguchi C, et al. Characterization of olivetol synthase, a polyketide synthase putatively involved in cannabinoid biosynthetic pathway. FEBS Lett, 2009, 583(12): 2061-2066. DOI:10.1016/j.febslet.2009.05.024
|
| [63] |
Qian S, Clomburg JM, Gonzalez R. Engineering Escherichia coli as a platform for the in vivo synthesis of prenylated aromatics. Biotechnol Bioeng, 2019, 116(5): 1116-1127. DOI:10.1002/bit.26932
|
| [64] |
Kuzuyama T, Noel JP, Richard SB. Structural basis for the promiscuous biosynthetic prenylation of aromatic natural products. Nature, 2005, 435(7044): 983-987. DOI:10.1038/nature03668
|
| [65] |
Bloemendal V, Van Hest JCM, Rutjes F. Synthetic pathways to tetrahydrocannabinol (THC): an overview. Org Biomol Chem, 2020, 18(17): 3203-3215. DOI:10.1039/D0OB00464B
|
| [66] |
Gülck T, Møller BL. Phytocannabinoids: origins and biosynthesis. Trends Plant Sci, 2020, 25(10): 985-1004. DOI:10.1016/j.tplants.2020.05.005
|
| [67] |
Shimizu Y, Ogata H, Goto S. Discriminating the reaction types of plant type Ⅲ polyketide synthases. Bioinformatics, 2017, 33(13): 1937-1943. DOI:10.1093/bioinformatics/btx112
|
| [68] |
Yang XM, Matsui T, Kodama T, et al. Structural basis for olivetolic acid formation by a polyketide cyclase from Cannabis sativa. FEBS J, 2016, 283(6): 1088-1106. DOI:10.1111/febs.13654
|
| [69] |
Tan ZG, Clomburg JM, Gonzalez R. Synthetic pathway for the production of olivetolic acid in Escherichia coli. ACS Synth Biol, 2018, 7(8): 1886-1896. DOI:10.1021/acssynbio.8b00075
|
| [70] |
Kearsey LJ, Prandi N, Karuppiah V, et al. Structure of the Cannabis sativa olivetol-producing enzyme reveals cyclization plasticity in type Ⅲ polyketide synthases. FEBS J, 2020, 287(8): 1511-1524. DOI:10.1111/febs.15089
|
| [71] |
Kirby J, Keasling JD. Biosynthesis of plant isoprenoids: perspectives for microbial engineering. Annu Rev Plant Biol, 2009, 60: 335-355. DOI:10.1146/annurev.arplant.043008.091955
|
| [72] |
Vranová E, Coman D, Gruissem W. Network analysis of the MVA and MEP pathways for isoprenoid synthesis. Annu Rev Plant Biol, 2013, 64: 665-700. DOI:10.1146/annurev-arplant-050312-120116
|
| [73] |
Li MJ, Hou FF, Wu T, et al. Recent advances of metabolic engineering strategies in natural isoprenoid production using cell factories. Nat Prod Rep, 2020, 37(1): 80-99. DOI:10.1039/C9NP00016J
|
| [74] |
Valliere MA, Korman TP, Woodall NB, et al. A cell-free platform for the prenylation of natural products and application to cannabinoid production. Nat Commun, 2019, 10: 565. DOI:10.1038/s41467-019-08448-y
|
| [75] |
Wang CL, Zada B, Wei GY, et al. Metabolic engineering and synthetic biology approaches driving isoprenoid production in Escherichia coli. Bioresour Technol, 2017, 241: 430-438. DOI:10.1016/j.biortech.2017.05.168
|
| [76] |
Vickers CE, Williams TC, Peng BY, et al. Recent advances in synthetic biology for engineering isoprenoid production inyeast. Curr Opin Chem Biol, 2017, 40: 47-56. DOI:10.1016/j.cbpa.2017.05.017
|
| [77] |
Banerjee A, Wu Y, Banerjee R, et al. Feedback inhibition of deoxy-D-xylulose-5-phosphate synthase regulates the methylerythritol 4-phosphate pathway. J Biol Chem, 2013, 288(23): 16926-16936. DOI:10.1074/jbc.M113.464636
|
| [78] |
Daletos G, Katsimpouras C, Stephanopoulos G. Novel strategies and platforms for industrial isoprenoid engineering. Trends Biotechnol, 2020, 38(7): 811-822. DOI:10.1016/j.tibtech.2020.03.009
|
| [79] |
Yao Z, Zhou PP, Su BM, et al. Enhanced isoprene production by reconstruction of metabolic balance between strengthened precursor supply and improved isoprene synthase in Saccharomyces cerevisiae. ACS Synth Biol, 2018, 7(9): 2308-2316. DOI:10.1021/acssynbio.8b00289
|
| [80] |
Kempinski C, Jiang ZD, Bell S, et al. Metabolic engineering of higher plants and algae for isoprenoid production//Schrader J, Bohlmann J, Eds. Biotechnology of Isoprenoids. Cham: Springer, 2015: 161-199.
|
| [81] |
Zhao JZ, Bao XM, Li C, et al. Improving monoterpene geraniol production through geranyl diphosphate synthesis regulation in Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 2016, 100(10): 4561-4571. DOI:10.1007/s00253-016-7375-1
|
| [82] |
Luo XZ, Reiter MA, D'Espaux L, et al. Complete biosynthesis of cannabinoids and their unnatural analogues in yeast. Nature, 2019, 567(7746): 123-126. DOI:10.1038/s41586-019-0978-9
|
| [83] |
Chatzivasileiou AO, Ward V, Edgar SM, et al. Two-step pathway for isoprenoid synthesis. Proc Natl Acad Sci USA, 2019, 116(2): 506-511. DOI:10.1073/pnas.1812935116
|
| [84] |
Valliere MA, Korman TP, Arbing MA, et al. A bio-inspired cell-free system for cannabinoid production from inexpensive inputs. Nat Chem Biol, 2020.
|
| [85] |
Fellermeier M, Zenk MH. Prenylation of olivetolate by a hemp transferase yields cannabigerolic acid, the precursor of tetrahydrocannabinol. FEBS Lett, 1998, 427(2): 283-285. DOI:10.1016/S0014-5793(98)00450-5
|
| [86] |
Page JE, Boubakir Z. Aromatic prenyltransferase from Cannabis: US, 9765308. 2017-09-19.
|
| [87] |
Kumano T, Richard SB, Noel JP, et al. Chemoenzymatic syntheses of prenylated aromatic small molecules using Streptomyces prenyltransferases with relaxed substrate specificities. Bioorg Med Chem, 2008, 16(17): 8117-8126. DOI:10.1016/j.bmc.2008.07.052
|
| [88] |
Zirpel B, Degenhardt F, Martin C, et al. Engineering yeasts as platform organisms for cannabinoid biosynthesis. J Biotechnol, 2017, 259: 204-212. DOI:10.1016/j.jbiotec.2017.07.008
|
| [89] |
Sirikantaramas S, Taura F, Tanaka Y, et al. Tetrahydrocannabinolic acid synthase, the enzyme controlling marijuana psychoactivity, is secreted into the storage cavity of the glandular trichomes. Plant Cell Physiol, 2005, 46(9): 1578-1582. DOI:10.1093/pcp/pci166
|
| [90] |
Taura F, Morimoto S, Shoyama Y, et al. First direct evidence for the mechanism of DELTA.1- tetrahydrocannabinolic acid biosynthesis. J Am Chem Soc, 1995, 117(38): 9766-9767. DOI:10.1021/ja00143a024
|
| [91] |
Taura F, Sirikantaramas S, Shoyama Y, et al. Cannabidiolic-acid synthase, the chemotype- determining enzyme in the fiber-type Cannabis sativa. FEBS Lett, 2007, 581(16): 2929-2934. DOI:10.1016/j.febslet.2007.05.043
|
| [92] |
Taura F, Morimoto S, Shoyama Y. Purification and characterization of cannabidiolic-acid synthase from Cannabis sativa L. J Biol Chem, 1996, 271(29): 17411-17416. DOI:10.1074/jbc.271.29.17411
|
| [93] |
Zirpel B, Degenhardt F, Zammarelli C, et al. Optimization of Δ9-tetrahydrocannabinolic acid synthase production in Komagataella phaffii via post-translational bottleneck identification. J Biotechnol, 2018(272/273): 40-47.
|
| [94] |
Shoyama Y, Tamada T, Kurihara K, et al. Structure and function of Δ1-tetrahydrocannabinolic acid (THCA) synthase, the enzyme controlling the psychoactivity of Cannabis sativa. J Mol Biol, 2012, 423(1): 96-105. DOI:10.1016/j.jmb.2012.06.030
|
| [95] |
Sirikantaramas S, Morimoto S, Shoyama Y, et al. The gene controlling marijuana psychoactivity: molecular cloning and heterologous expression of Δ1-tetrahydrocannabinolic acid synthase from Cannabis sativa L. J Biol Chem, 2004, 279(38): 39767-39774. DOI:10.1074/jbc.M403693200
|
| [96] |
Zirpel B, Kayser O, Stehle F. Elucidation of structure-function relationship of THCA and CBDA synthase from Cannabis sativa L. J Biotechnol, 2018, 284: 17-26. DOI:10.1016/j.jbiotec.2018.07.031
|
| [97] |
Lange K, Schmid A, Julsing MK. Δ9-tetrahydrocannabinolic acid synthase production in Pichia pastoris enables chemical synthesis of cannabinoids. J Biotechnol, 2015, 211: 68-76. DOI:10.1016/j.jbiotec.2015.06.425
|
| [98] |
Kesidis A, Depping P, Lodé A, et al. Expression of eukaryotic membrane proteins in eukaryotic and prokaryotic hosts. Methods, 2020, 180: 3-18. DOI:10.1016/j.ymeth.2020.06.006
|
| [99] |
Zirpel B, Stehle F, Kayser O. Production of Δ9-tetrahydrocannabinolic acid from cannabigerolic acid by whole cells of Pichia (Komagataella) pastoris expressing Δ9-tetrahydrocannabinolic acid synthase from Cannabis sativa L. Biotechnol Lett, 2015, 37(9): 1869-1875. DOI:10.1007/s10529-015-1853-x
|
| [100] |
Lange K, Poetsch A, Schmid A, et al. Enrichment and identification of Δ9-tetrahydrocannabinolic acid synthase from Pichia pastoris culture supernatants. DataBrief, 2015, 4: 641-649.
|
| [101] |
Chandra S, Lata H, ElSohly MA, et al. Cannabis cultivation: methodological issues for obtaining medical-grade product. Epilepsy Behav, 2017, 70: 302-312. DOI:10.1016/j.yebeh.2016.11.029
|
| [102] |
Nguyen H, Malm A, Bouchard M. Production, perceptions, and punishment: restrictive deterrence in the context of cannabis cultivation. Int J Drug Policy, 2015, 26(3): 267-276. DOI:10.1016/j.drugpo.2014.08.012
|
| [103] |
Lewis MM, Yang Y, Wasilewski E, et al. Chemical profiling of medical cannabisextracts. ACS Omega, 2017, 2(9): 6091-6103. DOI:10.1021/acsomega.7b00996
|
| [104] |
Wróbel T, Dreger M, Wielgus K, et al. The application of plant in vitro cultures in cannabinoid production. Biotechnol Lett, 2018, 40(3): 445-454. DOI:10.1007/s10529-017-2492-1
|
| [105] |
Reekie TA, Scott MP, Kassiou M. The evolving science of phytocannabinoids. Nat Rev Chem, 2017, 2: 0101.
|
| [106] |
Jung B, Lee JK, Kim J, et al. Synthetic strategies for (-)-cannabidiol and its structural analogs. Chem Asian J, 2019, 14(21): 3749-3762. DOI:10.1002/asia.201901179
|
| [107] |
Carvalho Â, Hansen EH, Kayser O, et al. Designing microorganisms for heterologous biosynthesis of cannabinoids. FEMS Yeast Res, 2017, 17(4): 1-31.
|
 2021, Vol. 37
2021, Vol. 37