
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 夏梦, 张逸风, 高海云, 刘远, 吴晓毅, 高伟
- Xia Meng, Zhang Yifeng, Gao Haiyun, liu Yuan, Wu Xiaoyi, Gao Wei
- 异戊烯基焦磷酸转运对雷公藤甲素生物合成的影响
- Effect of isopentenyl pyrophosphate translocation on the biosynthesis of triptolide
- 生物工程学报, 2021, 37(6): 2039-2049
- Chinese Journal of Biotechnology, 2021, 37(6): 2039-2049
- 10.13345/j.cjb.200752
-
文章历史
- Received: November 25, 2020
- Accepted: February 18, 2021
2. 首都医科大学 药学院,北京 100069
2. School of Pharmaceutical Sciences, Capital Medical University, Beijing 100069, China
雷公藤甲素(Triptolide,C20H24O6) 为松香烷内酯型二萜化合物,具有3个环氧基团及1个α, β-不饱和五元内酯环,最早从植物雷公藤Tripterygium wilfordii Hook. f.中分离获得,具有显著的抗炎和免疫抑制作用[1-3]。目前,以其为主要成分开发的药品如雷公藤片、雷公藤内酯软膏等已广泛用于自身免疫性疾病的治疗。而随着雷公藤甲素药理研究的深入,发现雷公藤甲素及其相关衍生物还具有明显的抑制前列腺癌和胰腺癌等肿瘤细胞的活性[4-8],故扩大雷公藤甲素的来源对于新药开发具有一定的现实意义和临床价值。然而,由于雷公藤甲素在植物中的分离率仅为0.001%–0.004%,且其化学合成方法存在反应路线长、收率低以及反应条件苛刻等弊端[9],难以获得理想的产量。因此,研究影响雷公藤甲素生物合成的多方面因素,对于今后有针对性地利用生物技术手段合成雷公藤甲素,扩大其来源,具有一定的应用前景和意义。
现代研究表明,雷公藤甲素等萜类次生代谢产物生物合成的关键前体物质异戊烯基焦磷酸(Isopentenyl pyrophosphate,IPP) 既可经由质体中的2-甲基-D-赤藻糖醇-4-磷酸(2-methyl-D-erythritol- 4-phosphate pathway,MEP) 途径合成,也可通过细胞质中的甲戊二羟酸(Mevalonic acid pathway,MVA) 途径生成[10],且IPP可透过磷脂双分子层,在细胞质和质体间自由转运,使两条途径相互联系、互相干扰[11-12],如图 1所示。尽管两条途径均可产生IPP,且IPP可在两途径间自由转运,但研究发现,在不同次生代谢产物生物合成过程中,MVA和MEP途径提供IPP的数量与其化学结构和性质密切相关,IPP自由转运的发生时间与转运方向也存在一定的差异[12-16],例如:固醇和甾醇类化合物的生成合成由两条途径同时参与;柠檬苦素类似物的生物合成则仅受MVA途径影响;两条途径均参与紫杉醇的生物合成,其中MEP途径占主导,且两条途径之间IPP转运主要发生在红豆杉悬浮细胞生长后期,其方向是从细胞质到质体。
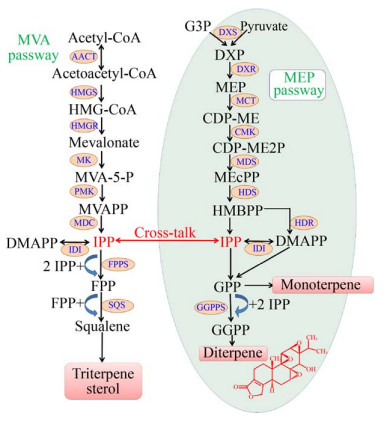
|
| 图 1 萜类次生代谢产物生物合成途径 Fig. 1 Biosynthetic pathway of terpenoids. AACT: acetoacetyl-CoA thiolase; HMGS: 3-hydroxy-3- methylglutaryl-CoA synthase; HMGR: 3-hydroxy-3- methylglutaryl coenzyme A reductase; MK: mevalonic acid kinase; PMK: phosphor-mevalonic acid kinase; MDC: mevalonic acid diphosphate decarboxylase; DXS: 1-deoxy-D-xylulose-5-phosphate synthase; DXR: 1-deoxy-D-xylulose 5-phosphate reductoisomerase; MCT: 2-C-methyl-D-erythritol-4-phosphate cytidylyltransferase; CMK: 4-(cytidine 5′-diphospho)-2-C-methyl-D-erythritol kinase; MDS: 2-C-methyl-D-erythritol-2, 4-cyclodiphosphate synthase; HDS: 4-hydroxy-3-methylbut-2-enyldiphosphate synthase; HDR: 4-hydroxy-3-methylbut-2-enyldiphosphate reductase; IDI: dimethylallyl diphosphate isomerase; GGPPS: geranylgeranyl diphosphate synthase; FPPS: farnesyl diphosphate synthase; SQS: squalene synthase. |
| |
目前,关于雷公藤甲素生物合成的研究多集中于功能基因挖掘、关键酶基因调控等方面[17-21],尚未见到IPP转运影响雷公藤生物合成的相关研究。雷公藤甲素生物合成过程中是否存在IPP自由转运,且两条途径之间IPP自由转运的时空特点及机制等关键科学问题仍亟待解决。因此,本研究以此为切入点,根据D, L-甘油醛(D, L-glyceraldehyde,DLG) 可阻断暗反应中碳的同化作用,且本身比长链糖更容易进入质体这一性质,选择其作为IPP转运的阻断剂[22]。同时,结合雷公藤悬浮细胞的生长特点,分别选择不同培养时期(7 d、14 d) 的细胞作为实验材料,分析DLG诱导前后不同时期细胞的活性及生物量、雷公藤甲素累积量及雷公藤甲素生物合成上游途径关键酶基因的变化规律,旨在探明雷公藤甲素生物合成过程中是否存在IPP的自由转运,且该转运过程是否存在一定的时间性和方向性,并通过相关性分析,从分子层面阐释IPP转运影响雷公藤甲素生物合成的机理,以期填补雷公藤甲素生物合成过程中IPP转运机制方面的空白。此研究的开展为雷公藤甲素生物合成途径的解析及其合成生物学关键技术的开发奠定了一定的理论基础,具有重要的现实意义。
1 材料与方法 1.1 材料、试剂与仪器雷公藤悬浮细胞由首都医科大学中药资源与分子生药学实验室继代保存。Murashige & Skoog (MS) 基本培养基购自美国PhytoTechnology Laboratories公司;激动素(Kinetin,KT)、2, 4-二氯苯氧乙酸(2, 4-D) 和吲哚-3-丁酸(IBA) 均购自美国Sigma公司;D, L-甘油醛(D, L-glyceraldehyde,DLG) 购自J & K ScientificⓇ公司;氯化三苯四氮唑(TTC) 购自Coolaber公司;雷公藤甲素购自上海源叶生物科技有限公司;甲硝唑购自中国食品药品检定研究院;乙腈、甲醇均为色谱纯试剂,购自美国Fisher公司;甲酸购自北京化工厂;KAPA SYBR FAST qPCR Master Mix Kit试剂盒购自美国KAPA Biosystems公司;总RNA提取试剂盒购自北京普洛麦格生物技术有限公司;Fast Quant RT kit (with gDNase) 试剂盒购自北京天根生化科技有限公司。Agilent1290/6490超高效液相色谱-三重四级杆串联质谱联用仪(UPLC-QQQ-MS,美国Agilent Technologies公司);实时荧光定量PCR仪(qRT-PCR仪,美国Thermo Fisher Scientific公司,Quant Studio5)。
1.2 方法 1.2.1 雷公藤悬浮细胞培养选取2.0 g生长良好、质地疏松、生长状况基本一致的雷公藤悬浮细胞,接种于40 mL含0.5 mg/L 2, 4-D+0.5 mg/L IBA+0.1 mg/L KT的MS液体培养基中,在25 ℃、黑暗、120 r/min的条件下进行悬浮培养,每25 d继代1次。
1.2.2 抑制剂DLG外源性诱导雷公藤悬浮细胞精密称取一定量的DLG溶解于DMSO中,浓度为400 mmol/L,过0.22 µm微孔滤膜后作为母液备用。分别在雷公藤悬浮细胞培养7 d和14 d,向实验组加入100 μL DLG母液使其终浓度达到1 mmol/L,向空白对照组(CK) 加入等体积DMSO,继续悬浮培养。诱导后0 h、24 h、72 h、120 h和168 h取样,除部分直接进行细胞活性和基因表达量测定外,其余样品于–80 ℃条件下冻存备用。每组3个生物学重复。
1.2.3 细胞活性及细胞生物量测定细胞活性测定:取0.2 g新鲜雷公藤悬浮细胞,加入2.5 mL TTC溶液(0.2 g TTC溶于50 mL 0.1 mol/L的磷酸缓冲液),于室温反应14 h,去除TTC溶液,用蒸馏水清洗3次,随后收集细胞,加入5 mL甲醇,60 ℃恒温水浴50 min,室温静置至细胞完全无色,8 000 r/min离心5 min,取上清液,在485 nm处测定其吸光值。
细胞生物量测定:取1.2.1中冻存在–80 ℃下的雷公藤悬浮细胞,冷冻干燥24 h后精确称重。
1.2.4 雷公藤甲素含量测定供试品溶液制备:精确称取一定量经冷冻干燥后的雷公藤悬浮细胞,置于15 mL离心管中,按质量体积比1:30加入80%甲醇,称重,浸泡过夜后,超声提取1 h,补足失重。提取液过0.22 μm微孔滤膜,备用。
标准品溶液制备:精确称取一定量的雷公藤甲素标准品,甲醇溶解,得浓度为9.20 µg/mL标准品储备液。精确称取一定量甲硝唑标准品,甲醇定容,得浓度为29.00 µg/mL甲硝唑内标储备液,将雷公藤甲素标准品储备液和甲硝唑内标储备液置于4 ℃冰箱中保存备用。
雷公藤甲素UPLC-QQQ-MS含量测定:精确量取一定量的雷公藤甲素标准品储备液,倍比稀释,制成一系列浓度分别为9.20 μg/mL、2.30 μg/mL、1.15 μg/mL、0.575 μg/mL、0.287 5 μg/mL的标准品溶液。在供试品和标准品溶液中添加一定量的甲硝唑内标储备液,使其浓度为4.83 μg/mL,按照以下色谱和质谱条件,进样测定。以标准品峰面积(Yi) 与内标峰面积(Ys) 的比值(Yi/Ys) 和其对应的标准品浓度(X) 作线性回归,绘制标准曲线,并根据所绘制的标准曲线计算供试品中雷公藤甲素含量。
色谱条件:Waters HSS T3 C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱(0–2 min 60% A,2–8 min 60%–35% A,8–10 min 35%–20% A,10–13 min 20%–10% A,13–16 min 10% A);柱温40 ℃;流速0.3 mL/min;进样量为5 μL。质谱条件:电喷雾离子源ESI,正离子状态下采用多反应监测模式(MRM);干燥气体为N2,温度200 ℃,气体流速14 L/min;雾化气体为N2,压力为137.9 kPa;鞘气气体为N2,温度400 ℃,气体流速11 L/min;毛细管电压为3 000 V,雷公藤甲素及内标物甲硝唑的质谱分析条件参数分别为361.1→128.0 (50 eV,定量离子)、105.0 (50 eV) 和172.0→127.9 (15 eV,定量离子)、82.0 (15 eV)。
1.2.5 雷公藤甲素生物合成途径上关键酶基因表达分析利用总RNA提取试剂盒提取雷公藤悬浮细胞RNA,并使用FastQuant RT kit (with gDNase)试剂盒,将其反转录成cDNA。以β-actin为内参基因,按照引物设计原则分别设计出适合TwDXR、TwHDR、TwHMGR、TwHMGS和β-actin实时定量扩增的引物序列,见表 1。根据KAPA SYBR FAST qPCR Master Mix Kit试剂盒说明书配制qRT-PCR反应体系和条件,反应结束后分析荧光值变化曲线和融解曲线。技术重复3次,采用2–ΔΔCT方法计算各基因相对表达量。
| Primer name | Primer sequence (5′-3′) |
| TwHMGS-F | CTGGAGGTAGGGAGCGAGAC |
| TwHMGS-R | CCATAGCAGGCATTGGTTGA |
| TwHMGR-F | GGCTTCAAAGTGTTCATTGTT |
| TwHMGR-R | TTCATCCCCATTGCGTCA |
| TwDXR-F | TCAAGGATTGCCAGAGGG |
| TwDXR-R | ATGAATGATAGACTGCGGATG |
| TwHDR-F | AATGTTACTGTGAGACTGGCGG |
| TwHDR-R | GTTGGATTGTGTATGATTTCGTTGG |
| β-actin-F | AGGAACCACCGATCCAGACA |
| β-actin-R | GGTGCCCTGAGGTCCTGTT |
| TwHMGS: 3-hydroxy-3-methylglutaryl-coenzyme A synthase; TwHMGR: HMG-CoA reductase; TwDXR: 1-deoxy- dxylulose-5-phosphate reductoisomerase; TwHDR: 1-hydroxy-2-methyl-2-(E)-butenyl 4-diphosphate reductase. | |
采用SPSS软件对细胞活性、生物量和雷公藤甲素含量测定结果进行独立样本t检验,P < 0.05为显著差异。
2 结果与分析 2.1 DLG对不同培养时期的雷公藤悬浮细胞活性及生物量的影响培养7 d的雷公藤悬浮细胞经DLG诱导后,各时间点的细胞活性和生物量较CK组均无显著变化(图 2A、图 2C)。与此明显不同的是,培养14 d的雷公藤悬浮细胞在诱导后24 h和72 h时间点,其细胞活性分别较CK组下降了21.9%和52.2%,且存在显著性差异(图 2B),而随着细胞活性的下降,诱导后72 h、120 h和168 h三个时间点的细胞生物量也较CK组显著下降(图 2D)。由此发现,在雷公藤悬浮细胞培养早期(7 d),DLG外源性诱导对细胞活性和生物量无显著影响,但随着细胞培养时间的延长,在细胞培养后期(14 d),DLG外源性诱导则对细胞活性和生物量有着不同程度的抑制作用。
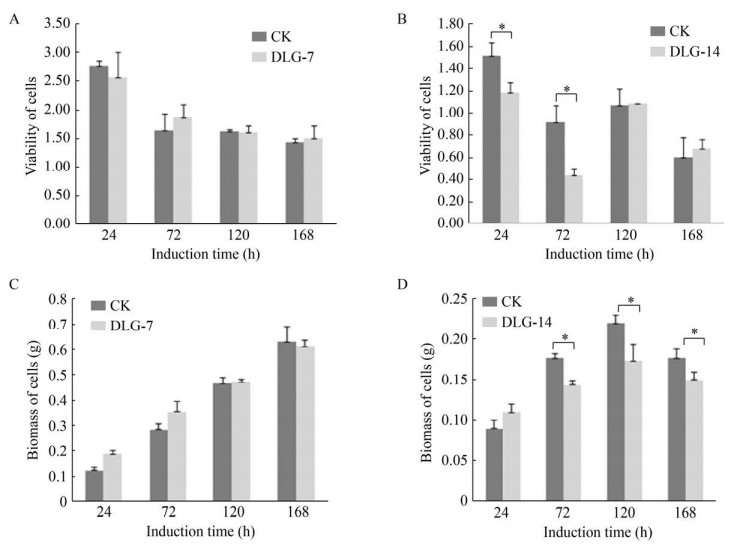
|
| 图 2 添加DLG对培养7 d、14 d雷公藤悬浮细胞细胞活性、生物量的影响 Fig. 2 Effects of adding D, L-glyceraldehyde (DLG) on cell viability and biomass accumulation of T. wilfordii suspension cells incubated for 7 d (A and C) and 14 d (B and D). Error bars: SD, n=3; *: P < 0.05. |
| |
结合雷公藤悬浮细胞生长规律,分析出现这一结果可能与以下两方面原因有关:一方面,从细胞自身而言,培养时间的延长使得细胞呼吸所产生的CO2更多地溶解于培养基中,易造成细胞悬浮液pH值下降,细胞生长环境变差,故培养14 d的细胞整体活性较培养7 d的细胞有所下降。另一方面,外源性抑制剂DLG的加入,使得细胞开启自身防御系统,合成一系列初生生长非必需的次生代谢产物,这些次生代谢产物的生成,不仅需要消耗部分细胞生物量,也会释放到培养基中进一步加重细胞生长环境的恶化,直接导致细胞活性显著下降的现象。与此同时,细胞活性的下降既在一定程度上影响了细胞生物量的累积,也造成了悬浮细胞对外源性刺激变得更为敏感,导致更多的细胞生物量被消耗以合成一系列用于自身防御的次生代谢产物。因此,培养14 d的细胞经诱导后,其细胞生物量也显著下降。
2.2 DLG对雷公藤甲素生物合成的影响 2.2.1 DLG对细胞培养不同时期雷公藤甲素累积量的影响培养7 d的雷公藤悬浮细胞经DLG诱导后,各时间点的雷公藤甲素累积量均显著高于CK组。其中,诱导后24 h,诱导组雷公藤甲素的含量较CK组增加4倍,但随着诱导时间的延长,两组间的差异逐渐减小,诱导组雷公藤甲素的含量仅较CK组增加2倍(图 3A)。与之相反,培养14 d的雷公藤悬浮细胞经DLG诱导后24 h,雷公藤甲素累积量较CK组降低了72.1%,而后各时间点雷公藤甲素累积量逐渐上升,但与CK组无显著差异(图 3B)。以上结果说明,在雷公藤悬浮细胞培养的不同时期,当对IPP转运进行阻断时,雷公藤甲素的累积量均发生不同程度的改变。

|
| 图 3 DLG对培养7 d、14 d雷公藤悬浮细胞内雷公藤甲素含量的影响 Fig. 3 Effects of DLG on contents of triptolide of T. wilfordii suspension cells incubated for 7 d (A) and 14 d (B). Error bars: SD, n=3; *: P < 0.05. |
| |
结合雷公藤甲素等二萜类次生代谢产物主要经由MEP途径合成这一科学观点,进一步对比分析不同细胞培养时期的数据。由于雷公藤甲素含量的变化与其关键前体物质IPP的累积量有一定的相关性,故在MVA和MEP途径间IPP转运被阻断的情况下,MEP途径合成的IPP对雷公藤甲素的累积起决定作用。因此,对于培养7 d的雷公藤悬浮细胞而言,诱导后雷公藤甲素含量的增加可能与以下两方面原因有关:一是“开源”,即DLG外源性诱导刺激MEP途径自身合成较多的IPP;二是“节流”,即从质体(MEP途径) 输出到细胞质(MVA途径) 的IPP减少。
然而,对于培养14 d的雷公藤悬浮细胞而言,经DLG诱导后,雷公藤甲素的含量出现先下降后上升的趋势,推测MEP途径中IPP的累积量也有着同样的变化规律。如果外源性诱导可刺激MEP途径自身合成较多的IPP,那么造成诱导后24 h内雷公藤甲素含量下降的原因是:从细胞质(MVA途径) 输入到质体(MEP途径) 的IPP有所减少,但随着诱导时间的延长,MEP途径中自身生成IPP逐渐增多。由此推断,在雷公藤甲素生物合成过程中存在IPP转运,且该过程具有一定的时空特点。
2.2.2 DLG对雷公藤甲素生物合成途径上关键酶基因表达量的影响为深入探究IPP转运影响雷公藤甲素生物合成的分子机制,探明外源性诱导剂DLG是否促进MEP途径生成IPP,进一步分析雷公藤甲素生物合成途径上部分关键酶基因在DLG外源性诱导作用下的动态变化规律。分别选择TwHMGS和TwHMGR以及TwDXR和TwHDR作为MVA和MEP途径上的关键酶基因进行基因表达量的分析。若外源性使用DLG能够刺激MEP途径生成IPP,那么对于不同培养时期的雷公藤悬浮细胞而言,诱导后MEP途径上游TwDXR和TwHDR基因表达量的趋势应该一致。实验结果显示,培养7 d的雷公藤悬浮细胞经DLG诱导后,MVA和MEP途径上游的关键酶基因表达量普遍低于CK组,但TwDXR经诱导后72 h和168 h两个时间点除外。与之相反,对于培养14 d的雷公藤悬浮细胞而言,除TwHMGS诱导后120 h、168 h和TwDXR诱导后168 h三个时间点的基因表达量较CK组降低,TwHDR诱导后168 h的基因表达量与CK组相近外,其余时间点各基因表达量均明显低于CK组,见图 4、图 5。由上述结果可知,在雷公藤悬浮细胞培养不同时期,当IPP转运被阻断后,MVA和MEP途径上游关键酶基因表达量的变化趋势不同,说明DLG不诱导MEP途径合成IPP,故在后续分析中,仅考虑DLG阻断IPP转运对雷公藤甲素累积的影响。

|
| 图 4 DLG对培养7 d雷公藤悬浮细胞基因表达量的影响 Fig. 4 Effects of DLG on relative transcript level of TwDXR (A), TwHDR (B), TwHMGR (C), and TwHMGS (D) T. wilfordii suspension cells incubated for 7 d. |
| |

|
| 图 5 DLG对培养14 d雷公藤悬浮细胞基因表达量的影响 Fig. 5 Effects of DLG on relative transcript level of TwDXR (A), TwHDR (B), TwHMGR (C) and TwHMGS (D) in T. wilfordii suspension cells incubated for 14 d. |
| |
结合2.2.1和2.2.2的数据结果,分析IPP转运、雷公藤甲素累积及其生物合成途径上关键酶基因表达三者之间的相关性。在细胞培养早期(7 d) 阻断IPP转运时,可阻断IPP流向MVA途径,造成MEP途径上的IPP短时间内大量堆积,使雷公藤甲素的累积量迅速升高。与此同时,为保证细胞内环境的稳定与平衡,降低IPP大量堆积造成的影响,MEP途径上游的关键酶基因出现负反馈调节,其表达量下降,进而减少了雷公藤甲素的累积,直接反映的结果就是诱导组与CK组雷公藤甲素的累积量差值逐渐变小。与之相反,细胞培养晚期(14 d) 则阻断了IPP流向MEP途径,使雷公藤甲素的累积量迅速下降,但随着MEP途径上游的关键酶基因正反馈调节的出现,诱导组雷公藤甲素的累积量逐渐升高。由此可以从内部分子机制佐证IPP转运存在于雷公藤甲素的生物合成过程中。由上述分析可推断雷公藤甲素生物合成过程中IPP转运的时空特点是:培养7 d的雷公藤悬浮细胞,IPP转运的方向主要是从质体输出到细胞质,而培养14 d的雷公藤悬浮细胞,IPP转运的方向则是从细胞质输入到质体。
3 讨论与结论对于外源性诱导子而言,其浓度的选择会直接影响实验结果的准确性和可信度。一般来说,当诱导子活性作用发挥最好,且不会破坏细胞正常生长的浓度即为外源性诱导的最适浓度。为确定本研究所用DLG的适宜浓度,对相关文献进行了归纳总结。根据文献报道,DLG外源性诱导植物悬浮细胞的浓度通常为1 mmol/L[23-24],因此文中也选择该浓度作为实验浓度。
通过本研究结果可知:在雷公藤甲素生物合成过程中,MVA与MEP途径间存在IPP转运。若单纯考虑这一交互作用,当阻断IPP转运后,MVA和MEP途径上的关键酶基因表达应该呈相反的趋势,这与本研究结果不一致。这可能是由于MVA和MEP途径上还存在其他前体物质,如FPP和GPP的转运[10],当IPP转运被阻断时,可能导致FPP和GPP在两条途径间的转运交流发生改变,代偿性地减少IPP转运被阻断造成的影响,故可能导致两途径上关键酶基因的表达呈现一致的现象,但具体原因还需通过后续深入的研究进一步分析。
在雷公藤甲素生物合成过程中,IPP转运呈现一定的时空特点,且当它被阻断的时候,雷公藤甲素的累积量及MVA和MEP途径上的关键酶基因表达量均发生了一定程度的改变,由此可推断雷公藤甲素的生物合成与MVA和MEP途径均有一定的相关性。为寻找MVA和MEP途径参与雷公藤甲素生物合成的直接证据,进一步探索性地使用MVA途径上关键酶基因HMGR的专一竞争性抑制剂为美伐他汀(MEV) 以及MEP途径上关键酶基因DXR的专一竞争性抑制剂磷铵霉素钠(FOS) 外源性诱导刺激雷公藤悬浮细胞从而阻断MVA或MEP途径[23]。当采用浓度为10 μmol/L MEV诱导后,雷公藤甲素的累积量下降了28.9%,当采用浓度为100 μmol/L FOS诱导后,雷公藤甲素的累积量下降了55.4%,由此说明MVA和MEP途径共同参与雷公藤甲素的生物合成。结合本文的实验结果,可得出结论:MVA和MEP途径共同参与雷公藤甲素的生物合成,且二者间存在交互作用(Crosstalk)。
本研究既能直接明确雷公藤甲素生物合成过程中IPP转运的时空特点及其相关分子机制,解析MVA和MEP途径共同参与雷公藤甲素生物合成的模式,完善雷公藤甲素生物合成的理论基础;同时也能间接挖掘提高雷公藤甲素累积量的新思路和新方法,为雷公藤甲素生物合成技术的开发和实现提供一定的科学依据。
| [1] |
Lv QW, Zhang W, Shi Q, et al. Comparison of Tripterygium wilfordii Hook F. with methotrexate in the treatment of active rheumatoid arthritis (TRIFRA): a randomised, controlled clinical trial. Ann Rheum Dis, 2015, 74(6): 1078-1086. DOI:10.1136/annrheumdis-2013-204807
|
| [2] |
He LG, Liang ZY, Zhao FQ, et al. Modulation of IL-37 expression by triptolide and triptonide in THP-1 cells. Cell Mol Immunol, 2015, 12: 515-518. DOI:10.1038/cmi.2014.92
|
| [3] |
Li RJ, Lu KY, Wang Y, et al. Triptolide attenuates pressure overload-induced myocardial remodeling in mice via the inhibition of NLRP3 inflammasome expression. Biochem Biophys Res Commun, 2017, 485(1): 69-75. DOI:10.1016/j.bbrc.2017.02.021
|
| [4] |
Chen ZY, Veena SW, Sulagna B, et al. Triptolide sensitizes pancreatic cancer cells to TRAIL-induced activation of the Death Receptor pathway. Cancer Lett, 2014, 348(1/2): 156-166.
|
| [5] |
Yuan SQ, Wang LP, Chen XX, et al. Triptolide inhibits the migration and invasion of human prostate cancer cells via caveolin-1/CD147/MMPs pathway. Biomed Pharmacother, 2016, 84: 1776-1782. DOI:10.1016/j.biopha.2016.10.104
|
| [6] |
Li XG, Lu QL, Xie W, et al. Anti-tumor effects of triptolide on angiogenesis and cell apoptosis in osteosarcoma cells by inducing autophagy via repressing Wnt/β-catenin signaling. Biomed Pharmacother, 2018, 496(2): 443-449.
|
| [7] |
Rohit C, Veena SW, Satish P, et al. A preclinical evaluation of minnelide as a therapeutic agent against pancreatic cancer. Sci Transl Med, 2012, 4(156): 156ra139.
|
| [8] |
Wang PY, Zeng WJ, Liu J, et al. TRC4, an improved triptolide derivative, specifically targets to truncated form of retinoid X receptor-alpha in cancer cells. Biochem Pharmacol, 2017, 124: 19-28. DOI:10.1016/j.bcp.2016.10.014
|
| [9] |
Xu HT, Tang HY, Feng HJ, et al. Metal-mediate reactions based formal synthesis of triptonide and triptolide. Tetrahedron Lett, 2014, 55(51): 7118-7120. DOI:10.1016/j.tetlet.2014.11.010
|
| [10] |
Vranová E, Coman D, Gruissem W. Network analysis of the MVA and MEP pathways for isoprenoid synthesis. Annu Rev Plant Biol, 2013, 64: 665-700. DOI:10.1146/annurev-arplant-050312-120116
|
| [11] |
Isabel MP, Erika K, Claudia H, et al. Metabolic cross-talk between pathways of terpenoid backbone biosynthesis in spike lavender. Plant Physiol Biochem, 2015, 95: 113. DOI:10.1016/j.plaphy.2015.07.029
|
| [12] |
Hemmerlin A, Hoeffler JF, Meyer O, et al. Cross-talk between the cytosolic mevalonate and the plastidial methylerythritol phosphate pathways in tobacco bright yellow-2 cells. J Biol Chem, 2003, 278(29): 26666-26676. DOI:10.1074/jbc.M302526200
|
| [13] |
Opitz S, Nes WD, Gershenzon J. Both methylerythritol phosphate and mevalonate pathways contribute to biosynthesis of each of the major isoprenoid classes in young cotton seedlings. Phytochemistry, 2014, 98: 110-119. DOI:10.1016/j.phytochem.2013.11.010
|
| [14] |
Aarthy T, Mulani FA, Pandreka A, et al. Tracing the biosynthetic origin of limonoids and their functional groups through stable isotope labeling and inhibition in neem tree (Azadirachta indica) cell suspension. BMC Plant Biol, 2018, 18(1): 230. DOI:10.1186/s12870-018-1447-6
|
| [15] |
Palazón J, Cusidó RM, Bonfill M, et al. Inhibition of paclitaxel and baccatin Ⅲ accumulation by mevinolin and fosmidomycin in suspension cultures of Taxus baccata. J Biotechnol, 2003, 101(2): 157-163. DOI:10.1016/S0168-1656(02)00318-8
|
| [16] |
Wang YD, Yuan YJ, Lu M, et al. Inhibitor studies of isopentenyl pyrophosphate biosynthesis in suspension cultures of the yew Taxus chinensis var. mairei. Biotechnol Appl Biochem, 2003, 37(Pt 1): 39-43.
|
| [17] |
Johan AR, Kenneth TK, Morten TN, et al. Expanding the landscape of diterpene structural diversity through stereochemically controlled combinatorial biosynthesis. Angew Chem Int Ed Engl, 2016, 128(6): 2182-2186. DOI:10.1002/ange.201510650
|
| [18] |
Nikolaj LH, Allison MH, Britta H, et al. The terpene synthase gene family in Tripterygium wilfordii harbors a labdane-type diterpene synthase among the monoterpene synthase TPS-b subfamily. Plant J, 2017, 89(3): 429-441. DOI:10.1111/tpj.13410
|
| [19] |
Tong YR, Zhang M, Su P, et al. Cloning and functional characterization of an isopentenyl diphosphate isomerase gene from Tripterygium wilfordii. Biotechnol Appl Biochem, 2016, 63(6): 863-869. DOI:10.1002/bab.1427
|
| [20] |
Tong YR, Su P, Zhao YJ, et al. Molecular cloning and characterization of DXS and DXR genes in terpenoid biosynthetic pathway from Tripterygium wilfordii. Int J Mol Sci, 2015, 16(10): 25516-25535. DOI:10.3390/ijms161025516
|
| [21] |
Liu YJ, Zhao YJ, Zhang M, et al. Cloning and characterisation of the gene encoding 3-hydroxy-3-methylglutaryl-CoA synthase in Tripterygium wilfordii. Molecules, 2014, 19: 19696-19707. DOI:10.3390/molecules191219696
|
| [22] |
Lipko A, Swiezewska E. Isoprenoid generating systems in plants — A handy toolbox how to assess contribution of the mevalonate and methylerythritol phosphate pathways to the biosynthetic process. Prog Lipid Res, 2016, 63: 70-92. DOI:10.1016/j.plipres.2016.04.002
|
| [23] |
Yang D, Du X, Liang X, et al. Different roles of the mevalonate and methylerythritol phosphate pathways in cell growth and tanshinone production of Salvia miltiorrhiza hairy roots. PLoS One, 2012, 7(11): 46797. DOI:10.1371/journal.pone.0046797
|
| [24] |
Wang YD, Yuan YJ, Wu JC. Translocation of isopentenyl pyrophosphate for Taxol biosynthesis in suspension cultures of Taxus chinensis var. mairei. Plant Cell Tiss Org, 2003, 74: 283-288. DOI:10.1023/A:1024019809910
|
 2021, Vol. 37
2021, Vol. 37




