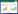中国科学院微生物研究所、中国微生物学会主办
文章信息
- 付正豪, 闫干干, 朱小红, 刘晓平, 陈云雨
- Fu Zhenghao, Yan Gangan, Zhu Xiaohong, Liu Xiaoping, Chen Yunyu
- 靶向β-catenin/TCF4相互作用小分子抑制剂酶联免疫吸附法高通量筛选模型的优化与应用
- Optimizations of an ELISA-like high-throughput screening assay for the discovery of β-catenin/TCF4 interaction antagonists
- 生物工程学报, 2021, 37(8): 2878-2889
- Chinese Journal of Biotechnology, 2021, 37(8): 2878-2889
- 10.13345/j.cjb.200533
-
文章历史
- Received: August 23, 2020
- Accepted: October 28, 2020
- Published: November 19, 2020
2. 中国医学科学院-北京协和医学院 医药生物技术研究所,北京 100050
2. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
非小细胞肺癌(Non-small cell lung cancer,NSCLC) 是中国发病率和死亡率较高的癌症之一,其五年生存率仅为20%,严重威胁人民的身体健康[1-2]。虽然目前已有手术治疗、化疗、放疗、靶向治疗等多种治疗手段,但由于NSCLC具有高转移和易复发等特点,患者的死亡率依然居高不下[3]。在NSCLC复发和转移的过程中,高度活化的Wnt/β-catenin信号通路极大地促进了肿瘤干细胞(Cancer stem cells,CSC) 的分化与自我更新,形成肿瘤起始细胞(Tumor initialing cells,TICs),促进了NSCLC的脑(骨) 转移与复发[4-6]。
在正常细胞中,β-catenin通过泛素化途径降解,Wnt/β-catenin信号通路呈沉默状态。但在NSCLC等恶性肿瘤细胞中,β-catenin泛素化降解途径受阻,累积在胞质内的β-catenin大量入核,与TCF4 (T-cell factor 4) 的βBD结构域(β-catenin binding domain,βBD,1-53氨基酸(aa)) 相互作用形成转录复合体,活化Wnt/β-catenin信号通路,启动原癌基因的大量表达,促进NSCLC的增殖、分化、转移、耐药与复发[7-8]。因此,β-catenin/TCF4相互作用已成为新型高选择性抗NSCLC转移药物开发的理想靶标之一。
本室利用所建立的荧光偏振(Fluorescence polarization,FP) 高通量筛选模型成功筛选到血根碱,对β-catenin/TCF4相互作用具有良好的抑制活性,初步证实了血根碱在Wnt/β-catenin信号通路中的潜在抗癌活性分子靶标可能是β-catenin/TCF4相互作用[8-9]。虽然荧光偏振高通量筛选模型具有操作简单、筛选时间短、筛选成本低等优点,但在荧光偏振筛选模型中,使用的荧光探针为异硫氰酸荧光素(Fluorescein isothiocyanate,FITC) 标记的TCF4短肽(FITC-TCF4)。因为FITC-TCF4还不能充分模拟核转录因子TCF4的真实空间结构,所以筛选到的苗头化合物还需要再以基于蛋白质-蛋白质相互作用的实验方法(如GST pull-down实验) 进一步确证其体外抑制活性。
为了快速筛选抑制β-catenin/TCF4相互作用的苗头化合物和定量评价其体外抑制活性,本研究基于酶联免疫吸附实验(Enzyme-linked immunosorbent assay,ELISA) 原理,根据β-catenin/TCF4相互作用的结构生物学信息[10-11],建立并应用ELISA高通量筛选模型筛选苗头化合物,为靶向β-catenin/TCF4相互作用小分子抑制剂的高效筛选奠定基础。
1 材料与方法 1.1 材料大肠杆菌Escherichia coli Rosetta(DE3) 感受态细胞、蛋白质标准分子量购自TransGen公司;酵母粉、胰蛋白胨、琼脂粉购自Oxoid公司;Lipofectamin 2 000、BCA (Bicinchoninic acid) 试剂盒、超灵敏化学发光液购自ThermoFisher公司;硫酸卡那霉素、异丙基硫代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)、噻唑蓝(Thiazolyl blue tetrazolium bromide,MTT) 购自上海阿拉丁生化科技股份有限公司;牛血清白蛋白(Bull serum albumin,BSA)、小鼠抗组氨酸(Histidine,His) 标签单克隆抗体、辣根过氧化物酶(Horseradish peroxidase,HRP) 标记的羊抗小鼠IgG购自Biosharp公司;96孔酶标板购自Corning公司;可溶型单组分四甲基联苯胺(3, 3′, 5, 5′-tetramethylbenzidine,TMB) 溶液购自天根生化科技(北京) 有限公司;荧光素酶质粒TOPFlash购自Merck公司;醋酸纤维素膜、HisTrapTM层析柱购自GE公司;荧光探针FITC-TCF4 (FITC-GGDDLGANDELISFKDEGEQ EEK-OH) 由GL Biochem公司合成;天然产物化合物库购自ChemDiv公司;PKF118-310、血根碱、白花丹素购自TargetMol公司;A549、H1299、MCF7、SW480、HEK293细胞由本室保存;重组谷胱甘肽转移酶(Glutathione S-transferase,GST)、重组人GST-TCF4 βBD (1-53 aa) 由本室制备和保存;其他生化试剂为国产分析纯试剂。
1.2 方法 1.2.1 β-catenin分离纯化与活性鉴定按照参考文献[12]所述的方法,将构建的重组质粒pET-30a-β-catenin转化到E. coli Rosetta(DE3) 感受态细胞中,设定诱导温度25 ℃、诱导时间10 h、0.2 mmol/L IPTG为诱导条件,进行β-catenin表达。离心收集诱导培养的菌体,再以超声波细胞粉碎机(SCIENTZ) 破碎菌体,离心收集上清液,再以HisTrapTM层析柱分离纯化β-catenin。
分别将1、4、10 μg β-catenin进行SDS-PAGE,再以半干法转膜,设定4 μg BSA为阴性对照组。封闭的免疫印迹膜经漂洗后,再依次加入小鼠抗His标签单抗(1︰2 000) 和HRP-羊抗小鼠IgG (1︰4 000),以超灵敏化学发光液显影成像,以Western blotting法鉴定β-catenin的正确表达。
按照参考文献[9]所述的荧光偏振方法,将40 nmol/L FITC-TCF4以30 μL/孔加入到384孔板中,再以30 μL/孔依次加入0、10、50、100、200、300、400、500、600、700、800、1 000 nmol/L β-catenin,设置3个复孔,在避光条件下,室温孵育15 min,以多功能酶标仪检测毫偏值(Millipolarization unit,mP),再以GraphPad Prism 5.0软件拟合β-catenin/FITC-TCF4结合反应曲线,计算解离平衡常数(Dissociation constant,Kd) 值。
1.2.2 基于ELISA原理的高通量筛选模型的优化与建立1) 最佳包被浓度与反应方案的确定
将0、1、2、3、4、5、6、7、8、9、10 μg/mL GST-TCF4 βBD以100 μL/孔包被于96孔酶标板中,设置3个复孔,4 ℃包被过夜。将酶标板以含0.1% Tween-20的磷酸盐缓冲液(Phosphate- buffered solution,PBST) 洗涤3次后,再以5% BSA溶液室温封闭2 h。封闭的酶标板经PBST洗3次后,再依次加入小鼠抗GST标签单抗(1︰2 000,100 μL/孔) 和HRP-羊抗小鼠IgG (1︰4 000,100 μL/孔),室温孵育1 h。以PBST充分洗涤未结合的抗体后,加入TMB溶液(100 μL/孔),室温孵育5 min显色。再加入2 mol/L H2SO4终止反应后,多功能酶标仪检测OD450值。设定包被BSA孔为对照组。
将2 μg/mL GST-TCF4 βBD以上述方法包被96孔酶标板后,再以100 μL/孔加入0、1、2、3、4、5、6、7、8、9、10 μg/mL β-catenin,室温孵育1 h。再加入小鼠抗His标签单抗(1︰2 000)和HRP-羊抗小鼠IgG (1︰4 000),TMB溶液显色,以多功能酶标仪检测OD450值。同法包被GST孔设定为对照组。
按照GST-TCF4 βBD的包被浓度设置和操作方法,同法包被β-catenin,以小鼠抗His标签单抗(1︰2 000) 和HRP-羊抗小鼠IgG (1︰4 000)检测β-catenin包被量。
将4 μg/mL β-catenin包被96孔酶标板后,再以100 μL/孔加入0、1、2、3、4、5、6、7、8、9、10 μg/mL GST-TCF4 βBD和GST,室温孵育1 h。再加入小鼠抗GST标签单抗(1︰2 000) 和HRP-羊抗小鼠IgG (1︰4 000),TMB溶液显色,以多功能酶标仪检测OD450值。
2) 最佳孵育温度的确定
将2 μg/mL GST和GST-TCF4 βBD以100 μL/孔包被于96孔酶标板中,设置3个复孔。酶标板经PBST洗涤和5% BSA封闭后,以100 μL/孔加入0、0.5、1、2、3、4 μg/mL β-catenin,4 ℃孵育1 h。再加入小鼠抗His标签单抗(1︰2 000)和HRP-羊抗小鼠IgG (1︰4 000),TMB溶液显色,以多功能酶标仪检测OD450值。再将孵育温度设定为室温(25 ℃) 和37 ℃,同法操作。
3) 最佳孵育时间的确定
按照上述实验方法,设定GST-TCF4 βBD和β-catenin的室温孵育时间为15 min。再加入小鼠抗His标签单抗(1︰2 000) 和HRP-羊抗小鼠IgG (1︰4 000),TMB溶液显色,以多功能酶标仪检测OD450值。将孵育时间设定为30、45、60 min,同法操作。以GST反应孔为对照组。
4) DMSO耐受性实验
在包被GST-TCF4 βBD (2 μg/mL) 的96孔酶标板中,以100 μL/孔加入0.5 μg/mL β-catenin,各反应体系中含DMSO终浓度为0%、1%、2%、3%、4%、5%,室温孵育30 min。再加入上述一抗和二抗,室温孵育1 h,多功能酶标仪检测OD450值。
5) ELISA筛选模型的特异性评价
以0.5 μg/mL β-catenin为稀释液,利用2倍倍比稀释法,将10 mmol/L血根碱稀释至12个浓度(起始浓度100 μmol/L),再加入到包被GST-TCF4 βBD (2 μg/mL) 的96孔酶标板中,室温反应30 min。加入上述一抗和二抗,室温孵育1 h后,以多功能酶标仪检测OD450值。以GraphPad Prism 5.0软件拟合血根碱的抑制曲线,计算其半数抑制浓度(Half maximal inhibitory concentration,IC50) 值。本实验中设定含1% DMSO的为阴性对照组,不含β-catenin的反应孔为阳性对照组。
6) Z′因子及HTS主要技术参数的确定
在包被GST-TCF4 βBD (2 μg/mL) 的96孔酶标板中,以100 μL/孔加入0.5 μg/mL β-catenin,室温孵育30 min。设定含30 μmol/L血根碱的孔为阳性对照组(A板1#-60#),含1% DMSO的孔为阴性对照组(B板1#-60#)。加入上述一抗和二抗,室温孵育1 h,以多功能酶标仪检测OD450值,按照BioTek操作系统的相关程序进行Z′因子计算。
根据上述相关检测数据,对信号本底比值(Signal to background,S/B)、信号窗值(Signal window,SW)、信噪比值(Signal to noise,S/N)、信号/本底变异系数值(Coefficient of variation of signal/background,CV) 进行计算分析。
1.2.3 苗头化合物的高通量筛选将0.5 μg/mL β-catenin以99 μL/孔加入到包被GST-TCF4 βBD (2 μg/mL) 的96孔酶标板中,再以1 μL/孔加入小分子化合物(10 mg/mL),室温孵育30 min。加入上述一抗和二抗,室温孵育1 h,以多功能酶标仪检测OD450值。设定含1% DMSO的孔为阴性对照组,含30 μmol/L血根碱的孔为阳性对照组。在初次筛选中,判定抑制率大于50%的小分子化合物为候选苗头化合物。
1.2.4 苗头化合物的复筛与IC50值的测定按照血根碱抑制活性检测所述的ELISA法,对候选苗头化合物进行复筛,以GraphPad Prism 5.0软件拟合苗头化合物的抑制曲线,计算IC50值。
1.2.5 MTT实验取对数生长期的A549、H1299、MCF7、SW480和HEK293细胞,以5 000个/孔接种到96孔细胞板中,培养过夜。将10 mmol/L白花丹素和血根碱分别以细胞培养基进行2倍倍比稀释(起始浓度100 μmol/L,共稀释10个浓度,100 μL/孔),每组设定3个复孔,继续孵育48 h。吸弃上述培养基后,再以200 μL/孔加入新鲜培养基,孵育24 h后,每孔中再加入22 μL MTT溶液(5 mg/mL),37 ℃孵育4 h。以150 μL/孔加入DMSO,室温振荡15 min,多功能酶标仪检测OD560值。设定含DMSO的孔为阴性对照组,含25 μmol/L PKF118-310的孔为阳性对照组,以GraphPad Prism 5.0软件拟合白花丹素和血根碱对上述细胞增殖的抑制曲线,计算IC50值。
同法稀释PKF118-310后,设定含DMSO的孔为阴性对照组,含25 μmol/L血根碱的孔为阳性对照组,以GraphPad Prism 5.0软件拟合PKF118-310对上述细胞增殖的抑制曲线,计算其IC50值。
1.2.6 TOPFlash实验按照Raghu等[13]所述的方法,取对数生长期的HEK293细胞,以3 000个/孔接种到96孔细胞板中,培养过夜。待细胞稳定贴壁生长后,使用Lipofectamin 2000将荧光素酶质粒TOPFlash转染到HEK293细胞中。在HEK293细胞转染8 h后,分别加入0.75、1.5、3 μmol/L白花丹素,设置3个复孔,再继续培养24 h。根据荧光素酶操作系统说明书裂解HEK293细胞,再以多功能酶标仪检测相对发光值(Relative luminescence unit,RLU)。采用RLU值表征β-catenin转录活性,DMSO组的RLU值计为100%,白花丹素的不同剂量组与DMSO组的RLU比值计为相对转录活性。
1.2.7 数据分析采用GraphPad Prism 5.0软件拟合血根碱和白花丹素的抑制曲线,其IC50值计算公式如下所述。

|
工程菌经诱导培养后,菌体裂解上清液以HisTrapTM层析柱进行分离纯化。SDS-PAGE结果表明,纯化的β-catenin在预期分子量77 kDa位置有明显且单一的蛋白质条带,说明其具有较高的纯度(图 1A)。Western blotting实验结果表明,在上述预期分子量的位置,抗His标签抗体能与β-catenin反应且具有良好的量效关系,但其不能与BSA反应,证实了β-catenin的正确表达(图 1B)。荧光偏振实验结果表明,纯化的β-catenin与FITC-TCF4具有良好的结合反应,其Kd值为65 nmol/L,这说明纯化的β-catenin具有良好的生物学活性(图 1C)。
|
| 图 1 重组人β-catenin的分离纯化与活性鉴定 Fig. 1 Purification and bioactivity analysis of recombinant human β-catenin. (A) Expression and purification analysis of β-catenin using the coomassie brilliant blue-stained SDS-PAGE. 1: protein marker; 2: purified β-catenin band (77 kDa); 3: purified GST-TCF4 βBD band (32 kDa); 4: purified GST band (26 kDa). (B) Validation of purified β-catenin using Western blotting assay. 1: 4 μg BSA control; 2: 1 μg β-catenin band; 3: 4 μg β-catenin band; 4: 10 μg β-catenin band. (C) Bioactivity analysis using fluorescence polarization (FP) assay. 40 nmol/L FITC-TCF4 was added into β-catenin solution at the indicated concentrations, and then the mixtures were incubated at room temperature (RT, 25 ℃) for 15 min. The mP values were recorded by a microplate reader (BioTek), and the Kd value that indicates the binding affinity of β-catenin/FITC-TCF4 interaction was subsequently analyzed using GraphPad Prism 5.0. The experiment was performed in triplicate. |
| |
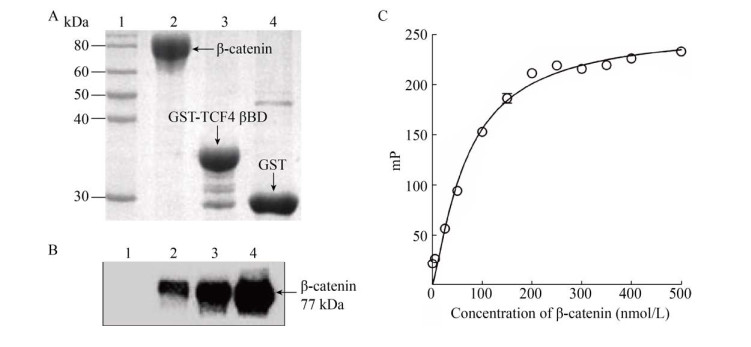
将不同浓度的GST-TCF4 βBD包被于96孔酶标板中,以ELISA法检测其包被量。实验结果显示,当包被浓度达到2 μg/mL时,其包被反应曲线趋于饱和(图 2A)。设定2 μg/mL作为GST-TCF4 βBD最佳包被浓度,ELISA实验结果显示,包被的GST-TCF4 βBD与β-catenin的结合反应具有明显的量效关系,但GST不能与β-catenin发生结合反应。当β-catenin反应浓度达到2 μg/mL时,其结合反应曲线趋于平台期,OD450值达0.66 (图 2B)。当包被不同浓度的β-catenin时,其包被反应曲线在4 μg/mL时趋于饱和(图 2C)。设定4 μg/mL作为β-catenin最佳包被浓度,ELISA实验结果显示,包被的β-catenin与GST-TCF4 βBD的结合反应较弱,在结合反应曲线的平台期,其OD450值达0.13,约为背景值的2倍(图 2D)。综上所述,将包被GST-TCF4 βBD与β-catenin反应作为最佳反应方案,此时GST-TCF4 βBD最佳包被浓度为2 μg/mL。
|
| 图 2 最佳包被浓度与反应方案的确定 Fig. 2 Determinations of an optimal working concentration of coated protein and GST-TCF4 βBD/β-catenin in vitro interaction mode in an ELISA-like screening assay. (A) Determination of an optimal working concentration of coated GST-TCF4 βBD. GST-TCF4 βBD at the indicated concentrations was coated into a 96-well microplate and then probed with the mentioned antibody. The OD450 values were measured. BSA was used as a control. (B) Analysis of GST-TCF4 βBD/β-catenin binding curve. Different concentrations of β-catenin were incubated in a GST-TCF4 βBD-coated 96-well microplate. After addition of antibody and TMB, GST-TCF4 βBD/β-catenin binding curve was determined by measuring the OD450 values. GST was used as a control. (C) Determination of an optimal working concentration of coated β-catenin. β-catenin at the given concentrations was coated into a 96-well microplate. After addition of antibody and TMB, the OD450 value was recorded. (D) Analysis of β-catenin/GST-TCF4 βBD binding curve. GST-TCF4 βBD at indicated concentrations was added into a β-catenin-coated 96-well microplate. After the measurement of OD450 values, the binding curve was plotted using GraphPad Prism 5.0. |
| |
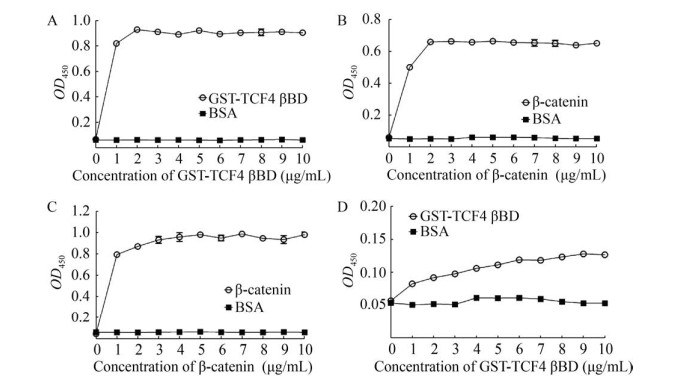
将不同浓度的β-catenin加入到2 μg/mL GST-TCF4 βBD包被的96孔酶标板中,其结合反应分别在4 ℃、室温(25 ℃)、37 ℃条件下孵育1 h。ELISA实验结果显示,孵育温度对GST-TCF4 βBD/β-catenin结合反应未产生显著影响。当β-catenin反应浓度达2 μg/mL时,其结合反应曲线趋于平台期(图 3A)。为了使高通量筛选模型具有更好的操作简便性,选择室温作为GST-TCF4 βBD/β-catenin结合反应的最佳孵育温度。
|
| 图 3 GST-TCF4 βBD/β-catenin结合反应条件的优化 Fig. 3 Incubation condition optimizations of GST-TCF4 βBD/β-catenin binding in an ELISA-like screening assay. (A) Analysis of GST-TCF4 βBD/β-catenin binding curve in the different incubation temperatures. β-catenin at the indicated concentrations was added into a GST-TCF4 βBD-coated 96-well microplate, and then the mixtures were incubated at 4 ℃, 25 ℃, 37 ℃ for 1 h, respectively. The binding curve was plotted according to the OD450 values. GST was used as a control. (B) Analysis of GST-TCF4 βBD/β-catenin binding curve in the different incubation durations. As previously mentioned, GST-TCF4 βBD/β-catenin binding mixtures were incubated at RT for 15, 30, 45, 60 min, respectively, and then the binding curve was recorded. GST served as a control. (C) Analysis of DMSO tolerance in an ELISA-like screening assay. β-catenin (0.5 μg/mL) was incubated in a GST-TCF4 βBD-coated 96-well microplate at RT for 30 min in the presence of the indicated DMSO concentrations. The OD450 values were recorded for comparison analysis. |
| |
将GST-TCF4 βBD/β-catenin结合反应分别在室温条件下孵育15、30、45、60 min。ELISA实验结果显示,孵育30 min时的结合反应曲线与45、60 min的结合反应曲线高度重合,说明在孵育时间为30 min的时间点,GST-TCF4 βBD与β-catenin已充分结合(图 3B)。因此,选择30 min作为GST-TCF4 βBD/β-catenin结合反应的最佳孵育时间。为了使高通量筛选模型具有更高的灵敏度和信号窗,选择0.5 μg/mL作为β-catenin最佳反应浓度,其结合反应最佳条件为室温孵育30 min。
利用上述实验确定的GST-TCF4 βBD/β-catenin最佳反应条件建立ELISA筛选模型,检测不同DMSO浓度对其结合反应的影响。ELISA实验结果显示,DMSO浓度在5%以内时,其对GST-TCF4 βBD/β-catenin结合反应未产生显著影响,其OD450值为(0.45±0.01) (图 3C)。
2.4 筛选模型的特异性评价本实验室利用荧光偏振高通量筛选模型,初步证实了血根碱在Wnt/β-catenin信号通路中的潜在抗癌活性分子靶标可能是β-catenin/TCF4相互作用。应用上述已优化的ELISA筛选模型检测血根碱对GST-TCF4 βBD/β-catenin相互作用的抑制作用。实验结果显示,在ELISA筛选模型中,血根碱对上述相互作用具有良好的抑制活性,其IC50值为(1.82±0.16) μmol/L (图 4),与其在荧光偏振筛选模型中的IC50值(1.22±0.08) μmol/L基本相近[8-9],说明所建立的ELISA筛选模型具有良好的特异性。

|
| 图 4 血根碱在ELISA筛选模型中的抑制活性 Fig. 4 The inhibitory activity of sanguinarine (SAN) in an ELISA-like screening assay. The mixtures containing β-catenin (0.5 μg/mL) and sanguinarine at indicated concentrations were added into a GST-TCF4 βBD-coated 96-well microplate at RT for 30 min. After addition of antibody and TMB, the OD450 values were recorded, and then IC50 value of sanguinarine was analyzed using GraphPad Prism 5.0. |
| |
经过上述优化实验,以多功能酶标仪计算所建立的ELISA高通量筛选模型的Z′因子值为0.83,满足了其大于0.5的基本要求(图 5)。另外,本筛选模型的S/B值、S/N值、SW值、CV值等HTS主要技术参数均满足了高通量筛选的基本要求(表 1),这说明通过上述优化方案,已成功建立了适用于β-catenin/TCF4相互作用小分子抑制剂高通量筛选的ELISA筛选模型。
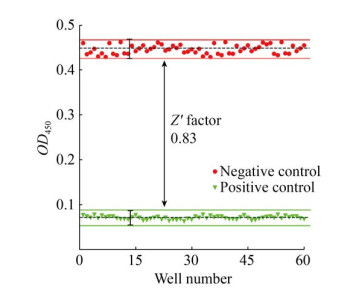
|
| 图 5 ELISA筛选模型Z′因子的确定 Fig. 5 Determination of Z′ factor in an ELISA-like screening assay. The OD450 values of the negative and positive wells were shown. |
| |
| Indicators | Requirements of HTS | Results of HTS |
| S/B | > 3 | 6.34 |
| S/N | > 10 | 31.16 |
| SW | Not determined | 0.38 |
| CV (%) | < 10 | 2.56 |
| Z′ factor | > 0.5 | 0.83 |
根据上述ELISA筛选模型的优化实验结果,选择2 μg/mL作为GST-TCF4 βBD最佳包被浓度,0.5 μg/mL作为β-catenin最佳反应浓度,最佳反应条件为室温孵育30 min,成功建立了ELISA高通量筛选模型(图 6A)。应用上述ELISA筛选模型对本室天然产物化合物库(含500个天然产物)进行高通量筛选,以初筛抑制率大于50%为标准,共获得10个候选苗头化合物(图 6B)。在第二轮复筛中,成功筛选到的白花丹素(Plumbagin) 具有良好的抑制活性,其IC50值为(4.55±0.27) μmol/L (图 6C)。MTT实验结果显示,白花丹素对A549、H1299、MCF7、SW480和HEK293细胞具有明显的细胞毒性(表 2)。TOPFlash实验结果显示,与DMSO对照组相比,白花丹素对HEK293转染细胞内β-catenin介导的转录活性(β-catenin-responsive transcription,CRT) 具有显著的抑制作用(图 6D)。
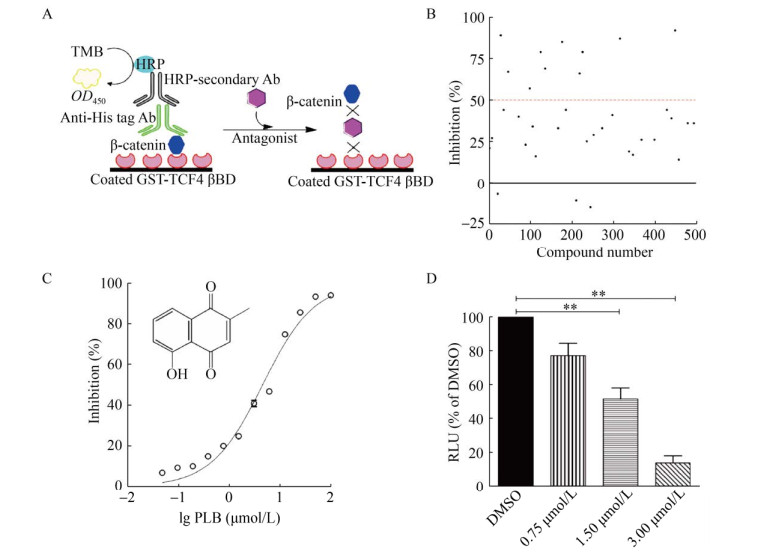
|
| 图 6 苗头化合物的筛选与白花丹素抗癌活性的分子靶标确证 Fig. 6 A pilot screening and the anticancer target validation of plumbagin in vitro. (A) The schematic illustration for an ELISA-like HTS assay. Briefly, 2 μg/mL GST-TCF4 βBD (100 μL/well, light red) was coated into a 96-well microplate overnight. After PBST washing, the mixtures containing of β-catenin (0.5 μg/mL, blue) and small molecule were incubated for 30 min at RT in a GST-TCF4 βBD-coated 96-well microplate. Remaining β-catenin was detected using anti-His tag antibody (green) and HRP-conjugated secondary antibody (gray). After addition of TMB, the OD450 values were measured. The candidate hits (purple) were identified as potential antagonists because of the lower OD450 values in the primary screening cycle. (B) Overview of a pilot screening of a natural product library. The red dashed line in the figure indicated 50% inhibition. The candidate hits (> 50% inhibition) were further validated in second ELISA-like screening assay. (C) The inhibitory curve of plumbagin (PLB) in second ELISA-like screening assay. The chemical structure of plumbagin (PLB) was shown. (D) The effect of plumbagin on the β-catenin-responsive transcription in TOPFlash assay. HEK293 transfection cells were treated with DMSO (control) or plumbagin (0.75-3.00 μmol/L) for 24 h, and TOPFlash luciferase activity was carried out as previously described in reference[13]. All data are expressed as the x±s from three independent experiments and considered significant if P values were found to be less than 0.05. |
| |
| Cell lines | IC50 (μmol/L) | ||
| PLB | SAN | PKF118-310 | |
| A549 | 7.83±0.51 | 8.74±0.85 | 0.75±0.15 |
| H1299 | 10.23±0.77 | 3.69±0.56 | 1.14±0.66 |
| MCF7 | 14.21±1.25 | 7.56±0.94 | 1.56±0.35 |
| SW480 | 7.36±1.21 | 5.37±0.86 | 0.24±0.19 |
| HEK293 | 8.12±1.38 | 10.31±1.05 | 3.56±0.89 |
在大部分恶性肿瘤细胞中(如NSCLC),Wnt/β-catenin信号通路异常活化,β-catenin泛素化降解途径受阻,导致胞质内累积的β-catenin大量入核与核转录因子TCF4相互作用形成转录调控元件,启动原癌基因的大量表达,促进肿瘤细胞的增殖、分化、侵袭、转移、复发和耐药[4-8]。鉴于正常细胞内不存在Wnt/β-catenin信号通路,因此β-catenin/TCF4相互作用被认为是广谱高选择性新型抗肿瘤药物开发的理想靶标之一。
制备高活性的β-catenin是建立靶向β-catenin/TCF4相互作用小分子抑制剂筛选模型的重要基础。本研究采用大肠杆菌原核表达技术,成功制备了高活性的β-catenin。目前,荧光偏振技术已发展成为基于蛋白质-蛋白质相互作用(Protein-protein interactions,PPIs) 为靶标的小分子抑制剂高通量筛选的重要方法之一,并且广泛应用于重组蛋白质的生物学活性分析[9, 14-15]。考虑到在Wnt/β-catenin信号通路中,β-catenin/TCF4相互作用是重要的转录调控“分子开关”,因此制备的β-catenin与TCF4是否具有高亲和力是其活性评价的核心指标之一。在荧光偏振实验中,将FITC-TCF4作为核转录因子TCF4的模拟物,证实了纯化的β-catenin能与FITC-TCF4特异性结合,其结合反应Kd值为65 nmol/L,与文献报道基本一致[9],说明纯化的β-catenin具有良好的生物学活性。
目前已报道了多种筛选方法成功应用于β-catenin/TCF4相互作用小分子抑制剂的筛选,其中4T1细胞荧光素酶报告基因筛选法和果蝇细胞化学遗传学筛选法主要基于化学发光和RNA干扰原理设计,但其操作复杂,筛选成本较高[16-17];基于β-catenin结构生物学信息的虚拟筛选法,虽然可使药物高通量筛选的成本大幅度地降低,但假阳性化合物的发生率也相对较高,所以必须结合其他实验筛选法进一步进行假阳性化合物的有效排除[18];本实验室建立的荧光偏振筛选法虽然耗时短、用量少、成本低,但筛选到的化合物还需再以GST-pull down实验模拟β-catenin/TCF4相互作用以进一步验证其体外抑制活性[9, 15]。ELISA实验能够较大程度地真实模拟蛋白质分子间的相互作用,具有操作简单、特异性强、灵敏度高等优点,已被广泛应用于药物筛选和疾病诊断[12, 19-20]。为了更好地弥补上述筛选方法的不足并促进β-catenin/TCF4相互作用小分子抑制剂的高效筛选,本研究基于ELISA原理,通过判断化合物对β-catenin与已包被的GST-TCF4 βBD的高亲和力相互作用是否具有阻断作用,进而高效地筛选苗头化合物。本研究建立的ELISA筛选模型基本真实地模拟了β-catenin/TCF4相互作用,不仅可以用于小分子抑制剂的高通量筛选,还可以用于化合物体外抑制活性的定量评价,因此本模型具有良好的实用性和推广性。
在Wnt信号通路中,β-catenin通过犰狳样蛋白质重复片段结构域(Armadillo repeats) 可与大部分功能蛋白质分子结合,发挥信号转导作用[21]。但TCF4和E-cadherin与β-catenin的结合域有部分重叠且大部分天然产物具有多靶点药理活性,利用本筛选模型筛选到的苗头化合物还需要再以荧光偏振实验、免疫共沉淀(Co-immunoprecipitation,Co-IP) 实验、Western blotting实验等系统地评价其抗癌靶标与药理活性的相关性[22]。由于本筛选模型的操作时间较长,后续可以进一步改进实验方法,采用HRP-抗人β-catenin抗体一步显色法进行检测;另外,β-catenin在较长时间冻存或反复冻融后会导致其活性降低,所以,定期采用荧光偏振法对β-catenin进行生物学活性评价至关重要。
与已报道的基于β-catenin包被方案的ELISA筛选模型相比[23],本筛选模型选择2 μg/mL作为GST-TCF4 βBD最佳包被浓度,此时酶标板的结合量基本饱和;选择0.5 μg/mL作为β-catenin最佳工作浓度,一方面保持了本筛选模型的高信号窗,另一方面最适中的β-catenin工作浓度也使本筛选模型具有更高的灵敏度。不同的包被方案导致差异的原因可能在于β-catenin的包被使其空间构象发生某些改变,从而与GST-TCF4 βBD (1-53 aa) 的亲和力减弱,使表征结合反应强弱的核心指标OD450值降低。
Z′因子是高通量筛选模型评价的核心参数,本研究建立的ELISA高通量筛选模型Z′因子为0.83,完全满足高通量筛选中Z′因子大于0.5的基本要求[24]。在上述优化的ELISA筛选模型中,血根碱的IC50值为(1.82±0.16) μmol/L,与文献报道基本相近[8-9],说明了本筛选模型具有良好的特异性、灵敏性和稳定性。
本文运用所建立的ELISA高通量筛选模型对本室天然产物化合物库进行了高通量筛选,成功筛选到的白花丹素对β-catenin/TCF4相互作用具有良好的抑制活性,但其细胞毒性的选择性较差,这可能与其多靶点抗癌活性有关[25-26]。另外,白花丹素对不同肿瘤细胞的毒性略有差异,这可能与不同肿瘤细胞中Wnt信号通路的活化程度有关。因此,白花丹素作为新型Wnt抑制剂的苗头化合物,还需要深入进行化学改造以提高其成药性。
白花丹素又名白花丹醌,是传统中药白花丹的主要药效成分之一,具有抗炎、抗肿瘤等多种药理活性[26]。已有研究表明,白花丹素对NSCLC细胞具有明显的细胞毒性,并通过抑制结直肠癌和乳腺癌细胞中的Wnt信号通路发挥抗癌活性,但白花丹素在Wnt信号通路中的潜在抗癌靶标尚未明确[13, 27-28]。本研究初步证实了β-catenin/TCF4相互作用可能是白花丹素抗癌活性的潜在分子靶标之一。
综上所述,本研究成功建立了适用于β-catenin/TCF4相互作用小分子抑制剂筛选的ELISA高通量筛选模型,为靶向β-catenin/TCF4相互作用小分子抑制剂的高效筛选及其药理学活性评价奠定了实验基础。
致谢: 衷心感谢中国医学科学院-北京协和医学院医药生物技术研究所国家新药(微生物) 筛选中心张晶副研究员和上海药明康德新药开发有限公司林晓燕博士在白花丹素细胞毒性实验和TOPFlash实验中给予的悉心指导和无私帮助!
| [1] |
Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338
|
| [2] |
Chen WQ, Zheng RS, Zeng HM, et al. The incidence and mortality of major cancers in China, 2012. Chin J Cancer, 2016, 35: 73. DOI:10.1186/s40880-016-0137-8
|
| [3] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer. Nature, 2018, 553(7689): 446-454. DOI:10.1038/nature25183
|
| [4] |
Nguyen DX, Chiang AC, Zhang XHF, et al. WNT/TCF signaling through LEF1 and HOXB9 mediates lung adenocarcinoma metastasis. Cell, 2009, 138(1): 51-62. DOI:10.1016/j.cell.2009.04.030
|
| [5] |
Chen CY, Jan YH, Juan YH, et al. Fucosyltransferase 8 as a functional regulator of nonsmall cell lung cancer. Proc Natl Acad Sci USA, 2013, 110(2): 630-635. DOI:10.1073/pnas.1220425110
|
| [6] |
Iqbal W, Alkarim S, AlHejin A, et al. Targeting signal transduction pathways of cancer stem cells for therapeutic opportunities of metastasis. Oncotarget, 2016, 7(46): 76337-76353. DOI:10.18632/oncotarget.10942
|
| [7] |
Nusse R, Clevers H. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities. Cell, 2017, 169(6): 985-999. DOI:10.1016/j.cell.2017.05.016
|
| [8] |
付正豪, 闫干干, 戚海燕, 等. 靶向β-catenin/TCF4相互作用抑制剂在肿瘤分子治疗中的研究进展. 药学学报, 2021, 56(5): 1238-1245. Fu ZH, Yan GG, Qi HY, et al. Recent advances in novel anticancer agents targeting β-catenin/TCF4 interaction for molecular cancer therapeutics. Acta Pharm Sin, 2021, 56(5): 1238-1245 (in Chinese). |
| [9] |
陈云雨, 胡克, 付正豪, 等. 靶向β-catenin/TCF4相互作用小分子抑制剂荧光偏振高通量筛选模型的建立与应用. 药学学报, 2020, 55(5): 884-891. Chen YY, Hu K, Fu ZH, et al. Development of a fluorescence polarization-based high-throughput screening assay to identify antagonists targeting β-catenin/TCF4 interaction. Acta Pharm Sin, 2020, 55(5): 884-891 (in Chinese). |
| [10] |
Omer CA, Miller PJ, Diehl RE, et al. Identification of Tcf4 residues involved in high-affinity β-catenin binding. Biochem Biophys Res Commun, 1999, 256(3): 584-590. DOI:10.1006/bbrc.1999.0379
|
| [11] |
Knapp S, Zamai M, Volpi D, et al. Thermodynamics of the high-affinity interaction of TCF4 with beta-catenin. J Mol Biol, 2001, 306(5): 1179-1189. DOI:10.1006/jmbi.2001.4463
|
| [12] |
陈云雨, 牛夏忆, 李妍, 等. 基于β-catenin/Lef1相互作用为靶标的新型抗肿瘤药物高通量筛选模型的建立. 生物工程学报, 2019, 35(4): 707-717. Chen YY, Niu XY, Li Y, et al. Development of an ELISA-based high throughput screening method for novel anticancer agents targeting β-catenin/Lef1 interaction. Chin J Biotech, 2019, 35(4): 707-717 (in Chinese). |
| [13] |
Raghu D, Karunagaran D. Plumbagin downregulates Wnt signaling independent of p53 in human colorectal cancer cells. J Nat Prod, 2014, 77(5): 1130-1134. DOI:10.1021/np4010085
|
| [14] |
牛夏忆, 韩茂椿, 李淼, 等. 重组人β-catenin原核表达条件的优化及生物学活性鉴定. 微生物学杂志, 2020, 40(1): 58-66. Niu XY, Han MC, Li M, et al. Optimization of prokaryotic expression conditions and biological activity identification of recombinant human β-catenin. J Microbiol, 2020, 40(1): 58-66 (in Chinese). DOI:10.3969/j.issn.1005-7021.2020.01.008 |
| [15] |
Chen YY, Fu ZH, Li DS, et al. Optimizations of a novel fluorescence polarization-based high-throughput screening assay for β-catenin/LEF1 interaction inhibitors. Anal Biochem, 2020, 612: 113966. DOI:10.1016/j.ab.2020.113966
|
| [16] |
Jang GB, Hong IS, Kim RJ, et al. Wnt/β-catenin small-molecule inhibitor CWP232228 preferentially inhibits the growth of breast cancer stem-like cells. Cancer Res, 2015, 75(8): 1691-1702. DOI:10.1158/0008-5472.CAN-14-2041
|
| [17] |
Gonsalves FC, Klein K, Carson BB, et al. An RNAi-based chemical genetic screen identifies three small-molecule inhibitors of the Wnt/wingless signaling pathway. Proc Natl Acad Sci USA, 2011, 108(15): 5954-5963. DOI:10.1073/pnas.1017496108
|
| [18] |
Trosset JY, Dalvit C, Knapp S, et al. Inhibition of protein-protein interactions: the discovery of druglike β-catenin inhibitors by combining virtual and biophysical screening. Proteins, 2006, 64(1): 60-67. DOI:10.1002/prot.20955
|
| [19] |
Siarot L, Chutiwitoonchai N, Sato H, et al. Identification of human immunodeficiency virus type-1 Gag-TSG101 interaction inhibitors by high-throughput screening. Biochem Biophys Res Commun, 2018, 503(4): 2970-2976. DOI:10.1016/j.bbrc.2018.08.079
|
| [20] |
Kim J, Bong S, Kim DR, et al. Validation and comparison of ELISA kits to measure interferon gamma responses in QuantiFERON cultural supernatants for diagnosis of tuberculosis. J Microbiol Methods, 2018, 150: 29-31. DOI:10.1016/j.mimet.2018.05.007
|
| [21] |
Bienz M. β-catenin: a pivot between cell adhesion and Wnt signalling. Curr Biol, 2005, 15(2): R64-R67. DOI:10.1016/j.cub.2004.12.058
|
| [22] |
Zhang M, Catrow JL, Ji HT. High-throughput selectivity assays for small-molecule inhibitors of β-catenin/T-cell factor protein-protein interactions. ACS Med Chem Lett, 2013, 4(2): 306-311. DOI:10.1021/ml300367f
|
| [23] |
Lepourcelet M, Chen YN, France DS, et al. Small-molecule antagonists of the oncogenic Tcf/β-catenin protein complex. Cancer Cell, 2004, 5(1): 91-102. DOI:10.1016/S1535-6108(03)00334-9
|
| [24] |
Zhang JH, Chung TDY, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2): 67-73. DOI:10.1177/108705719900400206
|
| [25] |
Liu YL, Cai Y, He CW, et al. Anticancer properties and pharmaceutical applications of plumbagin: a review. Am J Chin Med, 2017, 45(3): 423-441. DOI:10.1142/S0192415X17500264
|
| [26] |
Padhye S, Dandawate P, Yusufi M, et al. Perspectives on medicinal properties of plumbagin and its analogs. Med Res Rev, 2012, 32(6): 1131-1158. DOI:10.1002/med.20235
|
| [27] |
Gomathinayagam R, Sowmyalakshmi S, Mardhatillah F, et al. Anticancer mechanism of plumbagin, a natural compound, on non-small cell lung cancer cells. Anticancer Res, 2008, 28(2): 785-792.
|
| [28] |
Sakunrangsit N, Ketchart W. Plumbagin inhibits cancer stem-like cells, angiogenesis and suppresses cell proliferation and invasion by targeting Wnt/β-catenin pathway in endocrine resistant breast cancer. Pharmacol Res, 2019, 150: 104517. DOI:10.1016/j.phrs.2019.104517
|
 2021, Vol. 37
2021, Vol. 37