中国科学院微生物研究所、中国微生物学会主办
文章信息
- 吴晓淋, 徐平, 张亚莉, 张振鹏
- WU Xiaolin, XU Ping, ZHANG Yali, ZHANG Zhenpeng
- 人体特征的头发代谢组学及蛋白质组学研究进展
- Distinguishing human characteristics based on hair metabolomics and proteomics: a review
- 生物工程学报, 2022, 38(10): 3638-3647
- Chinese Journal of Biotechnology, 2022, 38(10): 3638-3647
- 10.13345/j.cjb.220526
-
文章历史
- Received: July 7, 2022
- Accepted: September 13, 2022
- Published: September 17, 2022
2. 军事科学院军事医学研究院 生命组学研究所国家蛋白质科学中心 (北京) 北京蛋白质组研究中心 蛋白质组学国家重点实验室, 北京 102206;
3. 中国医学科学院蛋白组学与新药研发创新单元, 北京 102206
2. State Key Laboratory of Proteomics, Beijing Proteome Research Center, National Center for Protein Sciences (Beijing), Beijing Institute of Lifeomics, Beijing 102206, China;
3. Research Unit of Proteomics & Research and Development of New Drug, Chinese Academy of Medical Sciences, Beijing 102206, China
头发是一类可以记录机体一段时间内状态的样本,与血液、尿液等常规样本相比,具有可记录、易采集、低成本的优点。文章首先介绍了头发的结构、组成,其次从代谢组学方面介绍了其应用现况,接着介绍了头发蛋白质组学的研究进展,包括心理压力下头发的表型变化,最后对头发蛋白质组学表征心理压力进行了展望。代谢组学应用包括毒品的检测、酒精滥用、兴奋剂等药物检测等方面,另也有研究利用代谢组学检测头发的皮质醇含量反应机体的压力状态,但皮质醇分泌存在较大的个体差异,缺乏衡量标准,难以应用于临床。头发中代谢物质含量低,以角蛋白和角蛋白相关蛋白为主。头发蛋白质组学在生命科学领域具有广泛应用前景。有研究用头发蛋白质组学来区性别、种族等人体特征;心理压力下头发也会发生脱发、发质变差等表型变化,故对蛋白质组学表征不同压力下的动态变化研究进行了展望。
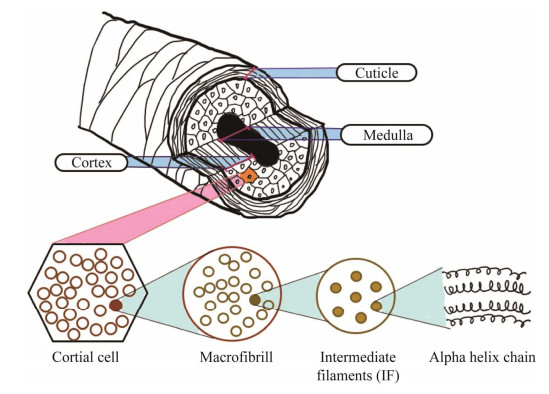
1 头发结构及主要成分头发是一类结构复杂的人体表皮附属物[1],在光学显微镜下可分成表皮层(cuticle)、皮质层(cortex) 和髓质层(medulla)[2]等3层结构(图 1)。蛋白质占头发总化学成分的60%–95%。其中角蛋白(keratin) 与角蛋白相关蛋白(keratin-associated proteins, KAP) 相互作用,形成交联结构,维持头发的化学和机械稳定性[3]。此外,头发还含有少量的水、脂质、色素和微量金属元素,其含量在个体间有较大差异[4]。
|
| 图 1 头发结构示意图 Fig. 1 Schematic diagrams of hair structure. |
| |
表皮层又称外层角质层,是头发最外层的保护层,由6–12层相互重叠的鳞片构成。鳞片由扁平的方形片状角质细胞构成,厚0.3–0.5 μm,长40–60 μm,包裹整个头发。表皮层的主要作用是保护头发内部结构,抵御环境的干扰,使头发保持光泽。其主要成分是硬质角蛋白,有一定硬度但质脆,表皮层对摩擦的抵抗性较差,当受到刮扯等物理伤害时,头发的表皮鳞片损伤甚至脱落,造成发质损伤,使头发变得粗糙脆弱[4-5]。
皮质层又称内皮层,紧挨表皮层之下,是头发的主干部分,占整个发干的45%。皮质层由细长的、交错的纺锤形细胞组成。这些细胞紧密地融合在一起,平行于纤维的轴线取向。每个细胞由直径0.2–0.4 μm间的细丝(巨原纤维) 组成,巨原纤维又由无定形基质和直径为7.5 nm的角蛋白中间丝(keratin intermediate filaments, KIF) 形成的微纤维束构成,KIF由高度组织化的α-螺旋角蛋白组成,大约6–9条螺旋角蛋白组成一条微纤维束。角蛋白是人类头发构成中的主要成分。纤维状的皮质层细胞相互扭绕,形成皮质层,使头发富有弹性和超强的韧性。皮质层含有黑色素,在维持头发的水分,决定头发的粗细、曲直和颜色中具有重要作用[6]。其中构成头发最基本的结构是无定形基质和中间丝,其蛋白主要包括角蛋白和角蛋白相关蛋白,它们相互交联形成一个复杂的网络结构,使头发具有良好的刚性和韧性[3]。角蛋白是中间纤维蛋白(intermediate protein, IP) 家族的重要成员,是构成头发、角、爪和人体皮肤外层的主要蛋白质,也是上皮细胞中主要的结构蛋白之一。根据蛋白的酸碱性特征,人头发角蛋白可分为Ⅰ型(酸性) 角蛋白(K31–K38) 和Ⅱ型(碱性-中性) 角蛋白(K81–K86)[7-8]。角蛋白中胱氨酸占比为11%–18%,半胱氨酸分子间形成的二硫键可增强头发强度,赋予头发坚韧的物理性质。角蛋白相关蛋白是角蛋白中间丝之间基质的主要成分,属相对较小的疏水蛋白,通常具有特征性的重复结构。根据其氨基酸组成,角蛋白相关蛋白分为高硫(半胱氨酸含量 < 30%)、超高硫(半胱氨酸含量 > 30%) 和高甘氨酸/酪氨酸几类。角蛋白中间丝是由Ⅰ型和Ⅱ型角蛋白组成的高度有序的共聚物,在皮质细胞的细胞质中堆积排列。角蛋白相关蛋白和角蛋白中间丝相互交联,形成的交联网络在发干结构稳定中起着至关重要的作用[9]。
髓质层又称毛髓层,位于头发的最中心层,由透明多角质化细胞组成,多为蜂巢状的中空组织。除角质化蛋白外髓质还含有些许麦拉宁黑色素粒子,与头发其他部分相比,它的脂肪含量较高,瓜氨酸含量较高,但胱氨酸含量较低,并且含有相对大量的酸性和碱性氨基酸以及羟基氨基酸。因此,二硫键被保持结构内凝聚力的多肽键取代,导致髓蛋白难溶于水,很难分离。髓质的含量会影响头发的硬度和强度,通常髓质较多的头发比较硬,反之较软。髓质不规则地存在于头发的中间,不具有运输营养的功能。髓质不是头发结构的必要组成成分,部分人的头发只由皮质层和表皮层构成[10-12]。
2 头发代谢组学研究进展及其在毒品等成瘾性物质和兴奋剂检测实践中的应用研究进展代谢组学是一种综合技术,用于系统地分析和量化细胞或组织内代谢物的行为和分泌的变化,并通过将各种代谢组与其相关的生理和病理条件联系以重新解释代谢物网络[13]。在当前医学中使用代谢组学的主要目的是确定药物作用或疾病的机制;发现用于诊断、预后、毒性的生物标志物和评估药物的治疗效果[14]。由于人类疾病和健康障碍是由身体代谢的变化引起的,因此代谢组学越来越多地用于诊断生物标志物和治疗靶点的发现和鉴定[15]。
头发特殊的蛋白和结构组成使其在常温环境中能稳定存在[16]。头发也因其独特的特性,成为一类具有“记录”机体一定时间生理状态的生物学样本,可利用其在代谢组学的优势,用于药物依赖性及慢性酒精滥用检测,法医毒理学和兴奋剂检测等领域具有极高的应用价值。
头发检测中的预处理流程暂未有标准化的过程。目前研究预处理主要分为头发采集、清洗、分区和碾磨4个步骤。头部后顶点区域的头发生长速度较其他区域相对变化小,处于生长阶段的头发数量也更恒定,并且受到年龄和性别相关因素的干扰较少,是最优的头发采集区域。文献中报道的头发样本量从0.1 mg到200 mg不等[17]。取样后,通常会使用有机溶剂对头发进行清洗,以除去外源的污染,洗净后会根据对应时间段,将头发分为不同的长度区域。把每个区域的头发剪碎或者碾磨,提取目标物质,再使用一定方法对物质进行测定。比较常用检测方法有酶联免疫分析法(enzyme- linked immunosorbent assay, ELISA)、放射免疫分析法(radio immune assay, RIA)、液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry, LC-MS/MS)、化学发光免疫分析法(chemiluminescent immune assay, CLIA) 等[18-19]。
头发代谢物是怀孕研究的重要信息来源,用于研究与怀孕有关的代谢机制和并发症以及胎儿生长状况。随着怀孕的进展,各种代谢物的浓度会发生变化。糖酵解和三羧酸循环的中间体,如丙酮酸、富马酸、柠檬酸和苹果酸,将各种代谢途径联系起来,碳水化合物代谢在怀孕期间显著改变[20-21]。
毒理学方面,已有的研究发现吸食含有伪麻黄碱成分药物人员的尿液用试纸检测时可能出现假阳性[22],迫切需要新的样品或检测技术。人类头发易于收集,成本低,易于运输和存储,也不易产生药物间的交叉反应,并可检测短期和长期暴露的信息,是毒品成瘾患者的理想样品来源[23-25]。早在1979年Baumgartner等利用放射免疫法检测头发中吗啡含量,从而鉴别海洛因吸食者[26-27]。芬太尼是一种合成阿片类药物,其效力是吗啡的50–100倍,因而越来越多地被掺入到海洛因中。Palamar等使用超高效液相色谱-串联质谱仪(ultra high performance liquid chromatography-tandem mass spectrometry, UHPLC MS/MS) 对一定长度的头发中芬太尼含量进行分析,追溯毒品成瘾者吸食毒品的时间[28]。除吸毒人员的检测外,头发也被用于过度饮酒者的诊断[29]。脂肪酸乙酯(fatty acid ethylesters, FAEE) 主要由乙醇和游离脂肪酸、甘油三酯、脂蛋白或磷脂由FAEE合成酶在肝脏中合成,也存在于人体毛囊中。其在诱导器官损害方面发挥着重要的作用,长期摄入酒精会导致FAEE含量升高,Kintz等通过气质联用色谱(gas chromatography-mass spectrometry, GC-MS) 检测FAEE含量,反映体内酒精的摄入量,从而实现酒精的监测[30]。
在兴奋剂检测方面头发样品也有一定的优势。代谢类固醇药物可以增加力量和攻击性,并缩短两次锻炼之间的恢复时间[31]。常规的兴奋剂检查时对运动员进行尿检和血检,但由于体液的瞬时性,无法检测较长时间前的服用状态,且血检、尿检前的短期停药可能会出现假阴性,影响检测结果[32]。为缓解这一矛盾,目前主要靠对运动员随时抽查来评判,可操作性低。头发检测药物可以很好地解决这两个难题。Kintz等通过对头发的药物检测,根据不同的长度段推测不同时间段内药物的服用情况,以此来进行服用时间追溯[33],不仅可减少假阴性的出现,还可减少运动员随时抽检的次数。
综上所述,头发在成瘾性药物、酒精滥用和兴奋剂检测以及法医毒理学方面具有广泛应用。头发在环境中稳定存在,又连续记录机体信息,可追溯某一段时间机体状态,在表征机体状态中具有独特的优势。对头发中的某一成分进行检测可实现对毒品、药品或者兴奋剂的使用情况的监测。头发中,蛋白质比微量化合物含量更多,若对头发中的蛋白质成分和占比进行检测,有望实现对人体的特征的判断和状态的追溯。
3 头发蛋白质组学研究现状蛋白质组学是研究一个基因组、细胞、组织或生物体在一定时间内所表达的整个蛋白质组的学科。本质上指在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平、翻译后的修饰、蛋白与蛋白相互作用等,由此获得蛋白质水平上的关于疾病发生发展、细胞代谢等过程的整体而全面的认识[34]。
蛋白质由20种氨基酸组成,且会发生各类的修饰,并且翻译后的可变剪切、固定修饰、蛋白酶切使得蛋白质种类可达百万之多。对于复杂的蛋白质组学来说,需要依赖许多具有高分辨率、高通量、对低丰度蛋白的识别技术以及对大量数据处理的解析方法和能力[35]。基于质谱的蛋白质组学允许同时测量数千种蛋白质的绝对或相对丰度,在吞吐量、灵敏度或两者方面都超过了其他方法。它还提供了一种没有特异性或敏感性限制的几乎通用的检测方法。即基于MS的蛋白质组学的一个典型的自下而上的“鸟枪式”蛋白质组学方法,该方法指的是样品中的所有蛋白质首先被消化成复杂的多肽混合物,然后对这些多肽进行分析以确定样品中存在哪些蛋白质,通常包括以下步骤:蛋白质酶消化成多肽、液相色谱分离和基于串联质谱的多肽测量、数据库搜索。液相色谱-串联质谱技术的最新发展使得快速分析样品中的多肽和蛋白质成为可能[36]。
2013年,Mellacheruvu等[37]开发的污染物亲和纯化质谱库(CRAPome) 质谱数据显示,90%以上的实验中都存在角蛋白作为污染物。这是由于角蛋白可以潜在地掩盖一些低丰度但具有临床意义的相关生物标志物的信号,所以被当作潜在污染库[38]。但同样重要的是,头发中的角蛋白及其他蛋白以及内源性和外源性的物质都为现代医学中的循证提供了便利条件和有价值的人体信息。Karantza[39]的研究表明角蛋白异构体的变化可被用于表征上皮疾病,是潜在的生物标志物。这为使用头发蛋白质组学方法寻找新的标志物开辟了新道路。
蛋白质组学方法可以研究头发蛋白质整体信息,实现个体特征鉴定。Zhang等[40]提出了一种基于凝胶的蛋白质组学方法来高灵敏度地分析头发样本,将每个样本分为10个组分,每个组分均鉴定到132–214个蛋白,其中角蛋白有13–15个,这15个角蛋白中有8个达到90%以上的覆盖率,其余7个中有5个达到50%以上,只有2个低于50% (KRT37和KRT84),基于凝胶电泳的蛋白质组学数据,作者建立了头发蛋白质库。Parker等[41]采用鸟枪法蛋白质组学技术对两组(EA1, n=51; EA2, n=15) 共66名的欧美受试者的头发蛋白进行表征,分别确定了182种和401种蛋白质。蛋白质组鉴定最丰富的蛋白质是角蛋白和角蛋白相关蛋白质,其他的包括钙调蛋白样蛋白3、S100钙结合蛋白A3、含V-set免疫球蛋白结构域蛋白8和硒-结合蛋白1,水平更低的包括管家蛋白、代谢酶以及与细胞结构(如细胞核、线粒体、质膜和溶酶体) 相关的蛋白质。以此获得了个性化和种族等生物地理信息。Laatsch等[42]使用相同方法对不同种族群体(包括高加索人、非裔美国人、肯尼亚人和韩国人) 的头发蛋白质组进行了鉴定,发现不同种族的人群具有独特的头发蛋白特征图谱,主要体现在头发KRT及KAP的表达水平。此外,Nasir等[43]发现人头发中Ⅰ型和Ⅱ型角蛋白,如KRT33b、KRT81、KRT83和KRT86等可以用来区分人类的性别和种族。在犯罪现场经常能找到头发的踪迹,尽管由于脱氧核糖核酸(deoxyribonucleic acid, DNA) 分析技术的快速进步,使得头发中DNA样品成为法医寻找犯罪人及受害人信息的重要来源。然而,DNA由于角质化过程而被广泛降解,可能不是头发分析的最有利部分[44]。头发中角蛋白的稳定性使头发具有研究个体特征的潜力和应用价值。
Rosenberg等[45]通过非标定量蛋白质组学技术对白头发进行研究,发现上调蛋白与能量代谢、线粒体和抗氧化防御相关,证明了心理压力是导致头发灰白的重要因素。Sinclair等[46]以丝状念珠菌为模型,探索头发蛋白质结构与头发强度和抗化妆品损伤的关系。在寻找头发中表征化学或氧化损伤的新多肽损伤标志物研究中,发现在漂白引起的氧化损伤具有头发蛋白质结构部位特异性,表明将蛋白质组学应用于先天性和获得性头发疾病的研究,可为头发损伤提供新的见解,并为发质保护提供新的策略。
4 头发蛋白质组学表征心理压力变化研究进展人体通常经受来自环境外部或内部情绪的各种压力。从心理学角度看,压力是压力源和压力反应共同构成的一种认知和行为体验过程,即心理压力[47]。心理压力会导致激素水平的失衡,使机体出现心血管疾病、炎症、肥胖、精神疾病等问题,对人的健康造成威胁[48-49]。因此,对心理压力状况的表征及监控十分重要。临床精神疾病诊断时,心理压力、焦虑或抑郁主要通过对患者直接观察和对患者及其直系亲属的医学访谈进行。在抑郁症或焦虑症的诊断中,还会使用心理压力评估量表作为一定的考量[50-51]。然而,这类诊断方法都是基于患者及医生的主观判断,准确性难以保证[52],亟需心理压力诊断客观标志物的出现。
心理压力与头发存在一定关系。心理压力过大通常会导致人持续的脱发和白发增多[53-56]。Zhang等[57]通过对小鼠毛发模型进行探索,发现心理压力通过控制毛囊干细胞微环境来改变头发生长状态,使得毛囊进入静息期,从而出现大量脱发或头发老化症状;还可通过交感神经过度激活导致黑素细胞干细胞耗竭进而导致白发增多。心理压力还通过患者自身免疫系统失衡,进而使得患者自身免疫系统攻击毛囊细胞,导致一种称为斑秃的自身免疫性疾病[58-59],诱导毛囊发生慢性炎症,进一步导致发质受损[60-61]。
目前,对心理压力标志物的实验研究主要包括皮质醇、免疫球蛋白A、溶菌酶、褪黑激素、α-淀粉酶、嗜铬粒蛋白A及成纤维细胞生长因子等[62]。皮质醇是人体内肾上腺皮质释放的一种糖皮质激素,是表征心理压力研究中最常用的标志物[63]。心理压力会影响皮质醇水平的升降及其变化幅度,因此,皮质醇下降幅度的快慢成为目前心理压力高低的生物学标志物[64]。2004年,Raul等[65]在头发中发现糖皮质激素之后,研究人员一直在探索头发皮质醇测量的可靠性和有效性。研究发现,每个月头发平均生长1 cm,可通过离头皮相应长度回溯相应时间的身体状态。由于过长暴露会受到一些化学试剂和其他因素的影响,导致皮质醇的含量发生改变,文献中最多利用大约6 cm长度的头发来评估机体在过去半年的受压水平[66-68]。
然而,头发中皮质醇作为反映心理压力的指标仍存在一定的难题。有研究发现仅凭单点的测量结果很难区分有严重抑郁症的患者[69],且皮质醇的浓度取决于其分泌的紊乱和昼夜节律[70]。头发皮质醇测量需要150根以上的头发,这使得许多秃头、发量稀少以及爱美人士受限于此。此外,由于每个人的生活规律以及体内的内分泌规律不同,皮质醇测量也有一定的偏差性,目前暂未有国际标准定义皮质醇衡量心理压力状况,结果缺乏对比性[15, 71-72]。除作为心理压力的指标外,头发皮质醇与体重指数、腰臀比密切相关,因此也与心血管疾病(如高血压、糖尿病和肥胖症) 的心脏代谢风险因素呈正相关[65, 73-75],其临床应用的潜力也有待挖掘。
现有基于激素的压力标志物检测存在瞬时性难题,难以追溯机体特定时间的承压水平[76]。相对于激素,蛋白质更为稳定。头发作为人体少有的具有时间延续性的生物学样本,其蛋白组成和组分变化有望用于评估机体特定时间内受压水平。心理压力导致头发产生系列变化,头发作为具有潜力及优势的分析样本,对其蛋白质组学分析可能找到客观依据进行诊断,有望提供表征心理压力的客观依据。
5 总结与展望近几年研究表明,头发正迅速成为诊断、治疗和法医毒理学学科中不可或缺的潜在标志物研究样本。与血液或尿液不同,头发具有稳定的物理和化学性质,可长时间记录机体生理状态,是一类可作为表征机体特定时间点或时间段受压水平的良好生物样本。但头发内角蛋白及角蛋白相关蛋白的相互交联,使得头发比常规的组织蛋白或体液蛋白质更难提取。笔者团队通过对提取流程比如裂解液、处理方式的优化,有效提高了毛发中蛋白质的提取率。另一方面,由于头发含有大量角蛋白和角蛋白相关蛋白,氨基酸顺序特殊,使得酶切也较常规的蛋白质组样品困难。笔者团队通过使用组合酶切,并提高酶的浓度,实现了毛发来源蛋白质组样品的高质量制备,实现了头发蛋白质组的高覆盖鉴定。这些研究为当前高发心理疾病头发蛋白质组学研究创造了条件。
人类头发差异是人种和不同地区人群的重要特征,其蛋白质组成、质地还可以反映人个体的心理、营养、免疫等健康状况。因此毛发蛋白质组学研究还可为特定心理压力人群健康维护、特殊护发和化妆品研制以及不同地区化妆品研发提供技术支撑。
| [1] |
Müller-Röver S, Handjiski B, Van Der Veen C, et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol, 2001, 117(1): 3-15. DOI:10.1046/j.0022-202x.2001.01377.x
|
| [2] |
Marshall RC, Orwin DF, Gillespie JM. Structure and biochemistry of mammalian hard keratin. Electron Microsc Rev, 1991, 4(1): 47-83. DOI:10.1016/0892-0354(91)90016-6
|
| [3] |
Barthélemy NR, Bednarczyk A, Schaeffer-Reiss C, et al. Proteomic tools for the investigation of human hair structural proteins and evidence of weakness sites on hair keratin coil segments. Anal Biochem, 2012, 421(1): 43-55. DOI:10.1016/j.ab.2011.10.011
|
| [4] |
Popescu C, Höcker H. Hair—the most sophisticated biological composite material. Chem Soc Rev, 2007, 36(8): 1282-1291. DOI:10.1039/b604537p
|
| [5] |
Jones LN. Hair structure anatomy and comparative anatomy. Clin Dermatol, 2001, 19(2): 95-103. DOI:10.1016/S0738-081X(00)00120-6
|
| [6] |
Dawber R. Hair: its structure and response to cosmetic preparations. Clin Dermatol, 1996, 14(1): 105-112.
|
| [7] |
Langbein L, Rogers MA, Winter H, et al. The catalog of human hair keratins. Ⅱ. Expression of the six type Ⅱ members in the hair follicle and the combined catalog of human type Ⅰ and Ⅱ keratins. J Biol Chem, 2001, 276(37): 35123-35132.
|
| [8] |
Langbein L, Rogers MA, Winter H, et al. The catalog of human hair keratins: i. expression of the nine type i members in the hair follicle. J Biol Chem, 1999, 274(28): 19874-19884.
|
| [9] |
Coulombe PA, Omary MB. 'Hard' and 'soft' principles defining the structure, function and regulation of keratin intermediate filaments. Curr Opin Cell Biol, 2002, 14(1): 110-122. DOI:10.1016/S0955-0674(01)00301-5
|
| [10] |
McEwen BS. Protective and damaging effects of stress mediators. N Engl J Med, 1998, 338(3): 171-179. DOI:10.1056/NEJM199801153380307
|
| [11] |
Powell BC, Rogers GE. The role of keratin proteins and their genes in the growth, structure and properties of hair. EXS, 1997, 78: 59-148.
|
| [12] |
De Cássia Comis Wagner R, Kiyohara PK, Silveira M, et al. Electron microscopic observations of human hair medulla. J Microsc, 2007, 226(Pt 1): 54-63.
|
| [13] |
Sugimoto M, Kawakami M, Robert M, et al. Bioinformatics tools for mass spectroscopy-based metabolomic data processing and analysis. Curr Bioinform, 2012, 7(1): 96-108. DOI:10.2174/157489312799304431
|
| [14] |
Worley B, Powers R. Multivariate analysis in metabolomics. Curr Metabolomics, 2013, 1(1): 92-107.
|
| [15] |
Dunn WB, Broadhurst DI, Atherton HJ, et al. Systems level studies of mammalian metabolomes: the roles of mass spectrometry and nuclear magnetic resonance spectroscopy. Chem Soc Rev, 2011, 40(1): 387-426. DOI:10.1039/B906712B
|
| [16] |
Lubec G, Nauer G, Seifert K, et al. Structural stability of hair over three thousand years. J Archaeol Sci, 1987, 14(2): 113-120. DOI:10.1016/0305-4403(87)90001-X
|
| [17] |
Kintz P, Villain M, Cirimele V. Hair analysis for drug detection. Ther Drug Monit, 2006, 28(3): 442-446. DOI:10.1097/01.ftd.0000211811.27558.b5
|
| [18] |
Russell E, Koren G, Rieder M, et al. Hair cortisol as a biological marker of chronic stress: current status, future directions and unanswered questions. Psychoneuroendocrinology, 2012, 37(5): 589-601. DOI:10.1016/j.psyneuen.2011.09.009
|
| [19] |
Braig S, Grabher F, Ntomchukwu C, et al. Determinants of maternal hair cortisol concentrations at delivery reflecting the last trimester of pregnancy. Psychoneuroendocrinology, 2015, 52: 289-296. DOI:10.1016/j.psyneuen.2014.12.006
|
| [20] |
Sulek K, Han TL, Villas-Boas SG, et al. Hair metabolomics: identification of fetal compromise provides proof of concept for biomarker discovery. Theranostics, 2014, 4(9): 953-959. DOI:10.7150/thno.9265
|
| [21] |
Delplancke TDJ, De Seymour JV, Tong C, et al. Analysis of sequential hair segments reflects changes in the metabolome across the trimesters of pregnancy. Sci Rep, 2018, 8(1): 36. DOI:10.1038/s41598-017-18317-7
|
| [22] |
Angerer J, Ewers U, Wilhelm M. Human biomonitoring: state of the art. Int J Hyg Environ Health, 2007, 210(3/4): 201-228.
|
| [23] |
Barbosa F Jr, Tanus-Santos JE, Gerlach RF, et al. A critical review of biomarkers used for monitoring human exposure to lead: advantages, limitations, and future needs. Environ Health Perspect, 2005, 113(12): 1669-1674. DOI:10.1289/ehp.7917
|
| [24] |
Zhang H, Chai ZF, Sun HB. Human hair as a potential biomonitor for assessing persistent organic pollutants. Environ Int, 2007, 33(5): 685-693. DOI:10.1016/j.envint.2007.02.003
|
| [25] |
Usman M, Naseer A, Baig Y, et al. Forensic toxicological analysis of hair: a review. Egypt J Forensic Sci, 2019, 9: 17. DOI:10.1186/s41935-019-0119-5
|
| [26] |
Moeller KE, Lee KC, Kissack JC. Urine drug screening: practical guide for clinicians. Mayo Clin Proc, 2008, 83(1): 66-76. DOI:10.4065/83.1.66
|
| [27] |
Baumgartner AM, Jones PF, Baumgartner WA, et al. Radioimmunoassay of hair for determining opiate-abuse histories. J Nucl Med, 1979, 20(7): 748-752.
|
| [28] |
Palamar JJ, Salomone A, Bigiarini R, et al. Testing hair for fentanyl exposure: a method to inform harm reduction behavior among individuals who use heroin. Am J Drug Alcohol Abuse, 2019, 45(1): 90-96. DOI:10.1080/00952990.2018.1550652
|
| [29] |
Agius R, Kintz P, Society EWDT. Guidelines for European workplace drug and alcohol testing in hair. Drug Test Anal, 2010, 2(8): 367-376. DOI:10.1002/dta.147
|
| [30] |
Kintz P, Cirimele V, Jeanneau T, et al. Identification of testosterone and testosterone esters in human hair. J Anal Toxicol, 1999, 23(5): 352-356. DOI:10.1093/jat/23.5.352
|
| [31] |
Mottram DR, George AJ. Anabolic steroids. Best Pract Res Clin Endocrinol Metab, 2000, 14(1): 55-69. DOI:10.1053/beem.2000.0053
|
| [32] |
Rivier L. Is there a place for hair analysis in doping controls. Forensic Sci Int, 2000, 107(1/2/3): 309-323.
|
| [33] |
Kintz P, Samyn N. Use of alternative specimens: drugs of abuse in saliva and doping agents in hair. Ther Drug Monit, 2002, 24(2): 239-246. DOI:10.1097/00007691-200204000-00006
|
| [34] |
Pandey A, Mann M. Proteomics to study genes and genomes. Nature, 2000, 405(6788): 837-846. DOI:10.1038/35015709
|
| [35] |
Pedrioli PGA, Eng JK, Hubley R, et al. A common open representation of mass spectrometry data and its application to proteomics research. Nat Biotechnol, 2004, 22(11): 1459-1466. DOI:10.1038/nbt1031
|
| [36] |
Jemal M. High-throughput quantitative bioanalysis by LC/MS/MS. Biomed Chromatogr, 2000, 14(6): 422-429. DOI:10.1002/1099-0801(200010)14:6<422::AID-BMC25>3.0.CO;2-I
|
| [37] |
Mellacheruvu D, Wright Z, Couzens AL, et al. The CRAPome: a contaminant repository for affinity purification–mass spectrometry data. Nat Methods, 2013, 10(8): 730-736. DOI:10.1038/nmeth.2557
|
| [38] |
Pu XZ, Oxford JT. Proteomic analysis of engineered cartilage. Methods Mol Biol, 2015, 1340: 263-278.
|
| [39] |
Karantza V. Keratins in health and cancer: more than mere epithelial cell markers. Oncogene, 2011, 30(2): 127-138. DOI:10.1038/onc.2010.456
|
| [40] |
Zhang Z, Burke MC, Wallace WE, et al. Sensitive method for the confident identification of genetically variant peptides in human hair keratin. J Forensic Sci, 2020, 65(2): 406-420. DOI:10.1111/1556-4029.14229
|
| [41] |
Parker GJ, Leppert T, Anex DS, et al. Demonstration of protein-based human identification using the hair shaft proteome. PLoS One, 2016, 11(9): e0160653. DOI:10.1371/journal.pone.0160653
|
| [42] |
Laatsch CN, Durbin-Johnson BP, Rocke DM, et al. Human hair shaft proteomic profiling: individual differences, site specificity and cuticle analysis. PeerJ, 2014, 2: e506. DOI:10.7717/peerj.506
|
| [43] |
Nasir NM, Hiji J, Jayapalan JJ, et al. Potential use of human hair shaft keratin peptide signatures to distinguish gender and ethnicity. PeerJ, 2020, 8: e8248. DOI:10.7717/peerj.8248
|
| [44] |
Bengtsson CF, Olsen ME, Brandt LØ, et al. DNA from keratinous tissue. Part I: hair and nail. Ann Anat, 2012, 194(1): 17-25.
|
| [45] |
Rosenberg AM, Rausser S, Ren JT, et al. Quantitative mapping of human hair greying and reversal in relation to life stress. eLife, 2021, 10: e67437. DOI:10.7554/eLife.67437
|
| [46] |
Sinclair R, Flagler MJ, Jones L, et al. The proteomic profile of hair damage. Br J Dermatol, 2012, 166(Suppl 2): 27-32.
|
| [47] |
Lazarus RS. From psychological stress to the emotions: a history of changing outlooks. Annu Rev Psychol, 1993, 44: 1-21. DOI:10.1146/annurev.ps.44.020193.000245
|
| [48] |
Hill DC, Moss RH, Sykes-Muskett B, et al. Stress and eating behaviors in children and adolescents: systematic review and meta-analysis. Appetite, 2018, 123: 14-22. DOI:10.1016/j.appet.2017.11.109
|
| [49] |
Tomiyama AJ. Stress and obesity. Annu Rev Psychol, 2019, 70: 703-718. DOI:10.1146/annurev-psych-010418-102936
|
| [50] |
Beck AT, Ward CH, Mendelson M, et al. An inventory for measuring depression. Arch Gen Psychiatry, 1961, 4: 561-571. DOI:10.1001/archpsyc.1961.01710120031004
|
| [51] |
Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry, 1960, 23(1): 56-62. DOI:10.1136/jnnp.23.1.56
|
| [52] |
Montgomery SA, Asberg M. A new depression scale designed to be sensitive to change. Br J Psychiatry, 1979, 134: 382-389. DOI:10.1192/bjp.134.4.382
|
| [53] |
Trüeb RM. The impact of oxidative stress on hair. Int J Cosmet Sci, 2015, 37(Suppl 2): 25-30.
|
| [54] |
Trüeb RM. Oxidative stress in ageing of hair. Int J Trichology, 2009, 1(1): 6-14. DOI:10.4103/0974-7753.51923
|
| [55] |
Hadshiew IM, Foitzik K, Arck PC, et al. Burden of hair loss: stress and the underestimated psychosocial impact of telogen effluvium and androgenetic alopecia. J Invest Dermatol, 2004, 123(3): 455-457. DOI:10.1111/j.0022-202X.2004.23237.x
|
| [56] |
York J, Nicholson T, Minors P, et al. Stressful life events and loss of hair among adult women, a case-control study. Psychol Rep, 1998, 82(3 Pt 1): 1044-1046.
|
| [57] |
Zhang B, Ma S, Rachmin I, et al. Hyperactivation of sympathetic nerves drives depletion of melanocyte stem cells. Nature, 2020, 577(7792): 676-681. DOI:10.1038/s41586-020-1935-3
|
| [58] |
Prie BE, Voiculescu VM, Ionescu-Bozdog OB, et al. Oxidative stress and alopecia areata. J Med Life, 2015, 8(Spec Issue): 43-46.
|
| [59] |
Ghanizadeh A, Ayoobzadehshirazi A. A review of psychiatric disorders comorbidities in patients with alopecia areata. Int J Trichology, 2014, 6(1): 2-4. DOI:10.4103/0974-7753.136746
|
| [60] |
Peters EMJ, Müller Y, Snaga W, et al. Hair and stress: a pilot study of hair and cytokine balance alteration in healthy young women under major exam stress. PLoS One, 2017, 12(4): e0175904. DOI:10.1371/journal.pone.0175904
|
| [61] |
Trüeb RM. Oxidative stress and its impact on skin, scalp and hair. Int J Cosmet Sci, 2021, 43(Suppl 1): S9-S13.
|
| [62] |
Chojnowska S, Ptaszyńska-Sarosiek I, Kępka A, et al. Salivary biomarkers of stress, anxiety and depression. J Clin Med, 2021, 10(3): 517. DOI:10.3390/jcm10030517
|
| [63] |
Levine A, Zagoory-Sharon O, Feldman R, et al. Measuring cortisol in human psychobiological studies. Physiol Behav, 2007, 90(1): 43-53. DOI:10.1016/j.physbeh.2006.08.025
|
| [64] |
Gozansky WS, Lynn JS, Laudenslager ML, et al. Salivary cortisol determined by enzyme immunoassay is preferable to serum total cortisol for assessment of dynamic hypothalamic—pituitary—adrenal axis activity. Clin Endocrinol (Oxf), 2005, 63(3): 336-341. DOI:10.1111/j.1365-2265.2005.02349.x
|
| [65] |
Raul JS, Cirimele V, Ludes B, et al. Detection of physiological concentrations of cortisol and cortisone in human hair. Clin Biochem, 2004, 37(12): 1105-1111. DOI:10.1016/j.clinbiochem.2004.02.010
|
| [66] |
Pragst F, Balikova MA. State of the art in hair analysis for detection of drug and alcohol abuse. Clin Chim Acta, 2006, 370(1/2): 17-49.
|
| [67] |
Xie QZ, Gao W, Li JF, et al. Correlation of cortisol in 1-cm hair segment with salivary cortisol in human: hair cortisol as an endogenous biomarker. Clin Chem Lab Med, 2011, 49(12): 2013-2019.
|
| [68] |
Kirschbaum C, Tietze A, Skoluda N, et al. Hair as a retrospective calendar of cortisol production-Increased cortisol incorporation into hair in the third trimester of pregnancy. Psychoneuroendocrinology, 2009, 34(1): 32-37. DOI:10.1016/j.psyneuen.2008.08.024
|
| [69] |
Yonekura T, Takeda K, Shetty V, et al. Relationship between salivary cortisol and depression in adolescent survivors of a major natural disaster. J Physiol Sci, 2014, 64(4): 261-267. DOI:10.1007/s12576-014-0315-x
|
| [70] |
Clow A, Thorn L, Evans P, et al. The awakening cortisol response: methodological issues and significance. Stress, 2004, 7(1): 29-37. DOI:10.1080/10253890410001667205
|
| [71] |
Gonzalez D, Jacobsen D, Ibar C, et al. Hair cortisol measurement by an automated method. Sci Rep, 2019, 9(1): 8213. DOI:10.1038/s41598-019-44693-3
|
| [72] |
Kim MY, Kim GU, Son HK. Hair cortisol concentrations as a biological marker of maternal prenatal stress: a systematic review. Int J Environ Res Public Health, 2020, 17(11): 4002. DOI:10.3390/ijerph17114002
|
| [73] |
Iob E, Steptoe A. Cardiovascular disease and hair cortisol: a novel biomarker of chronic stress. Curr Cardiol Rep, 2019, 21(10): 116. DOI:10.1007/s11886-019-1208-7
|
| [74] |
Massey AJ, Campbell BK, Raine-Fenning N, et al. Relationship between hair and salivary cortisol and pregnancy in women undergoing IVF. Psychoneuroendocrinology, 2016, 74: 397-405. DOI:10.1016/j.psyneuen.2016.08.027
|
| [75] |
Stalder T, Steudte-Schmiedgen S, Alexander N, et al. Stress-related and basic determinants of hair cortisol in humans: a meta-analysis. Psychoneuroendocrinology, 2017, 77: 261-274. DOI:10.1016/j.psyneuen.2016.12.017
|
| [76] |
Labad J, Stojanovic-Pérez A, Montalvo I, et al. Stress biomarkers as predictors of transition to psychosis in at-risk mental states: roles for cortisol, prolactin and albumin. J Psychiatr Res, 2015, 60: 163-169. DOI:10.1016/j.jpsychires.2014.10.011
|
 2022, Vol. 38
2022, Vol. 38