中国科学院微生物研究所、中国微生物学会主办
文章信息
- 阴梦琪, 阳佳君, 于汉杰, 李铮
- YIN Mengqi, YANG Jiajun, YU Hanjie, LI Zheng
- 糖鞘脂介导细胞凋亡及其在肿瘤治疗中的研究进展
- Glycosphingolipid-mediated apoptosis and tumor therapy: a review
- 生物工程学报, 2022, 38(10): 3659-3673
- Chinese Journal of Biotechnology, 2022, 38(10): 3659-3673
- 10.13345/j.cjb.220529
-
文章历史
- Received: July 8, 2022
- Accepted: September 9, 2022
糖脂是一类在生物体分布甚广,但含量较少的两亲性分子,糖脂据其组分中的醇基种类被分为两大类:甘油糖脂和糖鞘脂(glycosphingolipids, GSLs),其中研究较为深入和广泛的则是GSLs,其由糖链头部和神经酰胺(ceramide) 尾部组成,其广泛存在于各类生物细胞膜结构中[1],早期研究认为GSLs主要作为生物膜物理性质的调节者,但近年来的研究则发现GSLs是许多生物过程、信号通路和细胞死亡调节的关键分子。此外,GSLs作为调控膜微区、脂筏微结构域的各种信号的功能分子,其异常表达与癌症的发生发展密切相关[2],有望作为肿瘤标记物[3]。
随着糖组学以及糖链分析技术的发展,GSLs的结构及其功能被不断解析和发现。GSLs糖链作为信息分子,涉及多种类型细胞生命的空间和时间过程,是信息功能的呈递者。GSLs糖链有7种单糖组成,不同的糖链与神经酰胺的组合可形成约2 000种GSLs。GSLs糖链的多样性及其在细胞中的位置决定了它的功能重要性[4]。因此,本文从GSLs的合成代谢及功能方面进行概述,并且讨论了GSLs对细胞凋亡的影响及其在肿瘤治疗中的研究进展。
1 GSLs的合成代谢及功能 1.1 GSLs的合成鞘脂类分子由3部分构成:第一部分是脂肪酸长链,链长度大约为18−26个碳原子;二是鞘氨醇,其是带有氨基的二醇,链长约有18个碳原子,通过酰胺键将脂肪酸长链条与鞘氨醇之间相连接,即神经酰胺;三是头部的极性基团,鞘氨醇的一位碳原子羟基上一般连接着极性头部。由于极性基团的差异,产生种类不同的鞘脂,含有磷酸基团的这类为鞘磷脂,而带有糖基的一类则是GSLs。
GSLs的生物合成始于内质网胞质膜小叶[5],丝氨酸和棕榈酰-辅酶A在棕榈酰基转移酶催化下形成3-酮二氢鞘氨醇,再经过还原、脱氢生成神经酰胺,作为合成复杂GSLs和神经节苷脂的前体。神经酰胺首先通过囊泡运输或神经酰胺转移蛋白(ceramide transfer protein, CERT) 转运到高尔基体,然后在葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS) 的催化下将葡萄糖残基以葡萄糖-糖苷键连接到神经酰胺的1位,转化为葡萄糖神经酰胺(glucosylceramide, GlcCer)。脂结合蛋白FAPP2介导新合成的GlcCer的非囊状转运到不同细胞膜胞质表面,在顺式高尔基体早期腔室的腔面向GlcCer添加糖基,由相应的葡萄糖基转移酶(glucosyltransferase, GlcT) 和半乳糖基转移酶(galactosyltransferase, GalT) 催化,将核苷酸糖上的单糖转移至GlcCer或半乳糖神经酰胺上,进行GSLs糖链的延伸[6]。构成GSLs的糖链组成较为复杂,主要有d-葡萄糖、d-半乳糖、l-岩藻糖、d-甘露糖、N-乙酰葡萄糖胺(N-acetylglucosamine, GlcNAc)、N-乙酰半乳糖胺(N-acetylgalactosamine, GalNAc) 及唾液酸(sialic acid, SA) 等[7]。
根据糖基性质,可将GSLs分为含一个或者多个唾液酸的酸性GSLs和不含唾液酸且非硫酸化的中性GSLs,酸性GSLs又称为神经节苷脂,是研究较多的一类GSLs。根据糖链核心结构的不同,GSLs主要分为Gala-、Globo (Gb)-、isoglobo (iGb)-、Ganglio (Gg)-、lacto (Lc)-、Neolacto (nLc)-、Arthro (Ar)-以及Mollu (MI)-等系列[8]。GlcCer半乳糖化生成的乳糖神经酰胺(lactosylceramides, LacCer),是合成不同GSLs系列的共同前体,由不同的特定合成酶催化LacCer合成4个分支系列的GSLs即globo-、Asialo-、lacto-和ganglio-系列,各分支又进一步细分为多个小的种类。
GSLs的命名沿用了Svennerholm[9]为神经系列的神经节苷脂提出的命名体系:G代表神经节苷脂;A、M、D、T、Q、P、H、S分别代表含有0−7个唾液酸;含不同糖基但相同唾液酸的神经节苷脂用5糖基数之差表示;连接唾液酸的位置用a、b或c来表示,例如GM1a,字母G代表神经节苷脂,M表示含有1个唾液酸,1代表与神经酰胺相连的4个糖基(1=5–4),a表示唾液酸在第二位半乳糖上。
1.2 GSLs的代谢 1.2.1 溶酶体代谢途径GSLs的分解代谢过程主要在包涵体和溶酶体中有序进行。GSLs通过不同的途径到达包涵体和溶酶体,对于一些较大的结构,如含有大量糖脂的衰老细胞,可被巨噬细胞吞噬,或者通过受体介导的内吞作用被低密度脂蛋白运输到细胞中。另一种重要途径则是细胞膜的内吞作用和溶酶体降解模型(图 1),细胞膜表面聚集的GSLs通过细胞膜内陷,进入细胞质后形成内涵体,大部分需要分解的GSLs会通过囊泡进入到溶酶体降解[10-11]。GSLs糖链的水解需要特异性GSLs激活蛋白协助糖苷酶进行。GlcCer在溶酶体中被葡糖脑苷脂酶(glucocerebrosidase, GBA) 降解为神经酰胺和葡萄糖,神经酰胺则进一步被酸性神经酰胺酶分解为神经鞘氨醇和脂肪酸,而神经鞘氨醇经过再酰化作用生成神经酰胺或者作为1-磷酸鞘氨醇(sphingosine 1-phosphate, S1P) 合成酶的底物合成S1P,S1P作为细胞膜鞘氨醇的代谢产物,与细胞外伴侣结合,并与G蛋白偶联的S1P受体结合,调节免疫细胞转运、血管发育和稳态等重要过程[11]。
非溶酶体途径的GSLs分解代谢常常与信号转导有关,其代谢产物可以作为信号分子参与信号通路的调节,但是目前对非溶酶体途径的GSLs分解代谢的报道并不多。最近研究表明葡糖苷酶(GBA2) 可能会参与非溶酶体途径的GSLs分解代谢,该糖苷酶锚定在细胞膜的外侧,GlcCer被GBA2分解后产生的神经酰胺迅速地又生成了神经鞘磷脂,而不是如溶酶体分解代谢途径一样,继续分解成为神经鞘氨醇与脂肪酸,这说明GBA2与鞘磷脂合成酶(sphingomyelin synthase, SMS) 相伴而生,并且GBA2抑制剂对脂质异常具有一定的矫正作用[12-13]。此外,乳糖酶根皮苷水解酶(lactace-phlorizinhydrolase, LPH) 能够水解半乳糖神经酰胺、乳糖神经酰胺、GlcCer等,但却不能水解GM1,它结合在细胞膜的外侧,并且只表达于肠道微绒毛的上皮细胞,因此LPH很可能是在肠道内消化食物中的GSLs[7]。
1.3 GSLs的功能随着技术的不断改进以及分离方法的不断发展,各种生物组织中GSLs成分及其生物学功能逐渐被发现。GSLs的生物合成对细胞内蛋白质的运输起到重要的作用,抑制GSLs的合成会影响脂蛋白到髓鞘膜的转运。研究显示,GSLs缺失对黑色素细胞酪氨酸酶错定位有显著影响,若没有GSLs,黑色素合成所必需的酪氨酸酶便不能到达黑色素体,而是在高尔基体中积累,引起黑色素合成能力降低,皮肤敏感性增加[14]。也有研究表示GSLs/胆固醇在细胞内囊泡转运过程中起着更为普遍的蛋白分选作用[15]。抑制细胞GSLs生物合成导致p糖蛋白的细胞表面免疫检测丢失以及脂筏的减少,揭示了这些过程之间存在密切关系[16-17]。
GSLs能介导细胞间相互作用和调节信号转导通路,特别是其神经酰胺部分,具有调节细胞凋亡途径和细胞命运的能力。神经酰胺是GSLs的代谢产物,在各种应激刺激下产生,如肿瘤坏死因子-α、CD95/Fas、化疗药物和辐照。GSLs代谢会影响神经酰胺水平,而神经酰胺及其代谢产物广泛参与细胞生长控制的机制。GCS可以将神经酰胺糖基化而形成GlcCer,GSLs的合成会消耗神经酰胺,因此GCS是调控GSLs生物合成的主要控制点,也调控着细胞内神经酰胺的浓度[18]。GCS可间接参与细胞毒性药物诱导的神经酰胺积累从而控制各种肿瘤细胞的生长,并通过增加GCS活性而破坏此途径[19]。因此,GCS在肿瘤化疗耐药的发生中起着至关重要的作用。异常的GSLs生物合成会导致疾病的发生,如溶酶体储存疾病,可诱发严重的神经病变[20]。
神经节苷脂类GSLs具有修饰细胞膜受体的功能且与细胞生长有关,多项证据表明神经节苷脂GM1刺激神经元发芽并增强神经生长因子(nerve growth factor, NGF) 的作用,神经节苷脂GM1与NGF受体TrkA相关并调节受体功能,增强神经突生长[21]。说明GM1作为一种特异性的内源性NGF受体功能激活因子,而这些增强作用似乎是由于GM1与Trk的紧密联系。另一项研究表明,GM1与血小板衍生生长因子(platelet derived growth factor, PDGF) 的相互作用降低了PDGF受体的磷酸化,减少了丝裂原活化蛋白激酶(mitogen-activated protein kinase MAPK) 的激活,从而导致细胞增殖减少[22]。
虽然神经节苷脂GM3与表皮生长因子受体相互作用并调节其功能的机制尚不清楚,但有研究表明其可修饰表皮生长因子受体(epidermal growth factor receptor, EGFR) 酪氨酸激酶的信号转导[23]。当GM3与细胞外表皮生长因子(epidermal growth factor, EGF) 结合时,受体酪氨酸激酶在羧基末端的3个位点发生自磷酸化[24],当细胞GM3合酶缺陷导致神经节苷类缺失,进而引起EGF与EGFR结合减少,具体表现为生长速度和细胞迁移反应减弱,表明神经节苷脂相互作用也影响配体与EGFR结合[23, 25]。基于以上研究推测GM3对EGFR在以下2个方面产生影响:一方面GM3在脂筏中含量的提高增加了细胞表面脂筏所占比重,使EGFR在脂筏中的分布范围扩大;另一方面,GM3与EGFR-N糖链结构相互结合,促使EGFR在脂筏中分布进一步扩大,使配体结合变得更加不易,从而阻止了其磷酸化。
GSLs对胰岛素受体功能有一定的影响。神经节苷脂GM3被证明是胰岛素敏感性的负调节因子,GM3基因缺陷的小鼠对胰岛素敏感[26],并且在戈谢病(Gauchers) 患者中也发现胰岛素抵抗增加[27],其中葡萄糖神经酰胺和GM3积累[28]。抑制GSL合成可以改善Ⅱ糖尿病动物模型的胰岛素敏感性,药物抑制葡萄糖神经酰胺合成酶增强胰岛素敏感性。降低肥胖小鼠脂肪组织中GSLs的含量可以恢复胰岛素敏感性、脂肪生成和减少炎症反应[29]。
GSLs在人类免疫缺陷病毒(human immunodeficiency virus, HIV) 感染中的受体作用是非常复杂的[30]。HIV壳膜蛋白(gp120) 在病毒膜上形成一个高糖基化的三聚体复合物,gp120蛋白在HIV病毒入侵人体的机制中发挥着非常重要的作用。GSL结合位点位于gp120的V3环内,与gp120结合的GSLs包括GM3、GD3和Gb3。Lund等[31]利用HIV易感细胞,表明细胞中Gb3水平的增加导致HIV易感性的降低,而细胞Gb3的消耗导致了HIV易感性的显著增加。抑制半乳糖苷酶使细胞中Gb3水平升高,进而降低HIV易感性;抑制GCS使细胞中Gb3水平降低,进而显著升高HIV易感性,用Gb3合酶转染CD4-HeLa细胞可选择性地增加Gb3和降低对HIV的易感性,因此,Gb3可能是HIV易感性的负风险因素[32]。
2 GSLs与细胞凋亡细胞程序性死亡,是一种精确调控的细胞死亡形式,对多细胞生物的稳态和正常发展至关重要。凋亡是细胞死亡的一种特殊形式,最终导致细胞分裂成紧密的膜封闭结构,称为凋亡小体,被邻近的细胞和吞噬细胞所吞噬,通常可以防止炎症和组织损伤[33]。细胞凋亡最初表现为细胞形态的改变,如收缩、染色质凝结和核碎裂。细胞凋亡过程中,细胞内容物被细胞膜包裹在凋亡小体中,此过程主要是由半胱氨酸蛋白酶(caspases) 活性引起的,半胱氨酸蛋白酶裂解多个蛋白,导致凋亡小体被吞噬细胞识别[34]。细胞凋亡的诱导途径主要有两种,一种是线粒体通路(内在途径),另一种是死亡受体的激活通路(外在途径)。线粒体途径通过Bcl-2家族成员触发凋亡,Bcl-2家族成员控制线粒体外膜通透性、细胞色素c的释放以及引发半胱氨酸蛋白酶级联反应,导致细胞凋亡[35]。外源性细胞死亡通路通常由死亡配体和死亡受体结合而发生,死亡配体主要为肿瘤坏死因子(tumor necrosis factor, TNF) 家族,包括Fas配体、TNF受体和TNF相关的凋亡诱导配体(NF-related apoptosis-inducing ligand, TRAIL),与死亡受体结合后招募Fas相关死亡结构域蛋白、caspase-8组装成死亡诱导信号复合体,从而活化caspase-3来执行细胞凋亡[36]。
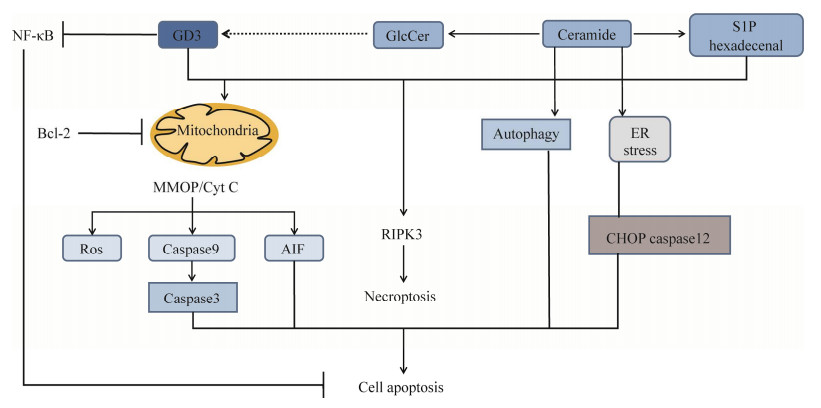
GSLs在细胞生理学和病理生理学的许多方面都扮演着重要的角色,其除了作为膜双分子层的结构成分,还调节多种细胞功能,特别是作为细胞凋亡的生物活性脂质。GSLs分别通过与线粒体相互作用和激活RIPK3诱导细胞凋亡或坏死。此外,神经酰胺可诱导内质网应激和自噬,进一步导致细胞死亡。除了激活这些细胞凋亡通路外,神经节苷脂GD3直接与分离的线粒体相互作用,诱导细胞器肿胀和活性氧(reactive oxygen species, ROS) 的产生以及细胞色素c、凋亡诱导因子(apoptosis inducing factor, AIF) 和caspase-9。除了与线粒体相互作用吸引这些细胞器进入凋亡通路外,GD3还破坏依赖NF-κB的生存通路。GD3在大多数正常组织中是一种次要的神经节苷脂,但在多种肿瘤中高表达,且在诱导细胞凋亡的作用是多方面的,包括募集主要途径,如线粒体通路、内质网应激和自噬,以及通过激活受体相互作用蛋白激酶3 (receptor interacting protein kinase 3, RIPK3) 诱导细胞凋亡(图 2)。GSLs与线粒体、内质网和溶酶体等不同细胞器的相互作用可引发细胞凋亡,细胞内该过程的分子调控机制十分复杂。
线粒体除了在能量产生中起主要作用,还在调节细胞死亡(包括凋亡或坏死) 中发挥作用。此外,线粒体在神经酰胺介导的细胞凋亡中起着重要作用。神经酰胺已被证明参与死亡受体介导的细胞凋亡,并调节了细胞内在通路,进而调节细胞凋亡通路的核心步骤。神经酰胺与线粒体电子传递链组分相互作用,并在结肠癌[37]、卵巢癌和乳腺癌[38-39]等不同肿瘤细胞的增殖和凋亡中起着至关重要的作用。线粒体内质网膜上神经节苷脂GM1的积累将内质网应激与Ca2+依赖的线粒体凋亡联系起来,在人溶酶体贮积症小鼠模型中发现,神经节苷脂GM1在线粒体相关膜富含糖脂的微域部分中积累,并与三磷酸肌醇(inositol triphosphate, IP3) 受体的磷酸化形式相互作用,影响该通道的活性。内质网Ca2+被线粒体吸收,导致细胞器Ca2+超载,诱导线粒体膜电位(mitochondrial membrane potential, MMP) 改变和线粒体凋亡通路的激活[40]。神经节苷脂GD3的合成和短暂积累对于Fas交联和神经酰胺诱导的凋亡信号的进展是必需的[41],阻止神经节苷类的生物合成和淋巴细胞中GD3的积累,可以显著保护细胞不受Fas来源的凋亡信号的影响[42]。除了与线粒体的相互作用从而诱导这些细胞器进入凋亡途径外,GD3还阻断依赖NF-κB的生存途径,从而调节细胞凋亡的平衡。这些研究结果清楚地表明神经节苷脂GD3在自噬和调节脂质筏微域方面的新作用,这对其在细胞凋亡中的作用至关重要[43]。
近年来,在神经酰胺介导的应激反应中,导致线粒体活化和随后细胞凋亡的细胞内途径得到了深入研究。除了从头合成产生神经酰胺外,细胞还可以通过鞘磷脂(sphingomyelin, SM) 水解产生神经酰胺。在许多有害刺激导致的应激、凋亡和细胞死亡时,细胞激活SMases导致神经酰胺在特定位点快速而短暂的释放,并参与特定的信号通路,此外,神经酰胺也可活化蛋白激酶C (protein kinase C, PKC),其活化可介导AKT抑制和JNK活化,诱导细胞凋亡[44]。
线粒体凋亡是由Bcl-2蛋白家族成员调控的[35],Bcl-2可以定位于不同细胞类型的线粒体、核膜以及内质网上,主要通过阻止线粒体细胞色素c的释放从而发挥其抗凋亡作用。Bcl-2家族中的成员Bax参与诱导细胞凋亡时,其将从胞液转移至核膜和线粒体上。有研究认为神经酰胺通过Bax依赖途径诱导人癌细胞线粒体活化和凋亡[45],但在最近的一篇综述中,Martinou等[46]提出了神经酰胺介导的细胞死亡途径的假说,该途径不依赖于Bax,线粒体分离的异型膜抑制了Bak/bax依赖的细胞色素c的释放。线粒体在生理和功能上都与异型膜相关,线粒体凋亡途径受Bcl-2家族蛋白调控,特别是Bax和Bak,它们控制着线粒体外膜通透性(mitochondrial outer membrane permeabilization, MOMP)、细胞色素c的释放和凋亡。
鞘脂代谢通过调控Bax/Bak的激活在线粒体凋亡中起关键作用[47],神经酰胺分解代谢的主要途径是神经酰胺酶催化神经酰胺去酰化到鞘氨醇,然后由鞘氨醇激酶将鞘氨醇磷酸化到S1P。S1P和十六烯醛分别与Bak和Bax特异性合作,诱导MOMP和细胞凋亡。
2.2 GSLs与内质网应激除了线粒体在细胞凋亡中的中心作用外,细胞凋亡还受到细胞器复杂分子相互作用的控制[48],内质网(endoplasmic reticulum, ER) 在细胞中起着重要的稳态功能,主要控制蛋白质和脂类的合成以及转运。内质网生理功能的破坏将导致应激反应,称为未折叠蛋白反应(unfolded protein response, UPR),其主要目的是恢复体内平衡。UPR的分子机制包括3个由Ca2+和主伴侣(glucose-regulating protein 78/binding immunoglobulin protein, GRP78/Bip) 调控的保守途径,在早期的UPR过程中,未折叠的蛋白使GRP78/Bip从ER常驻激酶中分离,然而,内质网过度和长时间的应激会激活转录因子(C/EBP-homologous protein, CHOP) 和caspase12等特定中间体而引起细胞凋亡[49]。由于溶酶体半乳糖苷酶缺乏导致GM1积累,继而引起GRP78和CHOP的上调,以及JNK2和caspase-12的激活,最终导致小鼠神经元细胞死亡[50]。
3 GSLs在肿瘤治疗中的研究现状 3.1 GSLs与肿瘤的发生发展细胞表面脂质糖基化的改变可以通过调控上皮-间质转化(epithelial-mesenchymal transition, EMT) 过程中涉及的不同信号通路来影响细胞粘附、识别和信号转导,从而参与肿瘤的发展和转移[51]。大量研究表明,肿瘤进程中发生的特异性GSLs及相关酶的异常表达与肿瘤的发生和恶性转化密切相关,例如外泌体通过microRNAs (miRNAs) 参与调节癌症的进展和转移,而外泌体分泌的神经酰胺途径可以影响癌细胞的凋亡[52-53]。
高增殖的癌细胞不仅需要脂质来生成细胞膜(磷脂、胆固醇和鞘脂),而且还需要脂质作为能量代谢的底物(三酰基甘油) 或信号分子的来源。GSLs与几种人类疾病有关,尤其在癌症中,相比于健康组织,乳腺癌、肾癌、肺癌和肝癌等癌症组织的脂质组谱显著改变。不同的细胞和组织表达不同的GSLs,而GSLs水平的失衡导致细胞过程的失调,将伴随着许多类型癌症的发生发展(表 1)。GSLs的异常表达已是肿瘤微环境中肿瘤和基质细胞的一个独特特征,肿瘤通常表达高水平的GSLs,这些高水平的GSLs通过主动或被动的过程,使肿瘤微环境中产生高浓度的游离GSLs从而干扰免疫系统的杀伤能力。
| Tumor | GSLs | Summary of the characteristics associated | References references |
| Breast cancer | Gb5 | Promotes cell proliferation and tumor growth | [60] |
| GM3 | Inhibits cell migration | [61] | |
| GM2 | GM2 is associated with stemness of cancer cells | [62] | |
| GD1b | Induces apoptosis in vitro | [63] | |
| GD2 | Expresses highly in breast cancer stem cells | [64] | |
| GD3 | Upregulated in breast cancer cells | [65] | |
| Lung cancer | GM2 | Promotes metastasis and tumorigenicity in vivo | [55] |
| GD2 | Promotes proliferation and invasion | [66] | |
| Colorectal cancer | Gb4 | Induces the extracellular signal-regulated kinase (ERK) pathway | [67] |
| Gb5 | Promotes cell proliferation in vivo | [68] | |
| GM1 | Induces apoptosis | [56] | |
| Ovarian cancer | Gb3 | Promotes cell migration, chemotherapy resistance | [69] |
| GM3 | Ovarian cancer cells have higher GM3 levels | [70] | |
| GD3 | Inhibits antitumor NKT cell responses | [71] | |
| Leukemia | GM3 | Promotes leukemia cell line differentiation | [72] |
| Sarcoma | GD2 | Enhances malignant properties | [73-74] |
| Stomach cancer | Gb3 | Gb3 is expressed in gastric adenocarcinoma | [75] |
| Glioma | GM3 | Exogenous GM3 inhibits proliferation/migration | [76] |
| Prostate cancer | GD1a | GD1a is abundant in highly metastatic cancer cells | [77] |
| Bladder cancer | GM3 | Exogenous GM3 inhibits cell proliferation and adhesion | [78] |
| Melanoma | GD2 | Enhances the malignant properties of cells | [79] |
| GD3 | GD3 induces adhesion in melanoma | [80] |
非小细胞肺癌和小细胞肺癌(small cell lung cancers, SCLCs) 主要表达神经节苷脂GM2和GM1,而只有SCLCs表达b系列神经节苷类物质,如GD2、GD1b和GT1b,许多SCLCs细胞系的GD3合酶基因上调[54]。神经节苷脂GM2参与细胞粘附和转移,在SCID小鼠模型中,表达GM2的SCLCs细胞发生多器官转移[55]。结直肠癌是常见的恶性肿瘤之一,其发病率仅次于肺癌和乳腺癌,某些GSLs及其相关酶在结直肠癌中异常表达。人结直肠癌相关抗原GA733也被称为上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM),在人结直肠癌中选择性表达。神经节苷脂GD1a和GM1的表达大大增强了抗EpCAM单克隆抗体在人结肠腺癌SW620细胞中的抗癌作用[56]。黑色素瘤是死亡率最高的皮肤癌,占皮肤癌相关死亡人数的近73%[57]。GD2和GD3在人类黑色素瘤组织中高特异性表达,其表达与细胞增殖、侵袭性等恶性特性相关。GD2和GD3参与修饰整合素功能,在晚期和垂直转移的黑色素瘤细胞中,GD2的表达上调[58]。此外,从黑色素瘤患者中分离的黑色素瘤细胞中GM3含量高的患者的生存率最低。去乙酰化GM3 (d-GM3) 在转移性黑色素瘤中发现,d-GM3可通过uPAR/整合素和p38 MAPK途径促进黑色素瘤细胞的转移,但在非侵袭性黑色素瘤或良性痣中未发现[59]。
3.2 GSLs与肿瘤治疗近年来对GSLs在癌细胞恶性特性中的作用分析表明,肿瘤相关GSLs不仅可作为肿瘤标志物,而且是调控膜微区、脂筏所引入的各种信号的功能分子,因此肿瘤相关GSLs已被用作恶性肿瘤的诊断标志物和免疫治疗靶点。酶介导的自由基激活结合质谱研究阐明癌症相关GSLs与膜分子的相互作用和细胞表面分子复合物的形成来调节细胞信号的机制。由癌症相关GSLs及其相关膜分子组成的膜分子复合物,为我们提供了新的抗癌疗法研究方向,而且基于癌症相关GSLs的功能和作用模式的新发现,新的治疗试验已经开展[81]。
3.2.1 GSLs与肿瘤免疫疗法了解GSLs确切的分子结构和参与的途径将进一步推进GSLs的治疗应用。GSLs也是很有希望的免疫治疗靶点,因为它们可以诱导治疗性细胞因子和细胞介导反应,恒定自然杀伤T细胞识别GSLs并释放杀死癌症或病毒感染细胞的细胞因子,使其成为治疗癌症和感染性疾病的一种潜在方式。肿瘤免疫治疗是通过动员人体的自身免疫系统,抑制或消灭肿瘤细胞,目前已成为肿瘤治疗相关领域中关注度较高的一种新型疗法。GSLs的异常表达是癌细胞的标志,并与它们的恶性特性有关。神经节苷脂GD2和GD3被认为是肿瘤神经外胚层起源的标志物,而focusyl-GM1在极少数正常组织中表达,但在各种癌症中过度表达,这些神经节苷脂在大多数正常的成人组织中缺失,促使它们成为免疫肿瘤学中感兴趣的目标[82]。对于GM2、GD2和其他GSLs的抗体在黑色素瘤患者的血清中可被检测到这一现象,目前还不清楚抗体的产生是由患者对肿瘤的免疫反应引起的,还是由环境因素引起的。许多研究表明,正常人和癌症患者血清中抗体的存在与环境因素有关,某些类型癌症患者体内的抗体水平高于正常人。因此,肿瘤自身GSLs的自体免疫反应仍有争议[83]。但是通过抗GD3小鼠IgG3克隆R24在恶性黑色素瘤患者中的Ⅰ期临床试验显示肿瘤消退、T细胞活化、ADCC和CDC的诱导,R24 mAb已经在一系列转移性黑色素瘤患者的临床试验中进行了测试,并在一些患者中诱发了反应。更重要的是,一项使用R24和白细胞介素-2的试验在复查中产生了更高的反应率[84-85]。罗克维尔(美国) 国家癌症研究所优先列出了4种不同的GSLs[86]。名单上的第一个是GD2,目前其中一种抗体(迪妥昔单抗) 已用于神经母细胞瘤Ⅲ期临床试验,此外嵌合抗原受体被设计并在T细胞中过表达,以靶向过表达GD2的神经母细胞瘤;下一个是一种抗GD3抗体药物偶联物(PF-06688992) 正在进行Ⅰ期临床试验,用于Ⅲ期或Ⅳ期黑色素瘤患者[87]。岩藻糖基化GM1是目前测试的临床前阶段抗体的目标,目的是治疗小细胞肺癌患者,名单上的最后一个GSLs是GM3,该抗体正在由Morphotek进行临床前研究[88]。
靶向特定肿瘤抗原的体液免疫反应的发展是根除肿瘤细胞的重要一步。然而,疫苗作为实体瘤治疗的研究因多种因素而变得复杂,包括独特的肿瘤抗原表达和免疫应答产生的不良反应。癌症疫苗利用宿主对肿瘤相关抗原的免疫反应并发挥抗肿瘤作用。在过去的20年中,癌症疫苗的主动免疫疗法已引起研究者们极大的关注,几种肿瘤相关碳水化合物抗原(tumor-associated carbohydrate antigens, TACAs) 在许多上皮肿瘤中过表达,在正常组织中表达有限,使其成为癌症免疫治疗的有希望的靶标。Globo H是一种六糖(Fucα1-2Galβ1-3GalNAcβ1-3Galα1-4Galβ1- 4Glc) 是用于主动免疫治疗中最普遍的TACA[89],Globo H之所以可以作为免疫治疗的理想靶标,是因为其在肿瘤干细胞中的表达特异性和在免疫检查点起到的抑制作用[90]。
选择接种GSLs或带有GSLs抗原的疫苗,以诱导患者对肿瘤过度表达的GSLs的抗体反应,但缺点是,用碳水化合物接种疫苗需要大量纯化的碳水化合物,这通常导致B细胞独立的低亲和力IgM反应,而没有长期的B细胞记忆。为了克服这些挑战,可以将含有表位的纯化碳水化合物或合成聚合物融合为能够诱导CD4+ T细胞的载体蛋白。由于碳水化合物表位与蛋白质的结合很难控制,因此正在研制完全合成的疫苗。
3.2.2 GSLs与抗黏附疗法抗黏附治疗的目的是破坏肿瘤细胞和其他类型细胞(如内皮细胞、血小板) 在肿瘤进展和转移过程中所必需的碳水化合物启动的相互作用。假设肿瘤细胞的转移和侵袭是由肿瘤细胞与某些器官的基底膜、内皮细胞、血小板和实质细胞的黏附引起的,阻断这种黏附可以消除肿瘤的转移和侵袭。该方法是基于GM3,黑色素瘤细胞转移的程度取决于GM3的水平,以及GM3依赖于微血管内皮细胞中Gg3Cer和乳糖神经酰胺的粘附。通过GM3或Gg3脂质体预培养肿瘤细胞,以及在原代肿瘤细胞形成后静脉注射这些脂质体,均可抑制B16黑色素瘤的肺转移[91]。许多肿瘤相关的GSLs被认为是黏附分子,并促进转移和侵袭。因此,阻断GSLs的合成可能会抑制这些过程。Radin和Inokuchi[92]的一系列研究表明,d-threo-PDMP是一种β糖基化的神经酰胺抑制剂,可以消耗大部分的GSLs,抑制肿瘤的生长和转移。
针对肿瘤疾病,为了使治疗效果到达预期目标,除了有选择性地提高GSLs在肿瘤细胞的浓度外,还可以利用药物干扰手段改变GSLs代谢。目前已有化疗药物通过干预神经酰胺转变成GSLs的代谢过程来发挥作用,如紫杉酚增加神经酰胺合成,葡萄糖神经酰胺合成酶抑制剂抑制神经酰胺糖基化作用和三苯氧胺抑制GSLs的合成而达到治疗的目的[93]。
4 总结与展望GSLs作为重要的信号分子,在生理和病理生理中发挥着广泛的作用。GSLs的异常表达已被证实与多种恶性癌症相关,因此,通过研究GSLs在癌症中的异常变化,有助于改正肿瘤细胞脂质代谢中异常部分。目前部分GSLs的作用机制研究得较为清楚,但仍存在很多GSLs的功能及作用需要进一步明确。关于GSLs角色认知在很大程度上受到现有工具限制的影响,GSLs研究的难度在于其功能多样性、结构异质性及涉及信号途径的不同GSLs之间互相转换的复杂性,而深入研究GSLs的生物合成及分解代谢途径,对了解各种疾病的发病原因、实现疾病的早期诊断、掌握病情的发展状况以及发展针对性的治疗方案都具有重要意义。GSLs作为功能性免疫系统的重要组成部分,已经在分子水平上发现,对于(免疫相关) 蛋白招募到特定的膜微域是必不可少的,并且GSLs可以直接与表面受体相互作用,直接与其他细胞类型上的分子相互作用进一步塑造了在免疫中的多方面功能[94]。我们认为这些GSLs的功能是紧密相连的,通过动态调节GSLs的组成来控制免疫细胞的功能。肿瘤通常表达高水平的GSLs,这干扰了免疫系统的杀伤能力。这些高水平的GSLs通过主动或被动的过程,在肿瘤微环境中产生高浓度的游离GSLs,肿瘤释放的高浓度GSLs导致细胞免疫反应的下调进而加速了肿瘤的发展。Globo H是一种最常见的与癌症相关的GSLs,同样也是肿瘤微环境中的重要调节剂,通过多种机制促进肿瘤进展。肿瘤微环境中存在的Globo H神经酰胺被肿瘤浸润的淋巴细胞吸收,导致免疫抑制,促进血管生成。这些发现为在癌症免疫治疗中靶向Globo H抗原提供了科学依据。
对GSLs进行完整的结构分析通常需要结合多种技术来确定其多糖组成、糖苷键、(α或β) 神经酰胺的异位构型和脂肪酸链,近年来,以核磁共振和质谱为基础的液相色谱技术已被用于GSLs的结构分析,液相色谱联用技术已成为GSLs结构分析的重要手段,基于质谱的技术,如电喷雾电离,基质辅助激光解吸/电离常用于完整糖脂的研究。然而,这些技术的主要局限性是劳动密集型、耗时长,对于复杂生物样品的初始比较,消耗巨大且成本低。另一种常用的是利用广泛的特异性酶切聚糖头部基团,然后纯化并单独对聚糖部分进行详细的表征。最近的一项研究[95]开发了基于凝集素芯片检测GSLs糖链的技术,这是一种省时、低成本的方法,不需要从复杂的样本中释放出多糖,可以实现直接检测GSLs的糖基化。尽管凝集素及高灵敏度质谱可以展示GSLs上的变化,但目前GSLs的特性主要用于组织及大细胞群的整体分析,给出一个一般的概览。细胞异质性是一种内在属性。即使是来自同一基因组的细胞,由于独特的微环境和随机过程,也具有不同的化学和生理特征,考虑到脂质和聚糖部分,GSLs糖链是如何驱动肿瘤细胞的转移,这在很大程度上仍是未知的,这也可能是未来研究的方向以进一步了解GSLs在癌症和EMT中的作用。未来的研究可能需要将目前的发现转化为使用凝集素或抗体的间接测量,并在更大的人类组织样本队列中,还需特别关注空间和细胞类型组成以及患者内部异质性。随着技术的不断发展和进步,生物分析技术的惊人进步将使单细胞GSL分析的未来发展成为可能,并展示它们在细胞代谢和过程中发挥的重要作用。
| [1] |
Merrill AH Jr. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev, 2011, 111(10): 6387-6422. DOI:10.1021/cr2002917
|
| [2] |
Furukawa K, Ohmi Y, Ohkawa Y, et al. New era of research on cancer-associated glycosphingolipids. Cancer Sci, 2019, 110(5): 1544-1551. DOI:10.1111/cas.14005
|
| [3] |
Jongsma MLM, De Waard AA, Raaben M, et al. The SPPL3-defined glycosphingolipid repertoire orchestrates HLA class I-mediated immune responses. Immunity, 2021, 54(1): 132-150.e9. DOI:10.1016/j.immuni.2020.11.003
|
| [4] |
张宗城, 张积仁, 张健. 鞘糖脂研究的创新思路. 医学与哲学, 2000, 21(2): 39-41. Zhang ZC, Zhang JR, Zhang J. Innovative ideas for glycosphingolipid research. Med Philos, 2000, 21(2): 39-41 (in Chinese). DOI:10.3969/j.issn.1002-0772.2000.02.016 |
| [5] |
Chiricozzi E, Aureli M, Mauri L, et al. Glycosphingolipids. Adv Exp Med Biol, 2021, 1325: 61-102.
|
| [6] |
D'Angelo G, Polishchuk E, Tullio GD, et al. Glycosphingolipid synthesis requires FAPP2 transfer of glucosylceramide. Nature, 2007, 449(7158): 62-67. DOI:10.1038/nature06097
|
| [7] |
王艳萍, 王征, 朱健, 等. 鞘糖脂研究进展. 生命科学, 2011, 23(6): 583-591. Wang YP, Wang Z, Zhu J, et al. Progress in study of glycosphingolipids. Chin Bull Life Sci, 2011, 23(6): 583-591 (in Chinese). DOI:10.13376/j.cbls/2011.06.009 |
| [8] |
朱峰, 吴雄宇, 林永成. 鞘糖脂的合成研究进展. 有机化学, 2002, 22(11): 817-826. Zhu F, Wu XX, Lin YC. Research progress on synthesis of glycosphingolipids. Organic Chem, 2002, 22(11): 817-826 (in Chinese). DOI:10.3321/j.issn:0253-2786.2002.11.003 |
| [9] |
Svennerholm L. Ganglioside designation. Adv Exp Med Biol, 1980, 125: 11.
|
| [10] |
Ryckman AE, Brockhausen I, Walia JS. Metabolism of glycosphingolipids and their role in the pathophysiology of lysosomal storage disorders. Int J Mol Sci, 2020, 21(18): 6881. DOI:10.3390/ijms21186881
|
| [11] |
Cartier A, Hla T. Sphingosine 1-phosphate: lipid signaling in pathology and therapy. Science, 2019, 366(6463): eaar5551. DOI:10.1126/science.aar5551
|
| [12] |
Boot RG, Verhoek M, Donker-Koopman W, et al. Identification of the non-lysosomal glucosylceramidase as beta-glucosidase 2. J Biol Chem, 2007, 282(2): 1305-1312. DOI:10.1074/jbc.M610544200
|
| [13] |
Lelieveld LT, Mirzaian M, Kuo CL, et al. Role of β-glucosidase 2 in aberrant glycosphingolipid metabolism: model of glucocerebrosidase deficiency in zebrafish. J Lipid Res, 2019, 60(11): 1851-1867. DOI:10.1194/jlr.RA119000154
|
| [14] |
Sprong H, Degroote S, Claessens T, et al. Glycosphingolipids are required for sorting melanosomal proteins in the Golgi complex. J Cell Biol, 2001, 155(3): 369-380. DOI:10.1083/jcb.200106104
|
| [15] |
Sillence DJ, Puri V, Marks DL, et al. Glucosylceramide modulates membrane traffic along the endocytic pathway. J Lipid Res, 2002, 43(11): 1837-1845. DOI:10.1194/jlr.M200232-JLR200
|
| [16] |
Wojtal KA, De Vries E, Hoekstra D, et al. Efficient trafficking of MDR1/P-glycoprotein to apical canalicular plasma membranes in HepG2 cells requires PKA-RIIalpha anchoring and glucosylceramide. Mol Biol Cell, 2006, 17(8): 3638-3650. DOI:10.1091/mbc.e06-03-0230
|
| [17] |
De Rosa MF, Ackerley C, Wang B, et al. Inhibition of multidrug resistance by AdamantylGb3, a globotriaosylceramide analog. J Biol Chem, 2008, 283(8): 4501-4511. DOI:10.1074/jbc.M705473200
|
| [18] |
Hayashi Y, Nemoto-Sasaki Y, Matsumoto N, et al. Complex formation of sphingomyelin synthase 1 with glucosylceramide synthase increases sphingomyelin and decreases glucosylceramide levels. J Biol Chem, 2018, 293(45): 17505-17522. DOI:10.1074/jbc.RA118.002048
|
| [19] |
Liu YY, Han TY, Giuliano AE, et al. Ceramide glycosylation potentiates cellular multidrug resistance. FASEB J, 2001, 15(3): 719-730. DOI:10.1096/fj.00-0223com
|
| [20] |
Natoli TA, Modur V, Ibraghimov-Beskrovnaya O. Glycosphingolipid metabolism and polycystic kidney disease. Cell Signal, 2020, 69: 109526. DOI:10.1016/j.cellsig.2020.109526
|
| [21] |
Wang XX, Cong PX, Wang XC, et al. Maternal diet with sea urchin gangliosides promotes neurodevelopment of young offspring via enhancing NGF and BDNF expression. Food Funct, 2020, 11(11): 9912-9923. DOI:10.1039/D0FO01605E
|
| [22] |
Szöőr Á, Ujlaky-Nagy L, Tóth G, et al. Cell confluence induces switching from proliferation to migratory signaling by site-selective phosphorylation of PDGF receptors on lipid raft platforms. Cell Signal, 2016, 28(2): 81-93. DOI:10.1016/j.cellsig.2015.11.012
|
| [23] |
Nakano M, Hanashima S, Hara T, et al. FRET detects lateral interaction between transmembrane domain of EGF receptor and ganglioside GM3 in lipid bilayers. Biochim Biophys Acta Biomembr, 2021, 1863(8): 183623. DOI:10.1016/j.bbamem.2021.183623
|
| [24] |
Zhou Q, Hakomori S, Kitamura K, et al. GM3 directly inhibits tyrosine phosphorylation and de-N-acetyl-GM3 directly enhances serine phosphorylation of epidermal growth factor receptor, independently of receptor-receptor interaction. J Biol Chem, 1994, 269(3): 1959-1965. DOI:10.1016/S0021-9258(17)42121-1
|
| [25] |
Zurita AR, Maccioni HJ, Daniotti JL. Modulation of epidermal growth factor receptor phosphorylation by endogenously expressed gangliosides. Biochem J, 2001, 355(Pt 2): 465-472.
|
| [26] |
Yamashita T, Hashiramoto A, Haluzik M, et al. Enhanced insulin sensitivity in mice lacking ganglioside GM3. PNAS, 2003, 100(6): 3445-3449. DOI:10.1073/pnas.0635898100
|
| [27] |
Ghauharali-Van Der Vlugt K, Langeveld M, Poppema A, et al. Prominent increase in plasma ganglioside GM3 is associated with clinical manifestations of type Ⅰ Gaucher disease. Clin Chimica Acta, 2008, 389(1/2): 109-113.
|
| [28] |
Inokuchi JI, Kanoh H, Inamori KI, et al. Homeostatic and pathogenic roles of the GM3 ganglioside molecular species in TLR4 signaling in obesity. EMBO J, 2020, 39(12): e101732.
|
| [29] |
Van Eijk M, Aten J, Bijl N, et al. Reducing glycosphingolipid content in adipose tissue of obese mice restores insulin sensitivity, adipogenesis and reduces inflammation. PLoS One, 2009, 4(3): e4723. DOI:10.1371/journal.pone.0004723
|
| [30] |
Liao Z, Cimakasky LM, Hampton R, et al. Lipid rafts and HIV pathogenesis: host membrane cholesterol is required for infection by HIV type 1. AIDS Res Hum Retroviruses, 2001, 17(11): 1009-1019. DOI:10.1089/088922201300343690
|
| [31] |
Lund N, Olsson ML, Ramkumar S, et al. The human P(k) histo-blood group antigen provides protection against HIV-1 infection. Blood, 2009, 113(20): 4980-4991. DOI:10.1182/blood-2008-03-143396
|
| [32] |
Ramkumar S, Sakac D, Binnington B, et al. Induction of HIV-1 resistance: cell susceptibility to infection is an inverse function of globotriaosyl ceramide levels. Glycobiology, 2008, 19(1): 76-82. DOI:10.1093/glycob/cwn106
|
| [33] |
Obeng E. Apoptosis (programmed cell death) and its signals-a review. Braz J Biol, 2021, 81(4): 1133-1143. DOI:10.1590/1519-6984.228437
|
| [34] |
Kesavardhana S, Malireddi RKS, Kanneganti TD. Caspases in cell death, inflammation, and pyroptosis. Annu Rev Immunol, 2020, 38: 567-595. DOI:10.1146/annurev-immunol-073119-095439
|
| [35] |
Zhang LL, Lu ZM, Zhao XX. Targeting Bcl-2 for cancer therapy. Biochim Biophys Acta Rev Cancer, 2021, 1876(1): 188569. DOI:10.1016/j.bbcan.2021.188569
|
| [36] |
Eisinger S, Sarhan D, Boura VF, et al. Targeting a scavenger receptor on tumor-associated macrophages activates tumor cell killing by natural killer cells. PNAS, 2020, 117(50): 32005-32016. DOI:10.1073/pnas.2015343117
|
| [37] |
Coe GL, Redd PS, Paschall AV, et al. Ceramide mediates FasL-induced caspase 8 activation in colon carcinoma cells to enhance FasL-induced cytotoxicity by tumor-specific cytotoxic T lymphocytes. Sci Rep, 2016, 6: 30816. DOI:10.1038/srep30816
|
| [38] |
Kitatani K, Usui T, Sriraman SK, et al. Ceramide limits phosphatidylinositol-3-kinase C2β-controlled cell motility in ovarian cancer: potential of ceramide as a metastasis-suppressor lipid. Oncogene, 2016, 35(21/): 2801-2812.
|
| [39] |
Kong JN, He Q, Wang GH, et al. Guggulsterone and bexarotene induce secretion of exosome-associated breast cancer resistance protein and reduce doxorubicin resistance in MDA-MB-231 cells. Int J Cancer, 2015, 137(7): 1610-1620. DOI:10.1002/ijc.29542
|
| [40] |
Sano R, Annunziata I, Patterson A, et al. GM1-ganglioside accumulation at the mitochondria-associated ER membranes links ER stress to Ca2+-dependent mitochondrial apoptosis. Mol Cell, 2009, 36(3): 500-511. DOI:10.1016/j.molcel.2009.10.021
|
| [41] |
Yokoyama N, Hanafusa K, Hotta T, et al. Multiplicity of glycosphingolipid-enriched microdomain-driven immune signaling. Int J Mol Sci, 2021, 22(17): 9565. DOI:10.3390/ijms22179565
|
| [42] |
Parı́s R, Morales A, Coll O, et al. Ganglioside GD3 sensitizes human hepatoma cells to cancer therapy. J Biol Chem, 2002, 277(51): 49870-49876. DOI:10.1074/jbc.M208303200
|
| [43] |
Garcia-Ruiz C, Morales A, Fernández-Checa JC. Glycosphingolipids and cell death: one aim, many ways. Apoptosis, 2015, 20(5): 607-620. DOI:10.1007/s10495-015-1092-6
|
| [44] |
Franzen R, Pautz A, Bräutigam L, et al. Interleukin-1beta induces chronic activation and de novo synthesis of neutral ceramidase in renal mesangial cells. J Biol Chem, 2001, 276(38): 35382-35389. DOI:10.1074/jbc.M102153200
|
| [45] |
Von Haefen C, Wieder T, Gillissen B, et al. Ceramide induces mitochondrial activation and apoptosis via a Bax-dependent pathway in human carcinoma cells. Oncogene, 2002, 21(25): 4009-4019. DOI:10.1038/sj.onc.1205497
|
| [46] |
Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics. Dev Cell, 2011, 21(1): 92-101. DOI:10.1016/j.devcel.2011.06.017
|
| [47] |
Hernández-Corbacho MJ, Salama MF, Canals D, et al. Sphingolipids in mitochondria. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(1): 56-68.
|
| [48] |
Galluzzi L, Bravo-San Pedro JM, Kroemer G. Organelle-specific initiation of cell death. Nat Cell Biology, 2014, 16(8): 728-736. DOI:10.1038/ncb3005
|
| [49] |
Breckenridge DG, Germain M, Mathai JP, et al. Regulation of apoptosis by endoplasmic reticulum pathways. Oncogene, 2003, 22(53): 8608-8618. DOI:10.1038/sj.onc.1207108
|
| [50] |
Tessitore A, Del P Martin M, Sano R, et al. GM1-ganglioside-mediated activation of the unfolded protein response causes neuronal death in a neurodegenerative gangliosidosis. Mol Cell, 2004, 15(5): 753-766. DOI:10.1016/j.molcel.2004.08.029
|
| [51] |
Cumin C, Huang YL, Everest-Dass A, et al. Deciphering the importance of glycosphingolipids on cellular and molecular mechanisms associated with epithelial-to-mesenchymal transition in cancer. Biomolecules, 2021, 11(1): 62. DOI:10.3390/biom11010062
|
| [52] |
Cheng Q, Li X, Wang Y, et al. The ceramide pathway is involved in the survival, apoptosis and exosome functions of human multiple myeloma cells in vitro. Acta Pharmacol Sin, 2018, 39(4): 561-568. DOI:10.1038/aps.2017.118
|
| [53] |
Kosaka N, Iguchi H, Yoshioka Y, et al. Secretory mechanisms and intercellular transfer of microRNAs in living cells. J Biol Chem, 2010, 285(23): 17442-17452. DOI:10.1074/jbc.M110.107821
|
| [54] |
Chen LC, Brown AB, Cheung IY, et al. Analysis of GD2/GM2 synthase mRNA as a biomarker for small cell lung cancer. Lung Cancer, 2010, 67(2): 216-220. DOI:10.1016/j.lungcan.2009.04.009
|
| [55] |
Yamada T, Bando H, Takeuchi S, et al. Genetically engineered humanized anti-ganglioside GM2 antibody against multiple organ metastasis produced by GM2-expressing small-cell lung cancer cells. Cancer Sci, 2011, 102(12): 2157-2163. DOI:10.1111/j.1349-7006.2011.02093.x
|
| [56] |
Kwak DH, Ryu JS, Kim CH, et al. Relationship between ganglioside expression and anti-cancer effects of the monoclonal antibody against epithelial cell adhesion molecule in colon cancer. Exp Mol Med, 2011, 43(12): 693-701. DOI:10.3858/emm.2011.43.12.080
|
| [57] |
Carr S, Smith C, Wernberg J. Epidemiology and risk factors of melanoma. Surg Clin North Am, 2020, 100(1): 1-12. DOI:10.1016/j.suc.2019.09.005
|
| [58] |
Nazha B, Inal C, Owonikoko TK. Disialoganglioside GD2 expression in solid tumors and role as a target for cancer therapy. Front Oncol, 2020, 10: 1000. DOI:10.3389/fonc.2020.01000
|
| [59] |
Yan Q, Bach DQ, Gatla N, et al. Deacetylated GM3 promotes uPAR-associated membrane molecular complex to activate p38 MAPK in metastatic melanoma. Mol Cancer Res, 2013, 11(6): 665-675. DOI:10.1158/1541-7786.MCR-12-0270-T
|
| [60] |
Cheung SKC, Chuang PK, Huang HW, et al. Stage-specific embryonic antigen-3 (SSEA-3) and β3GalT5 are cancer specific and significant markers for breast cancer stem cells. PNAS, 2016, 113(4): 960-965. DOI:10.1073/pnas.1522602113
|
| [61] |
Gu YC, Zhang JH, Mi WY, et al. Silencing of GM3 synthase suppresses lung metastasis of murine breast cancer cells. Breast Cancer Res, 2008, 10(1): R1. DOI:10.1186/bcr1841
|
| [62] |
Marijan S, Markotić A, Mastelić A, et al. Author correction: glycosphingolipid expression at breast cancer stem cells after novel thieno[2, 3-b]pyridine anticancer compound treatment. Sci Reports, 2021, 11: 8236.
|
| [63] |
Ha SH, Lee JM, Kwon KM, et al. Exogenous and endogeneous disialosyl ganglioside GD1b induces apoptosis of MCF-7 human breast cancer cells. Int J Mol Sci, 2016, 17(5): 652. DOI:10.3390/ijms17050652
|
| [64] |
Shao C, Anand V, Andreeff M, et al. Ganglioside GD2: a novel therapeutic target in triple-negative breast cancer. Ann N Y Acad Sci, 2022, 1508(1): 35-53. DOI:10.1111/nyas.14700
|
| [65] |
Sarkar TR, Battula VL, Werden SJ, et al. GD3 synthase regulates epithelial-mesenchymal transition and metastasis in breast cancer. Oncogene, 2015, 34(23): 2958-2967. DOI:10.1038/onc.2014.245
|
| [66] |
Yoshida S, Fukumoto S, Kawaguchi H, et al. Ganglioside G(D2) in small cell lung cancer cell lines: enhancement of cell proliferation and mediation of apoptosis. Cancer Res, 2001, 61(10): 4244-4252.
|
| [67] |
Park SY, Kwak CY, Shayman JA, et al. Globoside promotes activation of ERK by interaction with the epidermal growth factor receptor. Biochim Biophys Acta, 2012, 1820(7): 1141-1148. DOI:10.1016/j.bbagen.2012.04.008
|
| [68] |
Haraguchi N. SSEA-3 as a novel amplifying cancer cell surface marker in colorectal cancers. Int J Oncol, 2013, 42(1): 161-167.
|
| [69] |
Jacob F, Alam S, Konantz M, et al. Transition of mesenchymal and epithelial cancer cells depends on α1-4 galactosyltransferase-mediated glycosphingolipids. Cancer Res, 2018, 78(11): 2952-2965. DOI:10.1158/0008-5472.CAN-17-2223
|
| [70] |
Prinetti A, Cao T, Illuzzi G, et al. A glycosphingolipid/caveolin-1 signaling complex inhibits motility of human ovarian carcinoma cells. J Biol Chem, 2011, 286(47): 40900-40910. DOI:10.1074/jbc.M111.286146
|
| [71] |
Webb TJ, Li XM, Giuntoli RL 2nd, et al. Molecular identification of GD3 as a suppressor of the innate immune response in ovarian cancer. Cancer Res, 2012, 72(15): 3744-3752. DOI:10.1158/0008-5472.CAN-11-2695
|
| [72] |
Jin UH, Chung TW, Song KH, et al. Ganglioside GM3 is required for caffeic acid phenethyl ester-induced megakaryocytic differentiation of human chronic myelogenous leukemia K562 cells. Biochem Cell Biol, 2014, 92(4): 243-249. DOI:10.1139/bcb-2014-0015
|
| [73] |
Shibuya H, Hamamura K, Hotta H, et al. Enhancement of malignant properties of human osteosarcoma cells with disialyl gangliosides GD2/GD3. Cancer Sci, 2012, 103(9): 1656-1664. DOI:10.1111/j.1349-7006.2012.02344.x
|
| [74] |
Dobrenkov K, Ostrovnaya I, Gu J, et al. Oncotargets GD2 and GD3 are highly expressed in sarcomas of children, adolescents, and young adults. Pediatr Blood Cancer, 2016, 63(10): 1780-1785. DOI:10.1002/pbc.26097
|
| [75] |
Stimmer L, Dehay S, Nemati F, et al. Human breast cancer and lymph node metastases express Gb3 and can be targeted by STxB-vectorized chemotherapeutic compounds. BMC Cancer, 2014, 14: 916. DOI:10.1186/1471-2407-14-916
|
| [76] |
Fujimoto Y, Izumoto S, Suzuki T, et al. Ganglioside GM3 inhibits proliferation and invasion of glioma. J Neurooncol, 2005, 71(2): 99-106. DOI:10.1007/s11060-004-9602-3
|
| [77] |
Hersey P, Jamal O. Expression of the gangliosides GD3 and GD2 on lymphocytes in tissue sections of melanoma. Pathology, 1989, 21(1): 51-58. DOI:10.3109/00313028909059531
|
| [78] |
Wang H, Isaji T, Satoh M, et al. Antitumor effects of exogenous ganglioside GM3 on bladder cancer in an orthotopic cancer model. Urology, 2013, 81(1): 210.e11-210.e15. DOI:10.1016/j.urology.2012.08.015
|
| [79] |
Gargett T, Yu WB, Dotti G, et al. GD2-specific CAR T cells undergo potent activation and deletion following antigen encounter but can be protected from activation-induced cell death by PD-1 blockade. Mol Ther, 2016, 24(6): 1135-1149. DOI:10.1038/mt.2016.63
|
| [80] |
Ramos RI, Bustos MA, Wu JF, et al. Upregulation of cell surface GD3 ganglioside phenotype is associated with human melanoma brain metastasis. Mol Oncol, 2020, 14(8): 1760-1778. DOI:10.1002/1878-0261.12702
|
| [81] |
Furukawa K, Hamamura K, Aixinjueluo W, et al. Biosignals modulated by tumor-associated carbohydrate antigens: novel targets for cancer therapy. Ann N Y Acad Sci, 2006, 1086: 185-198. DOI:10.1196/annals.1377.017
|
| [82] |
Groux-Degroote S, Delannoy P. Cancer-associated glycosphingolipids as tumor markers and targets for cancer immunotherapy. Int J Mol Sci, 2021, 22(11): 6145. DOI:10.3390/ijms22116145
|
| [83] |
Yu J, Hung JT, Wang SH, et al. Targeting glycosphingolipids for cancer immunotherapy. FEBS Lett, 2020, 594(22): 3602-3618. DOI:10.1002/1873-3468.13917
|
| [84] |
Nasi ML, Meyers M, Livingston PO, et al. Anti-melanoma effects of R24, a monoclonal antibody against GD3 ganglioside. Melanoma Res, 1997, 7(Suppl 2): S155-S162.
|
| [85] |
Houghton AN, Mintzer D, Cordon-Cardo C, et al. Mouse monoclonal IgG3 antibody detecting GD3 ganglioside: a phase Ⅰ trial in patients with malignant melanoma. PNAS, 1985, 82(4): 1242-1246. DOI:10.1073/pnas.82.4.1242
|
| [86] |
Krug LM. Vaccine therapy for small cell lung cancer. Semin Oncol, 2004, 31(1 Suppl 1): 112-116.
|
| [87] |
Syed YY. Erratum to: durvalumab: first global approval. Drugs, 2017, 77(16): 1817. DOI:10.1007/s40265-017-0826-x
|
| [88] |
Aixinjueluo W, Furukawa K, Zhang Q, et al. Mechanisms for the apoptosis of small cell lung cancer cells induced by anti-GD2 monoclonal antibodies: roles of anoikis. J Biol Chem, 2005, 280(33): 29828-29836. DOI:10.1074/jbc.M414041200
|
| [89] |
Huang CS, Yu AL, Tseng LM, et al. Globo H-KLH vaccine adagloxad simolenin (OBI-822)/OBI-821 in patients with metastatic breast cancer: phase Ⅱ randomized, placebo-controlled study. J Immunother Cancer, 2020, 8(2): e000342. DOI:10.1136/jitc-2019-000342
|
| [90] |
Cheng JY, Wang SH, Lin J, et al. Globo-H ceramide shed from cancer cells triggers translin-associated factor X-dependent angiogenesis. Cancer Res, 2014, 74(23): 6856-6866. DOI:10.1158/0008-5472.CAN-14-1651
|
| [91] |
Wang P, Xu S, Wang YN, et al. GM3 suppresses anchorage-independent growth via Rho GDP dissociation inhibitor beta in melanoma B16 cells. Cancer Sci, 2011, 102(8): 1476-1485. DOI:10.1111/j.1349-7006.2011.01963.x
|
| [92] |
Radin NS, Inokuchi J. Glucosphingolipids as sites of action in the chemotherapy of cancer. Biochem Pharmacol, 1988, 37(15): 2879-2886. DOI:10.1016/0006-2952(88)90271-7
|
| [93] |
Sietsma H, Veldman RJ, Kolk D, et al. 1-phenyl-2-decanoylamino-3-morpholino-1-propanol chemosensitizes neuroblastoma cells for taxol and vincristine. Clin Cancer Res, 2000, 6(3): 942-948.
|
| [94] |
Bien T, Perl M, Machmüller AC, et al. MALDI-2 mass spectrometry and immunohistochemistry imaging of Gb3Cer, Gb4Cer, and further glycosphingolipids in human colorectal cancer tissue. Anal Chem, 2020, 92(10): 7096-7105. DOI:10.1021/acs.analchem.0c00480
|
| [95] |
Du HQ, Yu HJ, Yang FQ, et al. Comprehensive analysis of glycosphingolipid glycans by lectin microarrays and MALDI-TOF mass spectrometry. Nat Protoc, 2021, 16(7): 3470-3491. DOI:10.1038/s41596-021-00544-y
|
 2022, Vol. 38
2022, Vol. 38