
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 鲍艺今, 成祥, 朱玲玲, 范明, 高友鹤
- BAO Yijin, CHENG Xiang, ZHU Lingling, FAN Ming, GAO Youhe
- 大鼠急性低氧模型尿液蛋白质组的变化
- Changes in the urine proteome in an acute hypoxic rat model
- 生物工程学报, 2022, 38(10): 3878-3887
- Chinese Journal of Biotechnology, 2022, 38(10): 3878-3887
- 10.13345/j.cjb.220181
-
文章历史
- Received: March 9, 2022
- Accepted: June 8, 2022
2. 军事认知与脑科学研究所, 北京 100850
2. Institute of Military Cognition and Brain Sciences, Beijing 100850, China
高原地区具有气温低、温差大和紫外线辐射强等特点[1],而低压低氧则是其最主要的特征[2]。医学上的高原通常是指海拔3 000 m以上的地区。随着海拔高度增加,大气氧分压逐渐下降,人体血氧饱和度急剧下降,常出现低氧症状[3]。
全球有将近1.4亿人居住在海拔2 500 m以上的高原地区,每年约有4 000万人来到高原地区工作或者休闲旅游[4]。在中国有6 000万人生活在广阔的高原地区[5]。正是因为特殊的地理居住环境,也导致了高原人群具有一些特殊的生理特点。与低海拔人群相比,其脑耗氧量增大,呼吸系统的肺通气量和肺泡内氧分压增高。此外,长期居住在低氧环境也会引起红细胞过度增多和血细胞比容升高,这会导致血液粘度增加和流速减慢,使得高原地区脑血管病的发病率高于平原地区。另一方面,对于初次进入高原的人群来说,低氧是高原对其最大的挑战。不适应高原可能会导致一些高原疾病,轻者恶心、头晕、失眠、心悸、呼吸急促,严重的甚至会危及生命如高原肺水肿(high altitude pulmonary edema, HAPE)、高原红细胞增多症(high altitude polycythemia, HAPC) 和高原脑水肿(high altitude cerebral edema, HACE) 等[6]。我们希望能够动态监察高原人群的缺氧损伤进展,准确判断机体高原缺氧程度,以便对患者进行及时、精准的治疗。同时,更好地了解低氧引起的细胞或器官功能的改变也为开发新的生理病理候选物以揭示高原缺氧的潜在发病机制并改进对缺氧相关疾病的治疗是重要且必要的。
疾病进程涉及不同的生物过程,在不同的时间点表现出不同的病理生理状态,因此在不同的阶段应该有不同的生物标志物。尿液作为一种理想的疾病生物标志物来源,由于没有稳态调节机制的影响,可以敏感、及时地反映病理变化[7]。我们实验室利用蛋白组学技术已经在多种疾病动物模型中发现,病理变化出现之前,尿液蛋白质就发生了变化[8],这些结果表明尿液蛋白质组可以富集到机体产生的早期变化。再者尿液收集无创简单并可以连续收集,从而能够实现疾病的动态监测。
本研究首次利用尿液蛋白质组学研究急性低氧对大鼠的影响,通过低氧舱模拟海拔5 000 m的高原低氧条件,对低氧后0、12、24 h的尿液进行非标记定量蛋白组学分析,拟探究急性低氧刺激(即快速进入海拔5 000 m低氧环境) 对大鼠尿液蛋白质组造成的影响,寻找与低氧应激相关的尿蛋白变化。旨在为后续在尿液中寻找低氧的早期特异性生物标志物进行初步探索。
1 材料与方法 1.1 实验动物及模型建立 1.1.1 大鼠代谢笼的改造将大鼠放置在小鼠用规格的代谢笼中进行尿液收集,代谢笼改用直径为15 cm,网隙为1 cm的筛网滤过食物残渣及粪便。
1.1.2 低氧模型的建立无特定病原体(specific pathogen free, SPF)级的雄性Sprague-Dawley大鼠(170−190 g) 5只,购于北京维通利华实验动物技术有限公司,所有动物在标准环境(室温(22±1) ℃,湿度65%–70%) 下饲养,动物实验通过北京师范大学生命科学学院伦理委员会的审查和批准(编号:CLS-EAW-2020-034)。
建立方法:实验大鼠放置于低氧舱内,模拟海拔5 000 m高原环境饲养,低氧舱内氧气浓度为11.6%。本实验使用自身对照,常氧条件下收集的尿液样本即为对照组,时间记为T0。低氧12 h和24 h后收集的尿液样本是实验组,时间分别记为T1和T2。
1.2 尿液的收集将大鼠每个个体均单独放置于大鼠改造代谢笼中,在低氧条件下0、12、24 h后分别设置T0、T1、T2取样时间点。在尿液收集期间,提供饮水但不提供食物,避免污染尿液。最终共计取样15份,尿液用3 000×g离心30 min后取上清并将上清液放入−80 ℃冰箱保存。
1.3 尿液蛋白的提取和蛋白酶解取出4 mL尿样解冻,于4 ℃、12 000×g条件下离心30 min,去除细胞碎片,取上清用3倍体积的乙醇沉淀过夜,然后12 000×g离心30 min。将蛋白沉淀重悬于裂解液(8 mol/L尿素,2 mol/L硫脲,25 mmol/L二硫苏糖醇和50 mmol/L Tris)。用Bradford法测量蛋白浓度。使用滤器辅助样品制备(filter-aided sample preparation, FASP) 方法进行尿蛋白酶解[9]。将尿蛋白加载到10 kDa超滤管(PALL公司) 的滤膜上,用UA溶液(8 mol/L尿素、0.1 mol/L Tris-HCl (pH 8.5)) 和25 mmol/L NH4HCO3溶液洗涤2次;加入20 mmol/L二硫苏糖醇(dithiothreitol, DTT, Sigma) 在37 ℃中变性1 h,再与50 mmol/L碘乙酰胺(iodoacetamide, IAA, Sigma) 在黑暗中烷基化30 min,用UA溶液和NH4HCO3溶液洗涤2次,以1︰50比例加入胰酶(Trypsin Gold, Promega),37 ℃孵育过夜。过夜后离心收集酶解后的滤液即为多肽混合液。将多肽通过HLB柱(Waters) 除盐后用真空干燥仪进行抽干,置于−80 ℃保存。
1.4 LC-MS/MS串联质谱分析用0.1%的甲酸溶液复溶肽段,使用二辛可宁酸(bicinchonininc acid, BCA) 试剂盒对肽段浓度进行测定,将肽段浓度稀释至0.5 μg/μL。使用1 μg多肽样本通过Thermo ESAY-Nlc1200液相系统进行分离,参数设定如下,洗脱时间90 min,洗脱梯度为(流动相A:0.1%甲酸;流动相B:80%乙腈)。洗脱下来的肽段通过Orbitrap Fusion Lumos Tribird质谱仪(Thermo Fisher Scientific) 进行检测。对所有样品用数据依赖型采集模式(data-independent acquisition, DDA) 进行质谱数据采集,每个样本重复采集3次。
1.5 数据分析将从液相-质谱联用采集到的原始数据(RAW文件),导入Proteome Discoverer (version 2.1, Thermo Scientific) 和MaxQuant (version 1.6.17.0) 进行处理分析。通过Xcalibur Qual Browser (version 3.0.63,Thermo Fisher Scientific) 检查基峰总体情况。原始数据由MaxQuant使用大部分的默认参数处理。所有RAW文件在MaxQuant中同一个窗口进行处理,数据库搜索使用Andromeda search engine (MaxQuant中配置的搜索引擎),数据库采用UniProt Rattus norvegicus (Rat) sequence database (317, 2020; 8 137 sequences)。主搜索中前体母离子的质量容许偏差设置在0.000 45%以下,碎片离子质量容许偏差设置在0.002%以下。消化酶设置为trypsin/P,最大有2个错切位点。最小的肽段至少包括7个残基。蛋白质N端乙酰化和蛋氨酸的氧化作为可变修饰,半胱氨酸的脲甲基化(半胱氨酸碘乙酰化) 作为固定修饰。由于还原烷基化以后,二硫键被打开,半胱氨酸会带上carbamidomethyl基团(+57 Da),在搜库时,通常把carbamidomethyl (C) 选为固定修饰。对于没有修饰的肽段不设置Andromeda评分阈值,每一个鉴定到的修饰都有一个评分,对应参数为Andromeda score,最小设为40。肽段和蛋白的错误发现率设置为1% (基于目标-诱饵反相数据库target- decoy reverse database)。选择无标记定量选项(label-free quantification, LFQ),使用来自MaxQuant的MaxLFQ算法。蛋白质LFQ强度根据至少2个样本中识别到的多肽的相对强度比值的中位数来进行计算,并根据样本间的累积强度进行调整。定量使用共有和独有的肽进行,包括那些经过乙酰化(蛋白质N端) 和氧化(Met) 修饰的肽。蛋白强度归一化需要最小肽段比为1,并启用“Fast LFQ”。
使用Perseus version (version 1.6.14.0) 对数据进行预处理,去除污染和鉴别肽段数 < 1的蛋白,取LFQ intensity的log2进行归一化。缺失值或许是低于质谱检测的低丰度蛋白造成的,也或许是随机缺失造成的,有研究为了模拟低丰度LFQ值,用中值以下高斯分布中的随机值代替缺失值,另外也有些研究中的缺失值以0替换[10-11]。本研究以0替换缺失值。
1.6 统计学分析每个样品均进行了3次技术重复,取3次平均值用于统计学分析。将实验组(低氧T1组、T2组) 鉴定到的尿蛋白分别与对照组(常氧T0组) 鉴定到的尿蛋白进行对比,筛选差异蛋白。筛选条件如下:组间变化倍数≥2或≤0.05,双尾非配对t检验的P值< 0.01。
1.7 随机分组分析将低氧T1组(n=5) 和常氧T0组(n=5) 共10个样本随机分成两组,在总计126次随机组合中,按照相同的筛选条件计算所有随机次数的平均差异蛋白数目。
1.8 生物信息学分析使用悟空平台(https://www.omicsolution.org/wkomic/main/) 进行非监督聚类分析(hierarchical cluster analysis, HCA)[12],使用DAVID 6.8 (https://david.ncifcrf.gov/) 以大鼠基因组作为基因群体背景,对T1与T2时刻鉴定到的差异蛋白进行生物学过程、细胞定位和分子功能3个方面的富集分析[13]。在基于公开数据库(https://pubmed.ncbi.nlm.nih.gov) 的报道研究中搜索了差异蛋白的功能。
2 结果与分析 2.1 低氧模型尿蛋白组变化在低氧模型中,选取5只大鼠的T0、T1、T2时刻的尿液蛋白,进行非标记LC-MS/MS质谱鉴定。该模型共鉴定到1 162个蛋白(≥2个特异性的多肽,蛋白水平FDR < 1%),将其进行非监督聚类分析,图 1展示了具体的样本非监督聚类结果。该结果显示,T0和T1、T2区别十分显著,可以很明显地区分常氧组(T0) 和低氧组(T1、T2) 样品,说明低氧对大鼠机体造成的影响是极大的。
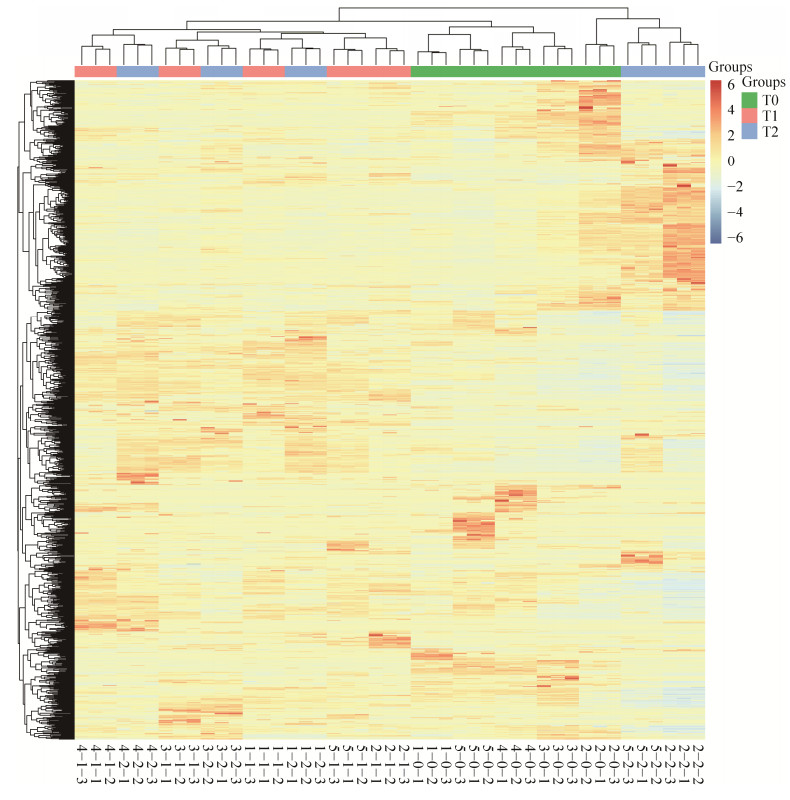
|
| 图 1 低氧组与常氧组整体尿液蛋白质组的非监督聚类分析 Fig. 1 Hierarchical cluster analysis of all proteins in hypoxic and normoxic groups. |
| |
采用自身对照的方法,将T1、T2的尿蛋白分别与T0进行比较,筛选标准,组间变化倍数≥2或≤0.5,P < 0.01,高丰度组的平均蛋白谱图数≥3,且高丰度组每个样品的蛋白谱图都高于低丰度组。相对于T0时刻,T1时刻鉴定到144个差异蛋白,其中88个上调,56个下调;在T2时刻鉴定到129个差异蛋白,其中73个上调,56个下调。不同时间点鉴定到的差异蛋白的详细信息已提交国家微生物科学数据中心(编号:NMDCX0000142)。此外,在T1时刻鉴定到的差异蛋白中有67个是从无到有变化的蛋白,53个是从有到无变化的蛋白;T2时刻鉴定到差异蛋白中65个是从无到有变化的蛋白;49个是从有到无变化的蛋白。这些从无到有或从有到无变化的差异蛋白占总差异蛋白85%以上。
2.2 尿液样本随机分组的结果鉴于样本中鉴定出的蛋白质组学特征数量高于样本数量,两组之间的差异可能是随机产生的。开发了随机分组统计分析策略以确认这些差异蛋白是否由低氧引起。将低氧T1组(n=5) 和常氧T0组(n=5) 共10个样本随机分成两组,在总计126次随机组合中,按照相同的筛选条件计算所有随机次数的平均差异蛋白数目为5 (详见已提交国家微生物科学数据中心(编号:NMDCX0000142))。这些结果表明只能随机生成5个差异蛋白,进一步表明96.5%的差异蛋白是可靠的。将T2组和T0组的尿液样本随机分成两组,同上操作,随机可能筛选到的平均差异蛋白数目为6 (详见已提交国家微生物科学数据中心(编号:NMDCX0000142))。说明随机生成的差异蛋白为6个,这进一步表明95.3%的差异蛋白是可靠的。由此说明,本研究中发现的这些差异蛋白是由于低氧导致的,而不是随机差异。
2.3 差异蛋白的功能注释使用DAVID数据库对T1时刻鉴定到的总计144个差异蛋白从生物学过程、细胞成分和分子功能3个方面进行功能富集分析(图 2)。生物学过程中(图 2A),这些差异蛋白倾向于参与谷胱甘肽代谢、内肽酶活性负调控、血管生成、细胞氧化解毒、糖酵解等。在细胞成分中(图 2B),大多数的差异蛋白来源于细胞外的外泌体和细胞外空间。在分子功能中(图 2C),这些差异蛋白倾向于钙粘蛋白结合参与细胞间粘附、钙离子结合、蛋白结合和谷胱甘肽转移酶活性等功能。为了鉴定差异蛋白参与的主要代谢通路,进行了京都基因及基因组百科全书(Kyoto Encyclopedia of Genes and Genome, KEGG)通路富集分析。结果显示,共有9个代谢通路被显著富集,其中包括谷胱甘肽代谢、氮代谢和碳代谢等(图 2D)。
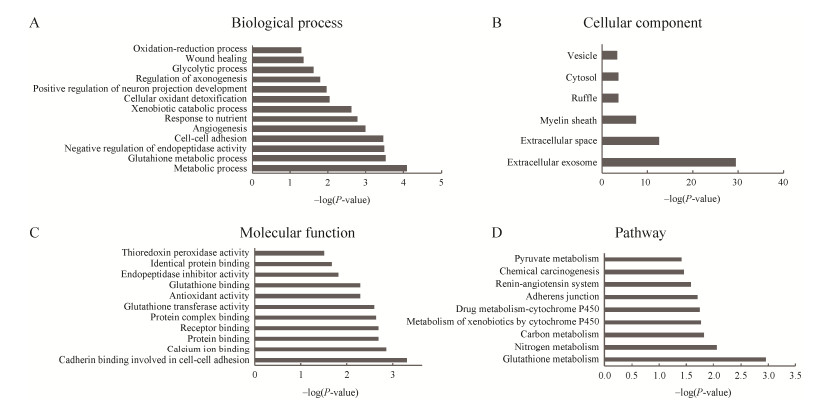
|
| 图 2 T1时刻差异蛋白的功能注释 Fig. 2 Functional analysis of differential proteins at T1. (A) Biological process. (B) Cellular component. (C) Molecular function. (D) Pathways. |
| |
同上,使用DAVID数据库对T2时刻鉴定到的总计129个差异蛋白从生物学过程、细胞成分和分子功能3个方面进行功能富集分析(图 3)。生物学过程中(图 3A),这些差异蛋白倾向于参与内肽酶活性负调控、细胞粘附、血小板聚集、血液凝固等。在细胞成分中(图 3B),大多数的差异蛋白来源于细胞外的外泌体和细胞外空间。在分子功能中(图 3C),这些差异蛋白倾向于钙粘蛋白结合参与细胞间粘附、胶原蛋白结合、碳酸盐脱水酶的活性等功能。为了鉴定差异蛋白参与的主要代谢通路,进行了KEGG通路富集分析。结果显示,共有3个代谢通路被显著富集,其中包括氮代谢、血小板激活、肌动蛋白细胞骨架的调节(图 3D)。
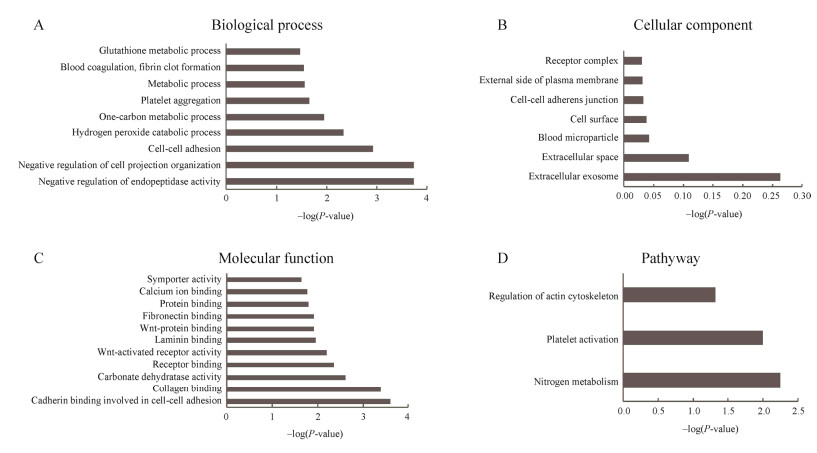
|
| 图 3 T2时刻差异蛋白的功能注释 Fig. 3 Functional analysis of differential proteins at T2. (A) Biological process. (B) Cellular component. (C) Molecular function. (D) Pathways. |
| |
对上述基于DAVID和KEGG数据库的富集结果检索相关资料后发现某些生物学过程和代谢通路与低氧有关。(1) 抗氧化应激。据报道,低压缺氧引起的氧化剂会调节两个主要的抗氧化蛋白家族的活性,即过氧化物酶和硫氧还蛋白[14]。其中硫氧还蛋白超家族的成员具有硫氧还蛋白折叠和共有活性位点序列(CxxC),并在氧化还原调节、氧化应激防御、含二硫键蛋白的重折叠和转录因子的调节中发挥作用[15]。(2) 糖酵解。随着高海拔地区O2水平的降低,ATP的生成从线粒体中依赖氧的氧化磷酸化过程会转变为细胞质中不依赖氧的糖酵解过程[16]。(3) 补体和凝血级联反应。有研究发现,高原地区人口的凝血相关蛋白的血浆水平高于平原地区人口[17]。(4) 血管生成。低氧会引起低氧诱导因子累积增加,从而诱导血管内皮生长因子表达升高,血管生成增强[18]。(5) 肾素-血管紧张素系统。有研究表明,肾素-血管紧张素系统的激活与肾脏慢性缺氧有关[19]。
与此同时,我们将两个时刻分别富集到的生物学过程比较后发现,低氧12 h后主要表现为物质代谢发生改变,如谷胱甘肽代谢、糖酵解等。而低氧24 h后机体从物质代谢变化趋向转为器质性变化,如血管生成、凝血等。
3 讨论本研究建立了急性低氧大鼠模型,通过对尿液进行非标记LC-MS/MS质谱鉴定,探究海拔5 000 m的低氧条件对大鼠尿液蛋白质组造成的影响,了解适应低氧的过程中机体的变化,进而为寻找低氧的生物标志物奠定基础,为寻找治疗低氧血症相关疾病的药物干预靶点提供线索。结果显示,低氧12 h后共鉴定到144个差异蛋白,低氧24 h后共鉴定到129个差异蛋白,其中104个为两个时刻共有差异蛋白,这说明机体暴露于低氧环境后发生急性高原反应,导致生理机能发生变化。随后,随着暴露时间的延长,机体通过调动一系列代偿性低氧调节反应,如肺通气量增加[20]、红细胞和血红蛋白增加[21]、能量代谢方式改变[22]等,改善机体氧的供应和利用,恢复稳态以适应高原缺氧环境,这种过程称为高原习服。
此外,在这些差异蛋白中大部分是从无到有或从有到无的变化,在我们以往做过的研究中,如高血脂、肿瘤注射[23]、肺纤维化[24]、阿尔茨海默病[25]等,没有一类病理生理变化能够对尿蛋白产生如此大的影响,这表明低氧对机体所产生的影响在尿液蛋白质组中的变化是十分显著的,也体现了尿液的敏感性。
我们对每条代谢通路富集到的蛋白做进一步分析也得到了治疗低氧血症的药物干预线索。我们发现有些蛋白被多次富集出现在代谢通路中,其中以谷胱甘肽相关蛋白最为显著。谷胱甘肽转移酶和羟酰基谷胱甘肽水解酶多次被富集出现在不同的代谢通路中,包括谷胱甘肽代谢、细胞色素P450对外源性物质的代谢、化学致癌作用。
有研究发现,大鼠在9 000 m海拔的环境条件下24 h后与对照组相比,缺氧会显著加剧氧化型谷胱甘肽(glutathiol, GSSG) 的表达水平,并抑制谷胱甘肽(glutathione, GSH) 表达[26]。缺氧诱导因子1 (hypoxia inducible factor-1, HIF-1) 作为细胞对缺氧反应的中心调节因子,诱导许多缺氧适应反应。有学者认为,细胞内的GSSG/GSH比率的变化可能在缺氧期间调节HIF-1的诱导[27]。谷胱甘肽转移酶(glutathione S-transferase, GST) 是重要的解毒酶,可催化谷胱甘肽与多种有毒氧化剂的结合。有研究表明,谷胱甘肽S-转移酶P1 (glutathione S-transferase P1, GSTP1) 在细胞对氧化应激的反应中起决定作用,并保护肿瘤细胞免受各种细胞毒剂,如H2O2、紫外线、顺铂和三氧化二砷引起的细胞凋亡[28]。此外,也有证据表明GST在调节氧化应激期间血管内皮细胞的细胞反应和信号通路中发挥作用[29-30]。
因此,我们猜测人为干预谷胱甘肽相关蛋白能够对低氧血症起到改善作用。目前这项猜测也在相应的文献中得到证实,有研究证明补充外源性GSSG能够减少缺氧对离体大鼠心肌细胞的负面影响,延长细胞耐受缺氧的时间,维持心肌细胞的收缩功能[31]。此外,也有研究证明了重组GSTP1蛋白在抑制炎症损伤方面的治疗潜力。通过补充重组GSTP1蛋白可有效抑制与急性炎症相关的细胞因子和酶的产生,表明外源性补充重组GST对细胞抗氧化和炎症反应有积极影响。这些发现可能为治疗全身性和局部炎症综合征提供一种新的策略[32]。由此说明尿液可以应用于寻找药物靶标的相关研究以此来指导用药。
4 结论我们的研究结果表明,尿液蛋白质组可以反映急性低氧刺激后的显著变化。这些发现可能提供一种判断机体高原缺氧程度的方法,有助于检测或辅助检测缺氧状态,方便无创,容易为病人接受,更便于动态监察高原人群的缺氧损伤进展。
| [1] |
Hartman-Ksycińska A, Kluz-Zawadzka J, Lewandowski B. High altitude illness. Przegl Epidemiol, 2016, 70(3): 490-499.
|
| [2] |
Meier D, Collet TH, Locatelli I, et al. Does this patient have acute mountain sickness? : the rational clinical examination systematic review. JAMA, 2017, 318(18): 1810-1819. DOI:10.1001/jama.2017.16192
|
| [3] |
Ahmad Y, Sharma NK, Ahmad MF, et al. Proteomic identification of novel differentiation plasma protein markers in hypobaric hypoxia-induced rat model. PLoS One, 2014, 9(5): e98027. DOI:10.1371/journal.pone.0098027
|
| [4] |
Murray AJ. Energy metabolism and the high-altitude environment. Exp Physiol, 2016, 101(1): 23-27. DOI:10.1113/EP085317
|
| [5] |
Luo H, Zhou DJ, Chen Z, et al. Establishment and evaluation of an experimental rat model for high-altitude intestinal barrier injury. Exp Ther Med, 2017, 13(2): 475-482. DOI:10.3892/etm.2016.4012
|
| [6] |
Du X, Zhang R, Ye SL, et al. Alterations of human plasma proteome profile on adaptation to high-altitude hypobaric hypoxia. J Proteome Res, 2019, 18(5): 2021-2031. DOI:10.1021/acs.jproteome.8b00911
|
| [7] |
Gao YH. Urine-an untapped goldmine for biomarker discovery. Sci China Life Sci, 2013, 56(12): 1145-1146. DOI:10.1007/s11427-013-4574-1
|
| [8] |
Gao YH. Now is the time to test early urinary biomarkers in large-scale human samples. Sci China Life Sci, 2019, 62(6): 851-853. DOI:10.1007/s11427-019-9562-y
|
| [9] |
Wiśniewski JR, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis. Nat Methods, 2009, 6(5): 359-362. DOI:10.1038/nmeth.1322
|
| [10] |
Goldman AR, Bitler BG, Schug Z, et al. The primary effect on the proteome of ARID1A-mutated ovarian clear cell carcinoma is downregulation of the mevalonate pathway at the post-transcriptional level. Mol Cell Proteomics, 2016, 15(11): 3348-3360. DOI:10.1074/mcp.M116.062539
|
| [11] |
Tyanova S, Temu T, Cox J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nat Protoc, 2016, 11(12): 2301-2319. DOI:10.1038/nprot.2016.136
|
| [12] |
Wang SS, Zheng W, Hu LQ, et al. MixProTool: a powerful and comprehensive web tool for analyzing and visualizing multigroup proteomics data. J Comput Biol, 2018, 25(10): 1123-1127. DOI:10.1089/cmb.2018.0050
|
| [13] |
Huang DW, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources. Nat Protoc, 2009, 4(1): 44-57. DOI:10.1038/nprot.2008.211
|
| [14] |
Felberbaum-Corti M, Morel E, Cavalli V, et al. The redox sensor TXNL1 plays a regulatory role in fluid phase endocytosis. PLoS One, 2007, 2(11): e1144. DOI:10.1371/journal.pone.0001144
|
| [15] |
Liu F, Rong YP, Zeng LC, et al. Isolation and characterization of a novel human thioredoxin-like gene hTLP19 encoding a secretory protein. Gene, 2003, 315: 71-78. DOI:10.1016/S0378-1119(03)00732-7
|
| [16] |
Seagroves TN, Ryan HE, Lu H, et al. Transcription factor HIF-1 is a necessary mediator of the Pasteur effect in mammalian cells. Mol Cell Biol, 2001, 21(10): 3436-3444. DOI:10.1128/MCB.21.10.3436-3444.2001
|
| [17] |
Wang ZK, Liu H, Dou MM, et al. The quality changes in fresh frozen plasma of the blood donors at high altitude. PLoS One, 2017, 12(4): e0176390. DOI:10.1371/journal.pone.0176390
|
| [18] |
Xu K, Sun XY, Benderro GF, et al. Gender differences in hypoxic acclimatization in cyclooxygenase-2- deficient mice. Physiol Rep, 2017, 5(4): e13148. DOI:10.14814/phy2.13148
|
| [19] |
Nangaku M, Fujita T. Activation of the renin-angiotensin system and chronic hypoxia of the kidney. Hypertens Res, 2008, 31(2): 175-184. DOI:10.1291/hypres.31.175
|
| [20] |
Böning D, Rojas J, Serrato M, et al. Extracellular pH defense against lactic acid in untrained and trained altitude residents. Eur J Appl Physiol, 2008, 103(2): 127-137. DOI:10.1007/s00421-008-0675-0
|
| [21] |
Schmidt W, Prommer N. Effects of various training modalities on blood volume. Scand J Med Sci Sports, 2008, 18(Suppl 1): 57-69.
|
| [22] |
Holloway CJ, Montgomery HE, Murray AJ, et al. Cardiac response to hypobaric hypoxia: persistent changes in cardiac mass, function, and energy metabolism after a trek to Mt. Everest Base Camp. FASEB J, 2011, 25(2): 792-796. DOI:10.1096/fj.10-172999
|
| [23] |
Wei J, Meng WS, Gao YH. Urine proteome changes in rats subcutaneously inoculated with approximately ten tumor cells. PeerJ, 2019, 7: e7717. DOI:10.7717/peerj.7717
|
| [24] |
Wu J, Li X, Zhao M, et al. Early detection of urinary proteome biomarkers for effective early treatment of pulmonary fibrosis in a rat model. Proteomics Clin Appl, 2017, 11(11/12): 2017Dec; 11(11-2017Dec; 11(12).
|
| [25] |
Zhang FS, Wei J, Li XD, et al. Early candidate urine biomarkers for detecting Alzheimer's disease before amyloid-β plaque deposition in an APP (swe)/ PSEN1dE9 transgenic mouse model. J Alzheimers Dis, 2018, 66(2): 613-637. DOI:10.3233/JAD-180412
|
| [26] |
Hou Y, Wang XB, Chen XR, et al. Establishment and evaluation of a simulated high altitude hypoxic brain injury model in SD rats. Mol Med Rep, 2019, 19(4): 2758-2766.
|
| [27] |
Tajima M, Kurashima Y, Sugiyama K, et al. The redox state of glutathione regulates the hypoxic induction of HIF-1. Eur J Pharmacol, 2009, 606(1/2/3): 45-49.
|
| [28] |
Gaté L, Tew KD. Glutathione S-transferases as emerging therapeutic targets. Expert Opin Ther Targets, 2001, 5(4): 477-489. DOI:10.1517/14728222.5.4.477
|
| [29] |
Xu Y, Gong B, Yang Y, et al. Glutathione-S-transferase protects against oxidative injury of endothelial cell tight junctions. Endothelium, 2007, 14(6): 333-343. DOI:10.1080/10623320701746263
|
| [30] |
Yang YZ, Yang YS, Trent MB, et al. Glutathione- S-transferase A4-4 modulates oxidative stress in endothelium: possible role in human atherosclerosis. Atherosclerosis, 2004, 173(2): 211-221. DOI:10.1016/j.atherosclerosis.2003.12.023
|
| [31] |
Poluektov YM, Petrushanko IY, Undrovinas NA, et al. Glutathione-related substances maintain cardiomyocyte contractile function in hypoxic conditions. Sci Rep, 2019, 9(1): 4872. DOI:10.1038/s41598-019-41266-2
|
| [32] |
Luo L, Wang Y, Feng Q, et al. Recombinant protein glutathione S-transferases P1 attenuates inflammation in mice. Mol Immunol, 2009, 46(5): 848-857. DOI:10.1016/j.molimm.2008.09.010
|
 2022, Vol. 38
2022, Vol. 38




