1. 安徽医科大学 基础医学院, 安徽 合肥 230032;
2. 军事科学院军事医学研究院 生命组学研究所 中国医学科学院蛋白质组学与药物研发新技术创新单元国家蛋白质科学中心 (北京) 北京蛋白质组研究中心蛋白质组学国家重点实验室, 北京 102206;
3. 军事科学院军事医学研究院 辐射医学研究所, 北京 100850;
4. 大连理工大学 生物工程学院, 辽宁 大连 116024
收稿日期:2021-12-08;接收日期:2022-02-24
基金项目:国家重点研发计划(2017YFA0505700);国家自然科学基金(31870824, 81773867)
作者简介:徐平 博士,国家蛋白质科学中心(北京) 翻译后修饰课题组PI、研究员、博士生导师,国家特殊计划领军人才,科技部“蛋白质稳态调控的翻译后修饰组学研究”创新团队负责人,中国生化和分子生物学会蛋白质组学专业委员会主任委员,亚太人类蛋白质组组织常务理事,国际人类染色体蛋白质组计划(C-HPP) 亚太区执委。主要从事蛋白质组学新技术、微生物蛋白质组学、蛋白质泛素化的新生物学功能和疾病分子机制等研究.
Quantitative proteomics reveals the abnormal liver metabolism-relieving effect of Anemarrhenae rhizoma in type 2 diabetes mellitus rats
1. School of Basic Medicine, Anhui Medical University Hefei 230032, Anhui, China;
2. State Key Laboratory of Proteomics, Beijing Proteome Research Center, National Center for Protein Sciences (Beijing), Research Unit of Proteomics & Research and Development of New Drug, Chinese Academy of Medical Sciences, Beijing Institute of Lifeomics, Academy of Military Medical Sciences of Academy of Military Science, Beijing 102206, China;
3. Institute of Radiation Medicine, Academy of Military Medical Sciences of Academy of Military Science, Beijing 100850, China;
4. School of Bioengineering, Dalian University of Technology, Dalian 116024, Liaoning, China
Received: December 8, 2021; Accepted: February 24, 2022
Supported by: National Key Research and Development Project of China (2017YFA0505700); National Natural Science Foundation of China (31870824, 81773867)
糖尿病是一种以高血糖水平、血脂异常、高胰岛素抵抗和胰腺β细胞功能障碍为特征的代谢性疾病[1-2],可能由遗传、饮食、环境、免疫反应等因素共同作用。如果不及时控制和治疗,血糖水平失控,易导致一系列可能危及生命的并发症。世界卫生组织(World Health Organization, WHO) 于1999年将糖尿病分为1型糖尿病、2型糖尿病、妊娠糖尿病及其他特殊糖尿病4种类型,其中2型糖尿病占比约为90%[3-4]。近年来,我国的糖尿病患病数快速增长[3-5]。到2045年,我国糖尿病人数量预计将上升至1.54亿[4]。由此可见,糖尿病的预防和治疗迫在眉睫。
大多数糖尿病的发生发展不仅与胰腺、肾脏等器官相关,与肝脏的关系也密不可分[6]。健康者进食后,全身细胞通过氧化分解为机体供能维持生命活动所需,多余的血糖首先合成肝糖原储存在肝脏中。肝糖原储备充足后,肝脏会将其转化为甘油、脂肪酸以合成脂肪或转换为氨基酸以合成蛋白质。然而,若经常超负荷摄入,肝脏贮积热量过多则会形成脂肪肝,机体会相应地增加额外的线粒体脂肪酸氧化并触发氧化和氮化应激(oxidative and nitrosative stress, ONS),大量消耗细胞内储存的ATP。同时,由于脂毒性会诱发胰岛素抵抗,糖代谢发生紊乱使血糖处于高水平,导致脂肪肝程度进一步加重。周而复始,肝脏内过多的脂肪细胞分泌的炎症细胞因子等使得疾病进一步发展,以至于血糖水平居高不下、血脂水平持续异常且胰岛素抵抗逐步严重,形成恶性循环[7]。并且,非酒精性脂肪肝患者患糖尿病的几率增加了两倍以上,反之亦然[8]。由此可见,糖尿病与肝脏代谢的关系密不可分,肝脏组织毋庸置疑地成为糖尿病研究的重要样本[9-11]。
目前临床上治疗糖尿病的方法主要为注射胰岛素或口服化学药物,虽然能达到不同程度的治疗效果,但这些方法普遍存在较多毒副作用[12]。而中药相比之下有更好的治疗优势,不仅可以减轻患者用药后产生的毒副反应,还能一定程度上增强患者的机体免疫功能[13]。目前知母可以缓解胰岛素抵抗和糖尿病已成为共识[14-16],在批准上市的30种缓解糖尿病的复方中药中有12种含有知母,是最常被使用的10种中药材之一[17-18],也是中国目前批准用于缓解糖尿病的中药产品中最常用的成分之一[19]。已有报道表明,知母可以通过过氧化物酶4过表达促进胰腺细胞再生并恢复胰岛细胞的功能[20],但知母治疗是否可以缓解肝脏代谢异常仍有待深入研究。本文通过对正常饮食大鼠对照组、高脂饮食大鼠模型、未治疗的2型糖尿病大鼠模型以及知母提取物治疗的2型糖尿病大鼠模型的肝脏组织定量蛋白质组数据进行分析发现,知母缓解2型糖尿病模型大鼠肝脏脂肪酸代谢异常可能与关键蛋白表达水平的回调有关。
1 材料与方法
1.1 造模方法和样本来源 雄性Wistar大鼠(150−170 g) 购自大连医科大学SPF实验动物中心,许可证号SCXK 2013-0003。目前的研究方案得到了大连理工大学动物护理和使用委员会的批准(编号:DUTSBE220719_02)。动物饲养于标准实验室条件下,将实验大鼠适应性饲养7 d后开始造模。
造模实验分组为正常饮食大鼠对照组(normal control, NC, n=6),使用正常饮食饲养;高脂饮食大鼠模型组(obesity model, OM, n=6),使用高脂饲料(high-fat diet, HFD) 饲养;2型糖尿病大鼠模型组(diabetes model, DM, n=6),由高脂饮食加化学药物链脲佐菌素(streptozotocin, STZ) 双因素诱导;知母提取物处理2型糖尿病大鼠模型组(Anemarrhenae Rhizoma, AR, n=6)。造模方法为6只Wistar雄性大鼠正常饮食喂养至整个实验结束作为正常饮食大鼠对照组。6只Wistar雄性大鼠喂养HFD至整个实验结束作为高脂饮食大鼠模型。74只Wistar雄性大鼠喂养高脂饲料18 d后一次性注射化学药物STZ,破坏胰岛细胞诱发大鼠产生糖尿病,持续25 d。在第25天进行血糖测定初步筛选,第42天进行血糖测定终筛,筛选采取口服葡萄糖耐量测试(oral glucose tolerance test, OGTT) 的方法,血糖高于11.1 mmol/L被认为是符合标准的2型糖尿病大鼠模型。将符合标准的2型糖尿病大鼠模型按照体重、空腹血糖、2 h餐后血糖浓度随机分为5组。选取2组进行后续给药实验,分别给予安慰剂(5%的羧甲基纤维素钠)、知母灌胃,42 d后处死。利用2 h餐后血糖浓度、胰岛素含量变化、肝脏中甘油三酯和胆固醇的变化及胰岛细胞破坏程度作为标准,确保模型的成功[20]。将对照组大鼠和模型组大鼠的肝脏组织样本保存在液氮中用于后续分析,该样本来源于军事科学院军事医学研究院辐射医学研究所以及大连理工大学[20]。
1.2 肝脏组织蛋白提取 使用经液氮预冷的杵和研钵在液氮中将各大鼠模型的肝脏组织(每组模型选取5−6只大鼠) 研磨成粉末,并在粉末中加入包含9 mol/L尿素(urea)、30 mmol/L氯化钠(NaCl)、10 mmol/L三羟甲基氨基甲烷盐酸盐(Tris- HCl)、10 mmol/L碘乙酰胺(iodoacetamide, IAM)、5 mmol/L焦磷酸钠(Na4P2O7)、100 mmol/L磷酸二氢钠(NaH2PO4)、1 mmol/L氟化钠(NaF)、1mmol/L钒酸钠(Na3VO4)、1 mmol/L磷酸甘油和蛋白酶抑制剂的裂解缓冲液。冰浴超声6 min,离心收集上清液。为了减少由于个体差异导致的实验误差,将各模型5组生物学重复的肝脏组织蛋白样品混合后分装,保存至–80 ℃冰箱备用。
1.3 蛋白质量检测及蛋白定量 使用SDS-PAGE对提取的肝脏组织蛋白进行质量检测,通过电泳使蛋白条带完全分离。电泳结束后加入适量考马斯亮蓝染色液染色。蛋白样品着色后使用脱色液(20% CH3OH,5% CH3COOH) 进行脱色,待背景色去除后,观察条带质量。对无降解情况发生的蛋白样品使用SCImage软件进行灰度定量。
1.4 蛋白质酶切 各取100 μg完成浓度平衡的蛋白样品进行蛋白质酶切实验。高脂饮食大鼠模型组(OM) 取两份100 μg起始肝脏组织蛋白样品进行酶切,作为技术重复。各起始样品中加入5 mmol/L二硫苏糖醇(dithiothreitol, DTT),于45 ℃金属浴还原反应30 min,加入20 mmol/L碘乙酰胺(IAM),室温避光烷基化反应30 min。使用SDS-PAGE胶分离,电泳长度0.8 cm。使用1.3中的方法进行考马斯亮蓝染色及脱色。将蛋白条带切为1 mm3左右的胶粒置于1.5 mL的离心管中。胶粒中加入脱色液(30% CAN, 500 mmol/L NH4HCO3) 振荡直至胶粒无色。在装有胶粒的离心管中加入乙腈(acetonitrile, ACN) 脱水,多次重复该步骤直至胶粒完全干燥。将装有干燥胶粒的离心管置于冰上,加入含有50 mmol/L NH4HCO3,5% ACN,12.5 ng/μL胰蛋白酶的酶解缓冲液,待胶粒充分膨胀后于37 ℃恒温箱孵育14 h。
次日,将离心管取出,使用17 000×g室温离心,将上清液转入新离心管中。向胶粒中加入抽提液(5% formic acid, 50% ACN),17 000×g离心1 min,静置4 min,将上清与上一步保留上清合并,重复该步骤4−5次。加入ACN重复脱水,将所有上清合并于新离心管中,混匀后检测肽段浓度,各取1 μg肽段置于PCR管中以备酶切效率检测所需。最后,将离心管及PCR管置于真空冷冻干燥仪中浓缩干燥获得肽段样品。
1.5 肽段TMT标记及标记效率检测 将1 mol/L四乙基溴化铵(tetraethylammonium bromide, TEAB) 母液使用ddH2O稀释20倍至终浓度50 mmol/L,将50%羟胺使用50 mmol/L TEAB稀释10倍至终浓度5%,以备后续实验所需。从冰箱中取出肽段样品后加入105 μL 50 mmol/L TEAB混匀,充分溶解肽段样品后离心,取100 μL样品转至新离心管中。从冰箱中取出TMT试剂,向每管TMT试剂中加入50 μL无水ACN充分混匀后离心。分别取45 μL TMT试剂加入5个相应的肽段样品中,标签127N标记AR组,标签128C标记DM组,标签129N标记NC组,标签129C和130C标记OM组,作为实验的技术重复。充分混匀后检测样品pH值,pH值应大于7.5,避光反应1–2 h。从各样品中取出1.5 μL样品合并至含有5 μL 5%羟胺的PCR管中终止反应,混匀蒸干,用于标记效率检测。剩余样品无需终止反应,直接于–80 ℃冰箱保存。
1.6 脱盐及标记效率检测 使用20 μL甲醇润洗C18脱盐柱,继续加入20 μL缓冲液B (80% CAN, 0.5% CH3COOH, ddH2O) 润洗,最后加入20 μL缓冲液A (1% CAN, 1% TFA, ddH2O) 平衡,重复平衡步骤1–2次。使用10 μL缓冲液A充分溶解步骤1.5中标记完成的肽段样品加入C18脱盐柱中,流穿液置于标记为“FT”的PCR管中,重复此步骤1次。向C18脱盐柱中加入20 μL缓冲液A,流穿液置于标记为“wash”的PCR管中。最后,向C18脱盐柱中加入20 μL缓冲液B,洗脱液置于标记为“elution”的PCR管中,重复此步骤1次。将标记为“elution”的PCR管置于真空冷冻干燥仪中浓缩干燥后,进行标记效率检测。确认标记效率正常后,将步骤1.5中剩余样品等量混合后蒸干。
1.7 液相分离及样本合并 混合肽段进行高效液相分离(Rigol, L- 3120),样品注入C18柱中(150 Å, 5 μm, 4.6 mm× 250 mm),分离梯度、A相浓度、B相浓度以及流速信息如下表 1。每1 min收集1个样品,共收集60个,合并为12个组分,标注为TMT1-12。合并方法如下表 2。合并蒸干后,每个组分取500 ng进行质谱检测。
表 1 离线反相高效液相色谱分离梯度
Table 1 Offline reversed-phase high performance liquid chromatography (HPLC) separation gradients
| Time (min) |
A (%) |
B (%) |
Flow (mL/min) |
| Initial |
100 |
0 |
0.4 |
| 05:00 |
100 |
0 |
0.4 |
| 08:00 |
97 |
3 |
0.7 |
| 45:00 |
78 |
22 |
0.7 |
| 55:00 |
68 |
32 |
0.7 |
| 56:00 |
10 |
90 |
0.7 |
| 58:00 |
10 |
90 |
0.7 |
| 60:00 |
100 |
0 |
0.7 |
表 2 样品合并方法
Table 2 Method of sample combination
| Sample |
TMT1 |
TMT2 |
TMT3 |
TMT4 |
TMT5 |
TMT6 |
TMT7 |
TMT8 |
TMT9 |
TMT10 |
TMT11 |
TMT12 |
| Fraction |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
| 13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
| 25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
| 37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
| 49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
1.8 TMT标记后样品质谱检测及数据库搜索 质谱检测使用Easy-Nano LC 1 200液相色谱,分离梯度、B相浓度以及流速信息见表 3。肽段经电喷雾离子源离子化后进入Q Exactive HF (Thermo Fisher Scientific) 质谱仪中进行检测。质谱参数设置为:扫描范围为375–1 400 m/z,分辨率为1.2×105,自动增益控制(automatic gain control, AGC) 为3×106;数据采集选用数据依赖型采集模式(data-dependent acquisition, DDA);选择一级谱中丰度排名前15的离子进一步在离子阱中碎裂并检测;离子碎裂模式为高能碰撞诱导碎裂(higher-energy collision-induced dissociation, HCD),AGC为1×105,最大离子注射时间为100 ms。自动排除扫描正1价离子和未被识别的离子。
表 3 定量蛋白质组数据
Table 3 Quantitative proteomic data
| Sample |
Total spectra |
PSM |
MS2 (%) |
Identified protein |
Identified peptide |
Labeling efficiency (%) |
| ALL |
593 977 |
146 068 |
24.59 |
5 919 |
52 939 |
> 91.2 |
将所有原始质谱文件提交至蛋白质搜索软件MaxQuant (version 1.6.6.0) 进行数据搜索,并与UniProt Rattus norvegicus蛋白数据库(version June, 2020, UP000002494) 进行比较,参数设置:酶切类型为trypsin;最大漏切为2个;肽段长度至少7个氨基酸;固定修饰为半胱氨酸烷基化(C);可变修饰为甲硫氨酸氧化和乙酰化修饰;肽段和蛋白水平FDR < 0.01;MS2报告离子同位素标签设置10标TMT,移除未使用标签即可。
1.9 仪器质控分析及数据分析 使用MaxQuant软件搜库得到的原始定量蛋白质组学数据进行仪器质量控制分析以及定量相关性分析。利用Perseus (version 1.6.6.0) 软件进行各组蛋白信号值的标准化(包括中值归一化处理和缺失值插补处理) 以及后续分析。中值归一化借助该软件的Subtract功能以及Transform功能完成。缺失值插补借助该软件的Imputation功能完成,Width参数定为0.3,Down shift参数定为1.8。进一步借助该软件基于整体蛋白对各模型组数据进行层次聚类分析以及主成分分析。以P < 0.05和差异倍数(fold change) > 1.5为阈值标准筛选差异表达蛋白,使用差异蛋白进一步对各模型组数据进行层次聚类分析获取关键蛋白簇(cluster)。利用David在线网站(https://david.ncifcrf.gov/tools.jsp) 对差异蛋白及关键cluster进行GO功能及KEGG通路分析。
2 结果与分析
2.1 肝脏蛋白样品质量好、仪器状态佳且数据稳定性高 为探究知母对2型糖尿病大鼠模型肝脏代谢的影响,分别研磨、超声裂解肝脏组织得到蛋白样品,取5 μL蛋白样品进行质量检测(图 1)。各组蛋白样品条带分布较均匀;蛋白条带清晰,未发生降解;各组样品提取效率基本一致。提取的蛋白质量好,可继续开展后续定量蛋白质组学实验。各组蛋白进行浓度检测,取100 μg蛋白按图 2流程进行后续分析。通过定量蛋白质组分析,共鉴定到593 977张谱图、二级谱匹配率为24.59%、鉴定到52 939个肽段、5 919个蛋白,标记效率大于91.20% (表 3)。基于定量蛋白质组数据对仪器进行质量控制分析,仪器质量偏差分布在–2e–3 Da到2e–3 Da,但绝大多数分布在–1e–3 Da到1e–3 Da,仪器状态佳(图 3A)。使用OM组技术重复(标签为129C和130C) 的信号值进行定量相关性分析,相关系数(R2) 值为0.998 2,获得的定量蛋白质组数据相关性强、数据稳定性高(图 3B)。各组样品鉴定到的蛋白信号强度分布范围一致,log2(intensity) 分布于5–25之间,信号强度跨越范围宽,仪器灵敏度高且数据质量好(图 3C)。
2.2 肝脏组织定量蛋白质组数据能反映知母对2型糖尿病大鼠模型的治疗效果 对肝脏组织的定量蛋白质组数据进行质控分析后,欲探究已获得的数据是否能反映知母的治疗效果。对MaxQuant软件搜库得到的蛋白信号值进行中值归一化以及缺失值插补等预处理后进行层次聚类分析(图 4A),理论上数据间相似性越高时越可能聚为一簇。高脂饮食大鼠模型(OM_1和OM_2) 聚集为一簇且OM_1和OM_2可以与正常饮食大鼠对照组(NC) 聚为一簇。以对照组(NC、OM_1、OM_2) 作为出发点,2型糖尿病大鼠模型知母治疗组(AR) 较未治疗组(DM) 而言更接近对照组,证明经知母治疗后2型糖尿病大鼠病情得到缓解,发生偏向于正常大鼠的回调。进一步进行主成分分析,选取贡献最大的两个主成分(component 1为54.0%,component 2为25.2%) 进行数据可视化,第一主成分方向贡献了最大方差。结论与层次聚类分析一致,高脂饮食大鼠模型组(OM_1和OM_2) 与正常饮食大鼠对照组(NC) 聚为一簇。以对照组(NC、OM_1、OM_2) 作为出发点,于贡献最大方差的第一主成分方向,2型糖尿病大鼠模型知母治疗组(AR) 较未治疗组(DM) 而言更接近对照组(图 4B)。使用P < 0.05,fold change > 1.5作为阈值标准进行火山图分析,差异蛋白数目越多时两组差异越大,火山图分析结果与层次聚类分析结果一致。未治疗组相较对照组差异最大(图 4C),包含212个差异蛋白,其中165个下调蛋白及47个上调蛋白;而知母治疗组相较对照组差异减小(图 4D),包含176个差异蛋白,其中157个下调蛋白及19个上调蛋白;高脂饮食组相较对照组差异最小(图 4E),包含64个差异蛋白,其中36个下调蛋白及28个上调蛋白。因此,基于肝脏组织定量蛋白质组的数据分析表明知母治疗后2型糖尿病大鼠病情发生一定程度的缓解,数据分析结果与表型结果相一致[20]。
2.3 知母能够缓解2型糖尿病模型大鼠的异常肝脏脂肪酸代谢 为了减小计算复杂度以及尽可能去除无关蛋白的噪音影响,找到2型糖尿病大鼠模型知母治疗后相较未治疗的2型糖尿病大鼠模型真正产生差异的蛋白以及这些蛋白所涉及的通路。选用DM组相较NC组的212个差异蛋白做后续分析,这212个差异蛋白是区别2型糖尿病大鼠模型组和正常对照组的关键蛋白,后续知母治疗是否有恢复作用理论上应该在这212个差异蛋白的基础上发生变化。因此,使用这212个差异蛋白对4种动物模型进行进一步层次聚类分析(图 5A),将差异蛋白分为10簇,聚类结果中虽然知母治疗组更接近于未治疗组,但是知母治疗组仍旧产生了接近正常对照组的回调趋势。特别是在知母治疗后,第3簇蛋白以及第9簇蛋白的表达水平有不同程度的回调为正常对照组的趋势。第3簇是知母治疗后相较未治疗组表达下调的关键蛋白簇,包含了31个差异蛋白;第9簇是知母治疗后相较未治疗组表达上调的关键蛋白簇,包含了7个差异蛋白。这38个可能由于知母治疗独立影响的蛋白是后续重点关注的蛋白。
我们进一步分析第3簇蛋白以及第9簇蛋白所涉及的GO功能及KEGG通路变化。图 5B呈现了知母治疗后的2型糖尿病模型大鼠相较未治疗的糖尿病模型大鼠产生差异的蛋白所富集到的分子功能(molecular function)、生物学过程(biological process) 和KEGG通路,即2型糖尿病大鼠模型体内失调程度得到缓解的信号通路。主要涉及的分子功能包括酰基辅酶A连接酶活性、脂肪酸连接酶活性和脂肪酰辅酶A合酶活性等;主要涉及的生物学过程包括酰基辅酶A代谢过程、脂肪酸合成过程、脂肪酸代谢过程等;主要涉及的KEGG通路为代谢途径等。知母提取物可能通过直接或间接调节这些生物学过程来实现对糖尿病的缓解作用。这些分子功能及通路均与脂肪酸代谢高度相关,表明2型糖尿病模型大鼠肝脏的脂肪酸代谢通路发生了显著变化。分析结果提示,知母缓解2型糖尿病中肝脏代谢异常可能与关键蛋白簇3和关键蛋白簇9表达水平的回调有关。
2.4 知母通过回调关键蛋白表达水平缓解2型糖尿病模型大鼠肝脏脂肪酸代谢异常 为探究知母通过哪些关键蛋白来缓解糖尿病大鼠肝脏异常脂肪酸代谢,将与脂肪酸代谢相关的生物学过程(图 5B中标注红色五角星) 中的10个蛋白提取出来展示在表 4中,并分别列出未治疗组和知母治疗组与正常对照中10个蛋白的信号丰度的比值情况,比值大于1为上调,小于1为下调,越接近正常对照,比值越接近于1。
表 4 与肝脏脂肪酸代谢相关的差异蛋白
Table 4 Differential proteins related to liver fatty acid metabolism
| No. |
Protein IDs |
Gene name |
DM/NC ratio |
AR/NC ratio |
| 1 |
O70490 |
acsm2 |
1.67 |
0.82 |
| 2 |
Q6AYT9 |
acsm5 |
1.95 |
1.06 |
| 3 |
O55171 |
acot2 |
1.52 |
1.15 |
| 4 |
P51647 |
aldh1a1 |
1.96 |
1.34 |
| 5 |
Q4KMC4 |
gfpt2 |
2.46 |
0.96 |
| 6 |
Q62730 |
hsd17b2 |
1.61 |
0.98 |
| 7 |
Q01134 |
chka |
1.79 |
1.00 |
| 8 |
D4A3V2 |
ndufa6 |
1.98 |
1.01 |
| 9 |
Q5XI95 |
adh6 |
2.43 |
1.22 |
| 10 |
P12369 |
prkar2b |
0.57 |
0.90 |
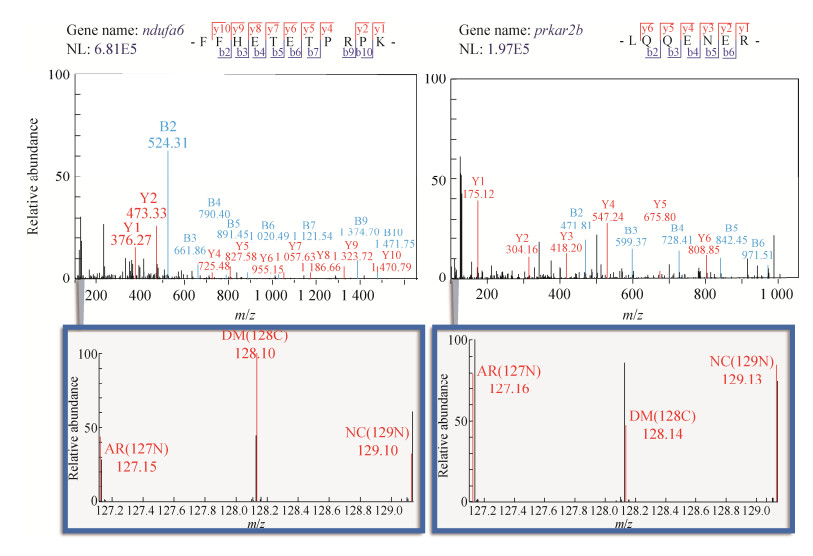
依据序列覆盖度、鉴定肽段数目、谱图质量、在UniProt或neXtProt的功能收录、知母治疗后与正常对照组ratio值以及文献报道等综合情况进行筛选,于10个差异蛋白中共筛选到2个关键蛋白,分别为No. 8 Ndufa6 (NADHdehydrogenase [ubiquinone] 1 alpha subcomplex subunit 6) 和No. 10 Prkar2b (cAMP-dependent protein kinase type 2-beta regulatory subunit)。2个蛋白鉴定到的所有肽段中最可信的肽段(特异性肽段、无漏切、打分最高) 分别为Ndufa6_FFHETETPRPK和Prkar2b_LQQENER,查看相应肽段的二级谱(图 6),通过报告离子相对信号丰度的比例情况可知,较未治疗组(DM_128C) 而言,知母治疗组(AR_127N) 信号丰度更接近于正常对照(NC_129N)。推测知母通过回调Ndufa6和Prkar2b蛋白的表达水平来缓解糖尿病大鼠体内肝脏脂肪酸代谢异常。
3 讨论 已有报道表明,知母可以通过过氧化物酶4过表达促进胰腺细胞再生并恢复胰岛细胞的功能[20],具有缓解糖尿病的作用。但鉴于肝脏代谢在糖尿病发生发展中的重要性,有必要探究知母能否有效缓解2型糖尿病中的肝脏异常代谢。
本研究基于2型糖尿病大鼠模型的肝脏组织定量蛋白质组数据分析发现,知母提取物能缓解2型糖尿病大鼠模型的肝脏脂肪酸代谢异常。我们进一步发现两簇关键蛋白中的Ndufa6和Prkar2b蛋白的表达水平很可能与知母缓解肝脏脂肪酸异常代谢相关。并且,在糖尿病相关研究中,已有报道Ndufa6蛋白和Prkar2b蛋白在糖尿病发生发展中发挥重要作用。2019年,Zhu等[21]基于2型糖尿病鼠肝脏组织的转录组数据及蛋白质组数据,研究avicularin的降血糖作用,发现氧化磷酸化信号通路涉及的差异蛋白Ndufa6在降血糖中起重要作用。2019年,Kerr等[22]阐明了敲低Prkar2b的siRNA会影响脂质储存和代谢。2020年,Zhu等[23]证明Prkar2b是受microRNA155调控的影响糖尿病患者体内葡萄糖和脂质代谢的靶基因。
全部与脂肪酸代谢相关的10个差异蛋白中,同样已有文献明确报道,Hsd17b2蛋白和Aldh1a1蛋白与糖尿病密切相关,在一定程度上体现出我们获得的糖尿病模型大鼠肝脏定量蛋白质组数据的可信性高。2014年,Giebułtowicz等[24]证明Aldh1a1和GST活性的增加可能与糖尿病疾病严重程度有关。2019年,Ge等[6]通过对糖尿病小鼠和正常小鼠肝脏转录组数据与蛋白质组数据进行差异分析,筛选到包括Aldh1a1蛋白在内的15个核心差异蛋白参与了糖尿病的发生,推断糖尿病的发病机制可能主要与类固醇生物合成、代谢过程和免疫反应相关。2021年,Tao等[25]报道在2型糖尿病以及糖尿病肾病中均有Hsd17b2蛋白的鉴定,并且二者中存在差异表达。
综上所述,我们阐明了在2型糖尿病大鼠模型的肝脏中存在异常脂肪酸代谢,并且知母提取物可能通过回调关键蛋白Ndufa6和Prkar2b的表达水平缓解2型糖尿病模型大鼠肝脏的异常脂肪酸代谢。本研究为进一步深入探寻知母缓解糖尿病患者肝脏异常代谢的分子机制提供了参考依据。但是,由于本研究仅对定量蛋白质组数据进行了初步验证,未进行深入探索,最后聚焦的两个关键蛋白调控肝脏异常代谢的分子机制仍需进一步研究;研究使用的样本均为来源于实验动物,结论是否能应用于临床样本仍需进一步验证。
 2022, Vol. 38
2022, Vol. 38