
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 董新文, 胡名玥, 孟文书, 高友鹤
- DONG Xinwen, HU Mingyue, MENG Wenshu, GAO Youhe
- 甲氨蝶呤对大鼠尿液蛋白质组的影响
- Effect of methotrexate on the urinary proteome of rats
- 生物工程学报, 2022, 38(10): 3914-3924
- Chinese Journal of Biotechnology, 2022, 38(10): 3914-3924
- 10.13345/j.cjb.210598
-
文章历史
- Received: August 6, 2021
- Accepted: January 14, 2022
- Published: January 19, 2022
甲氨蝶呤(methotrexate, MTX) 是常见的免疫抑制剂。最初被大剂量用于治疗肿瘤;近20年来,小剂量甲氨蝶呤作为一种完全不同于大剂量甲氨蝶呤的新疗法,成为抗风湿一线药物。甲氨蝶呤在美国风湿病学会发表的《类风湿性关节炎治疗指南(2015)》中被视为抗风湿的首选药物(可单用或联用其他药物)[1]。甲氨蝶呤成本较低、便于服用、副作用较少,因而在类风湿性关节炎(rheumatoid arthritis, RA) 等自身免疫病的治疗中大面积使用,已经成为治疗类风湿关节炎的基石药物[2]。
但目前为止,甲氨蝶呤的作用机制仍未十分明确,目前公认的机制为以下几种:(1) 甲氨蝶呤与叶酸途径相互作用,干扰DNA的合成,抑制细胞增殖;(2) 影响细胞因子,抑制T细胞和巨噬细胞中TNF-α合成等;(3) 增加Treg细胞从而抑制抗原提呈细胞的功能,降低致炎因子的分泌,维持免疫内环境稳定的功能[1-3]。
尿液是良好的生物标志物来源。相比血液,尿液最显著的特点是没有稳态调节机制,因而在早期(早于病理变化发生) 就能反映机体变化[4]。其次,尿液中的蛋白质可以非常灵敏地反映机体的状态,有利于研究含量较小的成分变化、寻找生物标志物、及时监测疾病[5]。那么,从尿液蛋白质组的变化出发,是否有助于我们研究甲氨蝶呤的作用机制及其用药后对机体的影响呢?
目前暂无利用尿蛋白作为生物标志物研究甲氨蝶呤的作用机理及影响的先例,因此,本研究通过让大鼠口服甲氨蝶呤后检测尿蛋白组变化,来评估甲氨蝶呤对于大鼠尿蛋白组的影响,探究该药物对大鼠机体的影响。
1 材料与方法 1.1 材料甲氨蝶呤片(上海上药信谊药厂有限公司生产)。
1.2 实验动物6–7周龄雄性CD (SD) 大鼠(226–250 g) 5只,购买自北京维通利华实验动物技术有限公司。动物生活在标准养殖环境中(室温(22±1) ℃,湿度65%–70%),喂养过程采用标准实验动物饮食。
1.3 尿蛋白样品制备和LC-MS/MS分析 1.3.1 尿蛋白收集大鼠在实验室预饲养一周。第8天收集一次尿液作为空白对照。甲氨蝶呤片用研钵研磨至粉碎,利用0.9% NaCl溶解制成0.25 mg/mL的悬液。第10天进行一次灌胃,根据人体表面积计算得到的人体等效剂量为1.55 mg/kg[6]。灌胃后10 h收集尿液。
1.3.2 尿蛋白提取在4 ℃以12 000×g将每份尿液样品离心40 min,并取上清于新离心试管。将预冷在−20 ℃的3倍体积的无水乙醇加入试管并过夜沉淀蛋白。4 ℃、12 000×g离心30 min,弃掉上清液,晾干沉淀,获得尿蛋白。加入适量蛋白裂解液(成分含有25 mmol/L二硫苏糖醇,2 mol/L硫脲,8 mol/L尿素及50 mmol/L Tris) 将沉淀溶解[7],反复吹打,并置于涡旋混合器完全混匀。4 ℃、12 000×g离心30 min,将上清(即尿蛋白溶液) 置于新的离心管内。使用Bradford方法测定蛋白质浓度。
1.3.3 尿蛋白膜上酶切和多肽除盐用新配制的UA溶液(8 mol/L尿素,0.1 mol/L Tris-HCl,pH 8.5) 洗涤2次10 kDa滤膜,4 ℃、12 000×g离心5 min,将蛋白加载到10 kDa滤膜上,用UA溶液洗涤2次,再用25 mol/L的NH4HCO3溶液洗涤2次。接下来加入20 mmol/L DTT于滤膜上并37 ℃水浴1 h,加50 mmol/L IAA于室温下避光静置45 min。用胰蛋白酶(酶与蛋白质比为1︰50) 37 ℃过夜消化后离心收集溶有肽段的溶液[8]。溶液通过HLB柱(Waters, Milford, MA) 脱盐,置于真空干燥仪抽干[9]。
1.3.4 LC-MS/MS串联质谱分析向酶切后的肽段中加入0.1%的甲酸酸化,进行质谱分析并收集数据。所用仪器为EASY-nLC 120色谱系统(Thermo Fisher Scientific, USA) 和Orbitrap Fusion Lumos Tribrid质谱仪(Thermo Fisher Scientific, USA)。
1.4 数据分析在Mascot软件中用数据库检索质谱采集得到的数据,利用Scaffold软件(设定参数:多肽FDR 1%,蛋白水平FDR最大1%,每个蛋白包含两个以上特异肽段) 对检索后的文件定量地找出各种蛋白质的数量。
1.5 统计学分析实验组(喂药后) 鉴定到的蛋白与对照组(喂药前) 进行比较(自身对照)。通过双尾非配对t检验P < 0.05,以组间变化倍数≥1.20或≤0.83为条件筛选出差异蛋白。同时要求上调组每个样品的蛋白量都高于对照组最大值,下调组每个样品的蛋白量都低于对照组最小值。
1.6 Gene ontology分析Gene ontology (GO) 数据库用于按照生物学过程、细胞学组分及分子功能对筛选到的差异蛋白归类,整理出显著改变的代谢通路。
2 结果与分析 2.1 动物行为学分析在本研究中,对动物进行了行为学观察和体重测量。从行为学观察来看,灌胃前后动物对食物和水分的摄取均无异常。在包括适应鼠房在内的为期4周的实验过程中,大鼠体重均稳步上升,生长状况正常,具体体重数据可见表 1。
| Time | Rat1 | Rat2 | Rat3 | Rat4 | Rat5 |
| day 8 | 347 g | 323 g | 311 g | 350 g | 325 g |
| day 15 | 381 g | 358 g | 328 g | 398 g | 348 g |
| day 22 | 390 g | 357 g | 325 g | 417 g | 357 g |
| day 29 | 436 g | 391 g | 339 g | 455 g | 394 g |
在甲氨蝶呤灌胃以后,对共10个尿液蛋白样品(包括实验组与对照组) 进行LC-MS/MS串联质谱鉴定。总共鉴定到631个蛋白(特异性多肽≥2个,蛋白水平FDR < 1%),具体数据已提交国家微生物科学数据中心(编号:NMDCX0000141)。10个样品的蛋白质组进行聚类分析得到图 1。甲氨蝶呤灌胃模型中共鉴定到31个差异蛋白,其中21个上调,10个下调,具体数据见表 2。鉴定到的差异蛋白详细信息可见表 3。
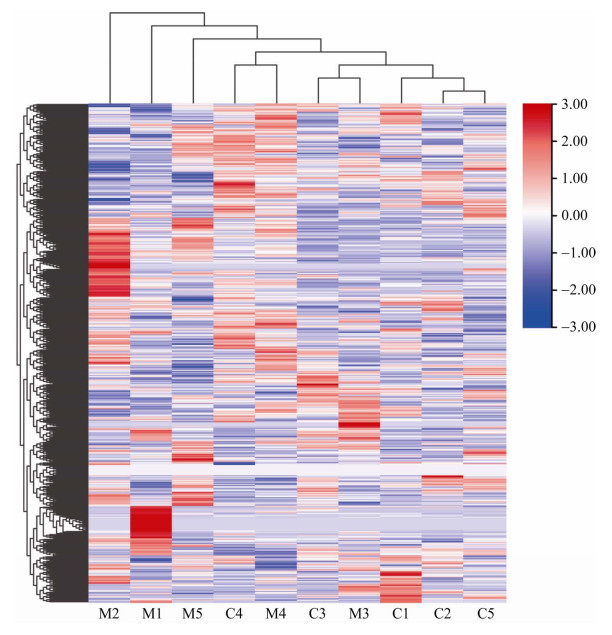
|
| 图 1 LC-MS/MS鉴定的所有蛋白质的聚类分析 Fig. 1 Cluster analysis of all proteins identified by LC-MS/MS. M1–M5: experimental group; C1–C5: control group. |
| |
| Accession number | C1 | C2 | C3 | C4 | C5 | M1 | M2 | M3 | M4 | M5 | Fold change | P-value |
| GSTA4_RAT | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.99 | 4.54 | 0.00 | 1.00 | 3.02 | ∞ | 0.05 |
| AL9A1_RAT | 1.04 | 0.00 | 0.00 | 0.97 | 0.00 | 3.98 | 5.44 | 0.00 | 2.00 | 4.03 | 7.68 | 0.03 |
| SAHH_RAT | 1.04 | 0.00 | 0.00 | 0.97 | 1.07 | 2.98 | 7.26 | 2.86 | 3.00 | 5.03 | 6.85 | 0.00 |
| PRDX2_RAT | 0.00 | 0.00 | 0.98 | 0.00 | 1.07 | 1.99 | 1.81 | 1.90 | 1.00 | 1.01 | 3.76 | 0.01 |
| CNDP1_RAT | 0.00 | 0.00 | 1.96 | 1.94 | 1.07 | 3.98 | 4.54 | 0.95 | 3.00 | 4.03 | 3.32 | 0.02 |
| LIFR_RAT | 2.09 | 1.11 | 1.96 | 1.94 | 1.07 | 5.97 | 6.35 | 0.95 | 7.00 | 6.04 | 3.22 | 0.01 |
| CK054_RAT | 3.13 | 2.21 | 0.98 | 2.90 | 1.07 | 4.97 | 8.17 | 3.81 | 5.00 | 8.05 | 2.91 | 0.00 |
| PGFRA_RAT | 1.04 | 1.11 | 0.00 | 0.97 | 1.07 | 1.99 | 0.91 | 1.90 | 4.00 | 3.02 | 2.82 | 0.03 |
| INHBC_RAT | 2.09 | 1.11 | 0.98 | 0.97 | 0.00 | 2.98 | 1.81 | 1.90 | 4.00 | 3.02 | 2.67 | 0.01 |
| CLIC4_RAT | 3.13 | 2.21 | 1.96 | 3.88 | 2.15 | 2.98 | 9.07 | 3.81 | 6.00 | 12.08 | 2.55 | 0.04 |
| ACTN4_RAT | 2.09 | 1.11 | 1.96 | 1.94 | 1.07 | 3.98 | 7.26 | 1.90 | 3.00 | 4.03 | 2.47 | 0.03 |
| DOPD_RAT | 3.13 | 3.32 | 0.98 | 1.94 | 0.00 | 4.97 | 7.26 | 2.86 | 3.00 | 4.03 | 2.36 | 0.04 |
| DHSO_RAT | 1.04 | 1.10 | 0.98 | 1.94 | 0.00 | 0.99 | 2.72 | 1.90 | 2.00 | 3.02 | 2.10 | 0.04 |
| KHK_RAT | 2.09 | 1.11 | 0.98 | 0.97 | 2.15 | 2.98 | 1.81 | 1.90 | 3.00 | 5.03 | 2.02 | 0.05 |
| SBP1_RAT | 3.13 | 1.11 | 3.91 | 2.91 | 2.15 | 4.97 | 6.35 | 6.66 | 3.00 | 4.03 | 1.89 | 0.02 |
| G6PI_RAT | 2.09 | 2.21 | 0.98 | 2.91 | 2.15 | 2.98 | 5.44 | 1.90 | 4.00 | 5.03 | 1.87 | 0.04 |
| CNDP2_RAT | 5.22 | 4.42 | 3.91 | 8.72 | 8.58 | 8.95 | 18.15 | 6.66 | 11.00 | 12.08 | 1.84 | 0.05 |
| AADAT_RAT | 5.22 | 3.32 | 3.91 | 9.69 | 7.51 | 7.96 | 12.70 | 5.71 | 14.00 | 12.08 | 1.77 | 0.05 |
| PDIA1_RAT | 3.13 | 2.21 | 1.96 | 1.94 | 1.07 | 3.98 | 2.72 | 1.90 | 4.00 | 4.03 | 1.61 | 0.05 |
| ACTC_RAT | 17.74 | 14.38 | 17.61 | 24.23 | 18.23 | 19.90 | 37.20 | 20.00 | 27.00 | 30.19 | 1.46 | 0.05 |
| ACTB_RAT | 30.27 | 25.44 | 23.47 | 32.95 | 24.67 | 31.84 | 49.90 | 27.61 | 38.01 | 46.29 | 1.42 | 0.04 |
| APOE_RAT | 25.05 | 19.91 | 19.56 | 26.17 | 22.53 | 18.90 | 17.24 | 19.04 | 21.00 | 13.08 | 0.79 | 0.03 |
| UP1_RAT | 140.90 | 159.25 | 109.54 | 141.50 | 133.00 | 104.47 | 83.47 | 99.02 | 134.02 | 102.65 | 0.77 | 0.02 |
| QSOX1_RAT | 30.27 | 17.70 | 25.43 | 21.32 | 25.74 | 18.90 | 21.78 | 17.14 | 16.00 | 18.11 | 0.76 | 0.04 |
| PRS7_RAT | 5.22 | 5.53 | 4.89 | 5.82 | 4.29 | 2.98 | 3.63 | 3.81 | 3.00 | 5.03 | 0.72 | 0.01 |
| TFF1_RAT | 11.48 | 12.17 | 7.82 | 10.66 | 9.65 | 7.96 | 4.54 | 8.57 | 9.00 | 4.03 | 0.66 | 0.03 |
| K1C19_RAT | 2.09 | 4.42 | 2.93 | 1.94 | 3.22 | 1.99 | 1.81 | 1.90 | 0.00 | 2.01 | 0.53 | 0.05 |
| TNR1B_RAT | 2.09 | 2.21 | 1.96 | 1.94 | 1.07 | 0.99 | 0.91 | 1.90 | 1.00 | 0.00 | 0.52 | 0.04 |
| RNAS4_RAT | 2.09 | 5.53 | 6.85 | 3.88 | 3.22 | 0.00 | 1.81 | 1.90 | 4.00 | 1.01 | 0.40 | 0.04 |
| Q9QZR8 | 2.09 | 2.21 | 0.98 | 0.97 | 1.07 | 0.99 | 0.91 | 0.95 | 0.00 | 0.00 | 0.39 | 0.04 |
| RENR_RAT | 2.09 | 3.32 | 2.93 | 1.94 | 3.22 | 0.99 | 0.00 | 1.90 | 2.00 | 0.00 | 0.36 | 0.01 |
| M1–M5: experimental group; C1–C5: control group. | ||||||||||||
| Accession | Protein names | Trend | Fold change | P-value |
| GSTA4_RAT | Glutathione S-transferase alpha-4 | ↑ | ∞ | 4.82E-02 |
| AL9A1_RAT | 4-trimethylaminobutyraldehyde dehydrogenase | ↑ | 7.68 | 2.52E-02 |
| SAHH_RAT | Adenosylhomocysteinase | ↑ | 6.85 | 3.79E-03 |
| PRDX2_RAT | Peroxiredoxin-2 | ↑ | 3.76 | 9.71E-03 |
| CNDP1_RAT | Beta-ala-his dipeptidase | ↑ | 3.32 | 1.74E-02 |
| LIFR_RAT | Leukemia inhibitory factor receptor | ↑ | 3.22 | 1.16E-02 |
| CK054_RAT | Ester hydrolase C11orf54 homolog | ↑ | 2.91 | 4.17E-03 |
| PGFRA_RAT | Platelet-derived growth factor receptor alpha | ↑ | 2.82 | 2.78E-02 |
| INHBC_RAT | Inhibin beta C chain | ↑ | 2.67 | 1.12E-02 |
| CLIC4_RAT | Chloride intracellular channel protein 4 | ↑ | 2.55 | 4.42E-02 |
| ACTN4_RAT | Alpha-actinin-4 | ↑ | 2.47 | 3.14E-02 |
| DOPD_RAT | d-dopachrome decarboxylase | ↑ | 2.36 | 3.75E-02 |
| DHSO_RAT | Sorbitol dehydrogenase (SDH) | ↑ | 2.10 | 4.46E-02 |
| KHK_RAT | Ketohexokinase | ↑ | 2.02 | 4.82E-02 |
| SBP1_RAT | Methanethiol oxidase (MTO) | ↑ | 1.89 | 2.26E-02 |
| G6PI_RAT | Glucose-6-phosphate isomerase (GPI) | ↑ | 1.87 | 3.67E-02 |
| CNDP2_RAT | Cytosolic non-specific dipeptidase | ↑ | 1.84 | 4.50E-02 |
| AADAT_RAT | Kynurenine/alpha-aminoadipate aminotransferase, mitochondrial | ↑ | 1.77 | 4.86E-02 |
| PDIA1_RAT | Protein disulfide-isomerase (PDI) | ↑ | 1.61 | 4.87E-02 |
| ACTC_RAT (+1) | Actin, alpha cardiac muscle 1 | ↑ | 1.46 | 4.94E-02 |
| ACTB_RAT (+1) | Actin, cytoplasmic 1 | ↑ | 1.42 | 3.79E-02 |
| APOE_RAT | Apolipoprotein E (Apo-E) | ↓ | 0.79 | 3.45E-02 |
| UP1_RAT | Urinary protein 1 (UP-1) | ↓ | 0.77 | 2.35E-02 |
| QSOX1_RAT | Sulfhydryl oxidase 1 | ↓ | 0.76 | 4.13E-02 |
| PRS7_RAT | 26S proteasome regulatory subunit 7 | ↓ | 0.72 | 1.29E-02 |
| TFF1_RAT | Trefoil factor 1 | ↓ | 0.66 | 2.60E-02 |
| K1C19_RAT | Keratin, type Ⅰ cytoskeletal 19 | ↓ | 0.53 | 4.86E-02 |
| TNR1B_RAT | Tumor necrosis factor receptor superfamily member 1B | ↓ | 0.52 | 3.93E-02 |
| RNAS4_RAT | Ribonuclease 4 | ↓ | 0.40 | 4.35E-02 |
| Q9QZR8 | PDZ domain-containing protein 2 | ↓ | 0.39 | 4.04E-02 |
| RENR_RAT | Renin receptor | ↓ | 0.36 | 1.11E-02 |
在DAVID数据库中,对鉴定的31个差异蛋白进行生物学过程、细胞成分和分子功能3个方面的功能富集分析(表 4,图 2)。这些差异蛋白参与的生物学过程主要包含(图 2A):对固定压力的反应、凋亡过程的调控、锌离子反应、细胞氧化还原稳态、血小板活化的负调控、心脏肌原纤维组装、膜蛋白胞外域蛋白水解的正调控、神经元凋亡过程的负调控以及肽的分解代谢。细胞学成分显示(图 2B),大部分差异蛋白来源于细胞质、细胞外空间及外泌体。分子功能分析的结果为(图 2C),这些差异蛋白可能会有结合NAD、蛋白质同二聚化和金属二肽酶的活性。
| Biological process | P-value | Count | Uniprot ID |
| Response to immobilization stress | 0.002 | 3 | Q6P6V0, Q63467, P60711 |
| Regulation of apoptotic process | 0.003 | 4 | P35704, Q9WUK5, Q9QXQ0, Q80WY6 |
| Response to zinc ion | 0.003 | 3 | P02650, Q02974, P14942 |
| Cell redox homeostasis | 0.005 | 3 | P04785, P35704, Q6IUU3 |
| Negative regulation of platelet activation | 0.011 | 2 | P02650, P20786 |
| Cardiac myofibril assembly | 0.017 | 2 | P68035, P20786 |
| Positive regulation of membrane protein ectodomain proteolysis | 0.024 | 2 | P02650, Q80WY6 |
| Negative regulation of neuron apoptotic process | 0.026 | 3 | P02650, P35704, Q6P6V0 |
| Peptide catabolic process | 0.036 | 2 | Q6Q0N1, Q66HG3 |
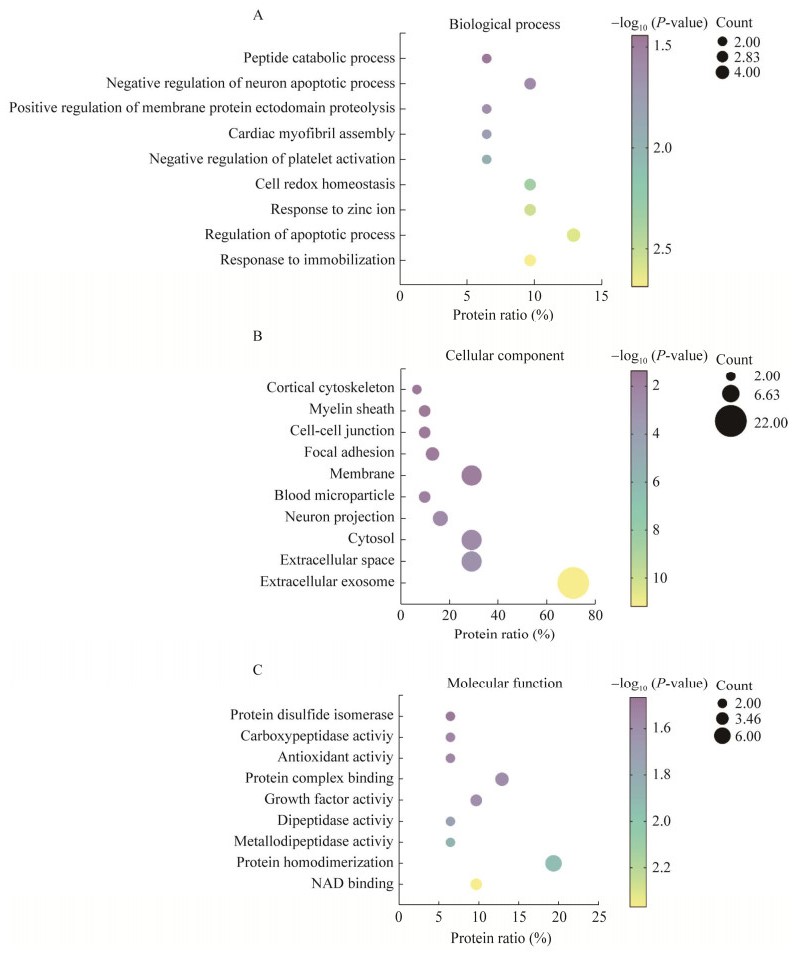
|
| 图 2 口服甲氨蝶呤大鼠模型中差异蛋白的功能注释 Fig. 2 Functional analysis of differential proteins identified from the methotrexate intragastric administration rat model. A:生物学过程;B:细胞成分;C:分子功能 (A) Biological process. (B) Cellular component. (C) Molecular function. |
| |
甲氨蝶呤是用于治疗类风湿性关节炎的基石药物,其对该疾病的治疗作用能在极大程度上体现甲氨蝶呤对免疫系统的影响。与类风湿性关节炎病理相关的差异蛋白可以表明甲氨蝶呤在治疗类风湿性关节炎中的有效性,也可以认为是该药物作用于免疫系统产生的结果。因此我们同时比较了差异蛋白与甲氨蝶呤及类风湿性关节炎的关系来探究尿蛋白组对药物作用的反映情况,发现在鉴定到的差异蛋白中,有7个曾被报道与疾病类风湿性关节炎和药物甲氨蝶呤有关。
首先是4个上调蛋白。过氧化物还原酶(peroxiredoxin-2, Prx-2) 是一种重要的抗氧化酶,类风湿性关节炎患者淋巴细胞内Prx-2蛋白水平增加,且水平与炎症程度相关[10-12]。Prx-2可能有激活炎症细胞的作用。白血病抑制因子受体(leukemia inhibitory factor receptor, LIF-R)其配体——白血病抑制因子是一种炎性细胞因子,被报道存在于类风湿性关节炎患者关节的软骨和滑膜[13]。血小板衍生生长因子受体(platelet- derived growth factor receptorα, PDGFR-α) 磷酸化后变为激活态,其阳性细胞在类风湿性关节炎患者的滑膜中积累[14]。山梨糖醇脱氢酶(sorbitol dehydrogenase, SDH) 的作用曾被报道受到甲氨蝶呤的抑制[15],类风湿性关节炎患者血清中山梨糖醇脱氢酶含量上升[16]。犬尿氨酸/ α-氨基己二酸转氨酶(kynurenine/α-aminoadipate aminotransferase, KAT/AadAT),这两种酶都具有犬尿氨酸转氨酶活性,可以将犬尿氨酸转变为犬尿酸,犬尿氨酸是色氨酸中间代谢产物,在炎症性关节炎和相关疾病中,犬尿氨酸可防止疾病的发展[17-19]。
另外,还有3个下调的蛋白与甲氨蝶呤和类风湿性关节炎相关。载脂蛋白E (apolipoprotein E, Apo-E) 参与免疫反应和炎症的调节,类风湿性关节炎患者的血浆Apo-E水平显著升高[20],其可能以固定形式存在于滑膜中,与局部组织结合或以颗粒物形式存在于滑膜悬浮液中,随后可能导致补体沉积[21]。肿瘤坏死因子受体超家族成员1B (tumor necrosis factor receptor superfamily member 1B, TNF-R2) 也下调,作为一种重要的促炎细胞因子,其在类风湿性关节炎的发生发展中起着关键作用,50%的RA患者血清和滑液中的TNF-α水平升高,曾有研究报道TNF-α和其受体TNF-R1和TNF-R2参与了导致CIA大鼠全身或局部关节病理损伤的过程[22]。第3种为肾素受体(renin receptor),类风湿关节炎患者的滑膜肾素浓度较正常人高,血清肾素浓度较正常人低[23-24]。
需要说明是,尿液蛋白质组中蛋白含量的变化与体内蛋白的含量变化没有相关性。据报道,类风湿性关节炎患者细胞内上述4种蛋白质含量较正常人上调,但大鼠服用治疗类风湿性关节炎药物甲氨蝶呤后,4种蛋白质在尿液中的变化也显示为上调,3种下调蛋白则与类风湿性关节炎患者体内蛋白变化相对应,这是正常的结果。机体内的变化较为复杂,尿液蛋白组变化与机体的关系不是单一的,关于这层关系可以有很多假设,例如某个蛋白在体内的消耗增多或生产减少,则在尿液中体现为下调;而某个蛋白消耗减少或生产增多,在尿液中表现为上调。我们无法建立一个确定的关系。在此基础上,我们只能通过筛选出变化的蛋白来体现机体内的变化,探究受到药物影响的通路,并不能找出其与体内蛋白变化的对应关系。
3.2 单个大鼠差异蛋白的功能注释从研究结果来看,实验组与对照组的蛋白质聚类分析显示实验组的聚类不明显(图 1),我们推测这是因为甲氨蝶呤作为一种调节机体免疫系统的免疫抑制剂,相比于一般药物作用不够明显。且不同个体的免疫系统存在差异,因此使用甲氨蝶呤后不同个体的反应也有所不同。
基于此,我们将5只大鼠用药后与用药前分别进行比较,筛选标准:组间变化倍数FC≤0.5或≥2。1–5号大鼠分别鉴定到206、221、162、135和184个差异蛋白。利用DAVID数据库分别进行差异蛋白功能富集分析,并对5只大鼠差异蛋白的生物学过程作韦恩图(图 3),韦恩图的具体数据已提交国家微生物科学数据中心(编号:NMDCX0000141)。5只大鼠共有8个共同的生物学过程,分别是缺氧反应、神经元凋亡过程的负调控、肌动蛋白细胞骨架重组、氧化还原过程、对糖皮质激素的反应、对有机物的响应、衰老以及对雌二醇的反应。

|
| 图 3 口服甲氨蝶呤大鼠模型中5只大鼠差异蛋白的生物学过程分析韦恩图 Fig. 3 Venn diagram of the biological processes of differential proteins in five rats identified from the methotrexate intragastric administration rat model. |
| |
根据单个大鼠差异蛋白的生物学过程分析及集合结果(图 3、附表2已提交国家微生物科学数据中心(编号:NMDCX0000141)),5只大鼠的免疫系统对药物产生的反应有较大差异:1号大鼠反应较强,有先天免疫反应、细胞对白细胞介素-6的反应、炎症反应的正调控、对细胞因子的反应以及参与炎症反应的白细胞迁移共5个与免疫相关的生物学过程;2号大鼠反应较弱,未显示与免疫相关的生物学过程;3号大鼠特异的免疫相关生物过程包括炎症反应的负调控以及生发中心B细胞分化;4号大鼠特异的免疫相关生物学过程包括γ-干扰素的负调控与细胞对白细胞介素1的反应;5号大鼠特异的免疫相关生物过程包括T细胞增殖的正调控。1号大鼠和5号大鼠的生物学过程还共同包括白细胞介素8分泌的负调控。
1、2、3、5号大鼠的生物学过程均包括谷胱甘肽的代谢过程,这与以往研究中甲氨蝶呤在叶酸途径的相关作用会干扰谷胱甘肽代谢从而导致单核细胞募集改变的报道是相符合的[3]。近些年研究中,甲氨蝶呤在功能筛选中被鉴定为JAK/STAT抑制剂,而JAK/STAT通路在免疫系统调节和炎症细胞因子上游和下游信号传递中发挥重要作用。例如,炎症促进细胞因子γ干扰素、白细胞介素6和白细胞介素10等直接由JAK和JAK相关受体发出信号[25-27]。受此启发,许多针对该通路的治疗类风湿性关节炎药物研发也被开发出来。在我们的结果中,4号大鼠的相关生物学过程中也出现了JAK/STAT级联的负调控,同样反映出了甲氨蝶呤的这一作用。以上结果体现出尿液蛋白质组能很好地反映甲氨蝶呤治疗对机体的影响。因此,在未来的研究中,应关注甲氨蝶呤治疗引起的尿液蛋白质组的变化以及其提供的与药物作用机制相关的更多线索。
在倡导精准医疗的当下,未来研究也需要注意到甲氨蝶呤作为免疫抑制剂的时候可能会使不同患者产生不同的反应,进一步的研究可以从甲氨蝶呤对不同患者作用后产生的不同反应方向展开。对该方向的研究有助于更好地鉴别不同类型的病人并为其提供更好的用药方案。尿液蛋白质标志物可反映不同人群的差异,在未来的研究中可以考虑将尿液蛋白质标志物作为区分的工具。
| [1] |
黄晶, 舒晓明, 王贵, 等. 甲氨蝶呤治疗类风湿关节炎的作用机制. 中华临床医师杂志(电子版), 2016, 10(21): 3276-3280. Huang J, Shu XM, Wang G, et al. Mechanism of methotrexate in treating rheumatoid arthritis. Chin J Clin (Electron Ed), 2016, 10(21): 3276-3280 (in Chinese). DOI:10.3877/cma.j.issn.1674-0785.2016.21.028 |
| [2] |
Chan ESL, Cronstein BN. Methotrexate——how does it really work. Nat Rev Rheumatol, 2010, 6(3): 175-178. DOI:10.1038/nrrheum.2010.5
|
| [3] |
Alqarni AM, Zeidler MP. How does methotrexate work. Biochem Soc Trans, 2020, 48(2): 559-567. DOI:10.1042/BST20190803
|
| [4] |
Gao YH. Urine-an untapped goldmine for biomarker discovery. Sci China Life Sci, 2013, 56(12): 1145-1146. DOI:10.1007/s11427-013-4574-1
|
| [5] |
井健, 高友鹤. 尿液作为新型生物标志物来源的探索. 生物化学与生物物理进展, 2016, 43(11): 1019-1028. Jing J, Gao YH. Urine as a source of novel biomarkers. Prog Biochem Biophys, 2016, 43(11): 1019-1028 (in Chinese). DOI:10.16476/j.pibb.2016.0192 |
| [6] |
Nair AB, Jacob S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm, 2016, 7(2): 27-31. DOI:10.4103/0976-0105.177703
|
| [7] |
Sun W, Li FX, Wu SZ, et al. Human urine proteome analysis by three separation approaches. Proteomics, 2005, 5(18): 4994-5001. DOI:10.1002/pmic.200401334
|
| [8] |
Wiśniewski JR, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis. Nat Methods, 2009, 6(5): 359-362. DOI:10.1038/nmeth.1322
|
| [9] |
An M, Ni Y, Li X, et al. Effects of arginine vasopressin on the urine proteome in rats. PeerJ, 2017, 5: e3350. DOI:10.7717/peerj.3350
|
| [10] |
Szabó-Taylor KÉ, Eggleton P, Turner CAL, et al. Lymphocytes from rheumatoid arthritis patients have elevated levels of intracellular peroxiredoxin 2, and a greater frequency of cells with exofacial peroxiredoxin 2, compared with healthy human lymphocytes. Int J Biochem Cell Biol, 2012, 44(8): 1223-1231. DOI:10.1016/j.biocel.2012.04.016
|
| [11] |
Finnegan S, Robson J, Scaife C, et al. Synovial membrane protein expression differs between juvenile idiopathic arthritis subtypes in early disease. Arthritis Res Ther, 2014, 16(1): R8. DOI:10.1186/ar4434
|
| [12] |
Kim DH, Lee DH, Jo MR, et al. Exacerbation of collagen antibody-induced arthritis in transgenic mice overexpressing peroxiredoxin 6. Arthritis Rheumatol, 2015, 67(11): 3058-3069. DOI:10.1002/art.39284
|
| [13] |
Dechanet J, Taupin JL, Chomarat P, et al. Interleukin-4 but not interleukin-10 inhibits the production of leukemia inhibitory factor by rheumatoid synovium and synoviocytes. Eur J Immunol, 1994, 24(12): 3222-3228. DOI:10.1002/eji.1830241247
|
| [14] |
Matsumura T, Saito Y, Suzuki T, et al. Phosphorylated platelet-derived growth factor receptor-positive cells with anti-apoptotic properties accumulate in the synovium of patients with rheumatoid arthritis. Front Immunol, 2019, 10: 241. DOI:10.3389/fimmu.2019.00241
|
| [15] |
Alım Z, Beydemir Ş. Effects of some anti-neoplastic drugs on sheep liver sorbitol dehydrogenase. Arch Physiol Biochem, 2012, 118(5): 244-252. DOI:10.3109/13813455.2012.688055
|
| [16] |
Dimov D, Popov B. Changes in blood-serum enzymes in rheumatic myocarditis. Cor Vasa, 1976, 18(4): 319-322.
|
| [17] |
Buchli R, Alberati-Giani D, Malherbe P, et al. Cloning and functional expression of a soluble form of kynurenine/alpha-aminoadipate aminotransferase from rat kidney. J Biol Chem, 1995, 270(49): 29330-29335. DOI:10.1074/jbc.270.49.29330
|
| [18] |
Badawy AA. Kynurenine pathway of tryptophan metabolism: regulatory and functional aspects. Int J Tryptophan Res, 2017, 10: 1178646917691938.
|
| [19] |
Ogbechi J, Clanchy FI, Huang YS, et al. IDO activation, inflammation and musculoskeletal disease. Exp Gerontol, 2020, 131: 110820. DOI:10.1016/j.exger.2019.110820
|
| [20] |
Chen YM, Chen PK, Chang CK, et al. Association of apolipoprotein E polymorphism with adipokines and cardiovascular disease risk in rheumatoid arthritis patients. Life, 2020, 10(12): 330. DOI:10.3390/life10120330
|
| [21] |
Vogt LM, Kwasniewicz E, Talens S, et al. Apolipoprotein E triggers complement activation in joint synovial fluid of rheumatoid arthritis patients by binding C1q. J Immunol, 2020, 204(10): 2779-2790. DOI:10.4049/jimmunol.1900372
|
| [22] |
Chen HQ, Yu B, Lu CH, et al. The effect of intra-articular injection of different concentrations of ozone on the level of TNF-α, TNF-R1, and TNF-R2 in rats with rheumatoid arthritis. Rheumatol Int, 2013, 33(5): 1223-1227. DOI:10.1007/s00296-012-2529-7
|
| [23] |
Wu YG, Li MY, Zeng J, et al. Differential expression of renin-angiotensin system-related components in patients with rheumatoid arthritis and osteoarthritis. Am J Med Sci, 2020, 359(1): 17-26. DOI:10.1016/j.amjms.2019.10.014
|
| [24] |
Guy A, Sharif K, Bragazzi NL, et al. Low levels of renin and high aldosterone-to-renin ratio among rheumatoid patients and ankylosing spondylitis patients: a prospective study. Isr Med Assoc J, 2018, 20(10): 632-636.
|
| [25] |
Loyola AC, Zhang L, Shang R, et al. Identification of methotrexate as a heterochromatin-promoting drug. Sci Rep, 2019, 9(1): 11673. DOI:10.1038/s41598-019-48137-w
|
| [26] |
Cronstein BN, Aune TM. Methotrexate and its mechanisms of action in inflammatory arthritis. Nat Rev Rheumatol, 2020, 16(3): 145-154. DOI:10.1038/s41584-020-0373-9
|
| [27] |
Owen KL, Brockwell NK, Parker BS. JAK-STAT signaling: a double-edged sword of immune regulation and cancer progression. Cancers, 2019, 11(12): 2002. DOI:10.3390/cancers11122002
|
 2022, Vol. 38
2022, Vol. 38




