
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张译元, 郭延华, 唐红, 王新华, 王立民, 周平
- ZHANG Yiyuan, GUO Yanhua, TANG Hong, WANG Xinhua, WANG Limin, ZHOU Ping
- 蛋白质组学技术对不同性别中国美利奴细毛羊(军垦型) 皮肤差异蛋白的筛选
- Proteomics-based screening of differentially expressed proteins in skin of Chinese merino fine sheep (JunKen type) of different gender
- 生物工程学报, 2022, 38(10): 3925-3939
- Chinese Journal of Biotechnology, 2022, 38(10): 3925-3939
- 10.13345/j.cjb.220321
-
文章历史
- Received: April 20, 2022
- Accepted: August 1, 2022
羊毛是一种重要的天然纤维材料,羊毛的品质直接决定了纺织品的品质和价格。影响羊毛品质特性的因素除了品种、年龄、部位、环境、营养等条件外,性别也是影响羊毛品质的又一重要因素。关鸣轩等[1]研究显示,性别对新吉细毛羊的主要经济性状存在显著影响,尤其在密度和弯曲度特性上公羊羊毛的质量优于母羊。在阿勒泰羊的研究中,公羊的底绒长度整体也优于母羊[2]。张小伟等[3]对多胎细毛羊主要经济性状的非遗传因素进行分析指出,公羊毛长、毛密度、细度、匀度、剪毛后体重、剪毛量均极显著大于母羊。陶卫东等[4]、王鹏宇等[5]研究均证实,性别对产毛量、毛长度、毛细度影响显著。但另有研究表明,性别只对内蒙古白绒山羊的抓绒量、抓绒后体重、毛长度影响极显著,对其细度影响却不显著。乔国艳等[6]研究也显示,性别仅对体重有极显著影响,对产毛量、毛长、毛纤维直径等性状影响不显著。本课题组实验前期对周岁中国美利奴羊公羊与母羊毛产量、毛细度进行了跟踪检测,结果显示,公羊毛产量与毛细度均优于母羊。综上所述,性别是影响绵羊毛产量和毛品质的重要因素之一,但其机理尚未明确。因此,解析性别影响羊毛性状的分子机制并阐明其对羊毛生长、发育的机理具有重要意义。
近年来,随着蛋白质组学技术和生物信息学技术飞速发展、数据非依赖性采集(data- independent acquisition, DIA) 技术的出现,为全新的定量蛋白质组学开辟了新的领域,大大提升了实验准确性。目前,该技术已被广泛应用于斑马鱼、小鼠、大鼠、人类体液和组织等研究[7-9]。有关绵羊毛品质方面的蛋白组学研究国内外已有相关报道。Plowman等[10]通过比较来自葡萄牙3种不同遗传类型绵羊群体羊毛的蛋白组和微观特征,发现3个品种之间角蛋白相关蛋白和角蛋白kRT75、kRT78存在显著差异,推测其是决定羊毛蛋白质组品质性状的主效因子。Zhao等[11]通过蛋白组学技术研究了中国敖汉细毛羊与小尾寒羊体侧皮肤毛囊的蛋白表达模式,筛选获得了数种差异表达蛋白,为更好地了解调节羊毛直径的分子机制并确定生产细羊毛提供新策略。截至目前,有关性别影响羊毛产量与毛品质的蛋白组学研究鲜有报道。基于此,本研究在前期获得不同性别中国美利奴羊(军垦型) 毛产量、毛细度表型数据基础上,利用DIA技术筛选挖掘不同性别绵羊皮肤组织差异表达蛋白,为探索羊毛生长、发育的分子机理及进一步细毛羊分子辅助育种积累基础数据。
1 材料与方法 1.1 样品选取新疆农垦科学院种羊场处于相同饲喂条件下的健康周岁中国美利奴羊(军垦型) 公羊和母羊各3只,在其肩胛骨后缘10 cm处采集1 cm2皮肤组织样品,用生理盐水冲洗干净后,迅速投入液氮保存。蛋白质组学DIA检测委托上海吉凯基因科技有限公司完成。
1.2 主要试剂及仪器SDT裂解液(2% SDS, 100 mmol/L二硫苏糖醇(dithiothreitol, DTT), 100 mmol/L Tris-HCl, pH 7.6);匀浆仪,MP公司;EasynLC液相色谱仪、Acclaim PepMap RSLC C18色谱柱(P/N164943)、Oribitrap Fusion Lumos质谱仪、真空浓缩仪,Thermo Fisher Scientific公司。
1.3 实验方法 1.3.1 样品制备将皮肤组织剪碎,加入适量的SDT裂解液,转移至Lysing Matrix A管中匀浆破碎(6.0 m/s, 60 s, 2次) 后,再进行超声破碎(功率15%,超声1 s暂停1 s,1 min 1个循环,共2个循环) 后,于沸水中煮10 min,之后用14 000×g离心15 min,分离上清,用0.22 µm滤膜过滤上清,收集滤液。最后采用二辛可宁酸(bicinchonininc acid, BCA) 法定量蛋白质,并分装于–80 ℃保存备用。
1.3.2 SDS-PAGE电泳取样品蛋白质各20 µg,加入6×上样缓冲液,充分混匀后沸水中煮5 min,离心取上清进行12.0% SDS-PAGE电泳(恒压250 V,40 min),0.25%考马斯亮蓝染色。
1.3.3 FASP (filter-aided sample preparation) 酶解将每个样品的蛋白质溶液各取200 µg,加入DTT至终浓度为100 mmol/L,沸水浴5 min,冷却至室温。加入200 µL尿素(UA buffer) 混匀,转入30 kDa超滤离心管中,12 500×g离心25 min,弃滤液(重复该步骤两次)。加入100 µL碘乙酰胺溶液(100 mmol/L iodoacetamide (IAA) in UA buffer),600 r/min振荡1 min,室温避光反应30 min,12 500×g离心25 min。加入100 µL UA buffer,离心15 min,重复该步骤两次。加入100 µL 0.1 mol/L三乙胺-碳酸缓冲液(triethylammonium bicarbonate buffer, TEAB buffer),12 500×g离心15 min,重复该步骤两次。加入40 µL胰蛋白酶(4 µg trypsin in 40 µL 0.1 mol/L TEAB buffer),600 r/min振荡1 min,37 ℃放置16–18 h。换新收集管,12 500×g离心15 min;再加入20 µL 0.1 mol/L TEAB缓冲液,12 500×g离心15 min收集酶解后产生的多肽混合物。采用C18 Cartridge进行脱盐,并冻干后加入40 µL 0.1%甲酸溶液进行复溶和肽段定量。
1.3.4 DDA谱图库建立取所有样品的肽段混合物通过高pH反相色谱柱分离成48个组分。采用EasynLC液相系统和Oribitrap Fusion Lumos质谱系统,色谱柱为Acclaim PepMap RSLC C18色谱柱(0.05 mm×150 mm, 5 µm, 100 Å, nano viper),流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸和80%乙腈水溶液。样品以300 nL/min的流速经非线性梯度分离:0–5 min,1% B;5–95 min,1%–28% B;95–110 min,28%–38% B;110–115 min,38%–100% B;115–120 min,100% B。喷雾电压2.0 kV。
质谱参数设置如下:(1) MS: scan range (m/z)=350–1 500;resolution=60 000;AGC target=3e6;maximum injection time=30 ms;include charge states=2–7;filter dynamic exclusion:exclusion duration=30 s;(2) dd-MS2: isolation window=1.6 m/z,resolution=15 000;AGC target=1e5;maximum injection time= 45 ms;NCE=28%。将质谱产生的原始数据通过Spectronaut Pulsar X (version 12, Biognosys AG) 进行分析,生成谱图库(Uniprot OvisAries (Sheep)_28046_20191117)。
1.3.5 DIA质谱分析各样品取出6 µL加入1 µL 10×iRT肽段,混合后进样6 µL,整个液质系统及方法同DDA谱图库的建立。表 1设置了42个隔离窗口,DIA质谱具体参数设置如下:(1) MS:scan range (m/z)=350–1 500;resolution=60 000;AGC target=3e6; maximum injection time=50 ms;(2) DIA:resolution=15 000;AGC target=2e5;maximum injection time=45 ms;NCE=28%。
| DIA window | Start (m/z) | End (m/z) | Width |
| 1 | 350 | 405 | 55 |
| 2 | 405 | 429 | 24 |
| 3 | 429 | 453 | 24 |
| 4 | 453 | 466 | 13 |
| 5 | 466 | 479 | 13 |
| 6 | 479 | 492 | 13 |
| 7 | 492 | 505 | 13 |
| 8 | 505 | 518 | 13 |
| 9 | 518 | 531 | 13 |
| 10 | 531 | 544 | 13 |
| 11 | 544 | 557 | 13 |
| 12 | 557 | 570 | 13 |
| 13 | 570 | 583 | 13 |
| 14 | 583 | 596 | 13 |
| 15 | 596 | 609 | 13 |
| 16 | 609 | 622 | 13 |
| 17 | 622 | 635 | 13 |
| 18 | 635 | 648 | 13 |
| 19 | 648 | 661 | 13 |
| 20 | 661 | 674 | 13 |
| 21 | 674 | 687 | 13 |
| 22 | 687 | 700 | 13 |
| 23 | 700 | 713 | 13 |
| 24 | 713 | 726 | 13 |
| 25 | 726 | 739 | 13 |
| 26 | 739 | 752 | 13 |
| 27 | 752 | 765 | 13 |
| 28 | 765 | 778 | 13 |
| 29 | 778 | 796 | 18 |
| 30 | 796 | 814 | 18 |
| 31 | 814 | 832 | 18 |
| 32 | 832 | 855 | 23 |
| 33 | 855 | 878 | 23 |
| 34 | 878 | 901 | 23 |
| 35 | 901 | 924 | 23 |
| 36 | 924 | 947 | 23 |
| 37 | 947 | 981 | 34 |
| 38 | 981 | 1 015 | 34 |
| 39 | 1 015 | 1 063 | 48 |
| 40 | 1 063 | 1 111 | 48 |
| 41 | 1 111 | 1 189 | 78 |
| 42 | 1 189 | 1 500 | 311 |
采用Spectronaut Pulsar X软件(Version 12.0.20491.8.29697) 默认参数(BGS Factory Settings) 对DIA数据进行分析,所有蛋白和多肽定性分析在Q value为0.01的水平下进行(相当于FDR为1.0%),在二级质谱(MS2) 水平下通过峰面积进行定量分析,得到定量数据后,进行归一化处理,将每个样本的碎片离子峰面积除以该次试验的总离子流图(total ion chromatogram, TIC) 以消除不同试验间肽段信号间系统误差的影响。将同一肽段的离子峰面积加和到肽段水平,对肽段信息进行双尾t-test,筛选具有显著差异的肽段(P < 0.05),归到蛋白水平,将蛋白质表达差异倍数 > 1.5倍且P < 0.05 (t-test) 作为差异表达蛋白质。
1.3.7 生物信息学分析得到差异蛋白后,利用BLAST2GO对目标蛋白质进行GO注释,并利用ProScan搜索欧洲生物信息研究所(European bioinformatics institute, EBI) 数据库中与目标蛋白质匹配的保守基序,将其相关的功能信息注释给目标蛋白质序列;运行ANNEX对注释信息进一步补充,并在不同的GO类别之间建立联系,以提高注释的准确性。对目标蛋白质集合进行KEGG通路注释时,利用KAAS (KEGG automatic annotation server) 软件,通过比对KEGG数据库,将目标蛋白质序列进行KEGG归类,并根据归类自动获取其参与的通路信息。
2 结果与分析 2.1 实验动物的羊毛表型特征本研究中,选取相同饲喂条件下的健康周岁中国美利奴羊(军垦型) 公羊和母羊各3只为实验对象,针对产毛量、毛长度和毛细度做了数据测量和统计学分析(表 2)。在产毛量和毛长度方面,公羊与母羊差异不显著(P > 0.05);毛细度方面,公羊较母羊有极显著优势(P < 0.01)。
| Samples | The average of wool yield (kg) | The average of wool length (cm) | The average of fineness (µm) |
| Rams | 5.38±1.70 | 9.92±1.11 | 15.05**±0.64 |
| Ewes | 4.81±0.34 | 9.25±0.86 | 16.86**±0.89 |
| **: extremely significant difference (P < 0.01). | |||
BCA蛋白质定量法对细毛羊公羊、母羊皮肤组织蛋白定量,其样品上样量为20 µL,经SDS-PAGE分离后,电泳条带清晰且样本间平行性较好(图 1)。
|
| 图 1 不同性别羊皮肤样品总蛋白的SDS-PAGE电泳图 Fig. 1 SDS-PAGE electrophoresis of total proteins in sheep skin samples of different gender. M:分子量标准蛋白;A:公羊组皮肤组织蛋白;B:母羊组皮肤组织蛋白 M: protein marker; A: skin tissue proteins of male group; B: skin tissue proteins of female group. |
| |
检测的2组样品,在“1% FDR”的过滤标准下,公羊组总共有17 629条肽段和2 878个蛋白得到鉴定,母羊组总共有16 957条肽段和2 853个蛋白得到鉴定。2种性别羊皮肤组织中含量差异的蛋白质(P < 0.05且差异倍数 > 1.5倍) 共674个。公羊皮肤组织表达上调的蛋白质数量为280个,表达下调的蛋白质数量为394个(表 3)。与羊毛生长发育相关的上调差异蛋白有30个,下调差异蛋白有13个(表 4)。将674个差异蛋白进行层次聚类分析,左侧3列表示公羊组3个皮肤组织蛋白,右侧3列表示母羊组3个皮肤组织蛋白,图中颜色表示表达量值,上调的蛋白质为红色,下调的蛋白质为绿色,公羊组和母羊组组内3个样本蛋白表达的趋势基本一致,并且样本重复性较好(图 2)。
| Samples | Total number of peptides |
Total number of proteins |
Total number of differential proteins |
Total number of up-regulated proteins |
Total number of down- regulated proteins |
| Raws | 17 629 | 2 878 | 674 | 280 | 394 |
| Ewes | 16 957 | 2 853 | |||
| Significant differences of expression proteins were analyzed (P < 0.05), and fold change > 1.5. | |||||
| No. | Accession | Name or annotation | Fold change | P value |
| 1 | W5Q5U5 | KRT4 | +4.75 | 1.841 6E-04 |
| 2 | W5P9D4 | PRR9 | +3.95 | 4.043 8E-03 |
| 3 | C8BKD5 | SPARC | +3.56 | 4.808 0E-04 |
| 4 | W5Q9H1 | ZYX | +3.01 | 8.391 4E-03 |
| 5 | W5P8A4 | FA2H | +2.56 | 1.128 4E-04 |
| 6 | W5QH53 | FMO5 | +2.43 | 1.282 9E-04 |
| 7 | W5P316 | NAMPT | +2.34 | 1.444 2E-04 |
| 8 | W5P7G4 | TNC | +2.29 | 1.656 4E-03 |
| 9 | W5P481 | COL1A1 | +2.24 | 1.003 1E-04 |
| 10 | W5Q517 | PCOLCE | +2.16 | 7.376 3E-05 |
| 11 | W5PGS4 | FABP5 | +2.14 | 9.958 3E-05 |
| 12 | F5AY94 | KAP11-1 | +2.02 | 3.513 5E-04 |
| 13 | W5PWD8 | SOX9 | +1.96 | 2.150 7E-04 |
| 14 | A6ZE98 | ABHD5 | +1.96 | 6.762 0E-06 |
| 15 | W5Q611 | KRT1 | +1.94 | 5.332 2E-08 |
| 16 | W5PH35 | CYP1B1 | +1.93 | 8.494 4E-03 |
| 17 | W5Q5S8 | KRT79 | +1.88 | 5.703 7E-06 |
| 18 | W5PGA9 | NCSTN | +1.78 | 3.150 3E-02 |
| 19 | C8BKE4 | MMP2 | +1.77 | 1.082 4E-02 |
| 20 | W5QGS4 | PHGDH | +1.70 | 1.361 2E-05 |
| 21 | W5PST4 | COL18A1 | +1.70 | 2.082 2E-04 |
| 22 | W5NWF6 | SFRP1 | +1.67 | 2.311 3E-03 |
| 23 | W5PHP8 | LRG1 | +1.64 | 1.546 0E-03 |
| 24 | W5QI38 | GPRC5D | +1.63 | 7.486 2E-04 |
| 25 | W5P6V2 | COL17A1 | +1.62 | 7.038 0E-03 |
| 26 | U3MXA9 | KRT17 | +1.62 | 1.921 4E-03 |
| 27 | W5PMH8 | SPTLC3 | +1.56 | 3.538 9E-02 |
| 28 | W5QFP0 | THBS1 | +1.56 | 3.919 2E-06 |
| 29 | W5PU19 | LSS | +1.56 | 3.284 2E-04 |
| 30 | W5PRQ8 | HSD17B14 | +1.52 | 1.999 4E-04 |
| 31 | W5PSZ2 | NFIC | –0.66 | 8.510 9E-03 |
| 32 | W5Q6H2 | KRT82 | –0.65 | 7.478 7E-04 |
| 33 | W5Q731 | ILK | –0.63 | 3.455 0E-03 |
| 34 | W5QAK7 | SCARB1 | –0.61 | 4.764 6E-03 |
| 35 | W5P3B5 | YWHAZ | –0.56 | 3.196 8E-05 |
| 36 | O02849 | PADI3 | –0.56 | 6.236 9E-06 |
| 37 | W5PB37 | RRAS | –0.48 | 1.984 1E-02 |
| 38 | W5P6X5 | STMN1 | –0.47 | 9.441 3E-06 |
| 39 | W5NR84 | S100A3 | –0.44 | 1.841 7E-03 |
| 40 | W5QDM1 | HDAC7 | –0.42 | 4.644 4E-03 |
| 41 | W5QGJ0 | CHP1 | –0.41 | 2.394 0E-03 |
| 42 | W5PSZ5 | ANXA1 | –0.40 | 1.006 2E-06 |
| 43 | A2SW69 | ANXA2 | –0.28 | 3.238 0E-06 |
| Accession No. are from UniProt database (https://www.uniprot.org/uploadlists/); +: up-regulated expression; –: down- regulated expression. | ||||
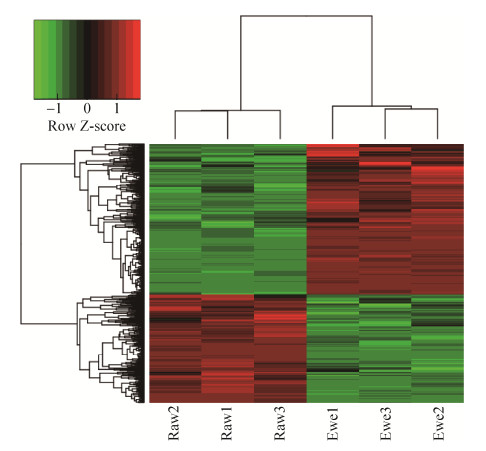
|
| 图 2 差异蛋白质层次聚类分析 Fig. 2 Cluster analysis of differentially expressed proteins. |
| |
通过Fisher精确检验(Fisher’s exact text) 对674个差异蛋白从生物学过程、分子功能和细胞组分3个方面进行功能富集分析。GO分析表明,参与生物过程的蛋白分别涉及细胞过程(17.27%)、生物调节(14.62%)、代谢过程(11.36%) 和对刺激的反应(9.87%) 等(图 3),这些差异蛋白在细胞氧化解毒作用、肌肉收缩调节、Notch信号通路、钙离子跨膜转运、谷胱甘肽新陈代谢等120个过程显著富集(图 4A);参与分子功能的蛋白分别涉及结合(50.70%)、催化活性(23.10%)、分子功能调节(7.53%) 和结构分子活性(6.88%) 等(图 3),这些差异蛋白在氧结合、硫酸软骨素结合、亚铁血红素结合、谷胱甘肽过氧化物酶活性和转运活性等37个过程显著富集(图 4B);细胞组分分别涉及细胞部分(21.55%)、细胞器部分(16.96%)、蛋白复合物(12.69%) 和细胞器(12.62%) 等(图 3),这些差异蛋白在肥大细胞颗粒、细胞核、肌质网状组织和内质网腔等31个过程显著富集(图 4C)。
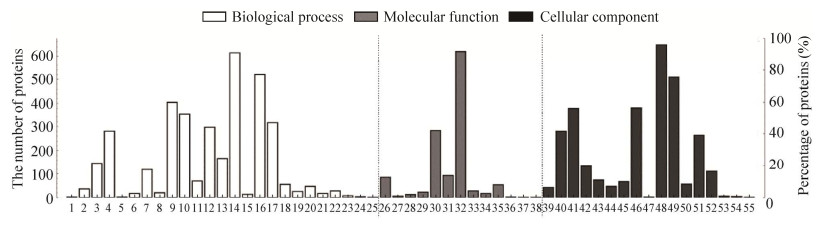
|
| 图 3 差异表达蛋白的GO功能注释二级分类统计图 Fig. 3 GO classification level 2 of differentially expressed proteins. 1: pigmentation; 2: cell population proliferation; 3: immune system process; 4: developmental process; 5: carbon utilization; 6: rhythmic process; 7: multi-organism process; 8: growth; 9: metabolic process; 10: response to stimulus; 11: reproductive process; 12: localization; 13: multicellular organismal process; 14: cellular process; 15: cell killing; 16: biological regulation; 17: cellular component organization or biogenesis; 18: locomotion; 19: detoxification; 20: biological adhesion; 21: signaling; 22: behavior; 23: biomineralization; 24: cell aggregation; 25: nitrogen utilization; 26: structural molecule activity; 27: cargo receptor activity; 28: translation regulator activity; 29: antioxidant activity; 30: catalytic activity; 31: molecular function regulator; 32: binding; 33: transcription regulator activity; 34: molecular transducer activity; 35: transporter activity; 36: molecular carrier activity; 37: cargo adaptor activity; 38: small molecular sensor activity; 39: extracellular region; 40: membrane; 41: organelle; 42: extracellular region part; 43: synapse part; 44: synapse; 45: cell junction; 46: protein-containing complex; 47: virion; 48: cell part; 49: organelle part; 50: supramolecular complex; 51: membrane part; 52: membrane-enclosed lumen; 53: host cellular component; 54: nucleoid; 55: other organism part. |
| |
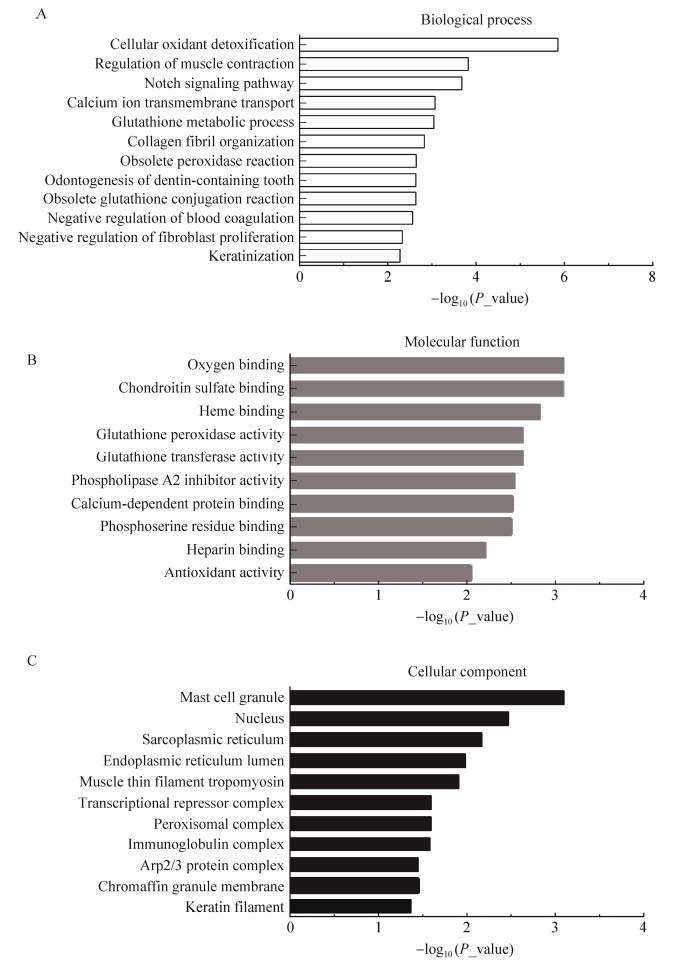
|
| 图 4 差异表达蛋白质的GO功能注释 Fig. 4 GO functional analysis of differential proteins. A:生物学过程;B:分子功能;C:细胞组分 (A) Biological process. (B) Molecular function. (C) Cellular component. |
| |
差异表达蛋白KEGG富集分析结果显示,共富集16条KEGG信号通路,经过筛选发现MAPK信号通路、P53信号通路可能和羊毛生长发育存在相关性。结果还显示了差异蛋白参与了化学致癌作用、细胞色素P450介导外源性物质代谢、铂耐药性和脂肪消化吸收等信号通路(图 5)。
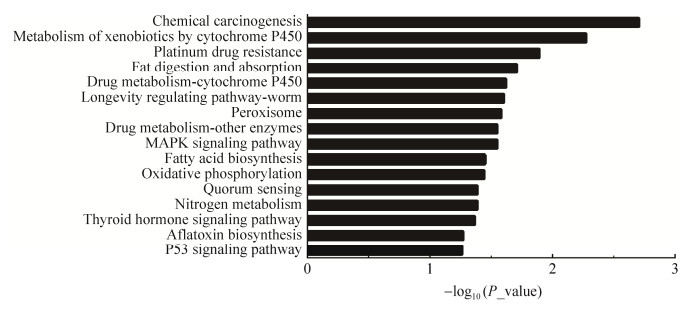
|
| 图 5 差异表达蛋白质KEGG富集分析 Fig. 5 KEGG enrichment analysis of differentially expressed proteins. |
| |
蛋白质与蛋白质之间的相互作用构成了细胞生化反应网络的一个主要组成部分,对调控细胞及其信号有重要意义。通过NCBI数据库查找差异蛋白中与毛发生长发育、毛发表型相关的蛋白,最终选取43个差异蛋白利用STRING数据库绘制蛋白质互作网络图(图 6)。
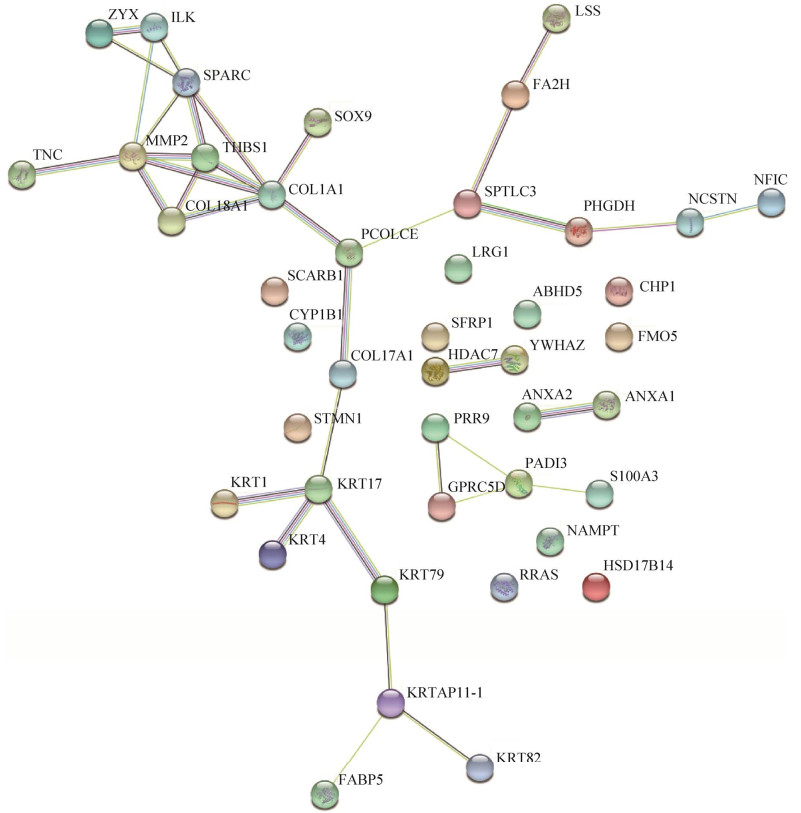
|
| 图 6 差异表达蛋白质互作网络图 Fig. 6 Interaction network of differentially expressed proteins. |
| |
在蛋白质互作网络中,节点表示单个蛋白,线表示它们之间的关系。两个蛋白之间,线条数目越多,表示联系越紧密。结果表明,相互关联的中心是以PCOLCE蛋白为核心,分别与COL1A1、COL17A1和SPTLC3蛋白进行互作,形成的3个分支,推测可能参与3种信号通路。除了PCOLCE、COL1A1节点外,MMP2、SPARC、THBS1等蛋白也为主要枢纽蛋白。提示这些蛋白质可能与羊毛生长发育存在紧密联系。
3 讨论羊毛的品质特性与品种、性别、年龄、季节和营养状况等多种因素有关。为探索性别因素对中国美利奴细毛羊羊毛经济性状的影响,本研究应用基于DIA的定量蛋白质组学分析技术,比较在羊毛生长发育过程中公羊与母羊皮肤组织蛋白组分差异表达,结果表明,获得的公羊和母羊蛋白质组种类数量相近,但由于公羊与母羊不同的生理状态,这些蛋白质的表达量也存在差异,共鉴定出674个差异表达蛋白质,其中280个上调表达,394个下调表达。与羊毛生长发育相关的上调差异蛋白有30个,下调差异蛋白有13个。其中羊毛主要结构蛋白—角蛋白中间丝(keratin intermediate filament, KIF) 和角蛋白关联蛋白(keratin-associated protein, KAP) 的出现频率较高,比如在公羊皮肤组织中筛选到上调表达的蛋白有KRT1、KRT79、KRT17、KRT4和KAP11-1,在母羊皮肤中筛选到上调表达的蛋白则只有KRT82。
角蛋白是羊毛纤维的主要成分蛋白,也是毛囊重要的结构蛋白。Mardaryev等[12]研究表明,miR-31能够靶向作用于KRT16、KRT17、同源异型框转录因子3 (distal-less homeobox 3, DLX3) 和成纤维细胞生长因子10蛋白(fibroblast growth factor-10, FGF10) 在毛发生长周期的早期和中期可促进毛发生长期的发育,改变毛发基质角质形成细胞的分化和毛干的形成。KRT4蛋白属于Ⅱ型角蛋白,在内根鞘中表达,其与胸腺素β4 (thymosin β4, Tβ4) 相互作用来介导细胞外信号调节蛋白激酶(extracellular signal-regulated kinase, ERK) 信号通路,从而促进次级毛囊的发育,进而提高羊绒产量和羊毛生长[13]。KRT79和KRT82也属于Ⅱ型角蛋白,KRT79在早期毛芽中表达[14],而KRT82仅在纤维角质层中表达[15]。KRT家族基因在绵羊皮肤不同结构中表达,从而改变羊毛的纤维结构[16]。由此可见,KRT基因家族成员对羊毛结构发挥重要作用。
KAP是毛纤维基质的重要组成部分。Jin等[17]研究结果显示,KAP11-1基因在辽宁山羊初级毛囊退行期的表达量显著高于生长期,而在次级毛囊中结果恰好相反;其次,该基因在毛囊内根鞘、毛发基质中表达较高,在毛球中表达较低;Liang等[18]研究发现KAP11-1的mRNA表达水平在毛囊退行期和静止期先增加后降低,过表达KAP11-1后,WNT2、KRT17、骨形态发生蛋白-2 (bone morphogenetic protein-2, BMP-2)和转化生长因子β1 (transforming growth factor-β-1, TGF-β-1) 基因的mRNA表达水平均增加。初步认为,KAP11-1基因可能是以级联调控方式参与调节毛囊的生长发育。
另外,本研究还筛选出其他一些与毛发生长密切相关的重要基因,诸如富含脯氨酸蛋白质9 (pseudo-response regulator 9, PRR9)、脂肪酸2-羟化酶(fatty acid 2-hydroxylase, FA2H)、上皮型脂肪酸结合蛋白5 (fatty acid-binding protein 5, FABP5) 和α1-Ⅰ型胶原蛋白(collagen, type Ⅰ, alpha 1, COL1A1) 等。PRR9作为负责交联的谷氨酰胺的底物,与毛囊皮肤发育过程中结构蛋白生物合成有关[19];FA2H在羊绒皮肤的端粒中高度表达,可用于提高羊绒产量[20];FABP5是皮脂腺和生长期毛囊球的标志基因[21]。COL1A1和COL1A2是羊绒再生的必需基因,与毛囊周期发育密切相关[20]。这些基因是否与性别因素存在相关性,目前尚不清楚。
前胶原C端蛋白酶增强子(procollagen C-endopeptidase enhancer, PCOLCE) 蛋白是差异表达倍数前10的上调蛋白,在皮肤真皮乳头细胞中高度表达,并且在BMP信号通路中作为BMP1的激活剂发挥作用[22]。表达量上调的差异蛋白中,基质金属蛋白酶2 (matrix metallopeptidase 2, MMP2)、分泌型卷曲相关蛋白1 (secreted frizzled-related protein 1, SFRP1) 会阻断毛囊周期,MMP2表达增加会降低毛发再生率,毛囊数量和毛囊长度[23],SFRP1蛋白通过与FGF10蛋白竞争性调节β-catenin信号调节毛囊发育[24]。G蛋白偶联受体C5家族亚型D (G protein-coupled receptor, family C, group 5, member D, GPRC5D)[25]、α1-ⅩⅤⅡ胶原蛋白(collagen, type ⅩⅤⅡ, alpha 1, COL17A1)[26]对毛囊发育和毛干分化起重要作用。有文献记载,血小板反应蛋白1 (thrombospondin 1, THBS1) 在毛发退行期诱导毛囊退化起关键作用[27]。Won等[28]研究证实其作用并选择THBS1、整合素β1 (integrins β1, ITGB1) 和胰岛素样生长因子结合蛋白3 (insulin-like growth factor binding protein 3, IGFBP3) 作为调节毛发生长的生物标志物。Li等[22]利用全基因组亚硫酸氢盐测序法研究了绒山羊羊毛生长期和退行期皮肤组织间的全基因组DNA甲基化谱,通过整合DNA甲基化和mRNA表达数据,揭示了丝氨酸棕榈酰转移酶长链碱性亚基3 (serine palmitoyl transferase, long chain based subunit 3, SPTLC3)、α1-Ⅴ型胶原蛋白(collagen, typeⅤ, alpha 1, COL5A1)、PCOLCE和形成素1 (formin-1, FMN1) 基因有助于毛发从退行期向生长期转变的表观遗传机制。另外两个酶也在毛囊生物学中起作用,一个是羊毛甾醇合酶(lanosterol synthase, LSS),是胆固醇生物合成途径中的关键酶,在毛囊的毛干和毛球中表达[29];另一个为17β羟类固醇脱氢酶14 (17β-hydroxysteroid dehydrogenase ⅩⅣ, HSD17B14),Brunner等[30]研究表明,狗脱毛时,该蛋白在皮肤组织中显著下调。以上结果与本研究结果相一致,从分子水平上阐释了公羊羊毛较母羊羊毛在产量方面的优势。
毛囊的形态发生需要多种信号的协调以及上皮和间质成分之间的交流。整合素连接激酶(integrin-linked kinase, ILK) 参与毛囊基质细胞的特异性、内根鞘形成和毛囊内陷,对毛囊形成至关重要[31];核因子Ⅰ家族成员C (nuclear factor Ⅰ-C, NFIC)[32]、小分子GTP酶超家族成员(related to Ras superfamily, RRAS)[33]和胞浆磷蛋白1 (stathmin-1, STMN1)[34]均对毛囊生长周期有调节作用。其中,NFIC在毛囊生长静止期抑制TGF-β1信号转导,导致NFIC缺乏,小鼠的祖细胞增殖、毛囊再生延迟[32]。本研究对43种差异蛋白进行了GO注释、KEGG通路以及蛋白互作分析,GO富集分析中生物学过程、分子功能和细胞组分类别中富集了大量细胞、代谢、发育和生物调节等类别,说明中国美利奴公羊和母羊皮肤组织在发育、代谢和调节功能方面可能存在明显差异。KEGG通路分析结果显示,丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、肿瘤抑制蛋白(protein 53, P53) 信号通路等被显著富集。COL1A1和COL1A2涉及磷脂酰肌醇-3-激酶-丝氨酸/苏氨酸激酶(phosphatidylinositol-3-kinases-serine/threonine kinase, PI3K-Akt) 信号通路,该通路对毛囊再生的影响也有报道[35]。蛋白质互作网络分析结果,COL1A1蛋白与MMP2、SPARC、THBS1等差异表达蛋白联系较为紧密,其可能在羊毛生长发育过程中起着关键作用。
4 结论本研究应用基于LC-MS/MS联用技术和DIA策略的定量蛋白质组学技术,结合生物信息学,共获得674种差异表达蛋白。其中,与毛囊生长发育相关的差异蛋白43种,包含一些参与细胞发育、代谢和生物调节功能等重要生物过程,具有分子信号转导和酶活性等重要分子功能的差异表达蛋白质,其中公羊上调的有30种,母羊上调的有13种。
| [1] |
关鸣轩, 李进龙, 杨存明, 等. 非遗传因素对新吉细毛羊主要经济性状的影响. 中国畜牧杂志, 2020, 56(8): 104-107, 110. Guan MX, Li JL, Yang CM, et al. Effects of non-genetic factors on the main economic traits of Xinji fine wool sheep. Chin J Animal Sci, 2020, 56(8): 104-107, 110 (in Chinese). |
| [2] |
张敏, 赛迪古丽·赛买提, 库木斯·哈布多拉, 等. 性别、年龄因素对阿勒泰羊绒毛细度与长度的影响. 家畜生态学报, 2014, 35(8): 45-48. Zhang M, Saidigul S, Kumus H, et al. Gender and age effect on the fineness and length of Altay sheep down hair. Acta Ecol Animalis Domastici, 2014, 35(8): 45-48 (in Chinese). DOI:10.3969/j.issn.1673-1182.2014.08.009 |
| [3] |
张小伟, 王浩, 何军敏, 等. 影响多胎细毛羊主要经济性状的非遗传因素分析. 中国畜牧杂志, 2021, 57(3): 75-78. Zhang XW, Wang H, He JM, et al. Analysis of non-genetic factors affecting main economic traits in multiple fetus fine wool sheep. Chin J Animal Sci, 2021, 57(3): 75-78 (in Chinese). |
| [4] |
陶卫东, 李彦飞, 田可川, 等. 影响南疆绒山羊主要性状的非遗传因素分析. 新疆农业科学, 2013, 50(2): 372-377. Tao WD, Li YF, Tian KC, et al. Analysis of non-genetic factors of southern Xinjiang cashmere goat's primary traits. Xinjiang Agric Sci, 2013, 50(2): 372-377 (in Chinese). |
| [5] |
王鹏宇, 官却扎西, 祁全青, 等. 影响青海细毛羊早期性状非遗传因素的研究. 内蒙古农业大学学报(自然科学版), 2011, 32(4): 29-33. Wang PY, Guan QZX, Qi QQ, et al. The studies of non-genetic factors influence on early traits of Qinghai fine- wool sheep. J Inner Mongolia Agric Univ (Nat Sci Ed), 2011, 32(4): 29-33 (in Chinese). |
| [6] |
乔国艳, 袁超, 郭婷婷, 等. 不同数据结构和动物模型对高山美利奴羊经济性状遗传参数估计的比较. 中国畜牧兽医, 2020, 47(2): 531-543. Qiao GY, Yuan C, Guo TT, et al. Comparison of different data structures and animal models for genetic parameter estimation of economic traits of alpine merino sheep. China Animal Husb Vet Med, 2020, 47(2): 531-543 (in Chinese). |
| [7] |
Zhao MD, Liu X, Sun HD, et al. Evaluation of urinary proteome library generation methods on data-independent acquisition MS analysis and its application in normal urinary proteome analysis. Proteomics Clin Appl, 2019, 13(5): e1800152. DOI:10.1002/prca.201800152
|
| [8] |
Anjo SI, Santa C, Manadas B. SWATH-MS as a tool for biomarker discovery: from basic research to clinical applications. Proteomics, 2017, 17(3/4): 1600278.
|
| [9] |
Meyer JG, Schilling B. Clinical applications of quantitative proteomics using targeted and untargeted data-independent acquisition techniques. Expert Rev Proteomics, 2017, 14(5): 419-429. DOI:10.1080/14789450.2017.1322904
|
| [10] |
Plowman JE, Harland DP, Campos AMO, et al. The wool proteome and fibre characteristics of three distinct genetic ovine breeds from Portugal. J Proteomics, 2020, 225: 103853. DOI:10.1016/j.jprot.2020.103853
|
| [11] |
Zhao JS, Qin HY, Xin JJ, et al. Discovery of genes and proteins possibly regulating mean wool fibre diameter using cDNA microarray and proteomic approaches. Sci Rep, 2020, 10(1): 7726. DOI:10.1038/s41598-020-64903-7
|
| [12] |
Mardaryev AN, Ahmed MI, Vlahov NV, et al. Micro-RNA-31 controls hair cycle-associated changes in gene expression programs of the skin and hair follicle. FASEB J, 2010, 24(10): 3869-3881. DOI:10.1096/fj.10-160663
|
| [13] |
Dai B, Liang H, Guo DD, et al. The overexpression of Tβ4 in the hair follicle tissue of alpas cashmere goats increases cashmere yield and promotes hair follicle development. Animals (Basel), 2019, 10(1): 75.
|
| [14] |
Mesler AL, Benedeck RE, Wong SY. Preparing the hair follicle canal for hair shaft emergence. Exp Dermatol, 2021, 30(4): 472-478. DOI:10.1111/exd.14210
|
| [15] |
Yu ZD, Wildermoth JE, Wallace OAM, et al. Annotation of sheep keratin intermediate filament genes and their patterns of expression. Exp Dermatol, 2011, 20(7): 582-588.
|
| [16] |
Bawden CS, McLaughlan C, Rogers G, et al. A unique type I keratin intermediate filament gene family is abundantly expressed in the inner root sheaths of sheep and human hair follicles. J Invest Dermatol, 2001, 116(1): 157-166.
|
| [17] |
Jin M, Cao Q, Wang RL, et al. Molecular characterization and expression pattern of a novel keratin-associated protein 11.1 gene in the Liaoning cashmere goat (Capra hircus). Asian-Australas J Anim Sci, 2017, 30(3): 328-337.
|
| [18] |
Liang S, Bao ZY, Zhao BH, et al. Characterization and functional analysis of Krtap11-1 during hair follicle development in Angora rabbits (Oryctolagus cuniculus). Genes Genomics, 2020, 42(11): 1281-1290.
|
| [19] |
Gao Y, Wang XL, Yan HL, et al. Comparative transcriptome analysis of fetal skin reveals key genes related to hair follicle morphogenesis in cashmere goats. PLoS One, 2016, 11(3): e0151118.
|
| [20] |
Wang JF, Sui J, Mao C, et al. Identification of key pathways and genes related to the development of hair follicle cycle in cashmere goats. Genes(Basel), 2021, 12(2): 180.
|
| [21] |
Collins CA, Watt FM. Dynamic regulation of retinoic acid-binding proteins in developing, adult and neoplastic skin reveals roles for beta-catenin and Notch signalling. Dev Biol, 2008, 324(1): 55-67.
|
| [22] |
Li C, Li Y, Zhou GX, et al. Whole-genome bisulfite sequencing of goat skins identifies signatures associated with hair cycling. BMC Genomics, 2018, 19(1): 638.
|
| [23] |
Hou C, Miao Y, Ji H, et al. 6-gingerol inhibits hair cycle via induction of MMP2 and MMP9 expression. An Acad Bras Cienc, 2017, 89(4): 2707-2717.
|
| [24] |
Zhang HH, Nan WX, Wang SY, et al. Balance between fibroblast growth factor 10 and secreted frizzled-relate protein-1 controls the development of hair follicle by competitively regulating β-catenin signaling. Biomed Pharmacother, 2018, 103: 1531-1537.
|
| [25] |
Ahlawat S, Arora R, Sharma R, et al. Skin transcriptome profiling of Changthangi goats highlights the relevance of genes involved in Pashmina production. Sci Rep, 2020, 10(1): 6050.
|
| [26] |
Shirai K, Obara K, Tohgi N, et al. Expression of anti-aging type-XVII collagen (COL17A1/BP180) in hair follicle-associated pluripotent (HAP) stem cells during differentiation. Tissue Cell, 2019, 59: 33-38.
|
| [27] |
Yano K, Brown LF, Lawler J, et al. Thrombospondin-1 plays a critical role in the induction of hair follicle involution and vascular regression during the catagen phase. J Invest Dermatol, 2003, 120(1): 14-19.
|
| [28] |
Won CH, Kwon OS, Kang YJ, et al. Comparative secretome analysis of human follicular dermal papilla cells and fibroblasts using shotgun proteomics. BMB Rep, 2012, 45(4): 253-258.
|
| [29] |
Romano MT, Tafazzoli A, Mattern M, et al. Bi-allelic mutations in LSS, encoding lanosterol synthase, cause autosomal-recessive hypotrichosis simplex. Am J Hum Genet, 2018, 103(5): 777-785.
|
| [30] |
Brunner MAT, Jagannathan V, Waluk DP, et al. Novel insights into the pathways regulating the canine hair cycle and their deregulation in alopecia X. PLoS One, 2017, 12(10): e0186469.
|
| [31] |
Rudkouskaya A, Welch I, Dagnino L. ILK modulates epithelial polarity and matrix formation in hair follicles. Mol Biol Cell, 2014, 25(5): 620-632.
|
| [32] |
Plasari G, Edelmann S, Högger F, et al. Nuclear factor I-C regulates TGF-β-dependent hair follicle cycling. J Biol Chem, 2010, 285(44): 34115-34125.
|
| [33] |
Su R, Gong G, Zhang LT, et al. Screening the key genes of hair follicle growth cycle in Inner Mongolian cashmere goat based on RNA sequencing. Arch Anim Breed, 2020, 63(1): 155-164.
|
| [34] |
Zhang CY, Li YH, Qin J, et al. TMT-based quantitative proteomic analysis reveals the effect of bone marrow derived mesenchymal stem cell on hair follicle regeneration. Front Pharmacol, 2021, 12: 658040.
|
| [35] |
Chen Y, Fan ZM, Wang XX, et al. PI3K/Akt signaling pathway is essential for de novo hair follicle regeneration. Stem Cell Res Ther, 2020, 11(1): 144.
|
 2022, Vol. 38
2022, Vol. 38




