L-丙氨酸厌氧发酵关键技术及产业化
刘萍萍
,
郭恒华
,
张冬竹
,
樊义
,
唐思青
,
张学礼
生物工程学报  2022, Vol. 38 2022, Vol. 38 Issue (11): 4329-4334 Issue (11): 4329-4334 |

氨基酸作为构成生命基础物质蛋白质的基本单元,具有重要的生理功能。随着氨基酸产品在医药、食品和饲料添加剂等领域应用范围的不断扩大,各类终端应用市场对氨基酸的需求也急剧扩增。因此,作为整个发酵行业的支柱方向之一,氨基酸制造业正受到日益增加的关注。
自1957年科学家首次发现谷氨酸棒杆菌可以天然分泌谷氨酸开始[1],氨基酸发酵已有几十年的发展历史并获得了一系列优良的工程菌株。目前,大多数氨基酸都已实现发酵生产[2]。其中,生物发酵法制备的谷氨酸、赖氨酸和苏氨酸等产能已达到几十万吨到几百万吨[3]。传统氨基酸发酵主要是利用天然高产菌株或化学诱变菌株在好氧条件下实现的。好氧发酵具有生长快、产量高等优势。但值得注意的是,好氧发酵中大量碳源用于生成能量和合成菌体细胞,造成糖酸转化率低,大量碳源被浪费,且持续通气消耗大量的能源。另外,对我国氨基酸行业来讲,很长时间内发酵的核心菌种都受到国外企业垄断,这严重限制了我国氨基酸行业的创新发展和迭代升级。因此,突破现有发酵技术,实现更低成本、更加环保的氨基酸制备,同时实现氨基酸发酵核心菌种的自主创制是具有重要意义的。
与好氧发酵工艺相比,厌氧发酵具有操作简单、无需通氧、糖酸转化率高易接近理论最大值等优势,因此可以实现低成本、低耗能、更加环保的生产工艺。如果能突破现有技术对好氧发酵的依赖,实现氨基酸的厌氧发酵对氨基酸行业的发展将具有创造性的意义。L-丙氨酸是国际上首个实现厌氧发酵产业化生产的氨基酸产品。L-丙氨酸厌氧发酵技术的成功为其他氨基酸类产品的厌氧发酵生产提供了重要的参考。本文以L-丙氨酸为例,综述了氨基酸厌氧发酵过程中的关键技术及在产业化实施中的应用。
1 L-丙氨酸厌氧发酵关键技术限制氨基酸实现厌氧发酵生产的因素主要有两个,第一个是葡萄糖到氨基酸的代谢途径在厌氧条件下还原力供给不平衡,第二个是厌氧条件下菌种量少,单个细胞合成效率低导致菌种整体生产性能差。这些问题的解决单靠化学诱变是很难实现的,但是代谢工程和合成生物学的快速发展为这些问题的解决提供了可能。
L-丙氨酸是氨基酸百年发展历史上首个实现厌氧发酵产业化生产的产品。传统的L-丙氨酸制造都是通过石化路线以石油基化合物为原料实现的(图 1A)[4-6]。由此带来的生产成本居高不下,环保压力大等因素严重限制了L-丙氨酸的下游应用。自然界中虽然有多种可以天然生产L-丙氨酸的微生物,但受限于较低的产率、较弱的生产能力和产物是DL-丙氨酸等使其无法直接应用于工业化生产[7-11]。

|
| 图 1 L-丙氨酸生产方式的对比 Fig. 1 Comparison of L-alanine production. (A) Traditional production process. (B) Fermentative production process. A:传统路线;B:发酵法路线 |
| |
通过代谢工程改造可以获得高效生产L-丙氨酸的工程菌[9, 12-16],但很长时间内主要集中于好氧或两步法发酵制备L-丙氨酸,并且无实际产业化实施的案例。大肠杆菌作为合成生物学中常用的模式生物,天然条件下主要通过转氨酶/谷氨酸脱氢酶双酶体系生产L-丙氨酸,每生成1 mol L-丙氨酸需要消耗1 mol NADPH (图 1B)。而厌氧条件下葡萄糖代谢只能提供NADH,因此就出现了还原力供给不平衡的问题。为了解决这个问题,张学礼等[17]通过在大肠杆菌中引入来自嗜热脂肪芽孢杆菌的NADH依赖型L-丙氨酸脱氢酶替代双酶体系成功创建了L-丙氨酸合成的新途径(图 1B)。该途径中,L-丙氨酸脱氢酶直接利用NADH和铵离子就可以将丙酮酸转化为L-丙氨酸,从而成功解决了还原力平衡的问题(图 2)。
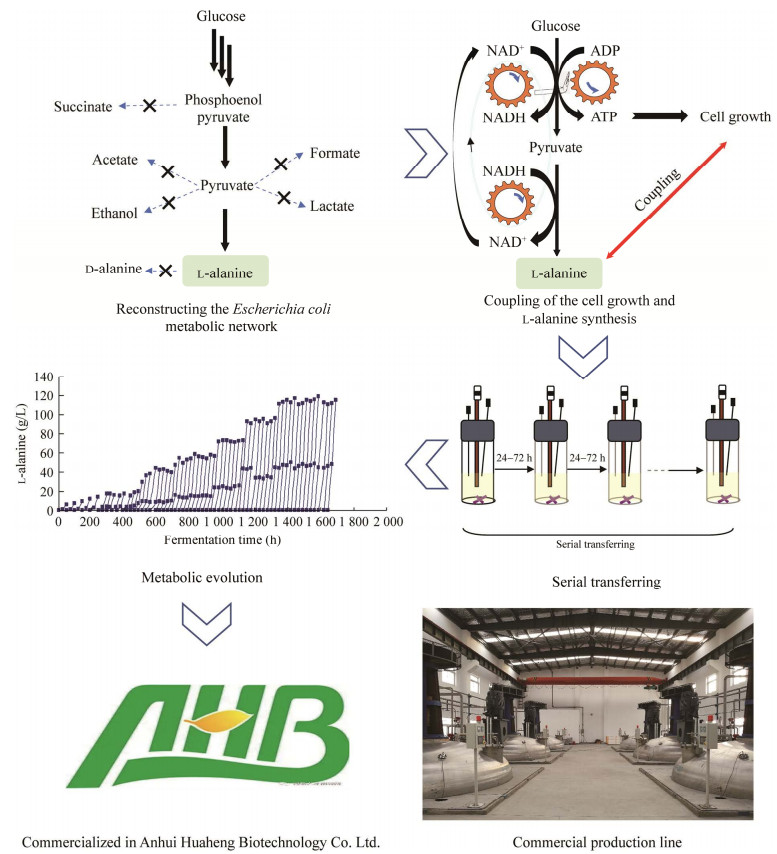
|
| 图 2 L-丙氨酸的厌氧发酵与产业化 Fig. 2 Anaerobic fermentative production of L-alanine and its commercialization. |
| |
针对限制实现厌氧发酵生产的另一个瓶颈问题,即厌氧条件下菌种量少,单个细胞合成效率低导致菌种整体生产性能差,张学礼等[17]通过设计代谢进化的技术方案,基于细胞生长和产物合成的偶联来提升单个细胞合成效率,实现了在菌种量少的条件下高效合成目标产物。研究人员首先通过重构大肠杆菌的代谢网络,敲除厌氧混合酸发酵的关键基因使L-丙氨酸成为厌氧条件下唯一消耗NADH的合成途径(图 2)。由于NAD+再生才能让糖酵解持续运转从而为细胞生长提供能量,因此使细胞生长和L-丙氨酸合成形成偶联(图 2)。以这种偶联为基础,就可以利用代谢进化技术通过在厌氧条件下连续传代积累具有优势突变的菌株,从而使细胞生长和L-丙氨酸合成能力逐步提升的菌株得到筛选。最终获得的高效生产L-丙氨酸的工程菌合成效率提高了8倍,比生产速率从最初的0.10 g/(g·h) 提高到了0.79 g/(g·h) 细胞干重,菌种生产强度达到3.9 g/(L·h),糖酸转化率高达95%,具有非常好的工业应用潜力。
L-丙氨酸厌氧发酵技术的成功颠覆了传统氨基酸必需好氧发酵的模式,打破了氨基酸发酵葡萄糖原料转化率不高于78%的行业瓶颈,为氨基酸行业菌种改造提供了一种新的思路。
2 L-丙氨酸厌氧发酵技术的产业应用实施相对于传统石化路线或者好氧发酵工艺,厌氧发酵技术具有成本低、能耗少、转化率高等众多显而易见的优势,因此对于工业化生产具有非常大的吸引力。厌氧发酵L-丙氨酸技术2012年在安徽华恒生物科技股份有限公司(以下简称为华恒生物) 实现了万吨级的商业化生产(图 2),这是全球首次实现L-丙氨酸的厌氧发酵生产[18]。后续,华恒生物与张学礼课题组合作,在生产中开发了L-丙氨酸厌氧批式串联发酵工艺,建立了氨基酸节能高效发酵的新模式。使用这种工艺,发酵菌种可以直接以简单的无机盐培养基加葡萄糖进行发酵,整个过程无需通气。同时,串联发酵工艺发酵过程中无需种子罐,省去种子液制备时间使发酵时间大幅缩短。在此基础上,华恒生物建成年产3万t国际最大规模的L-丙氨酸发酵生产线并实现稳定生产,生产成本相比化工路线降低50%,并避免了二氧化碳排放。
经过十年多的发展,华恒生物现已成长为L-丙氨酸行业的龙头企业。L-丙氨酸厌氧发酵技术已在安徽华恒生物科技股份有限公司及其全资子公司秦皇岛华恒生物工程有限公司得到应用,并成功实现了产业化。截至目前,厌氧发酵法生产L-丙氨酸技术已为企业新增销售28.8亿元,L-丙氨酸在全球市场占有率超过60%。L-丙氨酸生产成本的大幅下降不仅推动了其在医药和日化等原有领域的广泛应用,同时也有效促进了新型环保剂甲基甘氨酸二乙酸(methylglycinediacetic acid, MGDA) 的推广应用。2020年,该技术获得中国轻工业联合会技术发明奖一等奖。华恒生物L-丙氨酸也被评为工信部制造业单项冠军产品。厌氧发酵生产L-丙氨酸技术不仅使华恒生物迅速成长为L-丙氨酸行业的龙头企业,更是作为华恒生物的主营产品支撑企业于2021年4月在科创板上市。
3 展望厌氧发酵生产L-丙氨酸技术的成功不仅打破了传统的氨基酸好氧发酵模式,实现了高效、低成本、低碳环保的商业化生产,同时也为氨基酸行业未来菌种创制和行业发展起到了示范引领的作用。随着近年来生物大数据释放和计算能力的提升,未来可以通过代谢工程设计将这种技术推广应用到更多氨基酸或更多类别的化合物制造中。这对于促进我国发酵行业菌种迭代升级、创建具有自主知识产权的核心菌种将会产生重要的意义。
同时,从厌氧发酵氨基酸关键技术对华恒生物发展的影响来看,关键技术的更新和出现不仅能促进一个企业的发展,同时对于产业培育也具有重要的作用。但值得注意的是,作为发酵行业的核心,菌种的知识产权保护对行业的健康发展极其重要。随着合成生物学的快速发展,相应的知识产权保护策略也要加速跟上才能促进这个行业的健康发展和良性竞争。
| [1] |
Eggeling L, Sahm H. L-glutamate and L-lysine: traditional products with impetuous developments. Appl Microbiol Biotechnol, 1999, 52(2): 146-153. DOI:10.1007/s002530051501
|
| [2] |
陈宁, 范晓光. 我国氨基酸产业现状及发展对策. 发酵科技通讯, 2017, 46(4): 193-197. Chen N, Fan XG. Current situation and development strategy of amino acid industry in China. Bull Ferment Sci Technol, 2017, 46(4): 193-197 (in Chinese). |
| [3] |
马倩, 夏利, 谭淼, 等. 氨基酸生产的代谢工程研究进展与发展趋势. 生物工程学报, 2021, 37(5): 1677-1696. Ma Q, Xia L, Tan M, et al. Advances and prospects in metaboli engineering for the production of amino acid. Chin J Biotech, 2021, 37(5): 1677-1696 (in Chinese). DOI:10.13345/j.cjb.200588 |
| [4] |
Chibata I, Tosa T, Takamatsu S. Industrial production of L-alanine using immobilized Escherichia coli and Pseudomonas dacunhae. Microbiol Sci, 1984, 1(3): 58-62.
|
| [5] |
Shibatani T, Kakimoto T, Chibata I. Stimulation of L-asparate beta-decarboxylase formation by L-glutamate in Pseudomonas dacunhae and improved production of L-alanine. Appl Environ Microbiol, 1979, 38(3): 359-364. DOI:10.1128/aem.38.3.359-364.1979
|
| [6] |
Chibata I, Kakimoto T, Kato J. Enzymatic production of L-alanine by Pseudomonas dacunhae. Appl Microbiol, 1965, 13(5): 638-645. DOI:10.1128/am.13.5.638-645.1965
|
| [7] |
Hashimoto SI, Katsumata R. Overproduction of alanine by Arthrobacter strains with glucose-nonrepressible L-alanine dehydrogenase. Biotechnol Lett, 1993, 15(11): 1117-1122. DOI:10.1007/BF00131200
|
| [8] |
Hashimoto SI, Katsumata R. Mechanism of alanine hyperproduction by Arthrobacter oxydans HAP-1: metabolic shift to fermentation under nongrowth aerobic conditions. Appl Environ Microbiol, 1999, 65(6): 2781-2783. DOI:10.1128/AEM.65.6.2781-2783.1999
|
| [9] |
Hashimoto SI, Katsumata R. L-alanine fermentation by an alanine racemase-deficient mutant of the DL-alanine hyperproducing bacterium Arthrobacter oxydans HAP-1. J Ferment Bioeng, 1998, 86(4): 385-390. DOI:10.1016/S0922-338X(99)89009-6
|
| [10] |
Orlygsson J, Anderson R, Svensson BH. Alanine as an end product during fermentation of monosaccharides by Clostridium strain P2. Antonie van Leeuwenhoek, 1995, 68(4): 273-280. DOI:10.1007/BF00874136
|
| [11] |
Ohashima T, Soda K. Purification and properties of alanine dehydrogenase from Bacillus sphaericus. Eur J Biochem, 1979, 100(1): 29-30. DOI:10.1111/j.1432-1033.1979.tb02030.x
|
| [12] |
Zhou L, Deng C, Cui WJ, et al. Efficient L-alanine production by a thermo-regulated switch in Escherichia coli. Appl Biochem Biotechnol, 2016, 178(2): 324-337. DOI:10.1007/s12010-015-1874-x
|
| [13] |
Jojima T, Fujii M, Mori E, et al. Engineering of sugar metabolism of Corynebacterium glutamicum for production of amino acid L-alanine under oxygen deprivation. Appl Microbiol Biotechnol, 2010, 87(1): 159-165. DOI:10.1007/s00253-010-2493-7
|
| [14] |
Smith GM, Lee SA, Reilly KC, et al. Fed-batch two-phase production of alanine by a metabolically engineered Escherichia coli. Biotechnol Lett, 2006, 28(20): 1695-1700. DOI:10.1007/s10529-006-9142-3
|
| [15] |
Lee M, Smith GM, Eiteman MA, et al. Aerobic production of alanine by Escherichia coli aceF ldhA mutants expressing the Bacillus sphaericus alaD gene. Appl Microbiol Biotechnol, 2004, 65(1): 56-60.
|
| [16] |
Hols P, Kleerebezem M, Schanck AN, et al. Conversion of Lactococcus lactis from homolactic to homoalanine fermentation through metabolic engineering. Nat Biotechnol, 1999, 17(6): 588-592. DOI:10.1038/9902
|
| [17] |
Zhang XL, Jantama K, Moore JC, et al. Production of L-alanine by metabolically engineered Escherichia coli. Appl Microbiol Biotechnol, 2007, 77(2): 355-366. DOI:10.1007/s00253-007-1170-y
|
| [18] |
Liu PP, Xu HT, Zhang XL. Metabolic engineering of microorganisms for L-alanine production. J Ind Microbiol Biotechnol, 2022, 49(2).
|