中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王绪霞, 张龙雨, 王磊, 闫云君
- WANG Xuxia, ZHANG Longyu, WANG Lei, YAN Yunjun
- 藤壶附着机理及其粘胶蛋白的研究进展
- The adhesion mechanism of barnacle and its cement proteins: a review
- 生物工程学报, 2022, 38(12): 4449-4461
- Chinese Journal of Biotechnology, 2022, 38(12): 4449-4461
- 10.13345/j.cjb.220082
-
文章历史
- Received: January 30, 2022
- Accepted: April 24, 2022
2. 华中科技大学 生命科学与技术学院, 湖北 武汉 430074;
3. 郑州工程技术学院 化工食品学院, 河南 郑州 450044
2. School of Life Science and Technology, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China;
3. School of Chemical Engineering & Food Science, Zhengzhou University of Technology, Zhengzhou 450044, Henan, China
常规的粘胶剂在空气中具有优异的粘接强度,而在水中却表现出较弱的粘合性和较差的生物相容性。因为水分子进入粘合界面处对粘胶剂分子产生水化/溶胀/降解作用,特别是在海水环境中,由于水分子的阻隔,使得粘胶剂的性能受到更大影响[1-2]。生物粘附是利用天然大分子将生物体附着在基底表面,已知海洋生态系统中有5 000多种生物可以分泌具有较强水下粘附能力的粘胶蛋白。在过去的15年里,通过模拟海洋生物粘附特性,成功开发了各种类型的人工粘附蛋白[3]。与常规的粘附剂相比,海洋生物粘附剂是一种无毒、可生物降解、附着力强的替代品,它能够在不同湿度水平下保持稳定的粘结能力[4]。深入了解粘胶蛋白介导的海洋生物粘附,对仿生材料的开发、医用手术粘合、工业的水下修复以及各种涂层的表面改性等领域具有重要的理论意义和应用价值[5]。
目前,已经获得来自藤壶[6]、贻贝[7-8]、海星[9]、盘管虫、沙堡蠕虫[10]和牡蛎等9大类海洋动物50多个粘胶蛋白基因的信息。其中,对贻贝分泌的粘胶蛋白研究较多,其粘附机理的研究也最深入[8]。贻贝足丝蛋白(mussel foot protein, Mfp) 包含一种由酪氨酸翻译后修饰生成的氨基酸l-3, 4-二羟基苯丙氨酸(l-3, 4-dihydroxypheny- alanine, l-DOPA, 多巴),DOPA分子在贻贝与物体表面水下粘附固化中起关键作用。基于贻贝水下粘附机理(即来自DOPA灵感) 开发了众多仿生水下粘附材料[11-12]。然而,在体外环境中,DOPA发生粘附的氧化还原系统的平衡较难控制,这给生产工艺带来了巨大挑战。而藤壶的粘附不同于贻贝,为不依赖于DOPA分子系统的独特水下粘附,相对较为简单[13-14]。几十年来,对成体藤壶粘附性的研究提高了对其动态粘附过程的认识,但是藤壶胶粘附的分子机理尚不清楚[15],基于藤壶胶蛋白的仿生水下粘附剂的开发也鲜有报道。
基于以上背景,依据已报道的藤壶胶相关文献信息,本文从藤壶胶的水下粘附机理、粘胶蛋白的特点、获取方式以及应用等多个方面进行综述与分析,并对今后的研究热点和方向进行展望,以期对水下粘附剂的开发提供理论基础和新的研究思路。
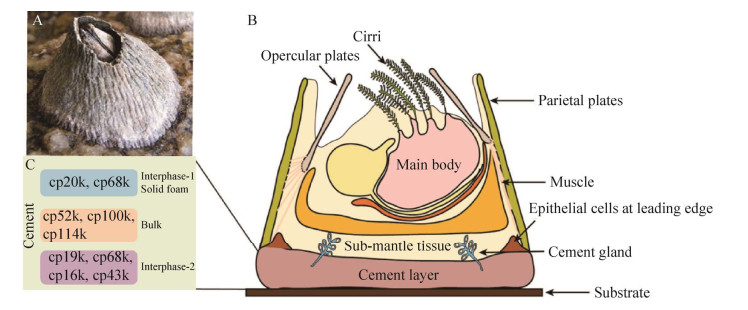
1 藤壶胶 1.1 藤壶胶概述20世纪70年代,最早由Saroyan等提出藤壶胶是藤壶与外界发生联系的主要物质,藤壶的牢固和永久粘附依赖于藤壶胶[16]。藤壶胶由成虫腺体细胞产生的一系列粘胶蛋白组成,通过导管分泌到藤壶与基质之间的界面上,经过水层置换,然后与表面结合和固化,最终成功实现与水下界面的附着[17]。藤壶胶具有很强的粘附强度,可附着在不同表面特性的材料上,包括具有高表面自由能和低表面自由能的材料,如金属氧化物、玻璃、塑料、木头和岩石等[18]。研究人员通过测定剥离藤壶所需力的大小和测量藤壶附着底盘的面积,来计算剥离藤壶所需的剪切强度,也即是藤壶在基底上的附着强度[19]。结果显示,在聚甲基丙烯酸甲酯(polymethyl methacrylate, PMMA) 基底上剥离藤壶所需的平均剪切强度为0.5 MPa[19]。Raman等对网纹藤壶(Amphibalanus reticulatus或Balanus reticulatus) 的藤壶胶纳米力学性能开展研究,结果表明,在PMMA的基底上硬度可达(52.56±12.18) MPa,弹性模量可达(1.2±0.16) GPa[20]。此外,研究发现藤壶胶在不同的基底表面所呈现的微观形态不同,在金属基底的表面一般形成纤维状结构,而在PMMA表面则呈现不同大小和形态的海绵状微观结构[20]。因此,推测藤壶能够粘附在不同的基底材料表面与藤壶胶和基底发生粘附的微观形貌具有密切关系。但是,究竟什么因素导致藤壶胶与基底表面的形貌差异,科学家目前尚无定论,需要继续对藤壶胶的粘附机理进行深入研究与探索。
1.2 藤壶胶的粘附机理藤壶胶的生成和固化是藤壶持久与基质连接的象征。藤壶胶的主要成分是一些复杂生物大分子,包含约92%的蛋白质、较少量的糖类和脂类[5, 21] (图 1)。目前,已经鉴定出多种藤壶胶蛋白,以其理论分子量大小和单位kDa命名,主要包括cp7k、cp16k、cp19k、cp20k、cp22k、cp36k、cp43、cp52k、cp57k、cp58k、cp68k、cp100k、cp105k和cp114k等[17, 21-22],其中cp16k、cp19k、cp20k、cp52k、cp68k和cp100k蛋白最早被发现和测序[5, 14]。
2013年,Kamino基于对红巨藤壶(Megabalanus rosa) 粘胶蛋白结构和功能的系统性研究,提出藤壶粘胶蛋白水下粘附的理论分子模型。Kamino认为cp19k蛋白和cp20k蛋白是固体基质和藤壶底板之间的界面层,因此在藤壶特有的牢固结合中起核心作用。cp19k蛋白负责与外部基底表面的粘附,cp20k蛋白负责与藤壶钙质底部的粘附连接。cp100k蛋白和cp52k蛋白是藤壶胶内部蛋白,含量丰富,通过自组装形成构象的变化而内聚[14]。在Kamino提出的粘附模型中,对藤壶粘胶蛋白的结构和功能进行了详细的阐述,虽然未完全解析藤壶胶蛋白组分之间交联固化的具体机制,但是对后来学者们研究藤壶胶粘附机理起了启发作用。
尽管藤壶胶中的脂质和糖类物质含量很低,但它们在藤壶与基底发生粘附的过程中所发挥的作用不容忽视。在Kamino理论模型的基础上,藤壶胶中的非蛋白成分也逐渐受到研究学者的关注。Gohad等认为藤壶的粘附是脂质和磷蛋白协同作用的结果;藤壶首先分泌一种脂质物质,该种物质将界面的水分排出,为磷蛋白的介入创造一个有利的环境;随后,藤壶再将蛋白质释放到脂质相中,脂质物质可以调节蛋白相的扩散,并保护新生的粘附斑块免受细菌的生物降解[23]。国防科技大学Liang等结合众多研究结果,从粘胶蛋白与基底表面之间以及粘胶蛋白各组分相互作用的角度,对Kamino最初提出的藤壶胶的水下粘附分子模型进行补充,并提出了较为完善的藤壶水下粘附分子模型。该分子模型指出,藤壶在蜕皮期间首先分泌一种相分离液,这种混合物质由富含酚的凝胶相组成,在与海水的交界处呈现出富含脂质和活性氧的相。该类物质可以去除基底表面吸附的生物薄膜,制备出干净的基底表面,然后再分泌藤壶胶[24]。许多学者也提出,藤壶胶中的界面粘胶蛋白cp19k和cp20k可能分别通过物理吸附和配位键的方式与外部基底和藤壶的钙质底盘相偶联[18, 25-26]。存在于内部的疏水性蛋白质cp52k和cp100k可能先通过自组装成淀粉样纤维,然后在多种氧化酶的催化下共价交联[27]。梁超在对白脊藤壶(B. albicostatus) cp19k蛋白的界面附着机理研究中提出,界面粘胶蛋白cp19k和cp20k与内部蛋白cp52k和cp100k之间也可能发生相同的酶促反应,从而促进粘胶蛋白各组分之间的相互作用。除此之外,cp19k蛋白利用自身丰富的赖氨酸与内部疏水蛋白中高比例的芳香族氨基酸形成cation-π的相互作用,同时疏水基团之间的疏水作用力促进藤壶胶界面蛋白与内部疏水蛋白的互作。而界面蛋白cp20k可能通过Ca2+辅助的配位相互作用与内部蛋白cp52k的糖基结合。通过以上粘胶蛋白与基底之间以及各粘胶蛋白组分之间的相互作用,最终将藤壶钙质底盘、主体胶和外部基底粘结到一起,形成一个完整的粘附过程[28]。但是,在其研究中尚未明确cp68k蛋白的功能。
综上所述,对于藤壶粘附机理的研究,目前假设性论断较多,可靠性结论较少,对藤壶水下粘附的分子机理仍缺乏深入了解。藤壶粘胶蛋白作为藤壶胶中含量最多的组成成分,对其进行系统的研究有助于进一步揭示藤壶的粘附机理。依据已报道的藤壶胶相关文献和藤壶胶蛋白序列信息,对主要的藤壶胶蛋白cp19k、cp20k、cp52k和cp100k进行论述。
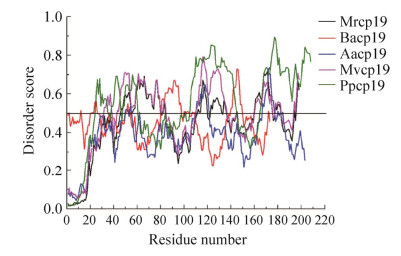
2 藤壶粘胶蛋白 2.1 粘胶蛋白cp19k 2.1.1 cp19k蛋白序列特征将已克隆的不同来源的藤壶cp19k蛋白序列进行分析,结果显示,cp19k蛋白具有氨基酸偏好性,其中丙氨酸、缬氨酸、甘氨酸、苏氨酸、丝氨酸和赖氨酸6种氨基酸约占蛋白质氨基酸总量的66%−70%,并含有大量疏水性氨基酸(表 1)。cp19k蛋白序列中亲水性氨基酸苏氨酸、丝氨酸和赖氨酸侧链富含羟基或氨基。此类官能团有利于去除材料表面的水化层[29],氨基还能通过置换矿物表面吸附的阳离子而促进界面的粘附[30]。众所周知,贻贝足丝蛋白序列内在是无序的,Mfp-1和Mfp-2通过无序序列连接局部结构(多聚丙氨酸和表皮生长因子模块)[31],Mfp-3、Mfp-5和Mfp-4几乎只在pH 3.0时可检测到结构[29],胶原蛋白preCOL-P和preCOL-NG中也富含无序弹性蛋白[32]。对藤壶胶cp19蛋白序列的无序性研究相对较少,受贻贝足丝蛋白内在无序性的启发,我们利用IUPred[33-34] (prediction of intrinsically unstructured proteins, https://iupred2a.elte.hu/) 在线数据库对cp19k蛋白序列进行无序性分析和预测。分析发现,红巨藤壶(M. rosa) Mrcp19k、刺巨藤壶(M. volcano) Mvcp19k和鹅颈藤壶(Pollicipes pollicipes) Ppcp19k属于高度无序性蛋白,无序残基的含量分别为42.9%、51.5%和56.7%。而白脊藤壶(B. albicostatus) Bacp19k和纹藤壶(A. amphitrite或B. amphitrite) Aacp19k属于中度无序性蛋白,无序残基的含量分别为28.3%和15.8% (图 2)。正是由于cp19k蛋白序列含有促进界面粘附功能的氨基酸残基,又存在高度无序或中度无序残基,空间结构上会表现出极大的灵活性,即所谓的无序性,所以cp19k蛋白可适应于各种不同性质和微观结构的基底,实现与基底表面的牢固粘附。
| Proteins | Sources | Accession No. | Hydrophobic amino acid (%) | Hydrophilic amino acid (%) | ||||||
| Ala | Val | Others | Gly | Thr | Ser | Lys | ||||
| Mrcp19k | M. rosa | BAE94409.1 | 12.12 | 9.09 | 12.63 | 14.14 | 11.11 | 10.61 | 8.59 | |
| Bacp19k | B. albicostatus | BAE94410.1 | 10.40 | 10.40 | 11.57 | 12.72 | 14.45 | 8.67 | 13.87 | |
| Aacp19k | A. amphitrite | AKZ20819.1 | 10.34 | 12.32 | 13.30 | 14.78 | 11.33 | 6.40 | 12.81 | |
| Mvcp19k | M. volcano | QDO67070.1 | 11.11 | 7.58 | 13.13 | 15.15 | 12.12 | 11.62 | 9.09 | |
| Ppcp19k | P. pollicipes | ATB53755.1 | 9.62 | 10.10 | 11.05 | 19.71 | 9.62 | 13.94 | 5.29 | |
|
| 图 2 藤壶粘胶蛋白cp19k无序性分析 Fig. 2 Disorder analysis of barnacle adhesive protein cp19k. 分数大于0.5 (横线上方) 为无序区,分数小于0.5为有序区 Scores greater than 0.5 (above the transverse line) are disorder regions, while scores less than 0.5 are an order regions. |
| |
对利用体外重组技术和大肠杆菌表达系统获得的重组cp19k蛋白进行表征,发现该蛋白可吸附在各种不同表面特性的材料上[18]。Liu等[35]在研究中发现,在模拟海水的条件下(0.6 mol/L NaCl, pH 8.0) 突变重组的cp19k蛋白,可自组装成淀粉样纤维蛋白,而在腺体分泌条件下(0.1 mol/L NaCl, pH 4.0) 则没有明显的自组装行为。这说明藤壶分泌的藤壶胶是液态的,随着外界环境的变化藤壶胶蛋白构象发生改变,然后进行自组装形成蛋白沉积和固化。藤壶胶的水下固化也与淀粉样蛋白聚集过程密切相关,但淀粉样蛋白聚集与cp19k表面粘附性之间的关系目前尚未可知。Liang等[36-37]将硫氧还蛋白Trx与cp19k蛋白进行融合表达,融合蛋白Trx-cp19k能够自我聚集,形成粘性极强的胶状物,粘附强度可以达到2 MPa左右。对没有经过突变重组的cp19k蛋白进行研究,发现该蛋白虽然没有形成典型的淀粉样纤维蛋白,但是可以自组装形成有序的纳米纤维结构,而且这种结构在模拟的海水环境中很稳定。粘附性测试表明,未自组装的cp19k蛋白纳米纤维的粘附能力弱于商业粘合剂Cell-Tak™,但是自组装后cp19k蛋白纳米纤维的粘附能力增强,粘附性也显著提高。这些研究说明自组装形成的纳米纤维结构有助于cp19k蛋白对基质表面的粘附。So等[38]进一步的研究发现,cp19k蛋白发生自组装行为的基础在于它的氨基酸序列是由带电氨基酸和非带电氨基酸交替组成的,二者交替存在的二元模式是形成纳米纤维结构的基础。该序列中有核心序列负责纳米纤维的聚合,带电的模式结构可以使该蛋白构象形成反向平行结构从而聚合成纤维。而且这种蛋白聚合物很难溶于一般的化学溶液,只有高浓度的盐酸胍溶液才可以将其溶解,这也解释了cp19k蛋白很难溶的原因。
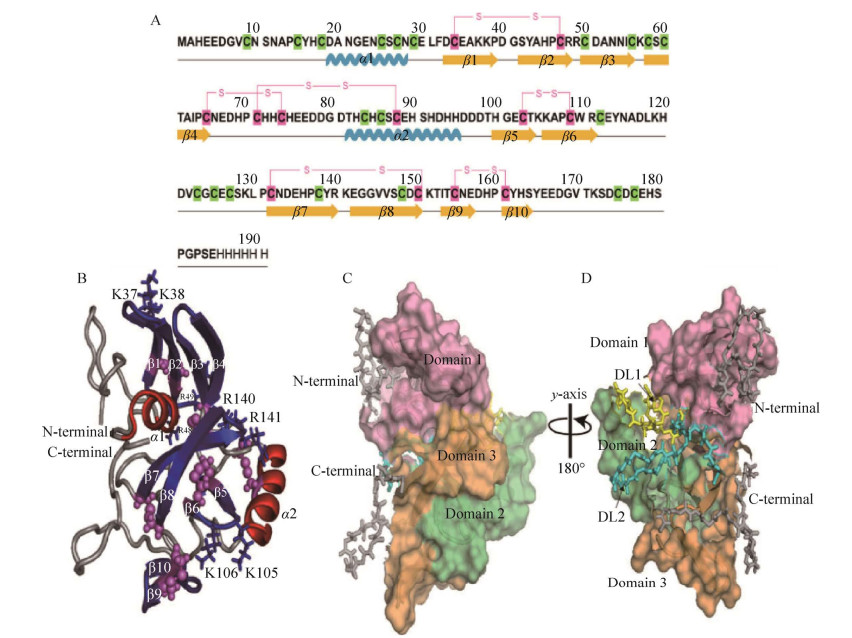
2.2 粘胶蛋白cp20k目前,已被克隆的cp20k蛋白主要包括来自红巨藤壶(M. rosa) 的Mrcp20k[39]、白脊藤壶(B. albicostatus) 的Bacp20k和纹藤壶(A. amphitrite) 的Aacp20k-1和Aacp20k-2[40]。cp20k蛋白含有丰富的半胱氨酸(Cys, 超过14%) 和带电氨基酸(Asp、Glu、Lys、Arg、His) (表 2)。独特的氨基酸组成对cp20k蛋白的功能具有重要的作用,成簇的带电氨基酸可促进cp20k蛋白与无机离子的配位[39-41]。Mori等[25]研究发现,Mrcp20k蛋白可选择性地吸附在方解石表面,而不能粘附于玻璃和合成聚合物上。Mrcp20k蛋白对基底的选择性粘附表明它与方解石底盘之间存在非共价的相互作用,因为方解石底盘缺少反应性官能团[24]。Kumar等[42]采用分子动力学的手段模拟了Mrcp20k蛋白在方解石表面的结合,研究表明该蛋白通过蛋白质和离子间无序-有序的相互作用,将游离的Ca2+和CO32−离子隔离在其高电荷的表面。此外,该蛋白质中大量阴离子残基的存在导致分子内静电排斥,从而产生相互转换的高度灵活的构象。这种构象的灵活性促进了Mrcp20k蛋白与方解石表面的粘附。因此,科学家普遍认为Mrcp20k蛋白在藤壶水下附着中发挥的作用主要包括汇集无机离子调控生物矿化、抑制CaCO3在成胶相互作用位点的径向生长和介导与矿物基底的粘附等[42]。Mohanram等[41]通过多维核磁共振(multidimensional nuclear magnetic resonance, NMR) 技术首次解析了重组Mrcp20k蛋白的三级结构,包含由2个α-螺旋和10条β-折叠组成的3个结构域。32个半胱氨酸中有12个形成二硫键,其余的20个半胱氨酸残基保持游离硫醇的状态。此外,三级结构还揭示另一个特征,4个二肽碱性残基(K37-K38、R48-R49、K105-K106、R140-K141) 占据了结构域β-折叠的转折区域,其各自的侧链暴露在外面(图 3)。这种结构可能会对带负电的矿物氧化物产生静电吸引力,在蛋白与表面基底的接触中起着重要作用。Murugan等[43]在对Mrcp20k蛋白造成金属结构生物污染的研究中充分验证了Mohanram的推测,Mrcp20k蛋白可通过硫醇官能团和高表面正电荷强烈地吸附在软钢上。通过腐蚀产物的化学分析、金属表面的蛋白质吸附和蛋白质的电化学活性分析指出,尽管Mrcp20k蛋白诱导腐蚀(protein-induced corrosion, PIC) 需要蛋白质的粘附性,但是Mrcp20k蛋白半胱氨酸中二硫键才是加速PIC的直接原因,即PIC首先依赖于Mrcp20k的强粘附性,再依靠电化学活性官能团之间的相互作用对金属造成腐蚀。此外,cp20k蛋白自组装方面也取得了一些研究结果[44],研究指出,在盐离子浓度接近海水中的盐离子含量时,该蛋白开始自组装过程,形成分子内二硫键,引起分子构象的改变,构象的变化促进纳米纤维的产生,最终可形成直径约200 nm的三维网状结构。
| Proteins | Sources | Accession No. | pI | Charged amino acid (%) | Cys (%) |
| Mrcp20k | M. rosa | 6LEK_A | 4.70 | 40.00 | 17.30 |
| Facp20k | Fistulobalanus albicostatus | BAF96022.1 | 8.50 | 52.00 | 14.40 |
| Aacp20k-1 | A. amphitrite | AFX74689.1 | 6.45 | 40.31 | 14.73 |
| Aacp20k-2 | A. amphitrite | AFX74690.1 | 8.29 | 59.54 | 14.50 |
|
| 图 3 Mrcp20蛋白序列信息、溶液状态下3D三维结构、结构域的表面模型和动态变化区域[41] Fig. 3 Primary structure and representative solution 3D structure and surface representation of structural domains and dynamic loop regions of Mrcp20 [41]. (A) Primary structure of Mrcp20. The sulfhydryl groups are highlighted in green and disulfide bonds are highlighted in pink with respective connectivities shown. (B) Cartoon representation of the tertiary structure of Mrcp20 in solution with disulfide linkages represented as pink spheres, α-helices in red and β-sheets in blue. (C) Surface representation of Mrcp20 in the same orientation as in (B) highlighting the structural core regions (domain 1, domain 2 and domain 3). (D) 180° rotation around y-axis of model (C) displaying the packing of structural domains with dynamic loop regions DL1 and DL2, highlighted in yellow and cyan coloured sticks, respectively. |
| |
对其他类型粘胶蛋白的研究报道相对较少。粘胶蛋白cp52k和cp100k也是藤壶胶中的主要蛋白成分,富含疏水性氨基酸,二者在氨基酸组成、疏水性和溶解性等方面类似(表 3),推测二者可能具有类似的生物学功能[45-46]。Kamimo等[45]首次发现天然Mrcp52k蛋白存在N-糖基化位点,但是尚不明确这种翻译后修饰对该蛋白功能的影响。Nakano等[27]尝试利用大肠杆菌表达系统进行重组粘胶蛋白Mrcp52k的表达,但是仅获得少量的包涵体,难以直接用于蛋白功能的研究。以Mrcp52k蛋白的一级结构为基础,设计合成20条多肽序列,每个多肽序列包含13−22个氨基酸残基,对这些多肽进行表征,发现一些多肽同样具有自组装的功能。但是,多肽的功能和特性并不能代表Mrcp52k全蛋白的功能。为了获得有功能活性的全蛋白,并对其功能进行表征,曾玲[47]利用大肠杆菌表达系统成功获得重组Mrcp52k蛋白,发现该蛋白在一定条件下具有自组装的行为,在材料表面可形成致密的网格状纤维,具有与来自贻贝的商业化粘合剂Cell-TakTM相当的粘附性能。
| Proteins | Sources | Accession No. | Hydrophobic amino acid (%) | Ser (%) | Arg (%) | |||
| Leu | Val | Iso | Others | |||||
| Aacp52k | A. amphitrite | AKZ20820.1 | 12.08 | 8.43 | 7.63 | 9.06 | 7.31 | 7.31 |
| Mrcp52k | M. rosa | BAL22342.1 | 11.52 | 7.62 | 6.56 | 10.29 | 9.75 | 7.27 |
| Ppcp52k | P. pollicipes | ATB53756.1 | 11.24 | 6.74 | 6.18 | 14.60 | 10.11 | 10.11 |
| Aacp100k | A. amphitrite | AGS19349.1 | 13.15 | 9.00 | 8.65 | 10.38 | 8.22 | 6.49 |
| Mrcp100k | M. rosa | BAB12269.1 | 11.58 | 7.45 | 7.55 | 10.38 | 8.66 | 6.85 |
| Ppcp100k | P. pollicipes | XP_037084548.1 | 14.31 | 9.25 | 5.93 | 12.66 | 8.55 | 8.29 |
目前,获取藤壶粘胶蛋白的方法主要有两种,分别是直接获取天然藤壶胶和利用基因工程技术进行体外重组表达。在早期研究中,研究人员试图采集固化的藤壶胶,但是固化的藤壶胶一般只有微米的厚度,难以采集足够的样品用于研究和应用[48]。后来尝试采集液态未固化的藤壶胶,但是藤壶胶分泌量非常少,一个底盘直径8 mm的藤壶24 h只能产出约5 µL的液态胶[49]。同时,这种收集藤壶胶的方式受到藤壶个体差异的影响,只有40%−50%的藤壶个体可以分泌藤壶胶,而且藤壶胶也容易受到成虫组织液的污染,导致藤壶胶的质量受影响。由此可见,直接获取天然藤壶胶的方法,所需的藤壶数量大,获得的藤壶胶纯度低,干扰因素较多,成本高。
众多研究表明,重组粘胶蛋白在结构和功能上与直接从动物中获取的蛋白具有高度的相似性[50-51]。基于直接获取藤壶胶蛋白的困难,越来越多的研究人员采用基因工程技术来获得重组藤壶粘胶蛋白。日本Kamino课题组首次利用大肠杆菌表达系统成功表达红巨藤壶(M. rosa) Mrcp19k[18]和Mrcp20k[25]重组粘胶蛋白,重组蛋白以可溶性形式获得和纯化,实验证实重组蛋白与原蛋白结构基本相同。Liu等[35]在大肠杆菌中表达了白脊藤壶(B. albicostatus) Bacp19k的同源基因,并融合了硫氧还蛋白Trx标签,Trx-cp19k蛋白在大肠杆菌中以可溶性形式表达,2 L细菌培养物中可提取和纯化20− 50 mg Trx-cp19k蛋白。Wang等[26]利用大肠杆菌表达系统成功获得可溶性的Mrcp19k和Bacp19k重组蛋白。Tilbury等[52]利用大肠杆菌表达系统获得重组鹅颈藤壶(P. pollicipes) Ppcp19k蛋白的表达。Du[53]对白脊藤壶(B. albicostatus) Bacp20k蛋白进行了大肠杆菌系统的表达,但是获得的重组蛋白含有包涵体,仅有一半是可溶性蛋白。此外,疏水性蛋白Mrcp52k在大肠杆菌中也获得表达,但未能在毕赤酵母表达系统中获得稳定表达[47]。Cleverley等[15]对新发现的未被鉴定的藤壶胶蛋白质cp57和cp36进行体外表达,也获得可溶性蛋白。以上研究中,研究人员均利用大肠杆菌表达系统成功获得了重组藤壶粘胶蛋白(表 4)。与获取的天然藤壶胶相比,利用重组方法生产藤壶粘胶蛋白,体系条件温和,不影响蛋白的初级结构。但是尚存在一个关键问题,大肠杆菌表达系统所获得的蛋白量很低,不能满足对藤壶胶蛋白的深入研究和仿生粘附材料的开发及商业化应用。华中科技大学闫云君等[54]利用真核生物毕赤酵母表达系统,采用体外构建外源基因多拷贝和蛋白分泌表达等多策略结合的方法,将藤壶粘胶蛋白Mrcp19k和Mrcp20k的表达量提高到克级的水平(表 4)。
| Proteins | Hosts | Expression vectors | Protein solubility | Protein yield (mg/L) | References |
| Mrcp19k | Escherichia coli Origami (DE3) | pET-32b | Yes | None mentioned | [18] |
| Aacp19k | E. coli BL21 (DE3) | pET-32a(+) | Yes | 10−25 | [35] |
| Mrcp19k | E. coli BL21 | pET-28a | Yes | 10−20 | [26] |
| Aacp19k | E. coli BL21 | pET-28a | Yes | 10−20 | [26] |
| Ppcp19k | E. coli BL21 (DE3) | pIG6 | Yes | 6 | [52] |
| Mrcp19k | Pichia pastoris GS115 | pAOαN pAO815 derivative |
Yes | 503 | [54] |
| Mrcp20k | E. coli OrigamiB (DE3) | pET-32a | Yes | None mentioned | [25] |
| Facp20k | E. coli Rosetta-gami (DE3) | pET-32a | Contain 50% inclusion body | 0.4 | [53] |
| Mrcp20k | P. pastoris GS115 | pAOαN pAO815 derivative |
Yes | 621 | [54] |
| Mrcp52k | E. coli BL21 (DE3) | pET-32a | Contain inclusion body | 3.5 | [47] |
对藤壶胶粘附机制和粘胶蛋白的研究成果,为水下粘附剂的研发提供了坚实的理论基础。Fan等[55]受藤壶粘胶蛋白氨基酸组成成分的启发,开发了对各种表面材料具有可重复使用且持久用于水下粘附的水凝胶。该水凝胶具有像藤壶粘胶蛋白中富含阳离子和疏水性氨基酸的特点,可在水下通过界面静电和疏水作用牢固地粘合在各种材料的表面。这种新型的水凝胶在水下传输、水基设备、水下修复以及水下软体机器人等领域都有着广泛的应用前景[55]。Fujii等[56]利用粘胶蛋白cp52k中R-Y序列的自组装特性[27, 45],设计了用细胞粘附肽RGDS修饰R-Y的肽,从而创造出一种多肽水凝胶,为应用于组织工程支架提供了非常重要的技术支撑。Zhang等[11]在开发生物被膜的过程中,利用藤壶粘胶蛋白含有淀粉样蛋白结构的灵感,获得活体生物被膜粘合材料,该材料在金属、玻璃以及不同高分子表面均具有较好的水下粘合能力。目前藤壶胶的应用中,主要利用藤壶粘附机制或者粘胶蛋白的组成特点,采用化学合成手段或者仿生设计的方式来开发水下粘附剂,直接应用藤壶粘胶蛋白的报道较少,仅见于少量专利的报道。例如,胡碧茹等[57]通过体外重组表达的Trx- cp19k融合蛋白(硫氧还蛋白Trx和cp19k的融合),能够在合适条件下自发形成一种粘性超强的生物胶粘剂,无需其他组分的配合,可粘接铝片、塑料和猪肋骨等材料,展示出在生物医学领域的潜在应用价值。
5 总结与展望目前,商业上应用的粘胶剂在干燥环境下粘附性能很强,而在潮湿环境中粘附强度和力学性能却大幅下降。因此,研制适应水环境、兼具优秀粘附强度和出色机械性能的水下粘胶剂是一个具有挑战性的课题。虽然已经有基于贻贝足丝蛋白DOPA开发的仿生水凝胶,但是在体外环境中,DOPA发生粘附的氧化还原系统的平衡较难控制,从而影响贻贝仿生粘附剂的效果。而藤壶胶的粘附机理不同于贻贝足丝蛋白,为不经任何修饰的直接粘附,因此以藤壶粘胶蛋白为基础材料,可开发性能更佳的仿生结构水下粘附材料,具有重要的研究价值和巨大的应用前景,未来可从以下方向展开研究。
(1) 利用体外重组技术高效获取重组粘胶蛋白。藤壶胶中的粘胶蛋白是由多个蛋白组分交联而成,目前的研究多集中于单独的蛋白组分,亟需阐明各蛋白组分之间如何发挥作用。利用体外重组技术可以高效地获取大量的重组粘胶蛋白,促进对各蛋白组分之间进行自组装及交联的研究,进一步深入揭示藤壶的粘附机理。本研究团队基于毕赤酵母表达系统,采用增加藤壶胶蛋白基因拷贝数、融合脂肪酶基因、选择合适的分泌途径以及协同表达辅助因子等策略,并优化酵母工程菌发酵培养基初始pH值、接种量、甲醇添加量、诱导时间和诱导温度等参数,将目的藤壶粘胶蛋白表达量提升到克级[54],说明通过利用体外重组技术获取大量重组粘胶蛋白是可行的。另外,还可以通过基因组、转录组和蛋白质组的研究和分析,挖掘更多藤壶胶蛋白资源,特别是对那些表达量少,但是性能良好的重要蛋白的获取极为重要。
(2) 依据cp19k蛋白结构为基础设计仿生肽。藤壶与外界表面发生粘附的过程中,其分泌的藤壶胶在不同基底材料表面所呈现的微观形貌差异很大。粘胶蛋白cp19k是藤壶胶中负责与材料表面发生粘附的蛋白质,该蛋白随环境条件(pH和盐离子浓度) 的改变而表现出不同的微观形态。在我们的研究中,利用IUPred (https://iupred2a.elte.hu/) 在线软件对cp19k蛋白序列进行无序性分析,发现来自红巨藤壶(M. rosa) 的Mrcp19k、刺巨藤壶(M. volcano) 的Mvcp19k和鹅颈藤壶(P. pollicipes) 的Ppcp19k属于高度无序性蛋白,推测大多数cp19k蛋白属于无序性蛋白。其灵活多变的构象决定着功能的多样性,有助于结合到不同的基底表面,这可能也是导致藤壶胶在不同材料表面呈现不同微观形貌的主要原因。为此,可以依据cp19k蛋白结构为基础,设计一系列具有无序性蛋白特征的仿生肽,拓宽仿生粘胶蛋白资源,为仿生材料的研究和应用提供理论基础。
(3) 未来藤壶胶的创新应用。目前,对于藤壶粘胶蛋白的应用研究虽然较少,但是因其超强的水下粘附性和在仿生领域的广泛发展前景,无疑显示其具有巨大的工程化应用潜力。今后对于藤壶粘胶蛋白的工程化应用研究可以聚焦于以下3个方面:采用化学合成法模拟藤壶粘胶蛋白的序列和结构特点,获得具有粘附性的胶粘剂;将藤壶粘胶蛋白与其他具有特异功能的蛋白(如类弹性蛋白、蚕丝蛋白、蛛丝蛋白等) 进行融合设计,获得兼具藤壶胶蛋白的强粘性以及其他蛋白优良特性的复合生物仿生材料;采用代谢工程技术获得重组表达的粘胶蛋白,在体外模拟粘胶蛋白的成胶条件,探索粘胶蛋白可以直接应用的场景。
| [1] |
Sun J, Han JY, Wang F, et al. Bioengineered protein-based adhesives for biomedical applications. Chem A Eur J, 2022, 28(1): e202102902.
|
| [2] |
Zhao YH, Wu Y, Wang L, et al. Bio-inspired reversible underwater adhesive. Nat Commun, 2017, 8(1): 2218. DOI:10.1038/s41467-017-02387-2
|
| [3] |
Sun J, Su JJ, Ma C, et al. Fabrication and mechanical properties of engineered protein-based adhesives and fibers. Adv Mater, 2020, 32(6): 1906360. DOI:10.1002/adma.201906360
|
| [4] |
Wunderer J, Lengerer B, Pjeta R, et al. A mechanism for temporary bioadhesion. PNAS, 2019, 116(10): 4297-4306. DOI:10.1073/pnas.1814230116
|
| [5] |
Li X, Li SG, Huang XN, et al. Protein-mediated bioadhesion in marine organisms: a review. Mar Environ Res, 2021, 170: 105409. DOI:10.1016/j.marenvres.2021.105409
|
| [6] |
Lin HC, Wong YH, Sung CH, et al. Histology and transcriptomic analyses of barnacles with different base materials and habitats shed lights on the duplication and chemical diversification of barnacle cement proteins. BMC Genom, 2021, 22(1): 1-18. DOI:10.1186/s12864-020-07350-y
|
| [7] |
Barros NR, Chen Y, Hosseini V, et al. Recent developments in mussel-inspired materials for biomedical applications. Biomater Sci, 2021, 9(20): 6653-6672. DOI:10.1039/D1BM01126J
|
| [8] |
Ou XW, Xue B, Lao YC, et al. Structure and sequence features of mussel adhesive protein lead to its salt-tolerant adhesion ability. Sci Adv, 2020, 6(39): eabb7620. DOI:10.1126/sciadv.abb7620
|
| [9] |
Lefevre M, Flammang P, Aranko AS, et al. Sea star-inspired recombinant adhesive proteins self- assemble and adsorb on surfaces in aqueous environments to form cytocompatible coatings. Acta Biomater, 2020, 112: 62-74. DOI:10.1016/j.actbio.2020.05.036
|
| [10] |
Sanfilippo R, Rosso A, Mastandrea A, et al. Sabellaria alveolata sandcastle worm from the Mediterranean Sea: new insights on tube architecture and biocement. J Morphol, 2019, 280(12): 1839-1849. DOI:10.1002/jmor.21069
|
| [11] |
Zhang C, Huang JF, Zhang JC, et al. Engineered Bacillus subtilis biofilms as living glues. Mater Today, 2019, 28: 40-48. DOI:10.1016/j.mattod.2018.12.039
|
| [12] |
Hu SS, Pei XB, Duan LL, et al. A mussel-inspired film for adhesion to wet buccal tissue and efficient buccal drug delivery. Nat Commun, 2021, 12(1): 1689. DOI:10.1038/s41467-021-21989-5
|
| [13] |
Kamino K. Molecular design of barnacle cement in comparison with those of mussel and tubeworm. J Adhesion, 2010, 86(1): 96-110. DOI:10.1080/00218460903418139
|
| [14] |
Kamino K. Mini-review: barnacle adhesives and adhesion. Biofouling, 2013, 29(6): 735-749. DOI:10.1080/08927014.2013.800863
|
| [15] |
Cleverley R, Webb D, Middlemiss S, et al. In vitro oxidative crosslinking of recombinant barnacle cyprid cement gland proteins. Mar Biotechnol (NY), 2021, 23(6): 928-942. DOI:10.1007/s10126-021-10076-x
|
| [16] |
Saroyan JR, Lindner E, Dooley CA. Repair and reattachment in the Balanidae as related to their cementing mechanism. Biol Bull, 1970, 139(2): 333-350. DOI:10.2307/1540088
|
| [17] |
Davey PA, Power AM, Santos R, et al. Omics-based molecular analyses of adhesion by aquatic invertebrates. Biol Rev Camb Philos Soc, 2021, 96(3): 1051-1075. DOI:10.1111/brv.12691
|
| [18] |
Urushida Y, Nakano M, Matsuda S, et al. Identification and functional characterization of a novel barnacle cement protein. FEBS J, 2007, 274(16): 4336-4346. DOI:10.1111/j.1742-4658.2007.05965.x
|
| [19] |
Berglin M, Gatenholm P. The nature of bioadhesive bonding between barnacles and fouling-release silicone coatings. J Adhes Sci Technol, 1999, 13(6): 713-727. DOI:10.1163/156856199X00956
|
| [20] |
Raman S, Kumar R. Interfacial morphology and nanomechanics of cement of the barnacle, Amphibalanus reticulatus on metallic and non-metallic substrata. Biofouling, 2011, 27(6): 569-577. DOI:10.1080/08927014.2011.589027
|
| [21] |
Fears KP, Orihuela B, Rittschof D, et al. Acorn barnacles secrete phase-separating fluid to clear surfaces ahead of cement deposition. Adv Sci (Weinh), 2018, 5(6): 1700762. DOI:10.1002/advs.201700762
|
| [22] |
Estrella LA, Yates EA, Fears KP, et al. Engineered Escherichia coli biofilms produce adhesive nanomaterials shaped by a patterned 43 kDa barnacle cement protein. Biomacromolecules, 2021, 22(2): 365-373. DOI:10.1021/acs.biomac.0c01212
|
| [23] |
Gohad NV, Aldred N, Hartshorn CM, et al. Synergistic roles for lipids and proteins in the permanent adhesive of barnacle larvae. Nat Commun, 2014, 5: 4414. DOI:10.1038/ncomms5414
|
| [24] |
Liang C, Strickland J, Ye ZH, et al. Biochemistry of barnacle adhesion: an updated review. Front Mar Sci, 2019, 6: 565. DOI:10.3389/fmars.2019.00565
|
| [25] |
Mori Y, Urushida Y, Nakano M, et al. Calcite-specific coupling protein in barnacle underwater cement. FEBS J, 2007, 274(24): 6436-6446. DOI:10.1111/j.1742-4658.2007.06161.x
|
| [26] |
Wang XQ, Wang C, Xu BM, et al. Adsorption of intrinsically disordered barnacle adhesive proteins on silica surface. Appl Surf Sci, 2018, 427: 942-949.
|
| [27] |
Nakano M, Kamino K. Amyloid-like conformation and interaction for the self-assembly in barnacle underwater cement. Biochemistry, 2015, 54(3): 826-835. DOI:10.1021/bi500965f
|
| [28] |
梁超. 白脊藤壶cp19k蛋白的界面附着机理及仿生多肽研究[D]. 长沙: 国防科技大学, 2018. Liang C. Studies on the interfacial adhesion mechanisms and peptide mimics of Balanus albicostatus cp19k[D]. Changsha: National University of Defense Technology, 2018 (in Chinese). |
| [29] |
Waite JH. Mussel adhesion-essential footwork. J Exp Biol, 2017, 220(4): 517-530. DOI:10.1242/jeb.134056
|
| [30] |
Maier GP, Rapp MV, Waite JH, et al. Adaptive synergy between catechol and lysine promotes wet adhesion by surface salt displacement. Science, 2015, 349(6248): 628-632. DOI:10.1126/science.aab0556
|
| [31] |
Hwang DS, Waite JH. Three intrinsically unstructured mussel adhesive proteins, mfp-1, mfp-2, and mfp-3: analysis by circular dichroism. Protein Sci, 2012, 21(11): 1689-1695. DOI:10.1002/pro.2147
|
| [32] |
Arnold AA, Byette F, Séguin-Heine MO, et al. Solid-state NMR structure determination of whole anchoring threads from the blue mussel Mytilus edulis. Biomacromolecules, 2013, 14(1): 132-141. DOI:10.1021/bm301493u
|
| [33] |
Dosztányi Z, Csizmók V, Tompa P, et al. The pairwise energy content estimated from amino acid composition discriminates between folded and intrinsically unstructured proteins. J Mol Biol, 2005, 347(4): 827-839. DOI:10.1016/j.jmb.2005.01.071
|
| [34] |
Dosztányi Z, Csizmok V, Tompa P, et al. IUPred: web server for the prediction of intrinsically unstructured regions of proteins based on estimated energy content. Bioinformatics, 2005, 21(16): 3433-3434. DOI:10.1093/bioinformatics/bti541
|
| [35] |
Liu XP, Liang C, Zhang XK, et al. Amyloid fibril aggregation: an insight into the underwater adhesion of barnacle cement. Biochem Biophys Res Commun, 2017, 493(1): 654-659. DOI:10.1016/j.bbrc.2017.08.136
|
| [36] |
Liang C, Li Y, Liu Z, et al. Protein aggregation formed by recombinant cp19k homologue of Balanus albicostatus combined with an 18 kDa N-terminus encoded by pET-32a(+) plasmid having adhesion strength comparable to several commercial glues. PLoS One, 2015, 10(8): e0136493. DOI:10.1371/journal.pone.0136493
|
| [37] |
Liang C, Ye ZH, Xue B, et al. Self-assembled nanofibers for strong underwater adhesion: the trick of barnacles. ACS Appl Mater Interfaces, 2018, 10(30): 25017-25025. DOI:10.1021/acsami.8b04752
|
| [38] |
So CR, Yates EA, Estrella LA, et al. Molecular recognition of structures is key in the polymerization of patterned barnacle adhesive sequences. ACS Nano, 2019, 13(5): 5172-5183. DOI:10.1021/acsnano.8b09194
|
| [39] |
Kamino K. Novel barnacle underwater adhesive protein is a charged amino acid-rich protein constituted by a Cys-rich repetitive sequence. Biochem J, 2001, 356(2): 503-507. DOI:10.1042/bj3560503
|
| [40] |
He LS, Zhang G, Qian PY. Characterization of two 20 kDa-cement protein (cp20k) homologues in Amphibalanus amphitrite. PLoS One, 2013, 8(5): e64130. DOI:10.1371/journal.pone.0064130
|
| [41] |
Mohanram H, Kumar A, Verma CS, et al. Three- dimensional structure of Megabalanus rosa cement protein 20 revealed by multi-dimensional NMR and molecular dynamics simulations. Philos Trans R Soc Lond B Biol Sci, 2019, 374(1784): 20190198. DOI:10.1098/rstb.2019.0198
|
| [42] |
Kumar A, Mohanram H, Li JG, et al. Disorder-order interplay of a barnacle cement protein triggered by interactions with calcium and carbonate ions: a molecular dynamics study. Chem Mater, 2020, 32(20): 8845-8859. DOI:10.1021/acs.chemmater.0c02319
|
| [43] |
Murugan VK, Mohanram H, Budanovic M, et al. Accelerated corrosion of marine-grade steel by a redox-active, cysteine-rich barnacle cement protein. NPJ Mater Degrad, 2020, 4: 20. DOI:10.1038/s41529-020-0124-z
|
| [44] |
Nakano M, Shen JR, Kamino K. Self-assembling peptide inspired by a barnacle underwater adhesive protein. Biomacromolecules, 2007, 8(6): 1830-1835. DOI:10.1021/bm0612236
|
| [45] |
Kamino K, Nakano M, Kanai S. Significance of the conformation of building blocks in curing of barnacle underwater adhesive. FEBS J, 2012, 279(10): 1750-1760. DOI:10.1111/j.1742-4658.2012.08552.x
|
| [46] |
He LS, Zhang G, Wang Y, et al. Toward understanding barnacle cementing by characterization of one cement protein-100 kDa in Amphibalanus amphitrite. Biochem Biophys Res Commun, 2018, 495(1): 969-975. DOI:10.1016/j.bbrc.2017.11.101
|
| [47] |
曾玲. 红巨藤壶52kDa胶蛋白的异源表达与功能研究[D]. 长沙: 国防科技大学, 2016. Zeng L. Expression and functional characterization of the 52 kDa cement protein (cp-52k) in Megabalanus rosa[D]. Changsha: National University of Defense Technology, 2016 (in Chinese). |
| [48] |
Krivis AF, Martz MD. Marine adhesives. IV: hexosamine content of Balanus eburneus adhesive. Microchem J, 1973, 18(4): 354-357.
|
| [49] |
Cheung PJ, Ruggieri GD, Nigrelli RF. A new method for obtaining barnacle cement in the liquid state for polymerization studies. Mar Biol, 1977, 43(2): 157-163. DOI:10.1007/BF00391263
|
| [50] |
Hwang DS, Gim Y, Cha HJ. Expression of functional recombinant mussel adhesive protein type 3A in Escherichia coli. Biotechnol Prog, 2005, 21(3): 965-970.
|
| [51] |
Liu XP, Liang C, Zhang XK, et al. Amyloid fibril aggregation: an insight into the underwater adhesion of barnacle cement. Biochem Biophys Res Commun, 2017, 493(1): 654-659. DOI:10.1016/j.bbrc.2017.08.136
|
| [52] |
Tilbury MA, McCarthy S, Domagalska M, et al. The expression and characterization of recombinant cp19k barnacle cement protein from Pollicipes pollicipes. Philos Trans R Soc Lond B Biol Sci, 2019, 374(1784): 20190205. DOI:10.1098/rstb.2019.0205
|
| [53] |
杜丽娜. 白脊藤壶藤壶胶20K的基因克隆、表达及粘附功能研究[D]. 厦门: 厦门大学, 2011. Du LN. Cloning, expression and adhesion function research of Balanus albicostatus cement protein 20K[D]. Xiamen: Xiamen University, 2011 (in Chinese). |
| [54] |
闫云君, 张龙雨, 阎金勇, 等. 一种高效表达藤壶粘胶蛋白的酵母工程菌及其制备方法: CN113088533A. 2021-07-09. Yan YJ, Zhang LY, Yan JY, et al. Method of construction yeast engineering strain for efficiently expressing barnacle protein: CN113088533A. 2021-07- 09 (in Chinese). |
| [55] |
Fan HL, Wang JH, Gong JP. Barnacle cement proteins-inspired tough hydrogels with robust, long-lasting, and repeatable underwater adhesion. Adv Funct Mater, 2021, 31(11): 2009334. DOI:10.1002/adfm.202009334
|
| [56] |
Fujii D, Takase K, Takagi A, et al. Design of RGDS peptide-immobilized self-assembling β-strand peptide from barnacle protein. Int J Mol Sci, 2021, 22(3): 1240. DOI:10.3390/ijms22031240
|
| [57] |
胡碧茹, 曾玲, 吴文健, 等. 生物粘合剂及其制备方法和应用: CN105031717A. 2015-11-11. Hu BR, Zeng L, Wu WJ, et al. Preparation and application of biological adhesive: CN105031717A. 2015-11-11 (in Chinese). |
 2022, Vol. 38
2022, Vol. 38