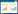中国科学院微生物研究所、中国微生物学会主办
文章信息
- 杨晨, 耿小宇, 原恺, 张娟琨, 校海霞
- YANG Chen, GENG Xiaoyu, YUAN Kai, ZHANG Juankun, XIAO Haixia
- B型流感病毒血凝素的表达及免疫原性测定
- Expression of influenza B virus hemagglutinin and its immunogenicity determination
- 生物工程学报, 2022, 38(3): 1112-1123
- Chinese Journal of Biotechnology, 2022, 38(3): 1112-1123
- 10.13345/j.cjb.210203
-
文章历史
- Received: March 11, 2021
- Accepted: May 10, 2021
2. 中国科学院天津工业生物技术研究所,天津 300308;
3. 山西高等创新研究院,山西 太原 030032
2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
3. Shanxi Academy of Advanced Research and Innovation, Taiyuan 030032, Shanxi, China
流感病毒是一种单股负链的RNA病毒,属于正粘病毒科(Orthomyxoviridae)[1]。根据其核蛋白(Nucleoprotein, NP) 的抗原性分为4种病毒类型:A、B、C和D[2-3]。其中,A型和B型流感病毒是引起季节性流行的主要原因[4-5]。据世界卫生组织(World Health Organization, WHO) 统计[4],每年约有5%–10%的成年人以及20%–30%的儿童感染季节性流感病毒。季节性流感在全球范围内已造成300万–500万例严重病例,29万–65万例流感相关死亡病例。A型流感病毒能够周期性地在动物身上出现,从而导致大流行及相关疾病与死亡[6-7];B型流感病毒的主要宿主是人类,也在海豹、雪貂中发现[8-9]。B型流感病毒也能导致严重疾病甚至死亡[10],婴儿、孕妇、老年人和免疫系统受损的患者都是B型流感病毒的易感人群[11]。
自1980年以来,根据血凝素基因序列,B型流感病毒可分为Victoria谱系和Yamagata谱系[12-13]。两种谱系在世界范围内共同传播,定期造成季节性流行,致使出现了大量人员死亡,加重了社会经济负担。在中国香港,每名感染B型流感病毒儿童的平均住院费约1 328.33美元[14]。在2014年的关于美国流感季死亡率统计中,因感染B型流感病毒死亡的人数占季节性流感死亡总人数的平均值为29%。有4个年份因B型流感病毒而死亡的人数占季节性流感死亡总人数比例较大,分别是2000–2001年占95%、2002–2003年占78%、2006–2007年占51%和2008–2009年占84%[15]。目前,对于B型流感病毒的研究及报道远少于A型流感病毒,但是B型流感病毒流行不断呈上升趋势。据美国疾控中心统计,近年在美国主要流行B型流感病毒的Victoria谱系,在2018–2019年度间零星传播,在2019–2020年初期已更频繁地传播[16]。
血凝素(hemagglutinin, HA) 蛋白是流感病毒的主要保护性抗原,能够诱导机体产生中和抗体及保护性抗体,同时也是疫苗的主要组分。神经氨酸酶(neuraminidase, NA) 是流感病毒表面的另一种重要的糖蛋白。NA在病毒复制的晚期能够催化唾液酸受体水解,从而防止HA的过度聚集,促进新生病毒颗粒从宿主细胞表面释放[17]。根据相关文献报道[18],NA在和HA共转染的状态下能够更好地模拟HA的形态帮助HA形成正确的折叠。因此,本研究将NA与HA-ecto共转染293T细胞,其目的是能够促进HA-ecto的表达,提高其产量。2020年9月和2021年2月,WHO推荐了南北半球季节性疫苗的组分,B/Victoria谱系的B/Washington/02/2019候选毒株[19],B/Yamagata谱系的B/California/12/2015来自WHO的国际标准品供应中心实验室(The National Institute for Biological Standards and Control, NIBSC)[20]。本研究采用哺乳动物细胞来表达纯化HA-ecto蛋白,能真实反映HA的糖基化修饰及其免疫原性。首先,我们通过哺乳动物细胞表达,镍离子亲和层析及分子筛纯化得到Victoria谱系B/Washington/02/2019、Yamagata谱系B/California/12/2015的HA胞外段蛋白。其次,我们通过肌肉注射免疫小鼠,测定其产生血清的抗体水平。最后,通过测定血清是否存在跨种谱系的交叉反应活性。
1 材料与方法 1.1 材料 1.1.1 细胞、病毒和质粒载体大肠杆菌(Escherichia coli) DH5α感受态细胞购自康维世纪生物有限公司;人胚肾细胞293T (human embryonic kidney, HEK-293T)、Victoria谱系B/Washington/02/2019及Yamagata谱系B/California/12/2015的病毒样颗粒(virus-like particle, VLP) 由本实验室保存;pCAGGS载体由日本东京大学Yoshihiro Kawaoka教授实验室赠送;Victoria谱系B/Washington/02/2019 (BV-WA)、Yamagata谱系B/California/12/2015 (BY-CA) 的流感毒株由中国疾控中心王大燕研究员提供。
1.1.2 主要试剂细胞培养基DMEM、胎牛血清购自Gibco公司;转染试剂线性PEI (分子量40 000) 购于Polysciences公司;胰酶(TRYPSIN 1︰250) 购于Amresco公司;HisTrapTM FF 5mL预装柱、分子筛Superdex 200 10/300GL均购于GE Healthcare公司;彩色预染蛋白Marker购于柏奥易杰(北京) 科技有限公司;anti-His鼠单克隆抗体购自康维世纪生物有限公司;辣根过氧化物酶(horseradish peroxidase, HRP) 标记的山羊抗鼠单克隆抗体购于碧云天生物技术有限公司;TMB显色液购于Solarbio公司;5周龄SPF级BALB/c (雌鼠) 购自北京维通利华实验动物技术有限公司;佐剂MINTANIDE ISA 61 VG购自SEPPIC公司;1%豚鼠红细胞购自广州鸿泉生物科技有限公司。
1.2 方法 1.2.1 基因合成与克隆构建将最新的疫苗候选毒株BV-WA、BY-CA的HA-ecto (BVHA-WA-ecto、BYHA-CA-ecto) 的密码子序列优化后构建到pCAGGS载体中,通过哺乳动物细胞表达系统进行表达。在每个编码基因的碱基序列5′端EcoRⅠ酶切位点序列GAATTC和起始密码子之间加入KOZAK序列GCCACC,在3′端终止密码子后加上XhoⅠ酶切位点CTCGAG,而后利用EcoRⅠ和XhoⅠ将目的基因构建到pCAGGS载体中。插入的目的基因片段组成:(1) BVHA-WA-ecto:BVHA-WA的HA第1–535位氨基酸(胞外段为16–535位氨基酸)、thrombin酶切识别序列为LVPRGSPGS、折叠序列GYIPEAPRDGQAYVR KDGEWVLLSTFL (维持HA三聚体形态[21-22])和HIS标签序列HHHHHH;(2) BYHA-CA-ecto:BYHA-CA的HA第1–537位氨基酸(胞外段16– 537位)、TEV酶识别序列ENLYFQSN,折叠序列GYIPEAPRDGQAYVRKDGEWVLLSTFL和HIS标签HHHHHH。基因合成、质粒构建和序列测定均由苏州金唯智生物科技有限公司完成。
1.2.2 质粒转染HEK-293T细胞用加有10%胎牛血清的DMEM培养基传代培养HEK-293T细胞,选取转染当天密度达到80%–90%的细胞。以转染1盘293T细胞为例,质粒部分:pCAGGS-HA-ecto和pCAGGS-NA- ORF两种质粒质量比为2︰1,总质量为30 μg/盘,用1 mL的NaCl缓冲液稀释。转染试剂PEI部分:转染试剂PEI质量为90 μg/盘,同样用1 mL的NaCl缓冲液稀释,各自静置5 min后,将质粒稀释液与PEI稀释液混合均匀后室温放置20 min,然后将其加至293T细胞中,十字摇匀将细胞放在细胞培养箱中培养。培养5 h后,弃去原有的培养基上清,用无菌的PBS轻轻洗3遍细胞,最后用不含胎牛血清的DMEM培养基继续培养。
1.2.3 HA-ecto的表达、纯化及粒径分析首先,收取转染后96 h的细胞上清,4 ℃、9 000 r/min离心45 min,弃去细胞沉淀。上清用0.22 μm微孔滤膜抽滤。其次,将抽滤后的上清过夜吸附至HisTrapTM FF 5 mL预装柱后,利用咪唑洗脱目的蛋白。最后,将洗脱的目的蛋白浓缩后交换为分子筛缓冲液PBS,选择分子筛Superdex 200 10/300 GL进行纯化。SDS-PAGE电泳制样时,在上样缓冲液里添加还原剂二硫苏糖醇(dithiothreitol, DTT) 用于还原状态下电泳(+DTT),不添加DTT的作为非还原电泳(–DTT)。将浓度为2 mg/mL的目的蛋白进行动态光散射(dynamic light scattering,DLS)分析,确定蛋白的均一性。
1.2.4 动物试验小鼠实验程序目前经中国科学院微生物研究所研究伦理委员会批准(SQIMCAS2020090)。选用5周龄SPF级别BALB/c雌性小鼠进行动物试验。将小鼠进行分组,一共分成3组:免疫BVHA-WA-ecto蛋白组、免疫BYHA-CA- ecto蛋白组、免疫PBS对照组,每组5只小鼠。HA-ecto蛋白用PBS进行稀释后,按照体积比4︰6加入灭菌处理的佐剂MINTANIDE ISA 61 VG[23]。对照组直接用PBS与佐剂按比例混合。用研磨器将混合液置于冰上彻底乳化。在第1天和第15天对小鼠腿部进行肌肉注射,每只小鼠的HA-ecto免疫剂量是20 μg,共计免疫2次。每一次免疫后2周通过脸颊部位采血一次,收集血清,用于ELISA和HAI测定。
1.2.5 ELISA抗体水平测定根据文献[24],为更好地显示血清中抗体的水平,采用ELISA方法进行检测。首先,将BVHA-WA-ecto或BYHA-CA-ecto蛋白按照200 ng/孔分别包被到96孔板上,4 ℃过夜。第二天用5%脱脂奶粉封闭1 h,然后用PBST (PBS与0.05% Tween-20,pH 7.4) 进行洗板3次,每次5 min;其次,加入小鼠血清或anti-His鼠单克隆抗体、阴性对照血清。血清或抗体用PBS稀释的起始倍数为1︰400,然后按2倍比梯度稀释。将稀释的血清或anti-His鼠单克隆抗体加入到包被抗原的96孔板中,100 μL/孔;血清吸附1 h后,用PBST洗3次,每次5 min;再加入1︰200倍稀释的HRP-山羊抗鼠单克隆抗体,100 μL/孔,室温作用1 h,而后PBST洗板3次,每次5 min;接着,每孔加入50 μL TMB显色液显色1 min,再加入50 μL 2 mol/L H2SO4终止反应。最后,用酶标仪读取450 nm处吸光值,采用GraphPad Prism 7软件分析实验数据。
1.2.6 HAI抗体水平测定根据WHO《流感实验室诊断和监测手册》的规定[25],进行了血凝及HAI测定。首先,测定病毒或VLP的血凝效价。取25 μL PBS加入到96孔“U”型板中,在第一孔中加入25 μL病毒或VLP,然后2倍比稀释,最后在每孔中加25 μL的1%豚鼠红细胞,4 ℃静置45 min,观察并记录血凝结果。其次,测定HAI效价。取25 μL PBS和25 μL相对应的小鼠首免和二免血清(56 ℃灭活30 min) 加入到96孔“U”型板中,并逐个进行2倍比稀释。以BV-WA的毒株或对应的VLP,BY-CA的毒株或VLP作为抗原,按照4个抗原单位稀释,并向每孔加入25 μL的单位抗原,室温反应1 h,最后每孔加入50 μL的1%豚鼠红细胞,4 ℃静置45 min,观察并记录结果。
2 结果与分析 2.1 HA-ecto蛋白的表达纯化及粒径分析细胞转染上清中的BVHA-WA-ecto和BYHA-CA-ecto经过镍柱亲和层析纯化后,目的蛋白选用分子筛Superdex 200 10/300 GL纯化,最终得到2种BHA-ecto蛋白的相对纯度均在91%以上,且BVHA-WA-ecto和BYHA-CA- ecto蛋白产量分别为0.47 mg/L和0.64 mg/L。结果显示,2种HA-ecto蛋白均有少量多聚体,其余大多是三聚体形式。BVHA-WA-ecto分子筛层析显示三聚体在12.03 mL出峰,其带标签的单体理论分子量为62 kDa,由于存在10个糖基化修饰,SDS-PAGE胶图显示还原状态下(+DTT) 条带在75 kDa左右,非还原状态(–DTT) 条带略高(图 1A)。BYHA-CA-ecto的三聚体出峰位置在分子筛上显示为11.84 mL,带标签的BYHA-CA-ecto单体理论分子量为63 kDa,存在9个糖基化的修饰,在SDS-PAGE胶图显示+DTT条带出现在75 kDa左右,–DTT的非还原状态下,BHA在SDS-PAGE变性胶出现的条带比单体的形式要高一些。这可能是因为在非还原状态下,HA单体间的连接不完全依靠二硫键的作用,而是一些非共价键或疏水作用,使得B型流感病毒的HA-ecto在变性条件下电泳出现单体间的交联[26-27],在SDS-PAGE胶图上显示的条带近似二聚体形式(图 1B)。DLS结果显示,BVHA-WA-ecto的单个球状颗粒粒径中值为13.8 nm,平均直径为14.3 nm;BYHA-CA-ecto的单个球状颗粒粒径中值为12.8 nm,平均直径为13.1 nm。两者的粒径分布系数(particle dispersion index, PDI) 分别为0.060和0.063 (图 1C–D),接近0.05,说明两个HA-ecto蛋白是近似单分散体系(即形式均一的单一蛋白)。DLS的峰图曲线显示,HA-ecto蛋白粒径的分布满足对数正态分布,球状颗粒聚集形态在0–500 nm粒径的吸光度范围(S曲线)内均只有一个单峰出现,也证明粒子整体是以一种状态存在。
|
| 图 1 BHA-ecto蛋白分子筛层析纯化及粒径分析 Fig. 1 Purification of BHA-ecto proteins by size exclusion chromatography and particle size analysis. (A) BVHA-WA-ecto was purified by Superdex 200 10/300 GL, M stands for marker, the long black arrow points to the collection samples of peak fraction on the SDS-PAGE gel. The short black arrow refers to the BVHA-WA-ecto, the molecular weight is 75 kDa. (B) BYHA-CA-ecto was purified by Superdex 200 10/300 GL, M stands for marker, the long black arrow points to the collection samples of peak fraction on the SDS-PAGE gel. The short black arrow refers to the BYHA-CA-ecto, the molecular weight is 75 kDa. (C) DLS of BVHA-WA-ecto, log-normal distribution stands for particle size range, S curve stands for the intensity. (D) DLS of BYHA-CA-ecto, log-normal distribution stands for particle size range, S curve stands for the intensity. |
| |
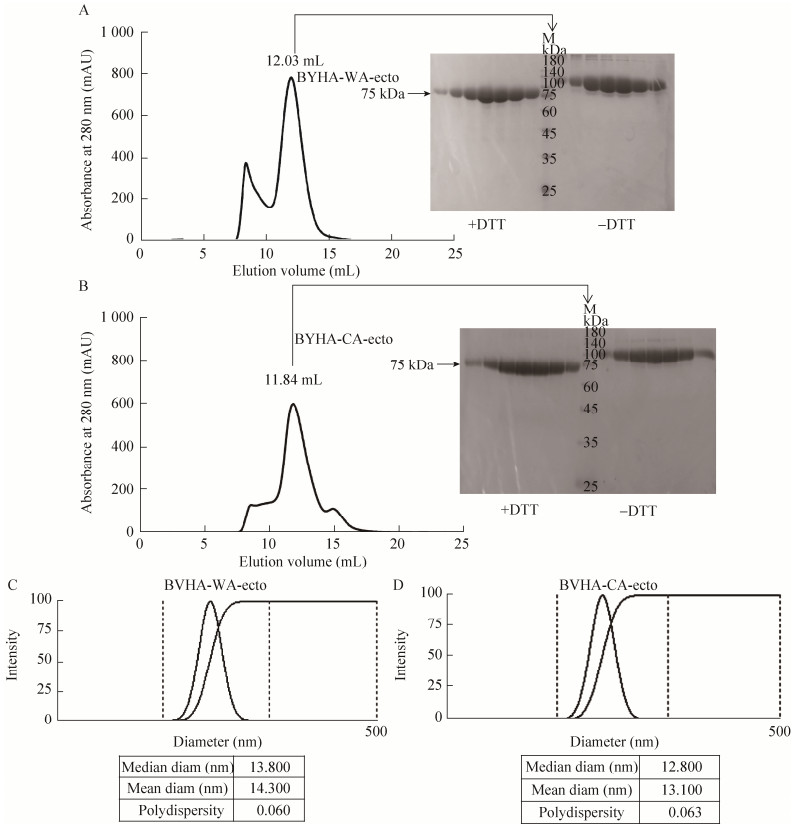
为检测免疫小鼠对整个抗原HA-ecto的免疫反应,我们测定了小鼠血清中针对HA-ecto的ELISA反应。BVHA-WA-ecto蛋白及BYHA- CA-ecto蛋白分别包被在96孔板上,对应一抗为BVHA-WA-ecto首免、二免血清和BYHA- CA-ecto首免、二免血清,二抗为HRP标记的山羊抗鼠抗体,阴性对照为免疫PBS的血清。结果发现,BVHA-WA-ecto和BYHA-CA-ecto均能诱导小鼠产生一定水平的抗体。首免BVHA-WA-ecto和BYHA-CA-ecto的小鼠血清的抗体半最大效应浓度(concentration for 50% of maximal effect, EC50) 平均值分别为2.53×10–3、1.45×10–3,二免后血清的抗体EC50平均值分别为1.97×10–4、3.46×10–4。统计学分析发现,BVHA-WA-ecto首免与对照组、二免与对照组存在极显著以上水平差异,首免与二免之间存在极显著水平差异(图 2A)。BYHA- CA-ecto首免血清与对照存在极显著差异,二免与对照组存在极显著水平差异,且显著性更强,首免与二免有显著水平差异(图 2B)。ELISA结果表明,2种HA-ecto均能诱导小鼠产生相应的抗体,且二免后抗体水平均较高。
|
| 图 2 同源ELISA抗体水平测定 Fig. 2 Antibody titers detected by homologous ELISA. (A) ELISA titers of BVHA-WA-ecto immunized mouse serum against BVHA-WA-ecto protein. (B) ELISA titers of BYHA-CA-ecto immunized mouse serum against BYHA-CA-ecto protein. Unpaired t-test, **: P < 0.01, ***: P < 0.001, ****: P < 0.000 1. |
| |
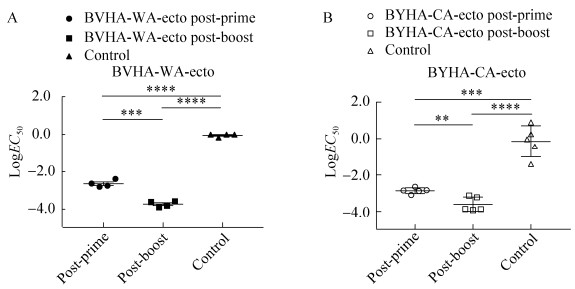
为测定2种BHA-ecto免疫小鼠后产生的抗体同异源B型流感病毒的HA-ecto蛋白之间是否有交叉反应活性,同样选择ELISA来检测。首先,包被BYHA-CA的HA-ecto蛋白,用BVHA-WA-ecto免疫小鼠血清测定交叉反应活性。其次,包被BVHA-WA的HA-ecto蛋白,用BYHA-CA-ecto血清测定。结果发现,BVHA-WA-ecto和BYHA-CA-ecto首免血清的抗体EC50平均值分别为7.58×10–2和2.91,二免血清的抗体EC50平均值分别为2.03×10–4和2.12×10–4,二免后血清对异源HA-ecto蛋白的交叉反应有大幅度提高。统计学分析发现,BVHA-WA-ecto首免血清与对照相比有显著差异,二免血清与对照组比差异水平达到极显著,首免血清与二免血清相比差异显著(图 3A)。BYHA-CA-ecto二免血清与对照组表现出极显著差异水平,首免血清与二免血清差异显著(图 3B)。异源ELISA结果显示,两种BHA-ecto首免的血清对异源BHA-ecto的交叉反应活性较低,第二次免疫小鼠后产生的血清对异源的BHA-ecto有较强的交叉反应活性。
|
| 图 3 异源ELISA抗体水平测定 Fig. 3 Antibody titers detected by heterologous ELISA. (A) ELISA titers of BVHA-WA-ecto immunized mouse serum against heterologous BYHA-CA-ecto protein. (B) ELISA titers of BYHA-CA-ecto immunized mouse serum against heterologous BVHA-WA-ecto protein. Unpaired t-test, **: P < 0.01, ****: P < 0.000 1. (There was no difference between the first immunization and the control, so it was not shown). |
| |
为测定小鼠免疫血清中针对BHA头部区的受体结合部位的抗体水平,我们利用病毒和VLP进行小鼠血清的HAI抗体水平测定。结果发现,BVHA-WA-ecto和BYHA-CA-ecto首免后能够诱导小鼠产生一定水平的HAI抗体,HAI效价范围分别在24–25、25–26;2个HA-ecto蛋白二免后抗体水平提高,HAI效价范围分别为27–28和27–29。统计学分析发现,BVHA-WA- ecto首免与二免的效价差异达到显著水平(图 4A)。BYHA-CA-ecto首免血清与二免血清抗体效价存在差异(图 4B)。与此同时发现,对于同源的病毒及VLP,首免后的血清均显示出了HAI抗体效价,随着免疫次数增加,HAI抗体水平也随之提高。另外,研究发现,利用活病毒和不具有感染性的VLP测定的小鼠血清中的HAI抗体水平是相一致的。
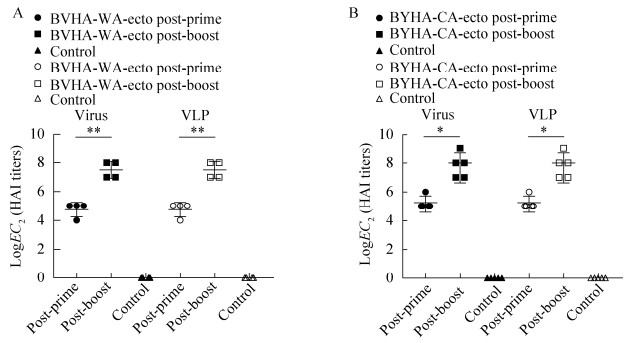
|
| 图 4 同源血清HAI抗体效价测定 Fig. 4 HAI titers of BVHA-WA-ecto immunized mouse serum against BV-WA virus and VLP (A) and HAI titers of BYHA-CA-ecto immunized mouse serum against BY-CA virus and VLP (B). Unpaired t-test, *: P < 0.05, **: P < 0.01. |
| |
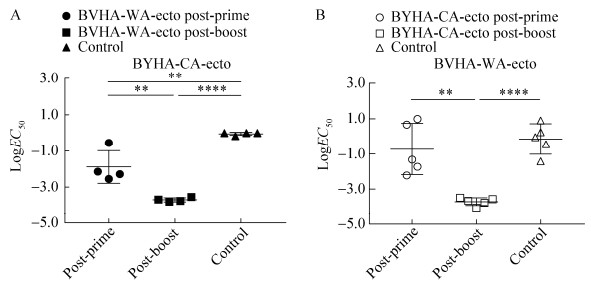
为测定2种BHA-ecto免疫小鼠后产生的抗体同异源病毒之间是否有交叉反应活性,同样选择HAI来检测。同源HAI结果显示,血清对于病毒及VLP的反应是一致的,且出于安全和实验操作方便考虑,检测交叉反应活性时,VLP作为抗原进行异源HAI测定。结果发现,BVHA-WA-ecto首免的血清对异源BY-CA的VLP和BYHA-CA-ecto的首免血清对异源BV-WA的VLP作用效果较低,效价分别在20–22和20–23,两种HA-ecto二免血清效价均提高,范围均在27–28。统计学分析发现,BVHA-WA- ecto首免与二免的效价存在显著差异,二免与对照组差异显著,首免与对照组没有差异,说明二免后的血清表现出对异源VLP的交叉反应活性(图 5A)。BYHA-CA-ecto首免与二免血清水平存在极显著差异,二免与对照组差异极显著,首免与对照组无差异(图 5B)。BVHA-WA- ecto和BYHA-CA-ecto第二次免疫的血清都表现出较高的对于异源VLP的交叉活性,且抑制水平相当,这与ELISA结果相一致。
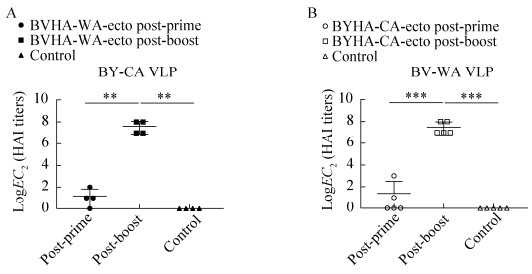
|
| 图 5 异源血清HAI抗体效价测定 Fig. 5 HAI titers of BHA-ecto immunized mouse serum against heterologous influenza B virus and VLP. (A) HAI titers of BVHA-WA-ecto immunized mouse serum against BY-CA VLP. (B) HAI titers of BYHA-CA-ecto immunized mouse serum against BV-WA VLP. **: P < 0.01, ***: P < 0.001. |
| |
B型流感病毒虽不及A型流感病毒变异速度快,感染病例也没有A型多,但是患病后的严重程度和反应是与A型流感病毒相当的。近年来,B型流感病毒的流行占据越来越多的比重。目前来说接种疫苗是预防流感最有效的措施。目前临床使用的季节性流感疫苗包括灭活疫苗、减毒活疫苗和昆虫杆状病毒系统生产的重组HA亚单位疫苗[28-29]。在接种鸡胚扩增病毒制备的裂解疫苗Fluzone后[30-31],能够在人体内诱导产生的抗体对于B型流感病毒的HAI效价范围在27–28;Fluzone能够在接种动物时产生抗体[32-33],对于A型流感病毒的HAI效价范围在24–26。接种MDCK细胞扩增制备的灭活疫苗Fluelvax后也能够在人体内产生的抗体[31, 34],其针对B型流感病毒的HAI效价在25–26。接种重组HA亚单位疫苗Flublok后[31],在人体内诱导产生针对B型流感病毒的HAI效价范围为26–27;在小鼠内诱导产生的[35]HAI效价在22–24。有研究[35]将B/Colorado/06/2017的重组HA蛋白合成到新型疫苗接种系统VaxiPatchTM中,该系统由亚单位糖蛋白疫苗抗原、佐剂和皮肤传递组成,通过哺乳动物细胞表达,加佐剂进行免疫小鼠,最终诱导产生的抗体HAI效价可达28。本研究中通过哺乳动物细胞表达的B型流感病毒疫苗候选毒株的HA蛋白,免疫小鼠后能够在小鼠体内诱导产生抗体的同源HAI效价在27–29,对于B型流感病毒的交叉反应的HAI效价在27–28,相比较而言有很好的应用前景。
目前正在进行临床试验的重组蛋白的通用疫苗M-001是包含有H1N1、H3N2及B型流感病毒株的HA、NP和M1等蛋白重组合成的,接种500 μg含有佐剂的疫苗人群对于疫苗的反应产生的抗体滴度增加了50倍,目前在进行Ⅲ期临床(临床登记号:NCT03450915)[36-37];FLU-v疫苗是合成的多肽通用疫苗,包括人及动物的A型和B型流感病毒的NP、M1和M2蛋白的高度保守区域,同样已经进行到了Ⅱb期临床(临床登记号:NCT03180801),被证实对于B型流感病毒有一定的保护作用[38-39]。在接受FLU-v疫苗接种后的受试者中,最多会导致出现中轻度至中度流感症状,发病率在2.6%– 32.5%,有着较好的保护作用[40]。预计2021年4月完成Ⅲ期临床试验(临床登记号:NCT04646590)[41]的新冠病毒重组亚单位疫苗ZF2001由哺乳动物的CHO细胞表达纯化,说明通过哺乳动物细胞表达系统纯化的亚单位疫苗具有较强的应用性。
本研究表明,哺乳动物细胞表达系统表达产生的BHA-ecto蛋白具有很好的免疫原性,能够诱导机体产生一定水平的抗体,可以作为亚单位疫苗的候选。本研究疫苗抗原的制备不限于病毒扩增,如鸡胚扩增等,且能够迅速应对流感病毒的变异,利用悬浮细胞,如CHO进行大批量的生产。沿袭新冠病毒的重组RBD二聚体亚单位疫苗的研发和临床使用历程,哺乳动物细胞表达系统纯化的流感病毒亚单位疫苗将会是一种新的趋势。
| [1] |
Stöhr K. Influenza——WHO cares. Lancet Infect Dis, 2002, 2(9): 517. DOI:10.1016/S1473-3099(02)00366-3
|
| [2] |
Lin TY, Brass AL. Host genetic determinants of influenza pathogenicity. Curr Opin Virol, 2013, 3(5): 531-536. DOI:10.1016/j.coviro.2013.07.005
|
| [3] |
Hause BM, Collin EA, Liu R, et al. Characterization of a novel influenza virus in cattle and swine: proposal for a new genus in the Orthomyxoviridae family. mBio, 2014, 5(2): e00031-14.
|
| [4] |
Iuliano AD, Roguski KM, Chang HH, et al. Estimates of global seasonal influenza-associated respiratory mortality: a modelling study. Lancet, 2018, 391(10127): 1285-1300. DOI:10.1016/S0140-6736(17)33293-2
|
| [5] |
Lafond KE, Nair H, Rasooly MH, et al. Global role and burden of influenza in pediatric respiratory hospitalizations, 1982–2012: a systematic analysis. PLoS Med, 2016, 13(3): e1001977. DOI:10.1371/journal.pmed.1001977
|
| [6] |
Puzelli S, Frezza F, Fabiani C, et al. Changes in the hemagglutinins and neuraminidases of human influenza B viruses isolated in Italy during the 2001–02, 2002–03, and 2003–04 seasons. J Med Virol, 2004, 74(4): 629-640. DOI:10.1002/jmv.20225
|
| [7] |
Virk RK, Jayakumar J, Mendenhall IH, et al. Divergent evolutionary trajectories of influenza B viruses underlie their contemporaneous epidemic activity. PNAS, 2020, 117(1): 619-628. DOI:10.1073/pnas.1916585116
|
| [8] |
Tan J, Asthagiri Arunkumar G, Krammer F. Universal influenza virus vaccines and therapeutics: where do we stand with influenza B virus?. Curr Opin Immunol, 2018, 53: 45-50. DOI:10.1016/j.coi.2018.04.002
|
| [9] |
Osterhaus AD, Rimmelzwaan GF, Martina BE, et al. Influenza B virus in seals. Science, 2000, 288(5468): 1051-1053. DOI:10.1126/science.288.5468.1051
|
| [10] |
Su S, Chaves SS, Perez A, et al. Comparing clinical characteristics between hospitalized adults with laboratory-confirmed influenza A and B virus infection. Clin Infect Dis, 2014, 59(2): 252-255. DOI:10.1093/cid/ciu269
|
| [11] |
Wu P, Goldstein E, Ho LM, et al. Excess mortality associated with influenza A and B virus in Hong Kong, 1998–2009. J Infect Dis, 2012, 206(12): 1862-1871. DOI:10.1093/infdis/jis628
|
| [12] |
Rota PA, Wallis TR, Harmon MW, et al. Cocirculation of two distinct evolutionary lineages of influenza type B virus since 1983. Virology, 1990, 175(1): 59-68. DOI:10.1016/0042-6822(90)90186-U
|
| [13] |
Kanegae Y, Sugita S, Endo A, et al. Evolutionary pattern of the hemagglutinin gene of influenza B viruses isolated in Japan: cocirculating lineages in the same epidemic season. J Virol, 1990, 64(6): 2860-2865. DOI:10.1128/jvi.64.6.2860-2865.1990
|
| [14] |
Chiu SS, Chan KH, So LY, et al. The population based socioeconomic burden of pediatric influenza-associated hospitalization in Hong Kong. Vaccine, 2012, 30(10): 1895-1900. DOI:10.1016/j.vaccine.2011.12.027
|
| [15] |
Matias G, Taylor R, Haguinet F, et al. Estimates of mortality attributable to influenza and RSV in the United States during 1997–2009 by influenza type or subtype, age, cause of death, and risk status. Influenza Other Respir Viruses, 2014, 8(5): 507-515. DOI:10.1111/irv.12258
|
| [16] |
Epperson S, Davis CT, Brammer L, et al. Update: influenza activity—United States and worldwide, May 19–September 28, 2019, and composition of the 2020 southern hemisphere influenza vaccine. MMWR Morb Mortal Wkly Rep, 2019, 68(40): 880-884. DOI:10.15585/mmwr.mm6840a3
|
| [17] |
Von Itzstein M. The war against influenza: discovery and development of sialidase inhibitors. Nat Rev Drug Discov, 2007, 6(12): 967-974. DOI:10.1038/nrd2400
|
| [18] |
Hsu HL, Millet JK, Costello DA, et al. Viral fusion efficacy of specific H3N2 influenza virus reassortant combinations at single-particle level. Sci Rep, 2016, 6: 35537. DOI:10.1038/srep35537
|
| [19] |
Recommended composition of influenza virus vaccines for use in the 2020–2021 northern hemisphere influenza season[EB/OL]. [2021-04-05]. https://www.who.int/influenza/vaccines/virus/recommendations/2021_south/en/.
|
| [20] |
Current availability from NIBSC of candidate influenza vaccine viruses, SRD reagents and neuraminidase reagents for use in the 2021–22 northern hemisphere season and 2021 southern hemisphere season[EB/OL]. [2021-04-05]. https://www.nibsc.org/science_and_research/virology/influenza_resource_/full_reagent_update.aspx.
|
| [21] |
Güthe S, Kapinos L, Möglich A, et al. Very fast folding and association of a trimerization domain from bacteriophage T4 fibritin. J Mol Biol, 2004, 337(4): 905-915. DOI:10.1016/j.jmb.2004.02.020
|
| [22] |
Zhang W, Qi JX, Shi Y, et al. Crystal structure of the swine-origin A (H1N1)-2009 influenza A virus hemagglutinin (HA) reveals similar antigenicity to that of the 1918 pandemic virus. Protein Cell, 2010, 1(5): 459-467. DOI:10.1007/s13238-010-0059-1
|
| [23] |
Iz SG, Metiner PS, Kimiz I, et al. Polyclonal antibody production against hapten-structured KDN molecule by using different adjuvants alternative to freund's adjuvant. Eur J Ther, 2018, 106-111. DOI:10.5152/EurJTher.2018.400
|
| [24] |
Carreño JM, Strohmeier S, Kirkpatrick Roubidoux E, et al. H1 hemagglutinin priming provides long-lasting heterosubtypic immunity against H5N1 challenge in the mouse model. mBio, 2020, 11(6): e02090-20.
|
| [25] |
World Health Organization (2011). Manual for the laboratory diagnosis and virological surveillance of influenza[EB/OL]. [2021-05-02]. https://www.who.int/influenza/gisrs_laboratory/manual_diagnosis_surveillance_influenza/en/.
|
| [26] |
Lee PS, Zhu X, Yu W, et al. Design and structure of an engineered disulfide-stabilized influenza virus hemagglutinin trimer. J Virol, 2015, 89(14): 7417-7420. DOI:10.1128/JVI.00808-15
|
| [27] |
Tao Y, Strelkov SV, Mesyanzhinov VV, et al. Structure of bacteriophage T4 fibritin: a segmented coiled coil and the role of the C-terminal domain. Structure, 1997, 5(6): 789-798. DOI:10.1016/S0969-2126(97)00233-5
|
| [28] |
Moa AM, Chughtai AA, Muscatello DJ, et al. Immunogenicity and safety of inactivated quadrivalent influenza vaccine in adults: a systematic review and meta-analysis of randomised controlled trials. Vaccine, 2016, 34(35): 4092-4102. DOI:10.1016/j.vaccine.2016.06.064
|
| [29] |
Del Giudice G, Rappuoli R. Inactivated and adjuvanted influenza vaccines. Curr Top Microbiol Immunol, 2015, 386: 151-180.
|
| [30] |
Frenck RW, Belshe R, Brady RC, et al. Comparison of the immunogenicity and safety of a split-virion, inactivated, trivalent influenza vaccine (Fluzone®) administered by intradermal and intramuscular route in healthy adults. Vaccine, 2011, 29(34): 5666-5674. DOI:10.1016/j.vaccine.2011.06.010
|
| [31] |
Richards KA, Moritzky S, Shannon I, et al. Recombinant HA-based vaccine outperforms split and subunit vaccines in elicitation of influenza-specific CD4 T cells and CD4 T cell-dependent antibody responses in humans. NPJ Vaccines, 2020, 5: 77. DOI:10.1038/s41541-020-00227-x
|
| [32] |
Carroll TD, Matzinger SR, Barro M, et al. Alphavirus replicon-based adjuvants enhance the immunogenicity and effectiveness of Fluzone® in rhesus macaques. Vaccine, 2011, 29(5): 931-940. DOI:10.1016/j.vaccine.2010.11.024
|
| [33] |
Corder BN, Bullard BL, DeBeauchamp JL, et al. Influenza H1 mosaic hemagglutinin vaccine induces broad immunity and protection in mice. Vaccines (Basel), 2019, 7(4): 195. DOI:10.3390/vaccines7040195
|
| [34] |
Manini I, Domnich A, Amicizia D, et al. Flucelvax (Optaflu) for seasonal influenza. Expert Rev Vaccines, 2015, 14(6): 789-804. DOI:10.1586/14760584.2015.1039520
|
| [35] |
Ellison TJ, Talbott GC, Henderson DR. VaxiPatch™, a novel vaccination system comprised of subunit antigens, adjuvants and microneedle skin delivery: an application to influenza B/Colorado/06/2017. Vaccine, 2020, 38(43): 6839-6848. DOI:10.1016/j.vaccine.2020.07.040
|
| [36] |
Atsmon J, Kate-Ilovitz E, Shaikevich D, et al. Safety and immunogenicity of multimeric-001—a novel universal influenza vaccine. J Clin Immunol, 2012, 32(3): 595-603. DOI:10.1007/s10875-011-9632-5
|
| [37] |
Atsmon J, Caraco Y, Ziv-Sefer S, et al. Priming by a novel universal influenza vaccine (multimeric-001)— a gateway for improving immune response in the elderly population. Vaccine, 2014, 32(44): 5816-5823. DOI:10.1016/j.vaccine.2014.08.031
|
| [38] |
Pleguezuelos O, Robinson S, Stoloff GA, et al. Synthetic influenza vaccine (FLU-v) stimulates cell mediated immunity in a double-blind, randomised, placebo-controlled PhaseⅠtrial. Vaccine, 2012, 30(31): 4655-4660. DOI:10.1016/j.vaccine.2012.04.089
|
| [39] |
Van Doorn E, Pleguezuelos O, Liu H, et al. Evaluation of the immunogenicity and safety of different doses and formulations of a broad spectrum influenza vaccine (FLU-v) developed by SEEK: study protocol for a single-center, randomized, double-blind and placebo-controlled clinical phase Ⅱb trial. BMC Infect Dis, 2017, 17(1): 241. DOI:10.1186/s12879-017-2341-9
|
| [40] |
TRIAL C. Efficacy of FLU-v in an H1N1 influenza human challenge model[EB/OL]. [2021-04-08]. https://clinicaltrials.gov/ct2/show/NCT03180801?term=FLUv&rank=1.
|
| [41] |
Yang SL, Li Y, Dai LP, et al. Safety and immunogenicity of a recombinant tandem-repeat dimeric RBD-based protein subunit vaccine (ZF2001) against COVID-19 in adults: two randomised, double- blind, placebo-controlled, phase 1 and 2 trials. Lancet Infect Dis, 2021, 21(8): 1107-1119. DOI:10.1016/S1473-3099(21)00127-4
|
 2022, Vol. 38
2022, Vol. 38