中国科学院微生物研究所、中国微生物学会主办
文章信息
- 许瑞, 龙欢, 汪迎晖, 黄开耀
- XU Rui, LONG Huan, WANG Yinghui, HUANG Kaiyao
- 用于超声造影的微囊藻气囊提取新方法
- A new method for isolating gas vesicles from Microcystis for ultrasound contrast
- 生物工程学报, 2022, 38(4): 1589-1601
- Chinese Journal of Biotechnology, 2022, 38(4): 1589-1601
- 10.13345/j.cjb.210265
-
文章历史
- Received: March 30, 2021
- Accepted: May 26, 2021
- Published: June 2, 2021
2. 中国科学院大学, 北京 100049;
3. 武汉大学中南医院, 湖北 武汉 430072
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Zhongnan Hospital of Wuhan University, Wuhan 430072, Hubei, China
超声成像作为临床诊断和生物学研究的常用手段,具有高时空分辨率、深穿透性和低成本等优点[1-3],特别是超声造影剂的靶向修饰可在分子水平上无创显示血栓、炎症及肿瘤血管,拓宽了传统成像模式的诊断能力和实用性[4-5]。携带药物的造影剂在受到低强度的超声辐射时,发生爆破并释放药物,发生空化效应,使附近的毛细血管和细胞通透性增高,提高组织对药物的摄取率。因而超声造影剂在脑部、心血管和癌症等重大疾病的检测和治疗中具有较好的应用前景[6-9]。
目前,临床上使用较多的造影剂是人工合成的由脂质、聚合物或蛋白外壳包裹气体的微泡,直径为几微米(1–8 μm),体积较大,无法穿过血管壁进入非血管肿瘤部位成像,使其在医学应用中受到了限制[10],同时还存在生物安全性的问题。
最近研究发现,来源于蓝藻和古菌内的气囊能显著增强超声成像的效果[11]。气囊蛋白外壳包裹的内部气体和周围介质之间的声阻抗不同使其能够散射声波,产生谐波信号,显著增强含气囊区域的对比度,并提供可区分的超声信号。并由于其纳米级尺寸,使气囊在超声成像中展现出巨大的潜力[12-13]。
气囊主要存在于蓝藻和古菌中,参与气囊形成的基因有gvpA1A2A3CNKJKFGWV,其中Gvp A和Gvp C是形成气囊的主要结构蛋白[14]。Gvp A具有很强的疏水性,在气囊壁上形成间距为4.6 nm的棱纹结构。Gvp C与Gvp A相互作用增强气囊壁的强度[15]。其他蛋白功能未知。为了将气囊广泛应用于临床研究中,2018年Shapiro团队通过基因工程的方法将表达气囊的基因簇(ARG1) 在肠道益生菌ECN (Escherichia coli strain Nissle 1917) 中表达,实现了微生物活体超声成像[16]。另外,Farhadi等将mARGs稳定表达于人体肾脏细胞,HEK-293T之后将含有气囊的HEK-293T注射于免疫缺陷小鼠腹部构建肿瘤模型,在超声成像下,可清晰地勾勒出肿瘤组织的轮廓[17]。这些研究表明气囊可以作为一种新型的超声造影剂。
除上述在异源细胞中表达气囊基因获得气囊以外,还可以直接从蓝藻或古菌中提取气囊,直接或修饰后进行超声成像[18-20]。藻类易于培养,且气囊含量丰富,是理想的气囊制备原料。前人通过摸索建立了从铜绿微囊藻提取气囊的方法[21],这里称为“高渗裂解法”。但该方法操作烦琐、耗时长、得率低,不适用于气囊的大规模提取。
鉴于此,本文建立了一个快速、高效提取微囊藻气囊的方法(H2O2法),为进一步开发生物合成的超声造影剂提供了技术支撑,展现出较好的工业潜力,同时也为研究气囊的精细结构提供了原材料。
1 材料与方法 1.1 藻种与培养藻种:微囊藻FACHB-2329、FACHB-1326、FACHB-928、FACHB-1416、FACHB-930和珠海微囊藻从国家水生生物种质资源库(http://algae.ihb.ac.cn/) 获得。
培养:将藻置于500 mL锥形瓶(200 mL培养基) 培养,温度为28 ℃,光照强度为20 μmol/(m2·s),光暗比为14 h︰10 h,接种量为4×105个/mL,待藻生长到对数期进行后续实验。
BG11培养基:1 L去离子水中含有1.5 g NaNO3、40 mg K2HPO4、75 mg MgSO4·7H2O、36 mg CaCl2·2H2O、6 mg柠檬酸、6 mg柠檬酸铁、1 mg Na2EDTA、20 mg Na2CO3、1 mL A5 (trace mental solution);其中A5组成为1 L去离子水中含有2.86 g H3BO3、1.86 g MnCl2·H2O、0.222 g ZnSO4·7H2O、0.079 g CuSO4·5H2O、0.39 g Na2MoO4·2H2O和0.049 g Co(NO3)2·6H2O。最终使用1 mol/L NaOH将培养基pH调整到9.5。
1.2 建立新型提取微囊藻气囊的方法Drábková等研究显示H2O2能有效抑制大部分蓝藻类群的生长[22],且H2O2能分解为水和氧气,满足了气囊作为造影剂的无毒性要求。所以选用H2O2作为主要试剂,建立了一个简便、高效提取微囊藻气囊的方法。
1.2.1 确定最佳藻细胞浓度在6个50 mL锥形瓶中分别加入10 mL的藻液,分别将对数期的细胞稀释或浓缩至0.5×107个/mL、1.0×107个/mL、2×107个/mL、3×107个/mL、4×107个/mL和8×107个/mL,各加入终浓度0.02 mol/L的H2O2,置于摇床上,转速为65 r/min,过夜处理。以上做3组生物学重复。
1.2.2 确定过氧化氢的最佳终浓度取一瓶生长到对数期的藻,将细胞浓度调整为3×107个/mL。分别加入终浓度为0.002 mol/L、0.01 mol/L、0.02 mol/L、0.05 mol/L、1 mol/L、3.5 mol/L和7 mol/L的H2O2溶液;置于摇床上,设置转速为65 r/min,过夜处理。以上做3组生物学重复。
1.2.3 确定最佳处理时间取一瓶对数期的藻,将细胞浓度调整为3×107个/mL,加入终浓度为1 mol/L的H2O2溶液。置于摇床上,以65 r/min的转速,分别处理5 min、10 min、30 min、60 min、120 min和240 min。以上做3组重复实验。
1.2.4 收获气囊藻液经H2O2溶液处理之后,分装于15 mL的离心管,置于离心机(AVANTI J-E,Beckman)中,在4 ℃、400×g离心2 h (重复操作至离心管上层不再有白色乳状物);用注射器将上层的白色乳状物吸取到1.5 mL EP管中,与0.01 mol/L PBS溶液(pH 7.4) 以1︰1混匀,400×g离心(4 ℃,1 h),收集上层白色乳状物。重复3次。白色雾状物即为气囊。
1.2.5 各实验组提取气囊的量的比较统计各实验组提取到的气囊溶液的体积v;使用氨基黑定量法定量,计算出气囊溶液中的蛋白浓度c;得到气囊溶液中总蛋白的量n=v×c。
1.2.6 藻细胞全蛋白、藻渣残留蛋白及其气囊蛋白样品制备藻细胞全蛋白及藻渣残留蛋白样品:6 000 r/min离心5 min,收集藻细胞或提取过气囊的藻渣;用1 mL的细胞裂解液(20 mmol/L Tris-HCl (pH 7.5)、150 mmol/L NaCl、1% DDM (十二烷基-beta-d-麦芽糖苷)、1 mmol/L PMSF (苯甲基磺酰氟)) 重悬藻细胞或藻渣;以20%的振幅,冰水浴超声10 min,超声时间5 s,间隔9 s (仪器:美国BRANSON Sonifier 250D/450D);冰上孵育1 h;4 ℃、12 000 r/min离心10 min,取上清,即为可溶性蛋白质溶液。加入5×样品缓冲液(0.225 mol/L Tris-HCl (pH 6.8),50%甘油,5% SDS (十二烷基硫酸钠),0.25 mol/L β-巯基乙醇,0.05%溴酚蓝),95 ℃水浴煮10 min;利用氨基黑进行蛋白定量。
气囊蛋白样品:将气囊溶液的OD500调整到1.5左右,加入含有10% SDS的2×样品缓冲液(0.09 mol/L Tris-HCl (pH 6.8),20%甘油,10% SDS,0.1 mol/L β-巯基乙醇,0.02%溴酚蓝) 中[23],95 ℃水浴10 min;利用氨基黑进行蛋白定量。
1.2.7 Western blotting检测Gvp C蛋白的含量对蛋白样品定量之后,藻细胞全蛋白和藻渣残留蛋白上样5 μg,气囊蛋白上样1 μg;经15% SDS-PAGE胶分离之后,分别进行考马斯亮蓝染色定量和转膜;转膜后通过用兔IgG特异性的碱性磷酸酶标记山羊抗体Gvp C孵育[24],然后显影和扫描。
1.2.8 气囊负染制样将200目的铜网倒扣在OD500=0.5左右气囊液滴上,静置5 min;用滤纸吸取多余溶液;黑暗条件下,用磷钨酸染色铜网5 min;室温晾干15 min,置于透射电子显微镜(Hitachi HT-7700) 下观察。
1.2.9 统计气囊的体积分布使用Image J软件打开气囊的电镜照片,统计每个气囊的长度L (nm) 和直径D (nm)。计算各个气囊的体积V(nm3)=Л·(D/2)2·L,统计气囊的数量n=500;将数据导入到Graph Prism中作图。
1.3 气囊的体外造影称量1 g琼脂糖置入100 mL的去离子水中,放入微波炉加热至琼脂糖完全融化,取出摇匀;冷却到60 ℃左右,倒入90 mm×50 mm的一次性细胞培养皿中;完全凝固后,使用一次性吸管在平皿中央等距离打4个孔;将PBS溶液和OD500值为2.4的微囊藻FACHB-2329、FACHB-1326和FACHB-930的气囊溶液分别与60 ℃的琼脂糖溶液以1︰1体积混合,冷却。调整超声仪器(型号:GE公司LOGIQ E9) 各参数:AO (输出功率) 为100%、D (深度) 为3.5、Gn (增益) 为8、MI (机械指数) 为1.2;选取超声造影实时双幅对照模式,并将超声耦合剂挤在超声仪器的9 L探头上,注意不要产生气泡;将9 L探头放置于培养皿中央,保证在样品的正上方,保持稳定之后,发射声波直到不再有造影信号。
使用超声仪器(LOGIQ E9) 的功能—超声造影定量分析(ultrasonic contrast quantitative analysis) 测定随时间变化不同藻的气囊造影信号的变化情况。
2 结果与分析 2.1 建立提取微囊藻气囊的方法因高渗裂解法操作烦琐,无法高效率地提取气囊,据报道,当藻细胞受到氧化胁迫时,细胞膜脂质损伤,破坏了细胞膜结构[25]。我们根据上述原理利用过氧化氢处理细胞,建立了新型提取微囊藻气囊的方法(图 1A)。通过预实验,我们选用微囊藻FACHB-2329开展气囊提取实验。我们主要通过摸索以下3个条件建立提取气囊的新方法:1) 过氧化氢处理的最适细胞浓度;2) 过氧化氢的最适终浓度;3) 最适处理时间。
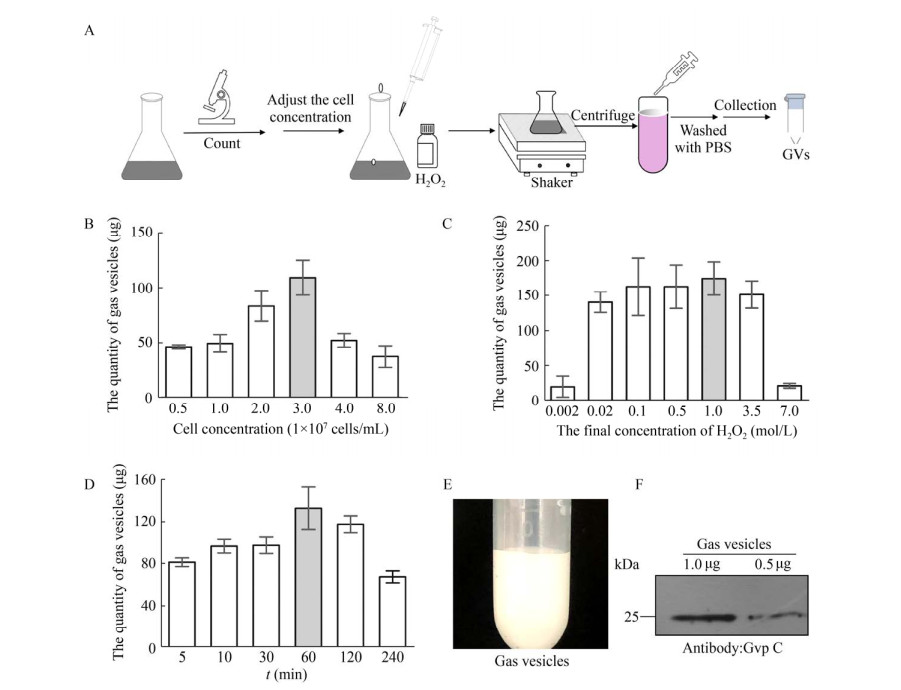
|
| 图 1 H2O2法提取微囊藻气囊方法的建立 Fig. 1 Development of an H2O2 method for isolation of gas vesicles from Microcystis. (A) The flowchart of H2O2 method for gas vesicles isolation. Firstly, adjusting the cells' concentration, then keeping cells on the shaker after adding H2O2. Finally, harvesting gas vesicles using centrifugation. (B) Comparison of the quantity of isolated gas vesicles when different amount of cells were used. (C) Effect of the concentrations of H2O2 on the quantity of gas vesicles. (D) Comparison of the quantity of harvested gas vesicles along different time. (E) Purified milk-like gas vesicles isolated by H2O2 method from Microcystis aeruginosa (FACHB-2329). (F) Immunoblot analysis of gas vesicles using the antibody against GvpC, which is about 25 kDa. The error bars in B, C, D represent standard deviations of three biological replicates. |
| |
为了有效提取出气囊,结合文献中过氧化氢对铜绿微囊藻的抑制生长浓度(0.002 8–0.045 mmol/L)[26]以及预实验,本实验初步选用0.02 mol/L过氧化氢处理藻细胞。如图 1B所示,当藻细胞浓度为3×107个/mL时,收获的气囊的质量最多,为109.17 μg蛋白。因此,随后的其他条件的优化,均以藻细胞浓度为3×107个/mL来进行。
2.1.2 过氧化氢终浓度的优化在一定细胞浓度下,过低的过氧化氢终浓度只能在一定时间内抑制藻细胞的生长,不能使藻细胞释放气囊;若使用浓度过高,后续PBS溶液洗涤气囊溶液并不能完全去除残留的过氧化氢,后期去除成本较高。因此我们比较了不同过氧化氢终浓度对收获气囊的质量关系(图 1C)。在相同的藻细胞下,过氧化氢终浓度从0.002 mol/L增加到0.02 mol/L时,气囊产量明显增加,在1 mol/L时收获的气囊的质量最多,约174.30 μg蛋白。当增加至3.5 mol/L时,气囊的产量明显降低。上述结果显示1 mol/L为最适提取微囊藻气囊的过氧化氢终浓度。
2.1.3 处理时间的优化要将H2O2法应用于工业生产,要尽量降低时间成本。因此,适当的处理时间至关重要。我们比较了不用处理时间下对收获气囊产量的影响,在使用1 mol/L的H2O2处理浓度为3×107个/mL的藻液时,当处理时间为60 min时,收获的气囊的量最多,为132.57 μg蛋白(图 1D)。因此,当藻液浓度为3×107个/mL时,使用终浓度为1 mol/L的过氧化氢处理60 min为最佳的纯化微囊藻气囊的条件。
2.1.4 气囊蛋白的Western blotting检测经H2O2法纯化的气囊呈现出乳白色(如图 1E),利用含有10% SDS 2×样品缓冲液将其溶解后,进行SDS-PAGE并使用Gvp C抗体进行检测。结果显示纯化的气囊条带在25 kDa左右,与预测的分子量一致(图 1F)。综上所述,我们成功地建立了新型的提取微囊藻气囊方法,并命名为H2O2法。
2.2 H2O2法优于传统的高渗裂解法为了排除H2O2会影响气囊的结构,我们将H2O2法提纯的气囊与使用高渗裂解法提纯的气囊的结构进行了比较。首先,我们将两种该方法提取纯化的气囊(图 2A) 在电镜下观察,对比二者的形态。结果显示二者都呈现完整的圆柱状结构(图 2B–C)。高渗裂解法提纯的气囊的长度为(690±209) nm,直径为(81±17) nm。利用H2O2法提取的气囊长度为(691±201) nm,直径为(85±15) nm。这些结果证明了,使用1 mol/L过氧化氢处理藻细胞不会对气囊结构造成损伤,能满足后续解析气囊结构以及造影实验的要求。
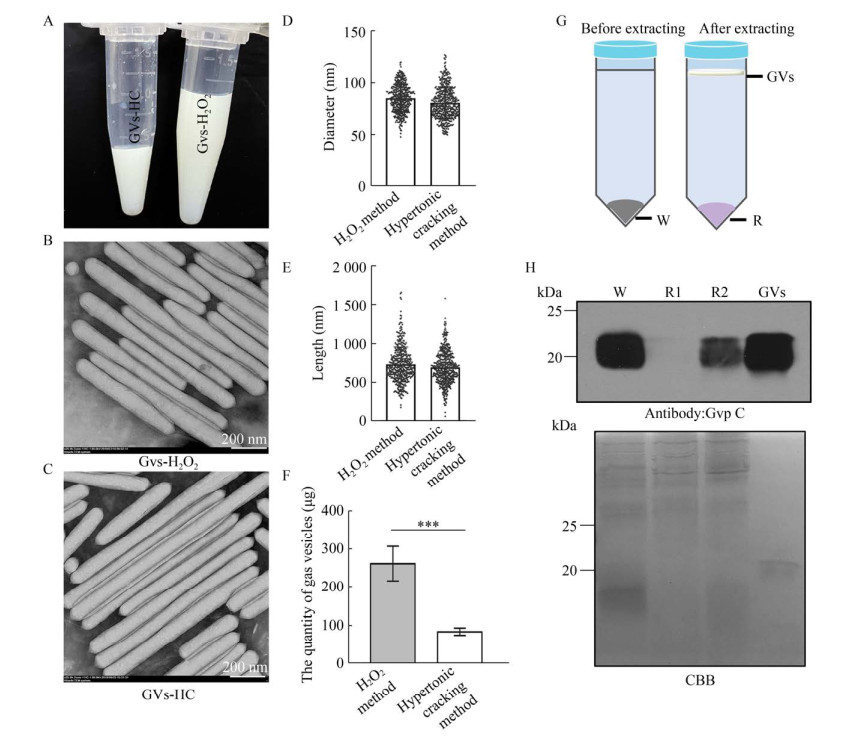
|
| 图 2 H2O2法与高渗裂解法的比较 Fig. 2 Comparison of H2O2 method versus hypertonic cracking method. (A) Comparison of the color of gas vesicles purified by H2O2 method (GVs-H2O2) versus hypertonic cracking method (GVs-HC). (B) The transmission electron micrograph (TEM) of gas vesicles purified by H2O2 method. Gas vesicles are rod-shaped under TEM. (C) The TEM of gas vesicles purified using hypertonic cracking method. Comparison of the diameter (D) and length (E) of gas vesicles and the isolation efficiency (F) using H2O2 method and hypertonic cracking method. (G) Schematic diagram of each samples used for immunoblot in (H). W: whole cells; R: remnant; GVs: gas vesicles. (H) Immunoblot analysis of gas vesicles protein in the cell remnant (R1, R2) using antibody against Gvp C. R1 and R2 represents the remnant from cells whose gas vesicles had been isolated by H2O2 method or hypertonic cracking method, respectively. The total proteins were visualized by Coomassie blue staining. |
| |
为了比较这两种方法分离气囊的效率,我们同时使用高渗裂解法和H2O2法对20 mL (3×107个/mL) 的藻液进行处理,将气囊分离纯化后,根据气囊体积和蛋白浓度,计算气囊蛋白的总量(μg),进而比较两种方法提取气囊的效率。利用高渗裂解法得到气囊83 μg,利用H2O2法得到气囊为260 μg (图 2F)。上述结果表明,H2O2法提取气囊的效率是高渗裂解法的3倍以上。另外,我们利用Gvp C抗体,检测经两种方法提取气囊的藻细胞沉淀中气囊蛋白的含量,进一步证明H2O2法的高效性。我们发现,经H2O2法提取过气囊的藻细胞沉淀中基本检测不到Gvp C蛋白(图 2H)。这说明了,H2O2法不仅具有高效性,而且还能将藻细胞的气囊提取得更加完全,可以满足后续将气囊应用为超声造影剂的工业生产要求。
综上,H2O2法可以将气囊完整地从藻细胞中提取出来,对气囊结构无影响;同时具有高效性,将气囊得率提升了3倍以上,且藻细胞沉淀中基本不含有气囊蛋白,降低了损耗,而且实验时间由24 h缩短为7 h。
2.3 H2O2法可提取出其他蓝藻的气囊在蓝藻水华中,较为常见的蓝藻种类有:微囊藻属、束丝藻属和鱼腥藻属等,这些蓝藻形成水华时都有气囊的分布[27-29]。为了验证H2O2法是否能提取出其他蓝藻的气囊,获得不同特性的造影剂,我们使用H2O2法尝试对不同蓝藻藻株的气囊进行提取。结果发现,此方法不仅可提取出经藻种库纯化的藻(图 3A,铜绿微囊藻FACHB-928;图 3B,铜绿微囊藻FACHB-1326;图 3C,束丝藻FACHB-1416;图 3D,珠海微囊藻)的气囊;也可提取出采样于野外的水华微囊藻的气囊(图 3E,武汉官桥;图 3F,江苏太湖)。这说明,H2O2法具有广谱性,可适用于提取多种蓝藻的气囊。
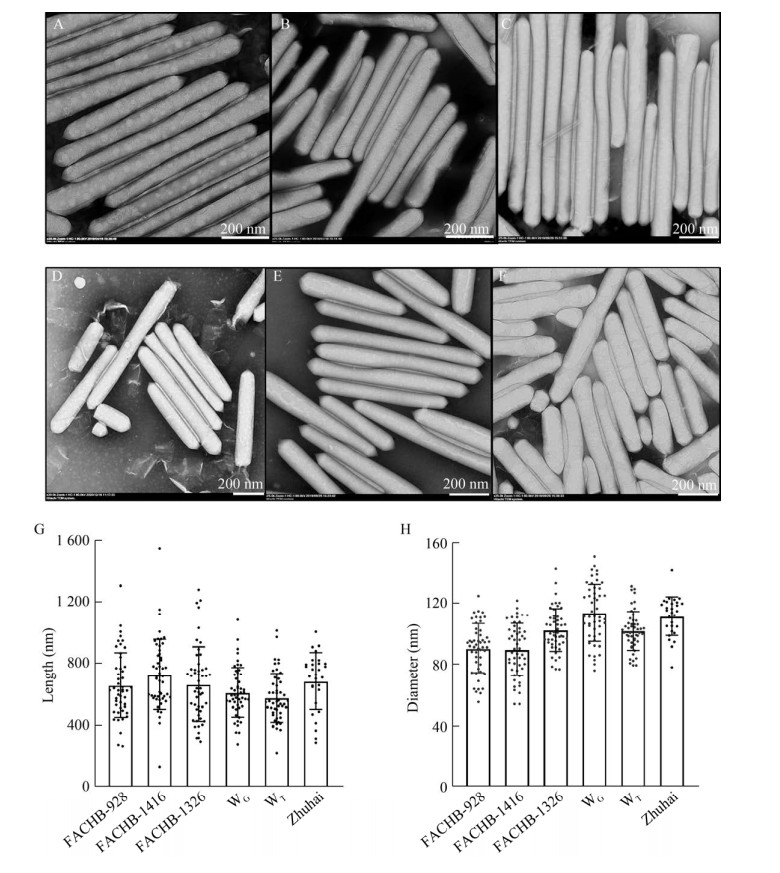
|
| 图 3 H2O2法可用于提取其他蓝藻的气囊 Fig. 3 The gas vesicles isolated from other cyanobacteria using H2O2 method. (A–F) TEM photograph of gas vesicles isolated from different cyanobacteria. (A) Microcystis aeruginosa FACHB-928. (B) Microcystis aeruginosa FACHB-1326. (C) Aphanizomenon sp. FACHB-1416. (D) Zhuhai Microcystis which purified and cultivated from FACHB. (E) Field Microcystis sample from Wuhan Guanqiao. (F) Field Microcystis sample from Tai lake in Jiangsu province. (G) Measurement of the length of gas vesicles. WG: purified gas vesicles from Wuhan Guanqiao; WT: purified gas vesicles from Tai lake in Jiangsu province. Zhuhai: purified gas vesicles from Zhuhai Microcystis. (H) Measurement of the diameter of gas vesicles. |
| |
我们进一步对纯化出的气囊长度和直径进行分析,束丝藻(Aphanizomenon sp.) FACHB-1416的气囊相对较长,平均长度为(729.3±224.3) nm,有的甚至长达1 500 nm,平均直径为(82.3±17.4) nm;采样自江苏太湖的野生微囊藻的气囊长度较短,平均长度为(577±154) nm,最长的为1 011 nm,平均直径为(101.6±12.6) nm;采样自武汉官桥的野生微囊藻的气囊平均直径略大,为(115.3±19.7) nm,平均长度为(612.7±156.6) nm;铜绿微囊藻(Microcystis aeruginosa) FACHB-1326和铜绿微囊藻(Microcystis aeruginosa) FACHB-928气囊的平均长度分别是(666.1±236.8) nm和(660.0±204.7) nm,平均直径为(98.3±14.0) nm和(89.0±15.8) nm;来自FACHB的珠海微囊藻的气囊平均长度为(686.2±179.6) nm,平均直径为(111.3±12.4) nm (图 3G–H)。以上结果说明我们建立的H2O2法可以广泛应用于从蓝藻中提取气囊。
2.4 气囊的体外造影我们通过H2O2法实现了从多种蓝藻细胞中高效率提取出高纯度的气囊,为了检测其是否具有造影特性以及信号持续性的强弱,将来源于不同蓝藻的气囊在超声系统下进行体外造影。
我们选取微囊藻FACHB-2329、FACHB-1326和FACHB-930为目的藻株,利用H2O2法纯化其气囊,并在超声9 L探头下进行体外造影(图 4A),发现这3株藻的气囊都具有造影信号(图 4B)。随后通过超声造影定量分析测量随时间变化不同气囊造影信号的变化情况。结果显示,微囊藻FACHB-1326的气囊表现出较优的造影特性,在超声持续作用15 s后,气囊才完全坍塌,不再具有造影信号,而微囊藻FACHB-2329和微囊藻FACHB-930的气囊仅在6 s时,就已坍塌完全(图 4C)。这可能与不同藻株气囊的稳定性相关,该特性对后续测量不同气囊的抗压力实验具有一定的参考意义。
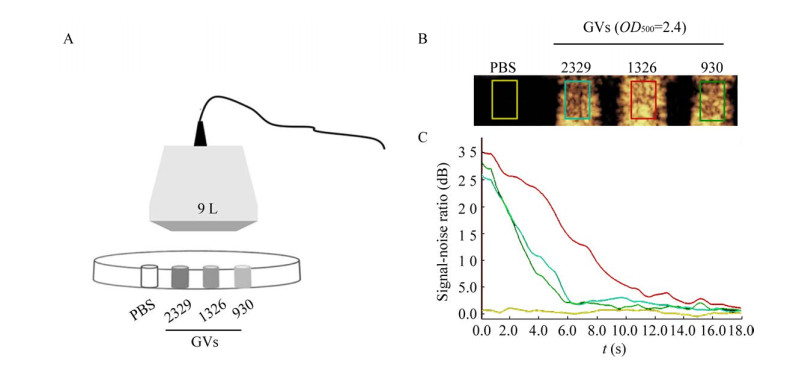
|
| 图 4 气囊的超声成像 Fig. 4 Ultrasound contrast imaging of gas vesicles. (A) The diagram of ultrasound imaging model for gas vesicles. (B) Comparison of contrast ultrasound signals of gas vesicles from different Microcystis cells at the same optical densities. (C) The change of contrast signals of gas vesicles from different Microcystis cells. Yellow: PBS; blue: FACHB-2329; red: FACHB-1326; green: FACHB-930. |
| |
在本研究中,以微囊藻制备纳米级超声造影剂为目的,我们建立了一种快速、高效提取微囊藻气囊的方法,并命名为H2O2法。
与高渗裂解法相比,H2O2法具有以下优点:第一,时间成本低。本方法使用过氧化氢处理微囊藻悬液1 h,便可分离纯化气囊。而高渗裂解法分离气囊前要耗费18 h,体现在向生长到对数期的藻细胞悬液中加入Mg2+和青霉素(0.16 mg/L) 摇床处理5 h后,离心浓缩耗费0.5 h,溶菌酶处理至少1 h,加入甘油混匀15 min,过夜处理至少12 h。因此H2O2法将提取气囊的时间从24 h缩短为7 h,降低了时间成本,有利于后期工业生产。第二,提取效率高,气囊的得率提高了3倍以上。使用H2O2法提取气囊之后,藻细胞沉淀中基本不含有气囊的残留,降低了损耗,大大提高了气囊纯化的效率。
第三,该方法具有广谱性。不仅适用于实验室培养的微囊中气囊的提取,同时适用于提取含有胶鞘壁的群体微囊藻的气囊。这都是高渗裂解法中无法实现的。第四,易于放大,大规模制备气囊。将为研究不同藻类气囊的理化性质及应用带来极大的便利。
本方法使用的过氧化氢是一种活性氧(reactive oxygen species, ROS) 物质,能抑制藻细胞生长或直接杀死藻细胞,通常用于控制蓝藻水华[30-31]。2005年,毕永红团队在培养微囊藻时加入不同浓度的过氧化氢,其结果显示过氧化氢对细胞生长有显著抑制作用,当使用60 μmol/L过氧化氢处理时,延迟了细胞的对数生长期,而使用150 μmol/L、240 μmol/L或300 μmol/L过氧化氢处理时,细胞的生长速率为负值[32]。有研究表明,H2O2对蓝藻的生长抑制依赖于其对光系统Ⅱ (PSⅡ) 中的关键组成部分D1蛋白的损伤[33-34]。细胞在正常生长情况下,因机体内具有防御活性氧和去除自由基毒害的机制,活性氧的产生和清除处于一个动态的平衡状态[35]。而在H2O2法中,终浓度为1 mol/L的H2O2可能使细胞膜脂质发生了过氧化作用,藻细胞本身对活性氧的产生和清除平衡被打破,过量的ROS对细胞造成损伤从而使气囊释放[36]。
利用H2O2法提取的3株藻的气囊在超声下成像,均表现出良好的造影特性。对气囊的体外造影技术,便于根据对不同气囊的造影特性制备不同特质的超声造影剂。为了促进气囊作为造影剂的适用性,我们后续仍需要更多的实验来验证其在生物医学上的应用,包括通过静脉注射气囊来评估小鼠的肝脏健康,以及在注射气囊后,建立小鼠的耐受性和免疫原性。
在超声作用下不同藻株的气囊造影特性不同。随着时间的增长,微囊藻FACHB-1326气囊的造影信号持续能力明显强于FACHB-2329和FACHB-930,信号持续性与气囊稳定性息息相关。有研究表明,气囊的稳定性与Gvp C蛋白和气囊的直径有关[14, 37-38]。气囊的Gvp C蛋白具有增强气囊壁强度从而稳定气囊结构的功能,气囊直径越大,临界压力越小。而微囊藻FACHB-1326的气囊直径稍大于FACHB-2329和FACHB-930。因此我们猜测微囊藻FACHB-1326的气囊特有的造影信号持续能力可能是由于gvpC基因的拷贝数和Gvp C蛋白在气囊壁上的组成不同带来的。具体调节机制仍需要更多的实验来证明,本文中所建立的H2O2法和气囊体外造影实验,为后续揭示Gvp C蛋白与气囊的稳定性、造影特性之间的关系提供了实验基础。
综上所述,气囊在医学方面显示了巨大的应用前景。本文所建立的H2O2法可用于大规模提取新型的超声造影剂。利用这些材料对气囊形成机制、结构以及分子生物学方面的深入研究,将充分发掘气囊的潜在超声成像用途,加速其在临床上的应用。
致谢: 感谢中国科学院水生生物研究所的宋立荣研究员实验室的李林和贾云路副研究员提供采自武汉官桥和江苏太湖的野外微囊藻样品;感谢中国科学院水生生物研究所的徐旭东研究员实验室提供Gvp C抗体;感谢协和肿瘤医院超声科覃晓娟老师对超声实验的指导和帮助。感谢中科院水生所藻类细胞生物学学科组徐南南、赵丽娟博士对文章修改提出的意见。
| [1] |
Cosgrove D, Harvey C. Clinical uses of microbubbles in diagnosis and treatment. Med Biol Eng Comput, 2009, 47(8): 813-826. DOI:10.1007/s11517-009-0434-3
|
| [2] |
de Leon A, Perera R, Nittayacharn P, et al. Ultrasound contrast agents and delivery systems in cancer detection and therapy. Adv Cancer Res, 2018, 139: 57-84.
|
| [3] |
Ye J, Fu GF, Yan XH, et al. Noninvasive magnetic resonance/photoacoustic imaging for photothermal therapy response monitoring. Nanoscale, 2018, 10(13): 5864-5868. DOI:10.1039/C8NR00044A
|
| [4] |
Sennoga CA, Kanbar E, Auboire L, et al. Microbubble-mediated ultrasound drug-delivery and therapeutic monitoring. Expert Opin Drug Deliv, 2017, 14(9): 1031-1043. DOI:10.1080/17425247.2017.1266328
|
| [5] |
张欣, 红华. 纳米级超声造影剂研究进展. 中国介入影像与治疗学, 2021, 18(2): 118-121. Zhang X, Hong H. Research advancements of nanoscale ultrasound contrast agents. Chin J Interv Imaging Ther, 2021, 18(2): 118-121 (in Chinese). |
| [6] |
Jang KW, Seol D, Ding L, et al. Ultrasound-mediated microbubble destruction suppresses melanoma tumor growth. Ultrasound Med Biol, 2018, 44(4): 831-839. DOI:10.1016/j.ultrasmedbio.2017.12.011
|
| [7] |
L ee, Mo on, H an, et al. Antitumor effects of intra-arterial delivery of albumin-doxorubicin nanoparticle conjugated microbubbles combined with ultrasound-targeted microbubble activation on VX2 rabbit liver tumors. Cancers, 2019, 11(4): 581. DOI:10.3390/cancers11040581
|
| [8] |
Wang LY, Zheng SS. Advances in low-frequency ultrasound combined with microbubbles in targeted tumor therapy. J Zhejiang Univ Sci B, 2019, 20(4): 291-299. DOI:10.1631/jzus.B1800508
|
| [9] |
Luo W, Wen G, Yang L, et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics, 2017, 7(2): 452-465. DOI:10.7150/thno.16677
|
| [10] |
Cao WJ, Matkar PN, Chen HH, et al. Microbubbles and ultrasound: therapeutic applications in diabetic nephropathy. Adv Exp Med Biol, 2016, 880: 309-330.
|
| [11] |
Kaufmann BA, Lindner JR. Molecular imaging with targeted contrast ultrasound. Curr Opin Biotechnol, 2007, 18(1): 11-16. DOI:10.1016/j.copbio.2007.01.004
|
| [12] |
Lakshmanan A, Lu GJ, Farhadi A, et al. Preparation of biogenic gas vesicle nanostructures for use as contrast agents for ultrasound and MRI. Nat Protoc, 2017, 12(10): 2050-2080. DOI:10.1038/nprot.2017.081
|
| [13] |
Maresca D, Lakshmanan A, Abedi M, et al. Biomolecular ultrasound and sonogenetics. Annu Rev Chem Biomol Eng, 2018, 9(1): 229-252. DOI:10.1146/annurev-chembioeng-060817-084034
|
| [14] |
Walsby AE. Gas vesicles. Microbiol Rev, 1994, 58(1): 94-144. DOI:10.1128/mr.58.1.94-144.1994
|
| [15] |
Englert C, Pfeifer F. Analysis of gas vesicle gene expression in Haloferax mediterranei reveals that GvpA and GvpC are both gas vesicle structural proteins. J Biol Chem, 1993, 268(13): 9329-9336. DOI:10.1016/S0021-9258(18)98354-7
|
| [16] |
Bourdeau RW, Lee-Gosselin A, Lakshmanan A, et al. Acoustic reporter genes for noninvasive imaging of microorganisms in mammalian hosts. Nature, 2018, 553(7686): 86-90. DOI:10.1038/nature25021
|
| [17] |
Farhadi A, Ho GH, Sawyer DP, et al. Ultrasound imaging of gene expression in mammalian cells. Science, 2019, 365(6460): 1469-1475. DOI:10.1126/science.aax4804
|
| [18] |
Song L, Wang G, Hou X, et al. Biogenic nanobubbles for effective oxygen delivery and enhanced photodynamic therapy of cancer. Acta Biomater, 2020, 108: 313-325. DOI:10.1016/j.actbio.2020.03.034
|
| [19] |
Wang G, Song L, Hou X, et al. Surface-modified GVs as nanosized contrast agents for molecular ultrasound imaging of tumor. Biomaterials, 2020, 236: 119803. DOI:10.1016/j.biomaterials.2020.119803
|
| [20] |
Yang Y, Qiu Z, Hou X, et al. Ultrasonic characteristics and cellular properties of Anabaena gas vesicles. Ultrasound Med Biol, 2017, 43(12): 2862-2870. DOI:10.1016/j.ultrasmedbio.2017.08.004
|
| [21] |
许柏英, 苗娅. 一种水华蓝藻气囊的分离纯化及气囊结构蛋白的鉴定. 微生物学通报, 2017, 44(8): 1802-1807. Xu BY, Miao Y. Isolation and structural proteins determination of gas vesicles from a bloom-forming cyanobacterium. Microbiol China, 2017, 44(8): 1802-1807 (in Chinese). |
| [22] |
Drábková M, Admiraal W, Maršálek B. Combined exposure to hydrogen peroxide and light selective effects on cyanobacteria, green algae, and diatoms. Environ Sci Technol, 2007, 41(1): 309-314. DOI:10.1021/es060746i
|
| [23] |
Walker JE, Walsby AE. Molecular weight of gas-vesicle protein from the planktonic cyanobacterium Anabaena flos-aquae and implications for structure of the vesicle. Biochem J, 1983, 209(3): 809-815. DOI:10.1042/bj2090809
|
| [24] |
许敏. 微囊藻伪空胞基因丛的研究[D]. 武汉: 中国科学院(水生生物研究所), 2006. Xu M. Studies on the gas vesicle gene cluster in Microcystis sp. [D]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2006 (in Chinese). |
| [25] |
李娟, 王应军, 高鹏. 过氧化氢对铜绿微囊藻的损伤效应研究. 环境科学学报, 2015, 35(4): 1183-1189. Li J, Wang YJ, Gao P. Damaging effects of hydrogen peroxide on Microcystis aeruginosa. Acta Sci Circumstantiae, 2015, 35(4): 1183-1189 (in Chinese). |
| [26] |
邱昌恩, 王卫东. 过氧化氢对铜绿微囊藻(Microcystis aeruginosa)生长及生理特性的影响. 湖北师范大学学报(自然科学版), 2017, 37(4): 1-5. Qiu CE, Wang WD. The effects of H2O2 on the growth and physiological characteristics of Microcystis aeruginosa. J Hubei Norm Univ (Nat Sci Ed), 2017, 37(4): 1-5 (in Chinese). DOI:10.3969/j.issn.2096-3149.2017.04.001 |
| [27] |
方群. 铜绿微囊藻氮磷代谢及微囊藻水华综合评价[D]. 北京: 北京工商大学, 2009. Fang Q. Nutrients metabolism of Microcystic aeruginosa and general evaluation of Microcystis algal[D]. Beijing: Beijing Technology and Business University, 2009 (in Chinese). |
| [28] |
贾晓会, 施定基, 史绵红, 等. 巢湖蓝藻水华形成原因探索及"优势种光合假说". 生态学报, 2011, 31(11): 2968-2977. Jia XH, Shi DJ, Shi MH, et al. Formation of cyanobacterial blooms in Lake Chaohu and the photosynthesis of dominant species hypothesis. Acta Ecol Sin, 2011, 31(11): 2968-2977 (in Chinese). |
| [29] |
刘永梅, 刘永定, 李敦海, 等. 氮磷对水华束丝藻生长及生理特性的影响. 水生生物学报, 2007, 31(6): 774-779. Liu YM, Liu YD, Li DH, et al. Effects of nitrate and phosphorus on growth and physiological characteristics of Aphanizomenon flos-aquae from Dianchi. Acta Hydrobiol Sin, 2007, 31(6): 774-779 (in Chinese). DOI:10.3321/j.issn:1000-3207.2007.06.002 |
| [30] |
Barrington DJ, Ghadouani A. Application of hydrogen peroxide for the removal of toxic cyanobacteria and other phytoplankton from wastewater. Environ Sci Technol, 2008, 42(23): 8916-8921. DOI:10.1021/es801717y
|
| [31] |
Qian H, Yu S, Sun Z, et al. Effects of copper sulfate, hydrogen peroxide and N-phenyl-2-naphthylamine on oxidative stress and the expression of genes involved photosynthesis and microcystin disposition in Microcystis aeruginosa. Aquat Toxicol, 2010, 99(3): 405-412. DOI:10.1016/j.aquatox.2010.05.018
|
| [32] |
Wang B, Wang X, Hu Y, et al. The combined effects of UV-C radiation and H2O2 on Microcystis aeruginosa, a bloom-forming cyanobacterium. Chemosphere, 2015, 141: 34-43. DOI:10.1016/j.chemosphere.2015.06.020
|
| [33] |
Lupínková L, Komenda J. Oxidative modifications of the photosystem Ⅱ D1 protein by reactive oxygen species: from isolated protein to cyanobacterial cells. Photochem Photobiol, 2004, 79(2): 152-162. DOI:10.1562/0031-8655(2004)079<0152:OMOTPI>2.0.CO;2
|
| [34] |
Nishiyama Y, Allakhverdiev SI, Murata N. A new paradigm for the action of reactive oxygen species in the photoinhibition of photosystem Ⅱ. Biochim Biophys Acta, 2006, 1757(7): 742-749. DOI:10.1016/j.bbabio.2006.05.013
|
| [35] |
李信书, 唐学玺. 亚心形扁藻超氧化物歧化酶活性对镉和铜的应答. 海洋湖沼通报, 2007, 3: 75-80. Li XS, Tang XX. Response of superoxide dismutase activity to cadium and copper in platymonas subcordiforming. CSOL, 2007, 3: 75-80 (in Chinese). |
| [36] |
Taylor ER, Hurrel F, Shannon RJ. Reversible glutatmonylation of complex Ⅰ increases mitoehondrial superoxide formation. J Bio Chem, 2003, 278(22): 19603-19610. DOI:10.1074/jbc.M209359200
|
| [37] |
许敏, 徐旭东. 微囊藻气囊尺寸与gvpA/gvpC基因的关系. 水生生物学报, 2010, 34(6): 1228-1230. Xu M, Xu XD. Correlation between sizes of gas vesicles and gvpa/gvpc in Microcystis. Acta Hydrobiol Sin, 2010, 34(6): 1228-1230 (in Chinese). |
| [38] |
Dunton PG, Walsby AE. The diameter and critical collapse pressure of gas vesicles in Microcystis are correlated with GvpCs of different length. FEMS Microbiol Lett, 2005, 247(1): 37-43. DOI:10.1016/j.femsle.2005.04.026
|
 2022, Vol. 38
2022, Vol. 38




