中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李中浤, 薛媚, 李顺江, 杜彩丽, 李晓光
- LI Zhonghong, XUE Mei, LI Shunjiang, DU Caili, LI Xiaoguang
- 气溶胶中抗生素抗性基因研究进展
- Antibiotic resistance genes in aerosols: a review
- 生物工程学报, 2022, 38(7): 2423-2432
- Chinese Journal of Biotechnology, 2022, 38(7): 2423-2432
- 10.13345/j.cjb.210829
-
文章历史
- Received: November 8, 2021
- Accepted: April 1, 2022
2. 金陵科技学院 动物科学与食品工程学院, 江苏 南京 210038;
3. 北京市农林科学院 植物营养与资源环境研究所, 北京 100091
2. College of Animal Science and Food Engineering, Jinling Institute of Technology, Nanjing 210038, Jiangsu, China;
3. Institute of Plant Nutrition, Resources and Environment, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100091, China
抗生素作为一种抗细菌、抗真菌和抗寄生虫的药物,不仅可用于预防和治疗人和动物的细菌感染,也可作为饲料添加剂用于畜禽养殖过程中的疾病预防。中国是世界上最大的抗生素生产国和消费国,抗生素消费量超过16.2万t[1]。过量使用或滥用抗生素现象较为普遍,大量抗生素在人类和动物体内没有完全代谢吸收,大部分以原形排出体外进入到水环境等自然环境中[2],导致抗性细菌(antibiotic resistant bacteria, ARB) 和抗生素抗性基因(antibiotic resistance genes, ARGs) 的出现、发展和传播[3]。
2014年全球因抗性细菌感染而导致死亡的人口达到70万,预计2050年这一数值将会达到1 000万[4],抗生素耐药性对全球健康构成了巨大威胁。随着分子生物学检测技术的发展,qRT-PCR、RT-PCR、数字PCR、epicPCR、高通量PCR、DNA芯片和高通量测序等技术在河流[5]、湖泊[6]、土壤[7]、沉积物[8]、粪便[9]、污水处理厂[10]、畜禽养殖场[11]和医院废水[12]等多种环境介质中检出多种ARGs,甚至在受人类影响较小的地区,如深海[13]、青藏高原[14]和冻土沉积物[15]中也均检测出四环素类、磺胺类、甲氧苄氨嘧啶类、万古霉素类、喹诺酮类和大环内酯类等多种ARGs。
生物气溶胶是空气中的生物颗粒物,其大小从亚微米到几百微米不等,在这些胶体体系中,分散着由微生物(包括细菌、病毒、霉菌孢子、蕨类孢子和寄生虫卵等)、微生物代谢物、毒素和悬浮在空气中的小液滴和固体颗粒,生物气溶胶的来源是植物、动物(包括人类)、土壤和水,是大气污染物的一个重要来源[16]。生物气溶胶能携带和传播有害病原微生物,如2003年的SARS冠状病毒(SARS-CoV-1) 和2019年的新型冠状病毒(SARS-CoV-2)[17]。ARBs和ARGs也可以通过空气颗粒物质和气溶胶传播。生物气溶胶是大气污染物的一个重要组成部分,可以在空气中悬浮数小时,并能长距离传播,气溶胶中的ARBs和ARGs易被人体吸入并进入肺部[18-19]。人体吸入的携带ARGs的微生物会引起呼吸道细菌的不平衡,并影响免疫系统。研究表明,空气中携带ARGs的人源致病菌与多种呼吸道疾病和感染密切相关[20]。此外,由于ARGs的传播特性,即使在不使用抗生素的偏远地区也仍可能暴露在“二手” ARGs之中[21]。目前,关于水、土壤等环境介质中ARGs分布规律的研究报道较多,但对于空气及气溶胶中ARGs分布特征的研究报道较少。
系统跟进和掌握气溶胶中ARBs和ARGs最新研究进展对识别和降低气溶胶中ARBs和ARGs潜在健康风险至关重要。本文对人类生活功能场所、养殖场、城市污水处理厂及医院等不同环境气溶胶中ARGs的污染现状、传播途径及潜在危害进行了系统性总结(图 1),为进一步系统跟进掌握气溶胶中ARGs的污染健康风险研究提供依据。
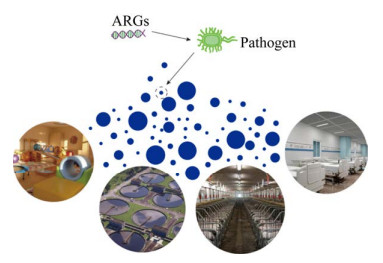
|
| 图 1 不同空气环境气溶胶ARGs污染 Fig. 1 ARGs pollution in aerosol of different air environments. |
| |
空气气溶胶的ARGs的传播过程主要有3个部分:(1) ARB和ARGs的分离和气溶胶化;(2) 生物气溶胶的运输;(3) 生物气溶胶的沉积[22]。人类自然活动等人为因素以及湿度、温度、风况和空气污染情况等物理因素,是影响生物气溶胶传播和运输的主要影响因素[23]。大气颗粒中存在的ARGs和ARBs可以通过降雨或降雪返回地球表面,从而促进ARGs的远距离传播。Wang等[24]通过观察PM2.5作为ARGs的载体在整个降雨过程中其丰度的变化,结果发现雨水促进了ARGs的传播。风力的大小和PM2.5也是影响雨水中ARGs分布的气象参数,土壤微观试验表明了雨水能促进ARGs从环境空气向土壤的扩散,在重金属污染土壤中这种影响更为明显。Zhu等[25]对中国主要城市的44个新鲜雪样本、3个北美城市和1个欧洲城市的ARGs进行了特征分析,结果表明空气污染会加剧了ARGs在新鲜雪中的传播,严重增加空气污染和ARGs的健康风险。由于空气动力学的特性,ARGs也可以由风极端天气事件(如沙尘暴) 进行长距离的运输[26]。
细菌耐药性可以通过抗生素选择压力下发生的基因突变及亲代与子代之间基因垂直转移获得,也可以通过基因水平转移获得。基因水平转移是ARGs在微生物间扩散的最主要方式,细菌通过接合转移获得的ARGs也会在环境中长时间存在[27]。环境中多种污染物会对ARGs的水平转移产生影响,包括抗生素、重金属和防腐剂等污染物。抗生素通常是ARGs扩散的主要驱动力,产生选择性压力或者通过刺激遗传元件的转移从而间接推动ARGs的扩散[28]。然而气溶胶中的污染物对于ARGs扩散的影响并不清楚,有必要了解不同化学品如抗生素和金属等对生物气溶胶中ARGs的分布及赋存状态的影响。与传统的化学污染物相比,ARGs可以通过整合在质粒、转座子、整合子和噬菌体等可移动遗传元件(mobile genetic elements, MGEs) 在同一或不同物种的细菌之间转移和传播[29],然而气溶胶中MGEs的来源与分布,以及MGEs在ARGs传播、扩散过程中的作用需要进一步探究。
1.2 ARGs的危害近年来,抗生素耐药性已经成为一个全球性的问题,并受到了极大的关注[30]。2013年,英国政府发布了一项五年战略,以解决抗生素耐药性问题。2019年,美国疾病预防控制中心发布了一份报告,指出需要高度警惕抗生素耐药性造成的威胁。随着城市化和人口密度的增加,未来通过空气气溶胶传播的抗生素耐药性只会越来越严重[31]。
通常情况下,空气中的微生物因为大气中的营养物质及水分较少而活性较低[32]。然而,它们可以在有利的环境中快速恢复其生物活性并迅速增殖[33]。人暴露于公众(非职业) 和职业环境中会吸入大量的生物气溶胶,据报道,在城市地区,一个成年人每天吸入大约107–108个细菌[34]。吸入的生物气溶胶含有ARBs和ARGs,特别是携带了多种ARGs的致病性ARBs,进入人体的呼吸道系统后快速恢复其活性并增殖,可能对人体健康造成直接损害[35]。其次,研究发现人体暴露在农场环境下,吸入的生物气溶胶会改变人体的肠道微生物群落,并增加了潜在的致病菌数量和ARGs水平[36]。
研究表明,从猪和鸡粪中释放的气溶胶中含大量病原体,其中大约80%的生物气溶胶是可呼入的[37]。致病菌可能穿过呼吸道并沉积在气管、支气管和肺泡区更深处[38],存在于细颗粒物中的ARGs很可能是向人体呼吸系统传播的重要途径。张兰河等[39]发现,动物舍内的四环素和红霉素耐药菌气溶胶主要沉降在人体的咽喉和支气管,这无疑危害着动物饲养员的生命健康。过去,人们认为耐药微生物引起的感染主要来自医疗机构,但在过去几年里,ARBs在许多不同的环境中被检测到。
2 不同空气环境气溶胶中ARGs污染现状 2.1 人类活动功能场所人类大约85%的时间都在封闭的空间中活动。与室外空气相比,封闭的空间有利于人类通过空气传播ARBs和ARGs,家庭、学校、办公室、室内娱乐和体育场馆等室内密闭活动场所中人类粪尿排泄物及唾液、喷嚏等分泌物成为ARGs和ARBs的源头。由于室内空气流通性不足,使得气溶胶中的ARGs和ARBs有更多机会通过摄取、皮肤接触和呼吸吸入等方式与人类接触,环境暴露风险较高[40]。同时,呼吸吸入的ARGs和ARBs可显著增加鼻咽部细菌负荷,进一步驱动免疫耐受性和免疫反应,导致严重侵入性呼吸道细菌疾病的发生[41]。
目前,研究学者已经在实验室[42]、幼儿园[43]和大学宿舍[44]等生活功能场所室内环境气溶胶中检出多种类型的ARGs。Zhao等调查了大学宿舍、办公室和室外环境气溶胶中ARGs及细菌微生物组丰度,结果表明,与室外气溶胶相比,室内气溶胶中有着更高丰度的ARGs亚型、可移动遗传元件(1–7个数量级) 和16S rRNA基因(2–3个数量级),并成功分离出对碳青霉烯类和多粘菌素B具有抗性的按蚊伊丽莎白金菌(Elizabethkingia anopheles)、肺炎克雷伯菌(Klebsiella pneumonia) 和池生戴尔福特菌(Delftia lacustris) 等菌株[44]。
相较于成人,儿童在幼儿园的时间长,幼儿呼吸频率较高,感染免疫力较低,幼儿园室内环境的抗微生物药物耐药性研究需引起重视。与其他持久性有机污染物相比,室内中的ARBs和ARGs比室外更丰富,ARBs和ARGs可以通过直接吸入对人类呼吸系统产生不利影响。Li等[43]对香港17所幼儿园中大气及土壤环境中ARGs的传播特征进行了调查,调查结果显示幼儿园空调过滤器中存在16种ARGs,采集的土壤样本中存在12种ARGs。在空气样本中,磺胺类ARGs最丰富(其丰度达到了6.9×10−3–0.2 copies per 16S rRNA基因),其次是大环内酯类ARGs (其丰度达到了1.8×10−3–3.3×10−2 copies per 16S rRNA基因)。而在土壤样品中,磺胺类ARGs和四环素类ARGs是丰度最高的2种ARGs,这可能归因于这两种药物的历史使用所产生的遗留效应。
各种室内娱乐和体育场馆,如健身房和游泳池,也是空气气溶胶传播ARBs和ARGs的潜在热点区域[45]。由于人类在身体活动时,呼吸加快导致空气吸入率高于正常水平,这增加了ARBs和ARGs生物气溶胶的呼出和吸入[46],其次室内娱乐和体育设施人口密度较高和通风系统差等原因,人们的剧烈活动会影响室内体育设施的空气质量[47]。Małecka-Adamowicz等对不同体育设施(健身房、武术室、游泳池、体育馆) 和运动场地中空气微生物质量进行评估,结果显示分离的葡萄球菌73%对青霉素具有抗性,90%以上的葡萄球菌对庆大霉素、左氧氟沙星和利福平具有抗性[45]。
2.2 养殖环境畜禽养殖场中的粪便和污水是水环境[7]和空气气溶胶中ARGs的主要来源[48]。养殖场内有大量动物排出的粪便尿液及养殖过程中产生的废水和废物,其中含有ARBs和ARGs在动物移动期间和处理过程中很容易被气溶胶化。畜禽粪污在厌氧发酵及好氧堆肥过程中会产生气溶胶,携带ARGs的致病菌从而逸散进入舍内空气中[49]。Yang等采用宏基因组方法对从养猪场和养鸡场收集的总悬浮颗粒中的ARGs进行了综合分析发现,在畜禽养殖场总悬浮颗粒的ARGs分布与各养殖场动物粪便中的分布特征一致,说明动物粪便可能是各畜禽养殖场空气中ARGs的主要来源[50]。Song等[51]对养猪场粪便及气溶胶中的ARGs和MGEs进行定量分析,结果发现,空气气溶胶样本和粪便样中的ARGs和MGEs丰度的季节差异为冬季 > 夏季,可能的原因是养猪场冬季为了保温而减少空气流通。MGEs中的IS613可以增强空气气溶胶中ARGs的传播,通过计算粪便对空气气溶胶中细菌的平均贡献比例,发现粪便中的细菌是冬季猪场空气中细菌的主要来源,通过网络分析ARGs、MGEs和细菌群落的共生互斥关系,气溶胶中存在的多种细菌是不同ARGs和MGEs的宿主,表明气溶胶是猪场抗生素抗性基因的重要传播途径。
养殖粪污的处理如厌氧处理(沼气发酵) 及堆肥过程也是气溶胶中ARGs的重要来源。Zhang等[52]在沼气池中检测到42种ARGs亚型,其中有28种可以通过气溶胶扩散到大气中,沼液贮藏过程降低了沼液中ARGs的总相对丰度,贮藏30 d后ARGs的总相对丰度降低了0.35 copies per 16S rRNA,但增加了tetM、tetX、tetQ、tetS、ermF和sul2等ARGs亚型的丰度。沼气池中检测到blaNDM-1、mcr-1和万古霉素耐药基因(vanA、vanB、vanRA和vanSA)等关注度比较高的ARGs,气溶胶中检测到blaNDM-1和vanB,这表明在沼气池存储过程中存在ARGs分散的潜在风险。
养殖场内空气气溶胶中的ARGs可以通过传统通风方式从舍内传播到舍外,从而将源于畜禽养殖场舍内的气溶胶在舍外传播。Gibbs等[53]采集距离养猪场不同距离(25、50、100和150 m) 的空气样本,发现耐药性金黄色葡萄球菌浓度随着距离的增加逐渐减少。Mceachran等[54]发现,肉牛饲养场附近空气颗粒物样品中,四环素类ARGs在下风向气溶胶中的丰度显著高于上风向气溶胶。
2.3 城市污水处理厂城市污水处理厂汇集了人类生产生活过程中产生的大量生活污水、医疗污水和工业废水等[8]。城市污水处理厂是ARBs和ARGs的重要储存库,也是实现其削减的重要环节。然而城市污水处理厂多采用生化处理,污泥中营养物丰富,细菌群落丰度高,抗生素污染严重且抗性细菌丰富[55]。同时,污水中含有葡萄球菌、芽孢杆菌、大肠杆菌、克雷伯氏菌和分枝杆菌等多种潜在病原体[56]。在污水处理过程中,污水中的抗性细菌在污水的紊流和曝气过程中释放到空气中,尤其是在污水的曝气阶段[57]。Han等[58]发现,污水处理过程在稳定曝气条件下产生的单个气溶胶尺寸分布范围为68−350 nm,气溶胶中含有大量的金属和非金属元素以及潜在的致病菌及病毒,通过宏基因组测序分析发现在气溶胶中还存在着大量的ARGs和毒力因子(type Ⅳ pili、flagella和C5a peptidase等),因此污水处理过程中产生的气溶胶存在一定的环境耐药性风险。
城市污水处理厂污水处理过程中产生的气溶胶能够通过呼吸和接触等方式侵入人体,对城市污水处理厂的工作人员产生一定危害。Zieliński等[59]对城市污水处理厂污水、受纳河流水样和污水处理厂员工鼻腔处采集的咽拭子样本分离出的葡萄球菌的耐药性进行了检测,结果发现从进水水样中分离出来的菌株有63%被鉴定为金黄色葡萄球菌,20%携带万古霉素抗性基因vanA,80%的分离株存在hla毒力基因,27%存在pvl毒力基因。在从员工咽拭子样本分离的菌株中,82%被鉴定为金黄色葡萄球菌,分离的菌株中有14%和16%分别含有万古霉素抗性基因vanA和甲氧西林抗性基因mecA。同时,对分离的菌株进行了遗传亲缘分析,结果显示ARGs和ARBs通过废水生物气溶胶传播到污水处理厂员工的上呼吸道粘膜,从而增加了员工接触ARGs和ARBs的机会及潜在健康风险。
随着城市的不断扩张和人口的增长,曾经偏远的城市污水处理厂周围逐渐出现大量居民区,城市污水处理厂逸散到空气中的气溶胶越来越受到人们的重视。Gaviria-Figueroa等通过PCR对城市污水处理厂各个风向的生物气溶胶和活性污泥中检测出44个ARGs,对多种抗生素具有耐药性。样本间ARGs的差异性分析结果显示,城市污水处理厂下风向生物气溶胶ARGs与活性污泥样本的ARGs相似度为68%,且通过初步参数分散模型预测出活性污泥中ARGs约以10 620 copies/h的速率释放至气溶胶中,依据风速生物气溶胶有可能被带离污水排放源数公里[60]。
2.4 医院环境医疗机构作为广泛使用抗生素药物和常规使用抗菌化学品的特殊功能场所,是气溶胶微生物污染的重要场所[61]。之前的研究表明,近年来医院环境的细菌耐药性明显升高[62],且医院中的获得性感染一直被认为是导致患者死亡的重要原因之一[63]。医疗废水和医疗废弃物中存在大量抗生素可能促进ARGs的发生,员工服装[64]、电话[65]、键盘[66]、空调及患者病床上[67]等医院环境中均检测出大量的ARGs。Abreu等[68]曾在医院的同一设备上分离出与医院感染相关的嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)、粪肠球菌(Enterococcus faecalis)和嗜线虫沙雷氏菌(Serratia nematodiphila) 等多种病原菌,这些病原菌在空气中弥漫和扩散,易造成患者之间的交叉感染,同时严重影响到医务人员的健康。
医院内部空气和医院周围空气中的灰尘是ARBs和ARGs的主要储存库和传播载体,从医院环境中分离出来的菌株往往都具有耐药性。Li等[63]通过宏基因组学调查和分析了不同气流条件下的医院空调空气尘埃样本,结果表明空气粉尘样品中含有多种ARGs,ARGs平均浓度为0.000 42 copies per 16S rRNA基因,和饮用水中的ARGs为一个数量级。Messi等[69]对医院空气中分离的280株细菌进行了抗生素耐药性检测,其中5%的分离菌株对所检测的所有抗生素均敏感,其他主要菌株对3种(13%)、4种(14%)、5种(9%) 和6种(10%) 抗生素具有抗性,表明空气样本中存在大量抗生素耐药细菌,因此应该预防和防范医院产生的院内感染。
医院周围常存在着大量社区,He等[70]发现,医院及周围社区空气气溶胶中广泛存在ARGs污染,医院空气气溶胶中的ARGs种类和丰度高于附近社区空气气溶胶中ARGs,特别是与临床上重要的病原体相关的ARGs,包括blaNDM、blaKPC、blaIMP、blaVIM和blaOXA-48等,因此需控制医院产生的ARGs从而减少社区大气气溶胶中的ARGs。
3 结论与展望过去一段时间大量的抗生素被用于人类医疗保健、食品加工、农业和畜牧业,造成严重的环境污染及抗生素耐药性等一系列问题。研究表明,空气中也存在着ARBs和ARGs,但目前对于气溶胶中ARGs的研究依然较少,对大气的长期微生态影响和人体呼吸系统产生的ARGs仍有待进一步探索。本文综述了人类生活功能场所、养殖场、城市污水处理厂和医院4个典型场所气溶胶中ARGs的研究现状,并对未来开展相关的研究提出以下几点建议。
(1) 开展不同场所环境生物气溶胶中ARGs的来源、种类和丰度研究,建立不同场所环境生物气溶胶中ARGs数据库;对影响生物气溶胶中ARGs传播扩散的宿主菌、可移动遗传元件和气溶胶中化学成分进行深入研究。
(2) 目前气溶胶中ARGs的研究多为ARGs的检测、传播及环境行为,对于ARGs的健康风险及对全球人类健康造成的负担知之甚少。因此需建立气溶胶中ARGs的风险评估方法,通过人体抗性基因水平与疾病暴露的关系确定不同ARGs的风险等级,并评价气溶胶传播的ARGs和全球疾病暴露的关系。
(3) 近年来,随着基因组学和大数据分析技术(包括网络分析、人工智能和机器学习) 的不断发展,以及计算机运算能力的不断提高,基于基因组学和大数据分析技术建立起气溶胶中ARGs和其他环境介质中ARGs之间的联系,并结合空气动力学可以对气溶胶中ARGs的传播进行溯源研究。
(4) 气溶胶中ARBs和ARGs的传播来源通常作为点源存在,采用空气过滤系统可以灭活和去除点源所产生的ARBs和ARGs,当前去除和削减ARBs和ARGs方面空气过滤器的研究还较少。因此,应对现有的空气过滤技术对于ARBs和ARGs的灭活和消除效果进行评价,基于吸附、高级氧化技术、光催化和紫外消毒等工艺的空气过滤系统需要进一步研究。
| [1] |
Liu S, Zhao H, Lehmler HJ, et al. Antibiotic pollution in marine food webs in Laizhou Bay, North China: trophodynamics and human exposure implication. Environ Sci Technol, 2017, 51(4): 2392-2400. DOI:10.1021/acs.est.6b04556
|
| [2] |
Kümmerer K. Antibiotics in the aquatic environment-a review-part Ⅱ. Chemosphere, 2009, 75(4): 435-441. DOI:10.1016/j.chemosphere.2008.12.006
|
| [3] |
Zhu YG, Zhao Y, Li B, et al. Continental-scale pollution of estuaries with antibiotic resistance genes. Nat Microbiol, 2017, 2(4): 1-7.
|
| [4] |
O'Neill J. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. Rev Antimicrob Resist, 2014, 1: 1-16.
|
| [5] |
Jiang L, Hu X, Xu T, et al. Prevalence of antibiotic resistance genes and their relationship with antibiotics in the Huangpu River and the drinking water sources, Shanghai, China. Sci Total Environ, 2013, 458: 267-272.
|
| [6] |
Yang Y, Song W, Lin H, et al. Antibiotics and antibiotic resistance genes in global lakes: a review and meta-analysis. Environ Int, 2018, 116: 60-73. DOI:10.1016/j.envint.2018.04.011
|
| [7] |
Tang X, Lou C, Wang S, et al. Effects of long-term manure applications on the occurrence of antibiotics and antibiotic resistance genes (ARGs) in paddy soils: evidence from four field experiments in south of China. Soil Biol Biochem, 2015, 90: 179-187. DOI:10.1016/j.soilbio.2015.07.027
|
| [8] |
Czekalski N, Díez EG, Bürgmann H. Wastewater as a point source of antibiotic-resistance genes in the sediment of a freshwater lake. ISME J, 2014, 8(7): 1381-1390. DOI:10.1038/ismej.2014.8
|
| [9] |
Brown-Jaque M, Calero-Cáceres W, Espinal P, et al. Antibiotic resistance genes in phage particles isolated from human feces and induced from clinical bacterial isolates. Int J Antimicrob Agents, 2018, 51(3): 434-442. DOI:10.1016/j.ijantimicag.2017.11.014
|
| [10] |
Chen H, Zhang M. Effects of advanced treatment systems on the removal of antibiotic resistance genes in wastewater treatment plants from Hangzhou, China. Environ Sci Technol, 2013, 47(15): 8157-8163.
|
| [11] |
Mazhar SH, Li X, Rashid A, et al. Co-selection of antibiotic resistance genes, and mobile genetic elements in the presence of heavy metals in poultry farm environments. Sci Total Environ, 2021, 755: 142702. DOI:10.1016/j.scitotenv.2020.142702
|
| [12] |
Wang Q, Wang P, Yang Q. Occurrence and diversity of antibiotic resistance in untreated hospital wastewater. Sci Total Environ, 2018, 621: 990-999. DOI:10.1016/j.scitotenv.2017.10.128
|
| [13] |
Chen BW, Yang Y, Liang X, et al. Metagenomic profiles of antibiotic resistance genes (ARGs) between human impacted estuary and deep ocean sediments. Environ Sci Technol, 2013, 47(22): 12753-12760. DOI:10.1021/es403818e
|
| [14] |
Chen B, Yuan K, Chen X, et al. Metagenomic analysis revealing antibiotic resistance genes (ARGs) and their genetic compartments in the Tibetan environment. Environ Sci Technol, 2016, 50(13): 6670-6679. DOI:10.1021/acs.est.6b00619
|
| [15] |
D'Costa VM, King CE, Kalan L, et al. Antibiotic resistance is ancient. Nature, 2011, 477(7365): 457-461. DOI:10.1038/nature10388
|
| [16] |
Wang Y, Lan H, Li L, et al. Chemicals and microbes in bioaerosols from reaction tanks of six wastewater treatment plants: survival factors, generation sources, and mechanisms. Sci Rep, 2018, 8(1): 1-12.
|
| [17] |
Cao Y, Shao L, Jones T, et al. Multiple relationships between aerosol and COVID-19: a framework for global studies. Gondwana Res, 2021, 93: 243-251. DOI:10.1016/j.gr.2021.02.002
|
| [18] |
Brągoszewska E, Biedroń I. Indoor air quality and potential health risk impacts of exposure to antibiotic resistant bacteria in an office rooms in Southern Poland. Int J Environ Res Public Health, 2018, 15(11): 2604. DOI:10.3390/ijerph15112604
|
| [19] |
Azim A, Singhal S. Engineering solutions for preventing airborne transmission in hospitals with resource limitation and demand surge. Indian J Crit Care M, 2021, 25(4): 453-460. DOI:10.5005/jp-journals-10071-23792
|
| [20] |
Gao XL, Shao MF, Wang Q, et al. Airborne microbial communities in the atmospheric environment of urban hospitals in China. J Hazard Mater, 2018, 349: 10-17. DOI:10.1016/j.jhazmat.2018.01.043
|
| [21] |
Li J, Cao J, Zhu YG, et al. Global survey of antibiotic resistance genes in air. Environ Sci Technol, 2018, 52(19): 10975-10984. DOI:10.1021/acs.est.8b02204
|
| [22] |
Gwenzi W, Shamsizadeh Z, Gholipour S, et al. The air-borne antibiotic resistome: occurrence, health risks, and future directions. Sci Total Environ, 2021, 150154.
|
| [23] |
Yang K, Li L, Wang Y, et al. Airborne bacteria in a wastewater treatment plant: emission characterization, source analysis and health risk assessment. Water Res, 2019, 149: 596-606. DOI:10.1016/j.watres.2018.11.027
|
| [24] |
Wang Q, Guo S, Hou Z, et al. Rainfall facilitates the transmission and proliferation of antibiotic resistance genes from ambient air to soil. Sci Total Environ, 2021, 799: 149260. DOI:10.1016/j.scitotenv.2021.149260
|
| [25] |
Zhu G, Wang X, Yang T, et al. Air pollution could drive global dissemination of antibiotic resistance genes. ISME J, 2021, 15(1): 270-281. DOI:10.1038/s41396-020-00780-2
|
| [26] |
De Rooij MM, Hoek G, Schmitt H, et al. Insights into livestock-related microbial concentrations in air at residential level in a livestock dense area. Environ Sci Technol, 2019, 53(13): 7746-7758. DOI:10.1021/acs.est.8b07029
|
| [27] |
Wang Y, Wang C, Song L. Distribution of antibiotic resistance genes and bacteria from six atmospheric environments: exposure risk to human. Sci Total Environ, 2019, 694: 133750. DOI:10.1016/j.scitotenv.2019.133750
|
| [28] |
Rizzo L, Manaia C, Merlin C, et al. Urban wastewater treatment plants as hotspots for antibiotic resistant bacteria and genes spread into the environment: a review. Sci Total Environ, 2013, 447: 345-360. DOI:10.1016/j.scitotenv.2013.01.032
|
| [29] |
Levy SB, Fitzgerald GB, Macone AB. Spread of antibiotic-resistant plasmids from chicken to chicken and from chicken to man. Nature, 1976, 260(5546): 40-42. DOI:10.1038/260040a0
|
| [30] |
Barlam TF, Gupta K. Antibiotic resistance spreads internationally across borders. J Law Med Ethics, 2015, 43(S3): 12-16. DOI:10.1111/jlme.12268
|
| [31] |
尹业师, 陈华海, 曹林艳, 等. 细菌耐药性应对策略研究进展. 生物工程学报, 2018, 34(8): 1346-1360. Yin YS, Chen HH, Cao LY, et al. Progress in strategies to combat antimicrobial resistance. Chin J Biotech, 2018, 34(8): 1346-1360 (in Chinese). |
| [32] |
Wei K, Zou Z, Yao M. Charge levels and Gram(±) fractions of environmental bacterial aerosols. J Aerosol Sci, 2014, 74: 52-62. DOI:10.1016/j.jaerosci.2014.04.002
|
| [33] |
Womack AM, Bohannan BJ, Green J. Biodiversity and biogeography of the atmosphere. Philos T R Soc B, 2010, 365(1558): 3645-3653. DOI:10.1098/rstb.2010.0283
|
| [34] |
Fernández-Natal I, Rodríguez-Lázaro D, Marrodán- Ciordia T, et al. Characterization and antimicrobial susceptibility of one antibiotic-sensitive and one multidrug-resistant Corynebacterium kroppenstedtii strain isolated from patients with granulomatous mastitis. New Microb New Infec, 2016, 14: 93-97. DOI:10.1016/j.nmni.2016.09.006
|
| [35] |
薛银刚, 刘菲, 王利平, 等. 气溶胶中抗生素抗性基因研究进展: 以养殖场和医院为例. 生态毒理学报, 2017, 12(6): 27-37. Xue YG, Liu F, Wang LP, et al. Progress in research on antibiotic resistance genes in aerosols: take farms and hospitals as examples. Asian J Ecotoxicol, 2017, 12(6): 27-37 (in Chinese). |
| [36] |
Sun J, Liao XP, D'Souza AW, et al. Environmental remodeling of human gut microbiota and antibiotic resistome in livestock farms. Nat Commun, 2020, 11(1): 1-11. DOI:10.1038/s41467-019-13993-7
|
| [37] |
Chien YC, Chen CJ, Lin TH, et al. Characteristics of microbial aerosols released from chicken and swine feces. J Air Waste Manage Assoc, 2011, 61(8): 882-889. DOI:10.3155/1047-3289.61.8.882
|
| [38] |
Kawanaka Y, Tsuchiya Y, Yun SJ, et al. Size distributions of polycyclic aromatic hydrocarbons in the atmosphere and estimation of the contribution of ultrafine particles to their lung deposition. Environ Sci Technol, 2009, 43(17): 6851-6856. DOI:10.1021/es900033u
|
| [39] |
张兰河, 贺雨伟, 陈默, 等. 畜禽养殖场空气中可培养抗生素耐药菌污染特点研究. 环境科学, 2016, 37(12): 4531-4537. Zhang LH, He YW, Chen M, et al. Pollution characteristics of antibiotic resistant bacteria from atmospheric environment of animal feeding operations. Environ Sci, 2016, 37(12): 4531-4537 (in Chinese). |
| [40] |
Adams RI, Bhangar S, Pasut W, et al. Chamber bioaerosol study: outdoor air and human occupants as sources of indoor airborne microbes. PLoS One, 2015, 10(5): e0128022. DOI:10.1371/journal.pone.0128022
|
| [41] |
Jusot JF, Neill DR, Waters EM, et al. Airborne dust and high temperatures are risk factors for invasive bacterial disease. J Allergy Clin Immunol, 2017, 139(3): 977-986. DOI:10.1016/j.jaci.2016.04.062
|
| [42] |
Song L, Wang C, Wang Y, et al. Optimized determination of airborne tetracycline resistance genes in laboratory atmosphere. Front Env Sci Eng, 2020, 14(6): 1-11.
|
| [43] |
Li N, Chai Y, Ying GG, et al. Airborne antibiotic resistance genes in Hong Kong kindergartens. Environ Pollut, 2020, 260: 114009. DOI:10.1016/j.envpol.2020.114009
|
| [44] |
Zhao Y, Wang Q, Chen Z, et al. Significant higher airborne antibiotic resistance genes and the associated inhalation risk in the indoor than the outdoor. Environ Pollut, 2021, 268: 115620. DOI:10.1016/j.envpol.2020.115620
|
| [45] |
Małecka-Adamowicz M, Kubera Ł, Jankowiak E, et al. Microbial diversity of bioaerosol inside sports facilities and antibiotic resistance of isolated Staphylococcus spp. Aerobiologia, 2019, 35(4): 731-742. DOI:10.1007/s10453-019-09613-y
|
| [46] |
Ramos CA, Wolterbeek HT, Almeida SM. Exposure to indoor air pollutants during physical activity in fitness centers. Build Environ, 2014, 82: 349-360. DOI:10.1016/j.buildenv.2014.08.026
|
| [47] |
Andrade A, Dominski FH, Coimbra D. Scientific production on indoor air quality of environments used for physical exercise and sports practice: bibliometric analysis. J Environ Manage, 2017, 196: 188-200. DOI:10.1016/j.jenvman.2017.03.001
|
| [48] |
Li J, Zhou L, Zhang X, et al. Bioaerosol emissions and detection of airborne antibiotic resistance genes from a wastewater treatment plant. Atmospheric Environ, 2016, 124: 404-412. DOI:10.1016/j.atmosenv.2015.06.030
|
| [49] |
Gao M, Jia R, Qiu T, et al. Size-related bacterial diversity and tetracycline resistance gene abundance in the air of concentrated poultry feeding operations. Environ Pollut, 2017, 220: 1342-1348. DOI:10.1016/j.envpol.2016.10.101
|
| [50] |
Yang Y, Zhou R, Chen B, et al. Characterization of airborne antibiotic resistance genes from typical bioaerosol emission sources in the urban environment using metagenomic approach. Chemosphere, 2018, 213: 463-471. DOI:10.1016/j.chemosphere.2018.09.066
|
| [51] |
Song L, Wang C, Jiang G, et al. Bioaerosol is an important transmission route of antibiotic resistance genes in pig farms. Environ Int, 2021, 154(12): 106559.
|
| [52] |
Zhang Y, Zheng Y, Zhu Z, et al. Dispersion of antibiotic resistance genes (ARGs) from stored swine manure biogas digestate to the atmosphere. Sci Total Environ, 2021, 761: 144108. DOI:10.1016/j.scitotenv.2020.144108
|
| [53] |
Gibbs SG, Green CF, Tarwater PM, et al. Isolation of antibiotic-resistant bacteria from the air plume downwind of a swine confined or concentrated animal feeding operation. Environ Health Perspect, 2006, 114(7): 1032-1037. DOI:10.1289/ehp.8910
|
| [54] |
Mceachran AD, Blackwell BR, Hanson JD, et al. Antibiotics, bacteria, and antibiotic resistance genes: aerial transport from cattle feed yards via particulate matter. Environ Health Perspect, 2015, 123(4): 337-343. DOI:10.1289/ehp.1408555
|
| [55] |
Schluter A, Szczepanowski R, Kurz N, et al. Erythromycin resistance-conferring plasmid pRSB105, isolated from a sewage treatment plant, harbors a new macrolide resistance determinant, an integron- containing Tn 402-like element, and a large region of unknown function. Appl Environ Microbiol, 2007, 73(6): 1952-1960. DOI:10.1128/AEM.02159-06
|
| [56] |
Wéry N, Lhoutellier C, Ducray F, et al. Behaviour of pathogenic and indicator bacteria during urban wastewater treatment and sludge composting, as revealed by quantitative PCR. Water Res, 2008, 42(1/2): 53-62.
|
| [57] |
Wang Y, Li L, Han Y, et al. Intestinal bacteria in bioaerosols and factors affecting their survival in two oxidation ditch process municipal wastewater treatment plants located in different regions. Ecotoxicol Environ Saf, 2018, 154: 162-170. DOI:10.1016/j.ecoenv.2018.02.041
|
| [58] |
Han Y, Yang T, Chen T, et al. Characteristics of submicron aerosols produced during aeration in wastewater treatment. Sci Total Environ, 2019, 696: 134019. DOI:10.1016/j.scitotenv.2019.134019
|
| [59] |
Zieliński W, Korzeniewska E, Harnisz M, et al. The prevalence of drug-resistant and virulent Staphylococcus spp. in a municipal wastewater treatment plant and their spread in the environment. Environ Int, 2020, 143: 105914.
|
| [60] |
Gaviria-Figueroa A, Preisner EC, Hoque S, et al. Emission and dispersal of antibiotic resistance genes through bioaerosols generated during the treatment of municipal sewage. Sci Total Environ, 2019, 686: 402-412. DOI:10.1016/j.scitotenv.2019.05.454
|
| [61] |
Wu B, Qi C, Wang L, et al. Detection of microbial aerosols in hospital wards and molecular identification and dissemination of drug resistance of Escherichia coli. Environ Int, 2020, 137: 105479. DOI:10.1016/j.envint.2020.105479
|
| [62] |
Fasugba O, Gardner A, Mitchell BG, et al. Ciprofloxacin resistance in community-and hospital- acquired Escherichia coli urinary tract infections: a systematic review and meta-analysis of observational studies. BMC Infect Dis, 2015, 15(1): 1-16. DOI:10.1186/s12879-014-0722-x
|
| [63] |
Li X, Wu Z, Dang C, et al. A metagenomic-based method to study hospital air dust resistome. Chem Eng J, 2021, 406: 126854. DOI:10.1016/j.cej.2020.126854
|
| [64] |
Wiener-Well Y, Galuty M, Rudensky B, et al. Nursing and physician attire as possible source of nosocomial infections. Am J Infect Control, 2011, 39(7): 555-559. DOI:10.1016/j.ajic.2010.12.016
|
| [65] |
Brady RR, Verran J, Damani N, et al. Review of mobile communication devices as potential reservoirs of nosocomial pathogens. J Hosp Infect, 2009, 71(4): 295-300. DOI:10.1016/j.jhin.2008.12.009
|
| [66] |
Bures S, Fishbain JT, Uyehara CF, et al. Computer keyboards and faucet handles as reservoirs of nosocomial pathogens in the intensive care unit. Am J Infect Control, 2000, 28(6): 465-471. DOI:10.1067/mic.2000.107267
|
| [67] |
Lax S, Smith D, Sangwan N, et al. Colonization and succession of hospital-associated microbiota. Sci Transl Med, 2017, 9(391): eaah6500. DOI:10.1126/scitranslmed.aah6500
|
| [68] |
Abreu PD, Farias P, Paiva G, et al. Persistence of microbial communities including Pseudomonas aeruginosa in a hospital environment: a potential health hazard. BMC Microbiol, 2014, 14(1): 1-10. DOI:10.1186/1471-2180-14-1
|
| [69] |
Messi P, Sabia C, Anacarso I, et al. Prevalence of multi-drug-resistant (MDR) bacteria in air samples from indoor and outdoor environments. Aerobiologia, 2015, 31(3): 381-387. DOI:10.1007/s10453-015-9371-9
|
| [70] |
He P, Wu Y, Huang W, et al. Characteristics of and variation in airborne ARGs among urban hospitals and adjacent urban and suburban communities: a metagenomic approach. Environ Int, 2020, 139: 105625. DOI:10.1016/j.envint.2020.105625
|
 2022, Vol. 38
2022, Vol. 38




