中国科学院微生物研究所、中国微生物学会主办
文章信息
- 宗工理, 陈曦, 张振, 涂煜, 曹广祥, 张佩佩, 付加芳, 张荣珍
- ZONG Gongli, CHEN Xi, ZHANG Zhen, TU Yu, CAO Guangxiang, ZHANG Peipei, FU Jiafang, ZHANG Rongzhen
- ABC转运蛋白SgnA/B促进纳他霉素胞外转运与高产
- ABC transporter SgnA/B promotes extracellular transport and efficient production of natamycin
- 生物工程学报, 2022, 38(7): 2534-2548
- Chinese Journal of Biotechnology, 2022, 38(7): 2534-2548
- 10.13345/j.cjb.220051
-
文章历史
- Received: January 21, 2022
- Accepted: April 6, 2022
2. 山东第一医科大学 (山东省医学科学院) 生物医学科学学院 (省医药生物技术研究中心), 山东 济南 250062
2. Biomedical Sciences College & Shandong Medicinal Biotechnology Centre, Shandong First Medical University & Shandong Academy of Medical Sciences, Jinan 250062, Shandong, China
临床真菌感染和食品真菌污染是威胁人类健康的两大重要因素。对哺乳动物细胞无显著毒副作用的纳他霉素(natamycin) (又称匹马霉素,pimaricin) 是一种天然、广谱、高效的多烯大环内酯类抗真菌剂,其分子式为C33H47NO13,在临床真菌感染及肿瘤治疗和食品真菌污染防治中具有重要价值[1-3]。纳他霉素可由多种链霉菌合成,其生物合成基因簇在核酸序列及蛋白水平上具有高度一致性[1, 4],褐黄孢链霉菌(Streptomyces gilvosporeus)[5]、纳塔尔链霉菌(Streptomyces natalensis)[6]、恰塔努加链霉菌(Streptomyces chattanoogensis)[7]和利迪链霉菌(Streptomyces lydicus)[8]均可以合成纳他霉素,合成基因分别标注为sgn、pim、scn和scl。褐黄孢链霉菌(Streptomyces gilvosporeus) F607是本实验室通过菌种选育获得的纳他霉素高产菌株[9]。
S. gilvosporeus纳他霉素的生物合成由Ⅰ型聚酮合酶(SgnS0-S4) 催化乙酸和丙酸形成其骨架结构,SgnD与SgnG负责编码的P450单氧化酶完成内酯环修饰。SgnJ与SgnC则与侧链糖基的形成有关[4]。纳他霉素的生物合成受到多个调控因子的复杂调控。途径特异性调控因子PimM[10]、PimR[11-12]及其同源基因[7]可专一性调控纳他霉素的生物合成。AdpA[13]、双组分系统(two component system, TCS)[14]和WhiG[15]等多个全局调控因子和群体感应诱导物PI因子也参与调控纳他霉素的合成。此外,研究表明,胞内一定浓度的活性氧(reactive oxygen species, ROS) 对抗生素生物合成具有重要作用[16-17]。发酵过程中维持一定浓度的H2O2,可提高纳他霉素的合成速度,该调控可能与途径特异性调控蛋白PimM的PAS结构域响应有关[18-19]。同时,由于纳他霉素是一类具有还原性的多烯大环内酯类抗生素,其胞内积累将影响ROS水平,进而不利于维持其高水平的生物合成。
抗生素胞外转运对抑制抗生素细胞累积、缓解产生产物抑制效应和直接前体产生累积具有重要意义[20-21]。杰多霉素生物合成簇内易化扩散家族蛋白JadL缺失株的胞外杰多霉素B产量降低,过表达株产量则高于野生型37.87%,表明通过加强外排可提高胞外杰多霉素B的产量[22]。多烯类抗生素ATP结合盒转运蛋白(ATP- binding cassette transporter, ABC转运蛋白) 促进抗生素的胞外转运,如:四烯类抗生素制霉菌素基因簇中编码ABC转运蛋白的基因nysG和nysH突变后,制霉菌素合成水平较野生菌株下调35%,且制霉菌素前体10-脱氧制霉菌素累积[20]。
纳他霉素合成基因簇中sgnA和sgnB编码的ABC转运蛋白SgnA和SgnB的生物学功能被预测为参与抗生素及其合成前体从胞内向胞外转运的过程[1, 23],但目前对于该ABC转运蛋白转运纳他霉素的研究较少,且尚未有基于改变转运效率以提高纳他霉素产量的研究。本研究在实验室前期选育获得的纳他霉素高产菌株S. gilvosporeus F607基础上,构建融合ermE高效启动子的sgnA和sgnB双拷贝菌株,并分析对纳他霉素产量的影响,通过提高转运效率以增加抗生素的产量,这在工业生产上具有很高的应用价值。
1 材料与方法 1.1 菌株与质粒褐黄孢链霉菌F607、pMS82质粒为本实验室保存;大肠杆菌(Escherichia coli) DH5α感受态细胞、pMD-18T载体,购自宝生物工程(大连) 有限公司;链霉菌强启动子ermE片段由生工生物工程(上海) 股份有限公司合成。
1.2 主要试剂限制性核酸内切酶(KpnⅠ、Hind Ⅲ) 购自Thermo Fisher Scientific公司;核酸连接酶(T4 DNA ligase)、琼脂糖凝胶回收试剂盒、SDS-PAGE凝胶配制试剂盒等均购自生工生物工程(上海) 股份有限公司;质粒小提试剂盒购自TIANGEN公司。
Pfu DNA聚合酶、Taq DNA聚合酶、dNTPs购自北京全式金生物科技有限公司;DNA分子量标准购自宝生物工程(大连) 有限公司;引物合成及测序,生工生物工程(上海) 股份有限公司;蛋白胨、酵母提取物、琼脂糖购自Oxoid公司;其他国产分析纯普通试剂。
1.3 培养基LB液体培养基(g/L):酵母提取物5.0,蛋白胨10.0,氯化钠10.0。LB固体培养基:LB液体培养基中加琼脂粉15.0 g。MS产孢固体培养基(g/L):黄豆粉20.0,甘露醇20.0,CaCO3 3.0,琼脂粉15.0。NTZ种子培养基(g/L):葡萄糖10.0,酵母提取物3.0,大豆蛋白胨5.0,麦芽浸粉3.0。NTF发酵培养基(g/L):大豆蛋白胨20.0,酵母提取物4.5,氯化钠2.0,结晶硫酸镁1.0,葡萄糖60.0。
1.4 SgnA/B转运纳他霉素方式的分析依据前期F607基因组测序(GenBank登录号:NZ_CP020569.1) 结果,从NCBI蛋白数据库中查找SgnA和SgnB的氨基酸序列(GenBank登录号:WP_016579058.1和WP_014143936.1)。BLAST分析SgnA与SgnB蛋白序列同源性。利用TMHMM-2.0分析其跨膜结构域。利用SWISS-MODEL同源建模构建SgnA和SgnB三维结构模型。利用Discovery Studio分子对接该ABC转运蛋白与纳他霉素,分析其结合转运方式及底物结合氨基酸残基。
1.5 SgnA/B超表达菌株的构建 1.5.1 SgnA/B接合转移质粒的构建以F607基因组为模板,设计带有KpnⅠ、Hind Ⅲ酶切位点和6×His标签序列的特异性引物EX-F和EX-R (表 1),高保真DNA聚合酶扩增sgnA/B基因序列,琼脂糖电泳并回收后,T-A克隆至pMD-18T载体,测序。测序正确的质粒经KpnⅠ和Hind Ⅲ双酶切后,与预先双酶切的pMS82连接,得到重组基因载体pMS82-EX,经酶切、测序验证正确的pMS82-EX质粒转化于E. coli ET12567 (pUZ8002)。
| Primers | Sequences (5′→3′) |
| EX-F | AAGCTTGGATCCGATGCTGTTGTGGGCACAATCGTGCCGGTTGGTAGGATCAAGCGGAAGAAGGGAGCGGACATCATCATCACCATCACCATGTGCTGCTCAGCCTTCTGCGAATC |
| EX-R | ATGGGTACCCATCATCACCATCACCATTCAGGAAAGACTGGGGGAAATGCC |
| V1-F | ATCCCTGTTACTTCTCGACCGTATTG |
| V1-R | GGATCGGTGAAGCCGGAGAG |
| V2-F | CCGATGCTGTTGTGGGCAC |
| V2-R | GGACCAGCAGCACGAGGG |
| SgnA/B-RT-F | CGACAGCGGCTATATCACCC |
| SgnA/B-RT-R | CACATCGTTGACGGTCCGC |
| 16S-RT-F | CCGCCTCGTTGCCCTCG |
| 16S-RT-R | CAGGGACGCCCATCGGTG |
避光条件下,用含有潮霉素(Hyg, 50 μg/mL)、氨苄青霉素(Amp, 100 μg/mL)、氯霉素(Cm, 25 μg/mL) 的LB培养基培养E. coli ET12567 (pUZ8002, pMS82-EX) 至OD600为0.4−0.6,等体积LB培养基洗涤2次,重悬于0.1倍体积的LB培养基中。MS平板培养S. gilvosporeus F607 3–4 d,刮取孢子接种于种子活化培养基培养约48 h,等体积2×YT培养基洗涤2次,重悬于0.1倍体积的2×YT培养基中。200 μL大肠杆菌与200 μL菌丝体混匀,涂布于添加10 mmol/L MgCl2的MS固体平板上,30 ℃培养16–20 h,1 mL无菌水(含0.5 mg萘啶酮酸(NDA) 和1 mg Hyg) 涂布平板,继续30 ℃培养,接合子在含有25 mg的NDA和30 mg的Hyg的培养基中进行筛选。对筛选出的接合子进行至少3轮的纯化后,活化孢子,提取细菌基因组,PCR验证引物V1-F和V1-R扩增hgy基因,V2-F和V2-R扩增ermE和sgnA融合片段进行验证,验证引物见表 1。阳性接合子命名为S. gilvosporeus F-EX。
1.6 SgnA/B表达情况S. gilvosporeus F607和S. gilvosporeus F-EX菌株摇瓶发酵培养,实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR) 分析sgnA/B基因在两者中的转录水平[24],分别在发酵不同时期(24、48、72、96、120 h) 10 000 r/min离心10 min,收集菌体。提取总RNA并反转录成cDNA,然后进行RT-qPCR分析。用不加模板的样品作为阴性对照,并用看家基因16S rRNA作为内标校正因样品初始浓度不同而造成的差异。sgnA/B基因引物SgnA/B-RT-F、SgnA/B-RT-R和16S rRNA基因引物16S-RT-F和16S-RT-R见表 1。Western blotting检测:发酵72 h后,分别取10 mL发酵液10 000 r/min离心20 min,上清TCA浓缩100倍,蛋白电泳,转PVDF,封闭液中封闭60 min,将一抗(CW0286, CWBIO, China) 4 ℃孵育过夜,二抗(CW0102, CWBIO, China) 37 ℃孵育60 min,PBS溶液室温脱色床上洗膜3次,显色液显色分析。
1.7 纳他霉素的发酵与含量测定 1.7.1 纳他霉素的液体摇瓶发酵取–80 ℃保存的S. gilvosporeus F607和S. gilvosporeus F-EX孢子,4 ℃解冻后,在超净台中分别取出1 mL涂布于MS固体平板(工程菌株需加入终浓度25 μg/mL的Hyg),29 ℃培养3–4 d,待长满白色孢子后,刮取孢子于种子活化培养基中进行活化。29 ℃、220 r/min培养约48 h,以5%转接量转接该培养产物于新鲜种子培养基中,进行种子的二级活化,29 ℃、220 r/min培养约24 h,以5%的比例接种于250 mL装液量为30 mL的三角锥形瓶中,并加入终浓度为6%的葡萄糖,29 ℃、220 r/min发酵培养120 h。发酵初始pH值为7.5。每隔24 h测定纳他霉素胞外与胞内产量。
1.7.2 纳他霉素含量的HPLC测定取1 mL发酵液,10 000 r/min离心10 min,上清液加入9 mL无水甲醇,得到外排到胞外的纳他霉素含量;沉淀用9 mL无水甲醇重悬后,超声萃取20 min,萃取液10 000 r/min离心10 min,得到胞内纳他霉素含量。0.22 μm微孔滤膜过滤上述萃取液,用于HPLC测定纳他霉素含量,以1.0 g/L的纳他霉素标准品作为对照。HPLC检测条件:色谱柱:Zorbax Eclipse XDB-C18柱(4.6 mm×150 mm, 5 μm);流动相:V (0.3% NH4Cl, 0.02% NH4Ac)︰V (乙腈)︰V (四氢呋喃)=75︰20︰5;流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:303 nm。
1.7.3 胞内ROS含量测定纳他霉素发酵过程中,每24 h收集菌体,弃上清。采用过氧化氢检测试剂盒(碧云天,S0038) 检测胞内ROS含量:按照每100万细胞加入100–200 μL过氧化氢检测裂解液的比例加入裂解液,随后充分破碎并裂解细胞。4 ℃约12 000 r/min离心3–5 min,取上清。加入反应试剂,测定560 nm处的吸光度,等量双蒸水作为空白对照。
1.7.4 转录组测序纳他霉素发酵24、60、120 h时,取2 mL发酵液加入EP管,10 000 r/min离心,弃上清液,沉淀置于液氮进行速冻,然后置于–80 ℃冰箱保存,送上海阿趣生物科技有限公司测序,进行表达差异分析、富集分析和聚类分析,筛选差异表达基因条件为:表达差异倍数|log2 fold change| > 1,显著性P-value < 0.05。
2 结果与分析 2.1 SgnA/B为内向开口的异源双亚基ABC转运蛋白ABC转运蛋白具有2个核苷酸结合区域(nucleotide binding domain, NBD) 和2个跨膜结合区域(transmembrane binding domain, TMD)[25-27]。SgnA/B作为ABC转运蛋白,其生物学功能被预测与纳他霉素的向胞外运输有关[23]。SgnA/B的序列分析发现,SgnA与SgnB的一级结构分别有577个和651个氨基酸,二者氨基酸序列同源性为31.57%,但SgnA与SgnB的二级结构十分相近,其中Walker-A、Q-loop、ABC signature、Walker-B、Switch和D-loop等ABC转运蛋白保守的模体(motif) 高度保守,其中SgnA的Walker-A结构域氨基酸序列为“GSTGAGKS”,SgnB为“GPTGAGKT”,较好地保留了Walker-A结构“GxTGxGKx”的保守序列。SgnB中模体开关(switch) 氨基酸残基分别为Gln528和His591,为高度保守氨基酸残基(图 1A)。因此,SgnA/B是由2种不同亚基组成的ABC转运蛋白。进一步分析跨膜结构域发现,SgnA和SgnB各有6个α螺旋形成ABC转运蛋白12个跨膜结构域的典型结构(图 1B)。
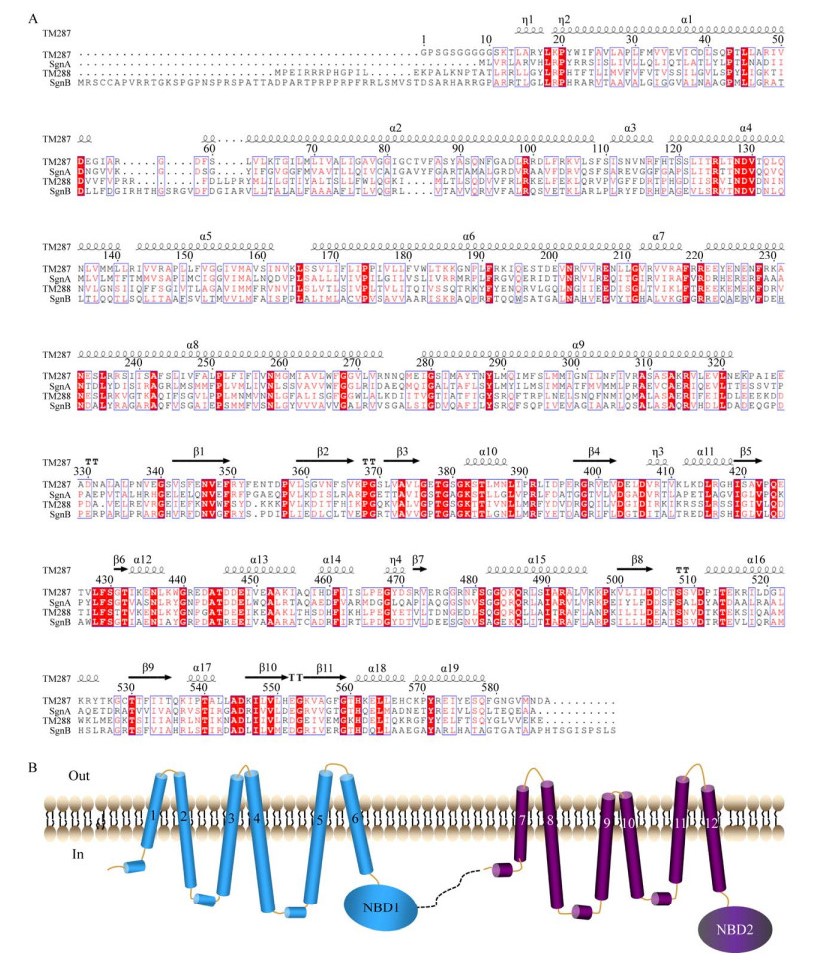
|
| 图 1 SgnA/B氨基酸序列及跨膜结构分析 Fig. 1 Sequence alignment and transmembrane structure of SgnA/B. (A) Sequence alignment of SgnA/B with TM287/288. (B) Topology diagram of SgnA/B. Diagram residues not resolved in the structure are shown as dashed lines. Out: outer cell membrane; In: inner cell membrane. |
| |
利用SWISS-MODEL的Multiple target project (https://swissmodel.expasy.org/),对SgnA/B进行同源建模,其三维结构模型与已知的海栖热袍菌(Thermotoga maritima) 中TM287/288 (PDB:3QF4) ABC转运蛋白同源性为40.33%,并依据此进行同源建模。SgnA/B结构模型表明,SgnA/B为内向开口构象(inward-facing conformation) 的ABC转运蛋白,该构象的蛋白形成“内宽外窄”的运输通道(图 2A)。SgnA/B转运蛋白有4个结构域,2个跨膜结构域TMD1、TMD2和2个核苷酸结合结构域NBD1、NBD2。2个TMD分别由6个螺旋组成,NBD结构则全部位于细胞内(图 2A)。Switch Gln528和His591则位于该通道的中心位置,与Walker-A、Walker-B形成底物转运的控制系统(图 2B)。TM287/288被报道通过与ATP和转运底物的结合后,TMD的螺旋重排形成外向开口构象(outward- facing conformation),然后释放转运底物,ATP水解后,TM287/288重新恢复其内向开口构象[26]。
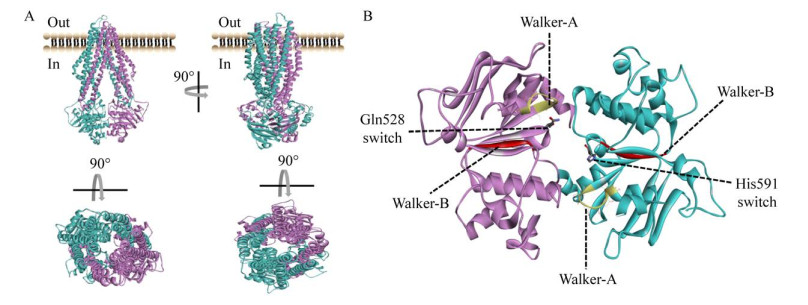
|
| 图 2 SgnA/B三维结构模型 Fig. 2 Three dimensional structural model of SgnA/B. (A) The overall structure of the SgnA/B. The N-terminal half (TMD1 and NBD1) is colored in lilac and the C-terminal half (TMD2 and NBD2) in blue. (B) Structure details of NBD1 and NBD2. |
| |
为探究SgnA/B转运纳他霉素的机制,采用分子对接的方法,分析了SgnA/B与纳他霉素结合的特性。结果表明,异源二聚体SgnA/B形成的转运通道具有2个纳他霉素结合部位(drug-binding cavity) DBC1和DBC2,分别位于NBD和TMD结构域(图 3A)。外向ABC转运蛋白结合ATP后,NBDs二聚体形成紧密的三明治结构,NBDs关闭,使得TMDs重排,进而蛋白由内向开放转变成外向开放的构象(ATP开关模型)[27]。
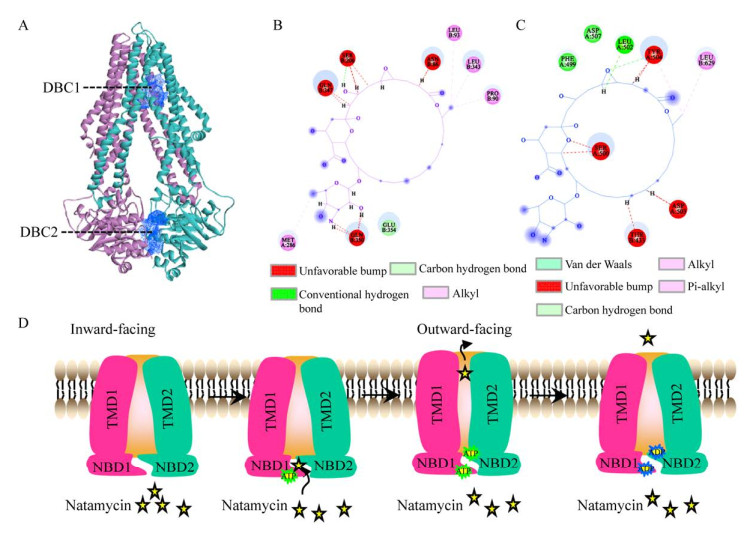
|
| 图 3 SgnA/B转运纳他霉素方式 Fig. 3 Natamycin transport mode mediated by SgnA/B. (A) Drug-binding cavity of SgnA/B. The inward-facing cavities are shown as a blue mesh. (B‒C) Interacting amino acid residues of DBC1 and DBC2 with natamycin. (D) Proposed mechanism of transport in heterodimeric ABC transporters. SgnA and SgnB are colored in carmine and cyan, respectively. Yellow, green and blue stars are natamycin, ATP and ADP. |
| |
进一步分析SgnA/B与纳他霉素转运结合部位发现,纳他霉素与DBC1之间形成常规氢键、unfavorable bump和alkyl相互作用,其结合氨基酸为SgnB的Gln347、Ser206、Asn86、Gln350、Leu93、Leu343、Pro90和Glu354。DBC2与纳他霉素之间,则还有范德华力、π-alkyl等其他相互作用,如:与SgnA链的Ser500、Asp503、Thr504及SgnB链的Thr433形成unfavorable bump相互作用,与SgnA链的Phe499、Asp507、Leu502形成常规氢键,与SgnB链的Leu629形成π-alkyl相互作用,并与Thr504存在alkyl相互作用(图 3B和3C)。这些作用力使DBC2与纳他霉素结合能降低,亲和力增加,因此SgnA/B呈现胞内底物亲和能力强,而跨膜区域亲和能力弱,因此有利于该外向转运蛋白向胞外转运纳他霉素,解除胞内因纳他霉素积累抵御ROS积累所引发的产物抑制效应,其转运模式见图 3D。
2.3 sgnA/B超表达菌株构建为解除纳他霉素胞内累积产生的产物抑制效应,构建了纳他霉素胞外转运蛋白sgnA/B超表达菌株。先基于pMS82质粒,构建带有ermE启动子片段的sgnA/B重组载体pMS-EX,酶切验证与目的片段理论大小一致,均是3 699 bp (图 4A)。pMS-EX经E. coli ET12567接合转移至S. gilvosporeus F607,潮霉素抗性筛选疑似阳性转化子,PCR扩增sgnA部分片段和潮霉素基因片段,扩增片段大小与理论大小一致,分别为809 bp和930 bp,获得阳性转化子,即S. gilvosporeus F-EX (图 4B和4C)。
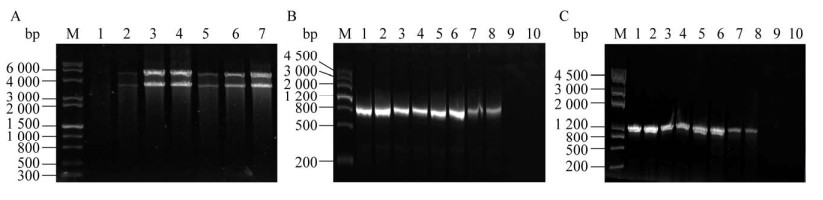
|
| 图 4 sgnA/B超表达菌株构建 Fig. 4 Construction of sgnA/B overexpression strain. (A) pMS-EX verification by digestion. Lane M: DNA marker; lane 1: blank control; lane 2–7: S. gilvosporeus F-EX positive transformants 1–6. (B) Verification of sgnA fragment in sgnA/B overexpression positive conjugations by PCR. Lane M: DNA marker; lane 1–8: positive conjugations 1–8; lane 9: F607; lane 10: blank control. (C) Verification of hgy fragment in sgnA/B overexpression positive conjugations by PCR. Lane M: DNA marker; lane 1–8: positive conjugations 1–8; lane 9: F607; lane 10: blank control. |
| |
为分析sgnA/B基因超表达对纳他霉素生物合成的影响,RT-qPCR分析了S. gilvosporeus F-EX中sgnA/B基因转录水平的变化,S. gilvosporeus- pMS82为阴性对照。结果显示,S. gilvosporeus F-EX菌株中sgnA与sgnB基因水平在48–120 h均增加(图 5A和5B),表明在S. gilvosporeus F-EX菌株中sgnA/B基因超表达成功。二者增加水平基本一致,与其基因共转录的特点一致。此外,在24 h时sgnA/B基因转录水平有轻微升高,可能与重组sgnA/B基因在基因组上,受途径特异性调控基因调控效率下降有关。
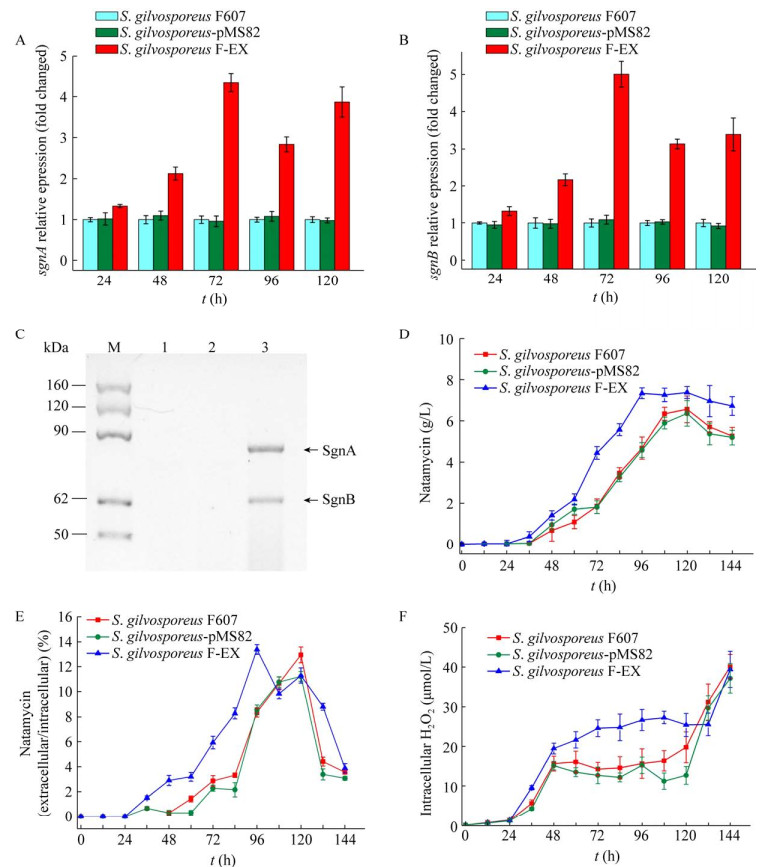
|
| 图 5 sgnA/B超表达影响纳他霉素的生物合成和胞外转运 Fig. 5 sgnA/B overexpression affects natamycin biosynthesis and extracellular transport. (A–B) Expression levels of sgnA and sgnB gene in different strains. (C) Western blotting of SgnA/B. Lane M: Western marker; 1–3: S. gilvosporeus strains F607, pMS82 and F-EX. (D) Total natamycin production of S. gilvosporeus strains F607, pMS82 and F-EX. (E) Ratio of extracellular natamycin and intracellular natamycin. (F) Intracellular H2O2 of S. gilvosporeus strains F607, pMS82 and F-EX. |
| |
超表达重组载体在sgnA/B基因两端加入了His标签序列,以区别于菌株自身sgnA/B的表达。sgnA/B基因分别编码577和651个氨基酸。Western blotting在泳道2中检测到SgnA和SgnB的条带,与理论的分子量一致,而对照泳道中没有检测到蛋白的表达(图 5C)。证实F607-EX中额外拷贝sgnA/B基因的表达。
为分析sgnA/B基因的超表达对纳他霉素产量的影响,菌株S. gilvosporeus F607、S. gilvosporeus-pMS82和S. gilvosporeus F-EX在摇瓶中发酵培养120 h,分别测定了胞内与胞外纳他霉素的含量。其中,S. gilvosporeus F-EX纳他霉素120 h总产量达到7.38 g/L,较F607的6.56 g/L提高了12.5%;负载空质粒菌株S. gilvosporeus-pMS82的纳他霉素产量与原始菌株F607无差异(图 5D)。分析sgnA/B超表达菌株纳他霉素的胞外/胞内比发现,在纳他霉素对数合成期,S. gilvosporeus F-EX的胞外/胞内比,明显高于F607菌株(图 5E)。以上结果证实,ABC转运蛋白SgnA/B具有纳他霉素向胞外转运功能,sgnA/B的超表达不仅促进了纳他霉素向胞外转运,而且提高了纳他霉素的总产量。
由于胞内ROS浓度对纳他霉素合成的促进作用,我们分析了在sgnA/B超表达并促进纳他霉素胞外转运情况下,胞内ROS浓度的变化。结果显示,F-EX菌株胞内ROS浓度在前48 h内与F607菌株相比,并无明显差异;在纳他霉素合成的对数期(48−72 h) 内,F-EX菌株则明显高于F607对照菌株;而纳他霉素合成的降速期,2个菌株都出现ROS的大幅上升,无明显差异(图 5F)。该结果表明,纳他霉素快速合成期的高效外排有利于S. gilvosporeus维持胞内的ROS水平,促进纳他霉素高效合成的持续进行。
2.5 sgnA/B超表达影响S. gilvosporeus的初级代谢和次级代谢进一步分析S. gilvosporeus F607和S. gilvosporeus F-EX的纳他霉素生物合成的转录组差异,对纳他霉素不同合成时期基因表达进行差异分析。结果发现,在纳他霉素快速合成期(60 h),S. gilvosporeus F-EX中有66.15%的基因差异表达,分别有2 816个基因表达量上调,1 941个基因下调,2 420个基因表达量无显著变化。在纳他霉素合成后期和前期,无显著变化基因则为5 754个和6 832个,表明sgnA/B超表达的影响在纳他霉素对数合成期更为显著(图 6)。在纳他霉素快速合成期,S. gilvosporeus F-EX与F607菌株出现纳他霉素合成速度的显著差异,因此,对该时期的基因表达进行了聚类分析,GO聚类分析发现,细胞学组件(cellular component)、分子功能(molecular function) 和生物学途径(biological process) 三大类中,细胞学组件类别变化较显著的是核糖体功能和细胞器形成相关基因;分子功能类别变化较显著的是离子跨膜运输和rRNA结合相关功能基因;生物学途径类别则集中于氮代谢和核苷酸代谢(图 7)。KEGG聚类分析发现,核糖体功能相关基因变化较为显著,而代谢途径类别中基因变化最多,包括了多种氨基酸代谢、丙酸盐代谢、糖代谢、TCA循环和五碳化合物代谢等初级代谢以及Ⅰ型聚酮化合物的代谢(图 8)。因此,转录组分析结果表明,sgnA/B的超表达提高了纳他霉素胞外转运效率的同时,还可能通过促进S. gilvosporeus初级代谢,增加纳他霉素高效合成所需前体的供给来间接促进纳他霉素的合成,但尚需进一步的实验证实。
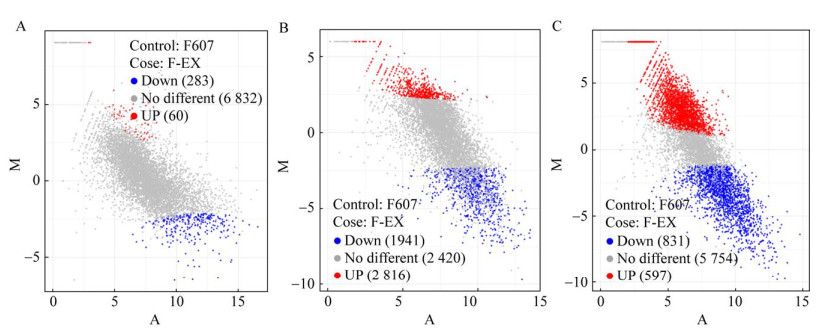
|
| 图 6 S. gilvosporeus F-EX的差异表达基因 Fig. 6 Differentially expressed genes of S. gilvosporeus strain F-EX compared with strain F607. (A–C) Differentially expressed genes at 24 h, 60 h and 120 h. The blue dots represent the down-regulated genes, red dots represent the up-regulated genes, gray dots indicate genes that are not significantly differentially expressed. |
| |
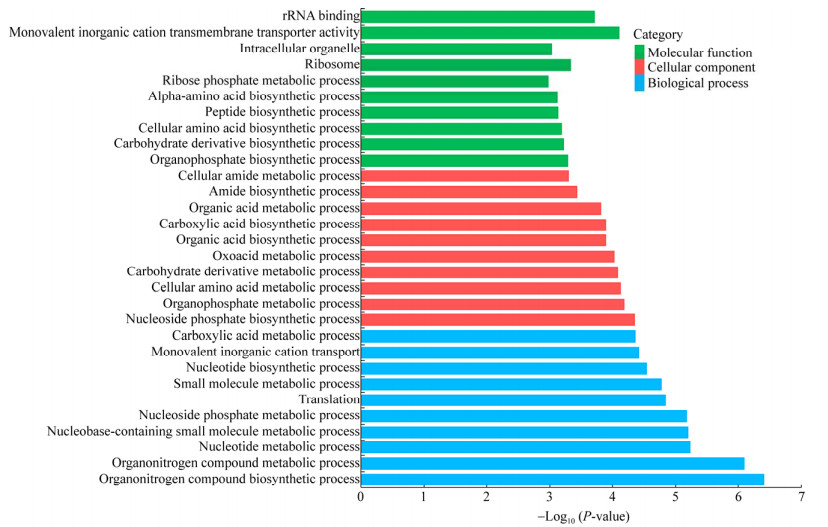
|
| 图 7 S. gilvosporeus F-EX在60 h时差异表达基因的GO富集分析柱状图 Fig. 7 GO functional classification map of differentially expressed genes of S. gilvosporeus F-EX at 60 h. |
| |
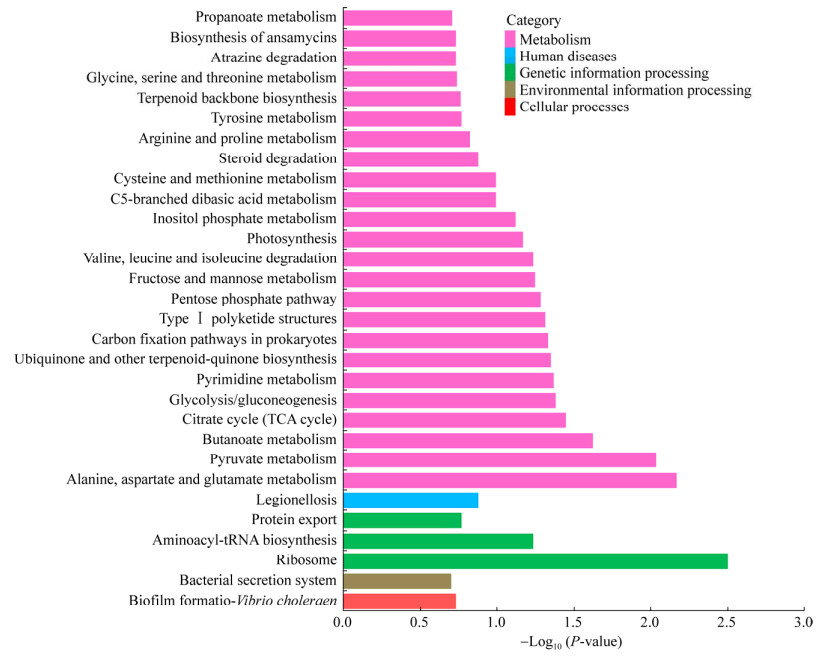
|
| 图 8 S. gilvosporeus F-EX在60 h时差异表达基因的KEGG代谢通路分类图 Fig. 8 KEGG classification of metabolic pathways map of differentially expressed genes of S. gilvosporeus F-EX at 60 h. |
| |
天然多烯大环内酯类纳他霉素具有广谱、高效的抗真菌特点,被广泛应用在食品防腐和真菌感染性疾病治疗领域[1]。然而,近期的研究则发现纳他霉素具有抑制前列腺癌细胞增殖的作用[2],为纳他霉素的应用开拓了更广阔的前景。纳他霉素自身具有还原性,易被氧化物氧化,而发酵过程中维持胞内一定浓度的H2O2,对纳他霉素的合成具有重要作用[18-19]。因此,基于这一特性,纳他霉素胞内合成后,高效率地胞外转运,缓解其对胞内ROS的清除作用,将是维持纳他霉素高效表达的途径之一。纳他霉素的胞外转运被预测由ABC转运蛋白SgnA和SgnB完成,但其实际作用及其机制尚未有实验证实,基于此,我们进行了SgnA/B转运纳他霉素方式的分析,并构建了sgnA/B超表达菌株,证实了其转运作用的同时,得到了纳他霉素产量提高的菌株S. gilvosporeus F-EX。
在原核生物中,ABC转运蛋白的4个区域可以是相同或不同的2种亚基组合。NBDs结合并水解ATP,为转运提供能量,其结构和序列在ABC转运蛋白家族中高度保守,包括Walker A和Walker B序列、ATP结合基序、H loop及Q loop。TMDs主要参与底物的识别并通过转运通过脂双层膜,结构及序列因转运底物的不同而具有多样性[25-27]。SgnA/B由2种亚基(SgnA和SgnB) 组成,虽然SgnA和SgnB同源性仅为31.57%,但所形成亚基的空间结构则高度相似。两种不同亚基组成的SgnA/B,呈现典型的内向开口结构,有研究表明该种结构的“ATP开关模型”,当ABC转运蛋白与ATP和转运底物结合后,TMD的螺旋重排形成外向开口构象,然后释放转运底物[26]。我们进一步分析SgnA/B与纳他霉素的结合区域发现,纳他霉素在SgnA/B上具有2个结合位点,即远离细胞膜的DBC1和靠近细胞膜的DBC2。通过分析2个结合位点的作用氨基酸及作用力,发现远离细胞膜的DBC1结合纳他霉素较为牢固,而靠近细胞膜的DBC2结合纳他霉素能力较弱,这一性质则更有利于纳他霉素的胞外转运。
通过构建ABC转运蛋白编码基因sgnA/B的超表达菌株F-EX并分析其对纳他霉素胞外转运效率的影响,F-EX菌株中纳他霉素的胞外/胞内浓度比的提高,促进了纳他霉素这一还原性次级代谢产物的胞外转运。这一作用将有助于减少胞内纳他霉素的积累,进而可能在一定程度上缓解ROS的消除作用,有助于维持对纳他霉素合成具有促进作用的胞内ROS浓度,提高纳他霉素的总产量。转录组差异基因聚类分析也证实Ⅰ型聚酮化合物的代谢得到了提升。转录组分析提示我们,sgnA/B的超表达对生长代谢中氨基酸代谢、丙酸盐代谢、糖代谢、TCA循环和五碳化合物代谢等初级代谢的多个基因表达具有影响,因此,初级代谢过程的变化可能是sgnA/B另一个影响纳他霉素的生物合成的间接因素。此外,构建的纳他霉素高效转运菌株S. gilvosporeus F-EX,纳他霉素产量已具备一定的工业化生产潜力。后续可以通过对代谢组、代谢通路的调控、胞内ROS的平衡和发酵条件的优化等方式,对该菌株的性能和生产能力进一步提升。
| [1] |
Aparicio JF, Barreales EG, Payero TD, et al. Biotechnological production and application of the antibiotic pimaricin: biosynthesis and its regulation. Appl Microbiol Biotechnol, 2016, 100(1): 61-78. DOI:10.1007/s00253-015-7077-0
|
| [2] |
Vasquez JL, Lai YH, Annamalai T, et al. Inhibition of base excision repair by natamycin suppresses prostate cancer cell proliferation. Biochimie, 2020, 168: 241-250. DOI:10.1016/j.biochi.2019.11.008
|
| [3] |
He C, Zhang ZQ, Li BQ, et al. Effect of natamycin on Botrytis cinerea and Penicillium expansum-postharvest pathogens of grape berries and jujube fruit. Postharvest Biol Technol, 2019, 151: 134-141. DOI:10.1016/j.postharvbio.2019.02.009
|
| [4] |
付加芳, 张晶, 张严洁, 等. 纳他霉素高产菌株Streptomyces gilvosporeus F607基因组及其生物合成基因簇分析. 微生物学通报, 2019, 46(9): 2312-2325. Fu JF, Zhang J, Zhang YJ, et al. Analysis of genome sequence and natamycin biosynthetic gene cluster on high producing strain Streptomyces gilvosporeus F607. Microbiol China, 2019, 46(9): 2312-2325 (in Chinese). |
| [5] |
Wang YM, Tao ZS, Zheng HL, et al. Iteratively improving natamycin production in Streptomyces gilvosporeus by a large operon-reporter based strategy. Metab Eng, 2016, 38: 418-426. DOI:10.1016/j.ymben.2016.10.005
|
| [6] |
Aparicio JF, Fouces R, Mendes MV, et al. A complex multienzyme system encoded by five polyketide synthase genes is involved in the biosynthesis of the 26-membered polyene macrolide pimaricin in Streptomyces natalensis. Chem Biol, 2000, 7(11): 895-905. DOI:10.1016/S1074-5521(00)00038-7
|
| [7] |
Du YL, Chen SF, Cheng LY, et al. Identification of a novel Streptomyces chattanoogensis L10 and enhancing its natamycin production by overexpressing positive regulator ScnRⅡ. J Microbiol, 2009, 47(4): 506-513. DOI:10.1007/s12275-009-0014-0
|
| [8] |
Wu HL, Liu WC, Shi LL, et al. Comparative genomic and regulatory analyses of natamycin production of Streptomyces lydicus A02. Sci Rep, 2017, 7(1): 9114. DOI:10.1038/s41598-017-09532-3
|
| [9] |
Zong GL, Zhong CQ, Fu JF, et al. Complete genome sequence of the high-natamycin-producing strain Streptomyces gilvosporeus F607. Genome Announc, 2018, 6(1): e01402-e01417.
|
| [10] |
Antón N, Santos-Aberturas J, Mendes MV, et al. PimM, a PAS domain positive regulator of pimaricin biosynthesis in Streptomyces natalensis. Microbiology (Reading), 2007, 153(Pt 9): 3174-3183.
|
| [11] |
Santos-Aberturas J, Vicente CM, Payero TD, et al. Hierarchical control on polyene macrolide biosynthesis: PimR modulates pimaricin production via the PAS-LuxR transcriptional activator PimM. PLoS One, 2012, 7(6): e38536. DOI:10.1371/journal.pone.0038536
|
| [12] |
Santos-Aberturas J, Payero TD, Vicente CM, et al. Functional conservation of PAS-LuxR transcriptional regulators in polyene macrolide biosynthesis. Metab Eng, 2011, 13(6): 756-767. DOI:10.1016/j.ymben.2011.09.011
|
| [13] |
Du YL, Li SZ, Zhou Z, et al. The pleitropic regulator AdpAch is required for natamycin biosynthesis and morphological differentiation in Streptomyces chattanoogensis. Microbiology (Reading), 2011, 157(Pt 5): 1300-1311.
|
| [14] |
Mendes MV, Tunca S, Antón N, et al. The two-component phoR-phoP system of Streptomyces natalensis: inactivation or deletion of phoP reduces the negative phosphate regulation of pimaricin biosynthesis. Metab Eng, 2007, 9(2): 217-227. DOI:10.1016/j.ymben.2006.10.003
|
| [15] |
Liu SP, Yu P, Yuan PH, et al. Sigma factor WhiGch positively regulates natamycin production in Streptomyces chattanoogensis L10. Appl Microbiol Biotechnol, 2015, 99(6): 2715-2726. DOI:10.1007/s00253-014-6307-1
|
| [16] |
Zhou WW, Ma B, Tang YJ, et al. Enhancement of validamycin A production by addition of ethanol in fermentation of Streptomyces hygroscopicus 5008. Bioresour Technol, 2012, 114: 616-621. DOI:10.1016/j.biortech.2012.03.124
|
| [17] |
Wei ZH, Bai LQ, Deng ZX, et al. Enhanced production of validamycin A by H2O2-induced reactive oxygen species in fermentation of Streptomyces hygroscopicus 5008. Bioresour Technol, 2011, 102(2): 1783-1787. DOI:10.1016/j.biortech.2010.08.114
|
| [18] |
Beites T, Pires SDS, Santos CL, et al. Crosstalk between ROS homeostasis and secondary metabolism in S.natalensis ATCC 27448:modulation of pimaricin production by intracellular ROS. PLoS One, 2011, 6(11): e27472. DOI:10.1371/journal.pone.0027472
|
| [19] |
Beites T, Rodríguez-García A, Santos-Beneit F, et al. Genome-wide analysis of the regulation of pimaricin production in Streptomyces natalensis by reactive oxygen species. Appl Microbiol Biotechnol, 2014, 98(5): 2231-2241. DOI:10.1007/s00253-013-5455-z
|
| [20] |
Sletta H, Borgos SEF, Bruheim P, et al. Nystatin biosynthesis and transport: nysH and nysG genes encoding a putative ABC transporter system in Streptomyces noursei ATCC 11455 are required for efficient conversion of 10-deoxynystatin to nystatin. Antimicrob Agents Chemother, 2005, 49(11): 4576-4583. DOI:10.1128/AAC.49.11.4576-4583.2005
|
| [21] |
Caffrey P, Lynch S, Flood E, et al. Amphotericin biosynthesis in Streptomyces nodosus. Chem Biol, 2003, 10(1): 93-94. DOI:10.1016/S1074-5521(03)00007-3
|
| [22] |
李月. 杰多霉素外排泵基因功能研究应用及一种biosensor筛选新调控基因方法的建立[D]. 兰州: 兰州大学, 2012. Li Y. Characterization and manipulation of the jadomycin effulux gene and construction of a biosensor-based method to screen for novel regulators[D]. Lanzhou: Lanzhou University, 2012 (in Chinese). |
| [23] |
Aparicio JF, Caffrey P, Gil JA, et al. Polyene antibiotic biosynthesis gene clusters. Appl Microbiol Biotechnol, 2003, 61(3): 179-188. DOI:10.1007/s00253-002-1183-5
|
| [24] |
Cao GX, Howard ST, Zhang PP, et al. Functional analysis of the EspR binding sites upstream of espR in Mycobacterium tuberculosis. Curr Microbiol, 2013, 67(5): 572-579. DOI:10.1007/s00284-013-0404-8
|
| [25] |
Orelle C, Dalmas O, Gros P, et al. The conserved glutamate residue adjacent to the Walker-B motif is the catalytic base for ATP hydrolysis in the ATP-binding cassette transporter BmrA. J Biol Chem, 2003, 278(47): 47002-47008. DOI:10.1074/jbc.M308268200
|
| [26] |
Hohl M, Briand C, Grütter MG, et al. Crystal structure of a heterodimeric ABC transporter in its inward-facing conformation. Nat Struct Mol Biol, 2012, 19(4): 395-402. DOI:10.1038/nsmb.2267
|
| [27] |
刘艳青, 赵永芳. ABC转运蛋白结构与转运机制的研究进展. 生命科学, 2017, 29(3): 223-229. Liu YQ, Zhao YF. Structure and mechanism of ABC transporter. Chin Bull Life Sci, 2017, 29(3): 223-229 (in Chinese). |
 2022, Vol. 38
2022, Vol. 38




