中国科学院微生物研究所、中国微生物学会主办
文章信息
- 徐嫄, 杨延丽, 邹兴启, 李翠, 朱元源, 秦义娴, 李琰, 盛亚男, 刘业兵, 彭国瑞, 徐小艾, 张松平, 赵启祖
- XU Yuan, YANG Yanli, ZOU Xingqi, LI Cui, ZHU Yuanyuan, QIN Yixian, LI Yan, SHENG Ya՚nan, LIU Yebing, PENG Guorui, XU Xiaoai, ZHANG Songping, ZHAO Qizu
- 应用高效体积排阻色谱偶联多角度激光散射鉴定猪圆环病毒2型灭活疫苗及病毒样颗粒疫苗抗原
- Characterization of the antigens in inactivated porcine circovirus type 2 vaccines and virus-like particle vaccines by high-performance size-exclusion chromatography coupled with multi-angle laser light scattering
- 生物工程学报, 2022, 38(8): 2948-2958
- Chinese Journal of Biotechnology, 2022, 38(8): 2948-2958
- 10.13345/j.cjb.210937
-
文章历史
- Received: December 22, 2021
- Accepted: March 22, 2022
- Published: March 25, 2022
2. 中国科学院过程工程研究所 生化工程国家重点实验室, 北京 100190;
3. 中国科学院大学 化学工程学院, 北京 100049
2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
3. School of Chemical Engineering, University of Chinese Academy of Sciences, Beijing 100049, China
猪圆环病毒(porcine circovirus, PCV) 是圆环病毒科(circoviridae) 圆环病毒属成员,是迄今发现的脊椎动物最小的DNA病毒之一。目前已知的猪圆环病毒包括4个基因型(PCV1−4)[1-2]。1974年,首次在德国分离的PCV1不具有致病性[3-4]。20世纪90年代末在断奶仔猪多系统衰竭综合征发病猪体内分离出PCV2[5]。经研究证明,PCV2能引发多种疾病,如断奶仔猪多系统衰竭综合征、猪皮炎和肾病综合征、猪呼吸道疾病综合征等,导致猪群出现大批量死亡,对畜牧业经济造成了严重威胁[6]。PCV3和PCV4分别于2016年和2019年在美国和中国被首次发现[7-8],它们的致病性有待深入研究。
目前,针对PCV2的防控措施是接种疫苗。PCV2疫苗以传统的灭活病毒疫苗和利用基因重组技术构建的亚单位疫苗为主。由于PCV2病毒体外增殖能力差,导致灭活病毒疫苗中的病毒含量普遍较低。此外,经油佐剂配制的灭活病毒疫苗接种动物后易导致局部不良反应。近年来利用大肠杆菌或杆状病毒等表达系统,重组表达PCV2衣壳蛋白Cap制备的亚单位疫苗相继问世,其中杆状病毒-昆虫细胞表达系统在高效表达可溶性外源蛋白上具有显著优势。PCV2开放阅读框2 (ORF2) 编码的衣壳蛋白Cap是PCV2唯一的结构蛋白,分子量为26−30 kDa,12个Cap五聚体排列构成PCV2的二十面体对称结构[9-11]。Cap蛋白包含重要的中和抗原表位,具有良好的免疫原性和反应原性。通过杆状病毒重组表达PCV2的Cap蛋白能够自组装成完整的病毒样颗粒(virus like particles, VLP),其兼顾安全性和良好的免疫原性[12]。目前国内已批准的PCV2疫苗产品有11个,生产企业近40家,并且一些国外的PCV2疫苗也已通过了我国进口兽药注册[13]。然而,众多的PCV2疫苗产品没有统一的效力评价和相应种类抗原含量的评价方法,因此尚未形成统一的标准来评价现有的疫苗产品。
疫苗中抗原含量的高低直接影响疫苗的免疫效果。灭活病毒疫苗及VLP疫苗中的抗原通常具有复杂的颗粒结构[14-15]。常用的酶联免疫吸附(enzyme linked immunosorbent assay, ELISA) 等方法往往难以区分具有不同颗粒结构的抗原[16]。随着色谱技术的发展,分离生物制品中直径在10−100 nm的颗粒已经成为可能[17]。通过高效体积排阻色谱(high-performance size-exclusion chromatography, HPSEC) 和多角度激光散射仪(multi-angle laser light scattering, MALLS) 联用可以获取生物样品中的颗粒直径分布、分子质量及分布、颗粒的聚集情况等信息。该方法高效便捷、重复性好,已在口蹄疫疫苗的质控中被广泛应用[18-20],可检测完整病毒粒子,是对现有的动物实验法和ELISA方法有力的技术补充。本文旨在探索应用HPSEC-MALLS方法检测PCV2灭活疫苗及VLP疫苗抗原的新方法,对疫苗中完整抗原颗粒进行分离鉴定,并对线性、重复性进行考察,以期为PCV2疫苗的质量控制和评价提供新的思路。
1 材料与方法 1.1 材料 1.1.1 检测样品猪圆环病毒2型灭活病毒疫苗2批(编号为a、b),杆状病毒重组表达VLP亚单位疫苗2批(编号为c、d),均来自不同生产企业。PCV2 (YZ株) 经PK-15细胞培养并采用BEI灭活后的病毒液由扬州优邦生物药品有限公司提供。病毒液经过8% (W/V) 聚乙二醇6 000沉淀纯化后作为灭活病毒参照品。经纯化的杆状病毒-昆虫细胞表达的PCV2 Cap VLP抗原(浓度为3.65 mg/mL) 参照品由扬州优邦生物药品有限公司提供。
1.1.2 主要仪器LC-2010A HT液相色谱仪(岛津);DAWN HELEOS Ⅱ型激光检测器,Optilab T-rEX型示差检测器(Wyatt);SRT SEC-500色谱柱(7.8 mm×300 mm, 赛分科技);超滤浓缩管(10 K, MWCO, Thermo公司);电泳仪(Bio-Rad);FEI Tecnai 20透射电子显微镜(transmission electron microscope, TEM, Royal Philips Electronics)。
1.1.3 主要试剂PCV2单抗7D7 (本实验室制备及保存[21]);HRP羊抗鼠IgG (Cwbiotech);无水硫酸钠,磷酸氢二钠,磷酸二氢钠,三氯甲烷、氯化钠(国药集团,分析纯)。猪圆环病毒2型抗原胶体金检测卡(北京标驰泽惠生物技术有限公司)。
1.2 方法 1.2.1 疫苗破乳使用三氯甲烷作为破乳剂,按三氯甲烷与疫苗体积比1︰1充分振荡混匀,6 000 r/min、4 ℃离心6 min,取上层水相用于检测。
1.2.2 HPSEC-MALLS检测流动相:50 mmol/L磷酸缓冲液(pH 7.4),含0.1 mmol/L硫酸钠;进样体积:100 μL;流速:0.6 mL/min;检测波长:280 nm。采用上述色谱条件对破乳后的水相抗原进行检测。为了获得样品相对分子量,分析柱连接至多角度激光散射仪(MALLS, DAWN EOS, λ=690 nm, Wyatt Technology Corp., USA) 及示差折光检测器(RID, OPTILAB DSP, Wyatt Technology Corp., USA)。流动相依次经过相连的UV,MALLS和RID。样品相对分子量通过ASTRA®软件(Wyatt Technology, USA) 计算获得。
1.2.3 PCV2抗原鉴定HPSEC检测过程中,收集疑似PCV2抗原颗粒保留时间附近的色谱峰。应用PCV2抗原检测卡检测HPSEC接取的样品。参照操作说明,向检测卡样品孔中缓慢滴加70 μL样品,水平放置20 min后观察结果。使用超滤浓缩管分别对4批疫苗收集到的样品进行高速离心,浓缩10−30倍。浓缩液加入4×非还原型蛋白变性缓冲液,70 ℃水浴10 min,20 μL上样,进行SDS-PAGE电泳分析。电泳结束后,将蛋白半干转移至PVDF膜,用含5% (W/V) 脱脂奶的PBST 4 ℃封闭过夜,PBS缓冲液洗涤3次,进行Western blotting鉴定。一抗采用PCV2单抗7D7 (1︰100倍稀释),二抗采用HRP标记的羊抗鼠IgG (1︰1 000倍稀释)。
1.2.4 电镜检测将HPSEC检测过程中接取的疑似PCV2抗原颗粒的色谱峰通过FEI Tecnai 20 TEM观察颗粒形貌。将少量样品滴至400-网眼铜载网,1%乙酸双氧铀染色干燥后测定。
1.2.5 检测重复性及峰面积与蛋白浓度的线性相关性取疫苗c及PCV2 Cap VLP纯化抗原,连续进样3次,测量检测重复性。用PBS缓冲液对PCV2 Cap VLP纯化抗原进行系列稀释,按上述色谱条件,进样100 μL检测。以仪器积分得到峰面积为纵坐标,以稀释后的蛋白浓度为横坐标,考察HPSEC检测PCV2 VLP峰面积与总蛋白浓度的线性相关性。
2 结果与分析 2.1 HPSEC-MALLS检测结果PCV2病毒颗粒直径为20−25 nm,选取HPSEC色谱柱基质孔径为50 nm左右的分析柱,理论上病毒可进入分析柱的孔道内部进行分离。由于大部分杂质蛋白尺寸较小,在HPSEC中保留时间与尺寸较大的病毒相比更晚,由此可能实现病毒与杂质的分离与分析。首先对经过纯化的PCV2灭活病毒及Cap VLP抗原参照品采用HPSEC检测,色谱图如图 1所示。PCV2灭活病毒和Cap VLP抗原分别在13.3 min和13.2 min左右有主要的吸收峰。病毒与其VLP有相近的尺寸,因此在HPSEC中具有相近的保留时间。此外,注意到Cap VLP抗原在11.3 min出现了一个较小的吸收峰。
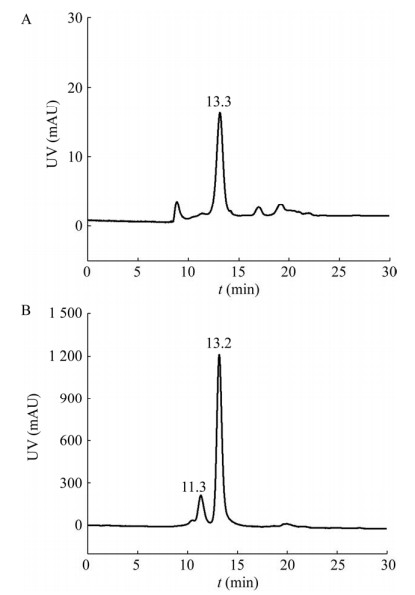
|
| 图 1 HPSEC-MALLS检测(A) PCV2灭活病毒及(B) CAP VLP抗原参照品 Fig. 1 HPSEC-MALLS analysis of (A) the purified inactivated PCV2 and (B) Cap VLP. |
| |
将PCV2两种灭活疫苗a、b及两种VLP疫苗c、d的破乳后水相分别采用HPSEC-MALLS检测,色谱图如图 2所示。图 2A、2B中显示PCV2灭活疫苗a、b具有类似的色谱图,主要色谱峰在17−22 min之间,该保留时间范围内为尺寸较小的蛋白质,因此认为可能是细胞培养液中的杂质。与PCV2灭活病毒参照品相同,在13.3 min左右,两种样品均出现一个较小的色谱峰(图 2中的放大图),尺寸大于大部分杂质,推测有可能是PCV2。为了进一步验证,首先采用MALLS计算其分子量分布,结果如图 2。该色谱峰的平均分子量分别为2.61×106 (±4.34%) Da及2.40×106 (±2.51%) Da,与PCV2的理论分子量相近。
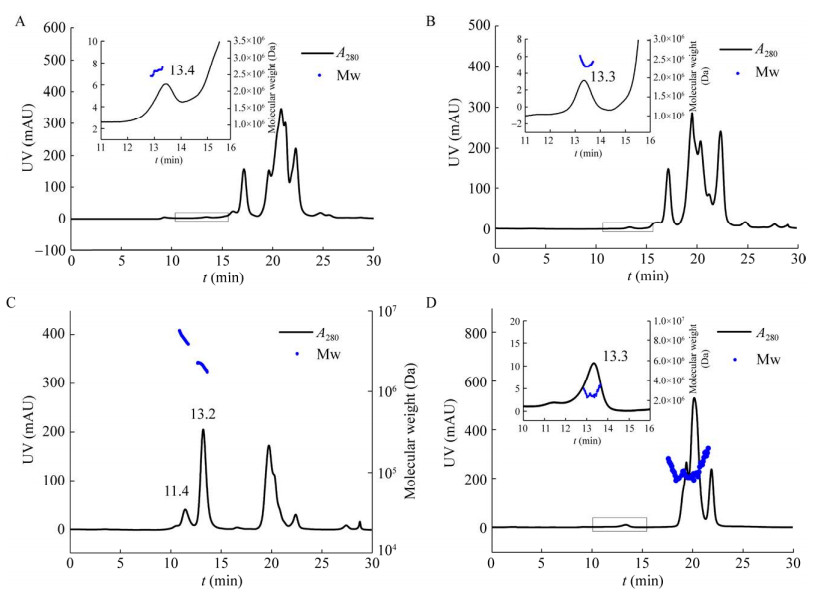
|
| 图 2 HPSEC-MALLS检测PCV2灭活疫苗及VLP疫苗破乳后的水相抗原 Fig. 2 HPSEC-MALLS analysis of the PCV2 antigens in inactivated vaccines and VLP vaccines after demulsification. (A) Vaccine a. (B) Vaccine b. (C) Vaccine c. (D) Vaccine d. |
| |
据报道,通过杆状病毒重组表达PCV2的Cap蛋白能够自组装成完整的VLP。首先采用相同的HPSEC-MALLS步骤对两种VLP疫苗进行分析。从图 2C、2D可见,尽管VLP疫苗的色谱图与灭活病毒疫苗有所不同,尤其是疫苗c,但在13.3 min左右同样出现了一个色谱峰。疫苗c在13.2 min的色谱峰经MALLS计算其分子量为2.09×106 (±2.94%) Da,疫苗d在13.3 min的色谱峰分子量为2.88×106 (±11.85%) Da,与全病毒的结果相近。此外,注意到疫苗c与Cap VLP抗原参照品相同,在11.4 min也出现了一个较小的吸收峰。该色谱峰经MALLS检测分子量为4.37×106 (±0.42%) Da,正好为PCV2 VLP的2倍(图 2C)。
2.2 HPSEC中PCV2抗原吸收峰的鉴定为进一步验证HPSEC中13.3 min左右的色谱峰是否为PCV2抗原,接取该色谱峰,分别采用PCV2抗原检测卡、Western blotting测定。如图 3所示,灭活PCV2和Cap VLP抗原参照品为阳性,疫苗a–d在13.3 min左右的色谱峰在抗原检测卡上也均显示阳性。其中灭活疫苗在检测卡上的显色显著弱于VLP疫苗。这是由于灭活疫苗中的病毒含量普遍较低,而重组亚单位疫苗往往可达到较高的表达量。HPSEC中13.3 min的疑似抗原峰的峰高也验证了这一点。灭活病毒疫苗a、b中的疑似抗原特征峰的峰高均不超过4 mAU,而VLP疫苗c、d中的峰高均超过10 mAU,其中疫苗c的峰高可达200 mAU以上,在图 3中也显示了最高的检测结果。
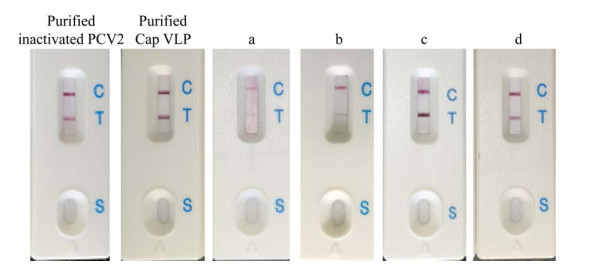
|
| 图 3 PCV2抗原检测卡检测PCV2灭活病毒、Cap VLP抗原参照样品及疫苗a、b、c、d在HPSEC 13.3 min左右色谱峰 Fig. 3 PCV2 antigen test of the purified inactivated PCV2, purified Cap VLP, and peaks of the four PCV2 vaccines at 13.3 min in HPSEC profile. |
| |
Western blotting结果均显示出4种疫苗的Cap蛋白特异性条带,且不同疫苗的条带位置有所差异(图 4)。SDS-PAGE分析显示,全病毒灭活疫苗抗原的目的条带在49 kDa和98 kDa左右。根据Cap蛋白分子量为26−30 kDa,推测这两条带为亚基蛋白的二聚体和四聚体。由于SDS-PAGE采用的是非还原型电泳,未打开二硫键,该结果表明在全病毒的亚基蛋白间存在二硫键[22]。两种重组亚单位疫苗抗原均在28 kDa附近有主要特异性条带,其中疫苗c在49 kDa左右有少量的特异性条带。可见,VLP疫苗的亚基间二硫键相比灭活病毒疫苗抗原少。二硫键通常具有提高颗粒结构稳定性的作用,PCV2抗原中二硫键的差异可能会导致其稳定性存在差异。综上,抗原检测卡与Western blotting的结果均表明,HPSEC中13.3 min的色谱峰为PCV2抗原。

|
| 图 4 Western blotting检测疫苗a、b、c、d在HPSEC 13.3 min左右的色谱峰 Fig. 4 Western blotting of the peaks of the four PCV2 vaccines at 13.3 min in HPSEC profile. |
| |
将4种疫苗在HPSEC中13.3 min左右的色谱峰经10倍或30倍浓缩后进行TEM检测,与PCV2灭活病毒、Cap VLP抗原参照品进行比较。两种灭活病毒疫苗的TEM结果检测到了尺寸为21 nm左右的病毒颗粒(图 5)。两个PCV2亚单位疫苗也均检测到尺寸为21–22 nm的球形颗粒,表明自组装形成了VLP。以上结果与PCV2灭活病毒及Cap VLP抗原参照品TEM检测尺寸一致,均为21−22 nm。以上结果进一步验证了HPSEC中13.3 min左右的色谱峰为PCV2灭活病毒抗原或VLP抗原。
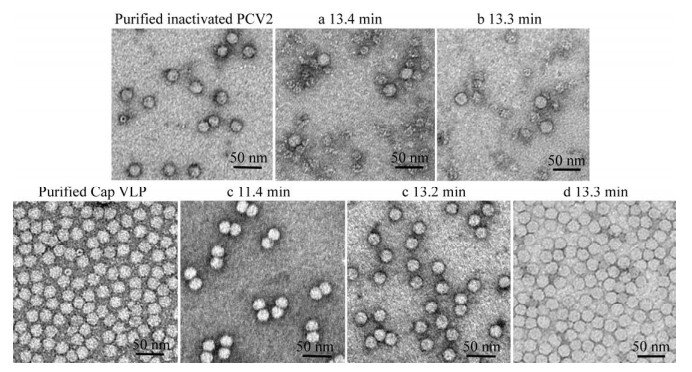
|
| 图 5 TEM检测PCV2灭活病毒、Cap VLP抗原参照品及疫苗a (30×浓缩)、b (30×浓缩)、c (10×浓缩)、d (30×浓缩) 在HPSEC-MALLS检测中的特征峰 Fig. 5 TEM images of the purified inactivated PCV2, purified Cap VLP, and samples corresponding to the elution peaks of HPSEC of four vaccines. |
| |
收集疫苗c在HPSEC-MALLS中出现在11.4 min且检测分子量为4.37×106 (±0.42%) Da的色谱峰,进行TEM检测,发现为2个VLP形成的聚集体,与MALLS的检测结果一致。其他文献也报道了PCV2 Cap VLP中检测到了聚集体的存在[23]。由疫苗c中13.2 min色谱峰的紫外吸收高于其他疫苗10倍以上,可以看出该疫苗抗原浓度远高于其他抗原。推测11.4 min出现的VLP二聚体可能是由于抗原浓度过高形成的。
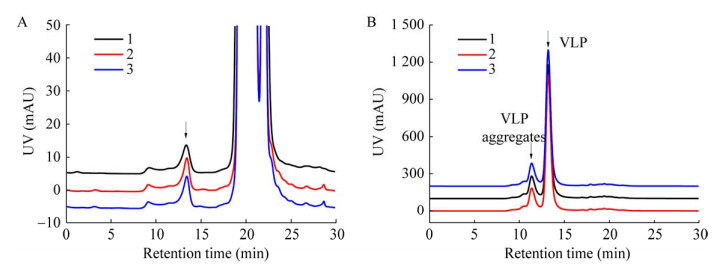
2.4 HPSEC检测的重复性取重组亚单位疫苗d的破乳液水相及Cap VLP抗原参照品连续进样3次(图 6),可以看出疫苗d的VLP色谱峰峰面积重复性良好(RSD=1.3%, n=3) (表 1)。研究中发现高浓度的PCV2 VLP易发生聚集,分别对其13.3 min VLP的吸收峰面积及11.4 min多聚体的吸收峰面积进行积分,验证HPSEC检测VLP及其聚集体含量是否具有重复性。如表 1所示,VLP及其聚集体的峰面积均具有良好的重复性,RSD分别为0.7%和0.6% (n=3)。
|
| 图 6 HPSEC检测(A) 疫苗d及(B) Cap VLP抗原参照品三次重复性检测的色谱图 Fig. 6 HPSEC chromatograms of (A) PCV2 VLP vaccine d and (B) purified Cap VLP in triplicates. |
| |
| Samples | No. of injection | Retention time (min) | Peak area (mAU·min) | Average peak area (mAU·min) | RSD (n=3) (%) |
| Vaccine d | 1 | 13.42 | 598 804 | ||
| 2 | 13.43 | 582 955 | 591 551 | 1.3 | |
| 3 | 13.42 | 592 893 | |||
| Cap VLP | 1 | 13.19 | 40 722 934 | 41 080 314 | 0.7 |
| 2 | 13.19 | 41 173 885 | |||
| 3 | 13.20 | 41 344 123 | |||
| Cap VLP aggregates | 1 | 11.35 | 5 882 778 | 5 926 121 | 0.6 |
| 2 | 11.36 | 5 940 089 | |||
| 3 | 11.35 | 5 955 497 |
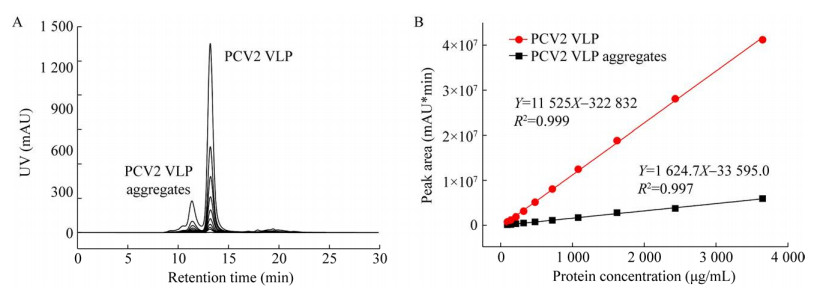
为考察HPSEC检测的峰面积与抗原蛋白浓度的线性相关性,将PCV2 VLP抗原参照品进行梯度稀释,分别对其13.2 min的VLP的吸收峰面积及11.4 min多聚体的吸收峰面积进行积分,并建立峰面积与抗原总浓度的线性相关性。色谱图如图 7所示。线性回归处理结果表明,在研究范围内VLP及其多聚体的吸收峰面积与浓度均呈良好的线性相关性,R2分别为0.999及0.997,满足定量分析的R2要求。此外,VLP在不同浓度样品中的色谱峰占比为87.11%±0.98% (n=10,RSD=1.1%),具有很好的重复性,表明HPSEC具有用于监测亚单位疫苗中聚集体含量的前景。
|
| 图 7 Cap VLP纯化抗原中VLP及多聚体的HPSEC检测的峰面积与蛋白浓度的线性相关性 A:Cap VLP抗原参照品梯度稀释色谱图;B:VLP及VLP聚集体的HPSEC检测峰面积与抗原蛋白浓度的线性回归曲线 Fig. 7 The linear correlation between the HPSEC peak area of VLP and aggregates of purified Cap VLP and the protein concentration. (A) HPSEC chromatograms of Cap VLP diluted to different concentration. (B) Linear response curves between the peak areas of VLP at 13.3 min and VLP aggregates at 11.4 min against protein concentration of the sample. |
| |
随着生猪养殖产业的规模化发展和疫病防控的复杂多变,疫苗作为防控疫病的有效手段,质量不容小觑。PCV2作为流行范围较广、合并感染较严重的病原,使用疫苗的质量尤为关键。然而,针对目前的PCV2疫苗产品众多,且无统一的质量标准,急需对该类疫苗进行全面的评价,以便更加科学地选用疫苗,防控疫病。病毒类疫苗产品的质量控制和评价方法多是基于动物或细胞的传统技术,抗体技术的发展使得病毒测定的特异性和灵敏度显著提升,然而它们都存在各自的弊端。
近年来,基于分离和病毒颗粒定量的新技术在疫苗的研发和质量控制中发挥了越来越显著的作用。本研究选用适合分离PCV2病毒及病毒样颗粒的体积排阻色谱偶联多角度激光散射仪对样品中分离物质的分子量进行鉴定,并通过PCV2抗原检测卡、Western blotting和TEM技术,对目标色谱峰进行鉴定,成功分析了PCV2灭活疫苗及病毒样颗粒疫苗中的完整抗原粒子。结果显示,保留时间13.3 min左右的色谱峰为疫苗中的完整抗原粒子——灭活PCV2病毒颗粒或PCV2病毒样颗粒。通过HPSEC-MALLS检测到PCV2 VLP抗原中可能存在聚集体,而聚集往往会带来抗原活性的改变从而影响疫苗质量。通过HPSEC可实现快速定量分析PCV2病毒样颗粒疫苗中的组装体及其聚集体组成,进而指导疫苗质量的提升,这些是ELISA及动物实验难以实现的。通过试验证明该方法具有很好的重复性和检测线性。以上显示了HPSEC-MALLS方法在PCV2疫苗抗原定量分析和质量评价中的优势。该方法有望成为一种准确、高效的PCV2疫苗的体外评价方法,作为现有方法的一种补充方法,在疫苗的质量监管及提升中发挥作用。
| [1] |
Rosell C, Segalés J, Plana-Durán J, et al. Pathological, immunohistochemical, and in situ hybridization studies of natural cases of postweaning multisystemic wasting syndrome (PMWS) in pigs. J Comp Pathol, 1999, 120(1): 59-78. DOI:10.1053/jcpa.1998.0258
|
| [2] |
Madec F, Rose N, Grasland B, et al. Post-weaning multisystemic wasting syndrome and other PCV2-related problems in pigs: a 12-year experience. Transbound Emerg Dis, 2008, 55(7): 273-283. DOI:10.1111/j.1865-1682.2008.01035.x
|
| [3] |
Tischer I, Mields W, Wolff D, et al. Studies on epidemiology and pathogenicity of porcine circovirus. Arch Virol, 1986, 91(3/4): 271-276.
|
| [4] |
Allan GM, McNeilly F, Cassidy JP, et al. Pathogenesis of porcine circovirus, experimental infections of colostrum deprived piglets and examination of pig foetal material. Vet Microbiol, 1995, 44(1): 49-64. DOI:10.1016/0378-1135(94)00136-K
|
| [5] |
Ellis J, Hassard L, Clark E, et al. Isolation of circovirus from lesions of pigs with postweaning multisystemic wasting syndrome. Can Vet J=La Revue Veterinaire Can, 1998, 39(1): 44-51.
|
| [6] |
Palinski R, Piñeyro P, Shang PC, et al. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure. J Virol, 2016, 91(1): e01879-e01816.
|
| [7] |
Phan TG, Giannitti F, Rossow S, et al. Detection of a novel circovirus PCV3 in pigs with cardiac and multi-systemic inflammation. Virol J, 2016, 13(1): 184. DOI:10.1186/s12985-016-0642-z
|
| [8] |
Zhang HH, Hu WQ, Li JY, et al. Novel circovirus species identified in farmed pigs designated as porcine circovirus 4, Hunan province, China. Transbound Emerg Dis, 2020, 67(3): 1057-1061. DOI:10.1111/tbed.13446
|
| [9] |
Crowther RA, Berriman JA, Curran WL, et al. Comparison of the structures of three circoviruses: chicken anemia virus, porcine circovirus type 2, and beak and feather disease virus. J Virol, 2003, 77(24): 13036-13041. DOI:10.1128/JVI.77.24.13036-13041.2003
|
| [10] |
Meehan BM, McNeilly F, Todd D, et al. Characterization of novel circovirus DNAs associated with wasting syndromes in pigs. J Gen Virol, 1998, 79(Pt 9): 2171-2179.
|
| [11] |
Zimmerman JJ, Karriker LA, Ramirez A, et al. Diseases of Swine. New York: John Wiley & Sons, 2019.
|
| [12] |
Masuda A, Lee JM, Miyata T, et al. Purification and characterization of immunogenic recombinant virus-like particles of porcine circovirus type 2 expressed in silkworm pupae. J Gen Virol, 2018, 99(7): 917-926. DOI:10.1099/jgv.0.001087
|
| [13] |
国家兽药基础数据库[EB/OL]. [2021-02-18] http://www.ivdc.org.cn. National Veterinary Drug Basic Information Database. http://www.ivdc.org.cn (in Chinese). |
| [14] |
Yang YL, Li H, Li ZJ, et al. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens. Vaccine, 2015, 33(9): 1143-1150. DOI:10.1016/j.vaccine.2015.01.031
|
| [15] |
Liu FX, Ge SQ, Li L, et al. Virus-like particles: potential veterinary vaccine immunogens. Res Vet Sci, 2012, 93(2): 553-559. DOI:10.1016/j.rvsc.2011.10.018
|
| [16] |
Harmsen MM, Fijten HPD, Westra DF, et al. Effect of thiomersal on dissociation of intact (146S) foot-and-mouth disease virions into 12S particles as assessed by novel ELISAs specific for either 146S or 12S particles. Vaccine, 2011, 29(15): 2682-2690. DOI:10.1016/j.vaccine.2011.01.069
|
| [17] |
Yang YL, Su ZG, Ma GH, et al. Characterization and stabilization in process development and product formulation for super large proteinaceous particles. Eng Life Sci, 2020, 20(11): 451-465. DOI:10.1002/elsc.202000033
|
| [18] |
徐嫄, 邹兴启, 李翠, 等. 应用体积排阻色谱法测定口蹄疫灭活疫苗中的146S抗原含量. 生物工程学报, 2018, 34(5): 676-684. Xu Y, Zou XQ, Li C, et al. Using size-exclusion chromatography to quantify the 146S antigen in inactivated foot-and-mouth disease vaccine. Chin J Biotech, 2018, 34(5): 676-684 (in Chinese). |
| [19] |
宋艳民, 杨延丽, 苏志国, 等. 高效体积排阻色谱法定量检测口蹄疫疫苗中146S的疫苗预处理方法. 生物工程学报, 2019, 35(8): 1441-1452. Song YM, Yang YL, Su ZG, et al. Vaccine pretreatment for quantification of 146S antigen in foot-and-mouth disease vaccines by high performance size exclusion chromatography. Chin J Biotech, 2019, 35(8): 1441-1452 (in Chinese). |
| [20] |
徐嫄, 邹兴启, 刘晓东, 等. 应用高效体积排阻色谱法测定市场抽检口蹄疫灭活疫苗中的抗原(146S)含量. 中国兽药杂志, 2018, 52(1): 7-12. Xu Y, Zou XQ, Liu XD, et al. Using high performance size exclusion chromatography to determine antigen (146S) content in foot-and-mouth disease inactivated vaccine of quality supervision. Chin J Vet Drug, 2018, 52(1): 7-12 (in Chinese). |
| [21] |
何天慈. 单克隆抗体夹心ELISA检测猪圆环病毒2型抗原含量的研究[D]. 北京: 中国兽医药品监察所, 2019. He TC. Development of a monoclonal antibody sandwich ELISA for antigen detection of porcine circovirus type 2[D]. Beijing: China Institute of Veterinary Drug Control, 2019 (in Chinese). |
| [22] |
Wu PC, Lin WL, Wu CM, et al. Characterization of porcine circovirus type 2 (PCV2) capsid particle assembly and its application to virus-like particle vaccine development. Appl Microbiol Biotechnol, 2012, 95(6): 1501-1507. DOI:10.1007/s00253-012-4015-2
|
| [23] |
Duan JK, Yang DQ, Chen L, et al. Efficient production of porcine circovirus virus-like particles using the nonconventional yeast Kluyveromyces marxianus. Appl Microbiol Biotechnol, 2019, 103(2): 833-842. DOI:10.1007/s00253-018-9487-2
|
 2022, Vol. 38
2022, Vol. 38




