中国科学院微生物研究所、中国微生物学会主办
文章信息
- 彭新亮, 简纪常, 丁燏
- PENG Xinliang, JIAN Jichang, DING Yu
- 溶藻弧菌VcrV基因缺失株的构建及生物学特性
- Construction of VcrV-deleted mutant of Vibrio alginolyticus and its biological characteristics
- 生物工程学报, 2022, 38(8): 3062-3075
- Chinese Journal of Biotechnology, 2022, 38(8): 3062-3075
- 10.13345/j.cjb.220240
-
文章历史
- Received: March 29, 2022
- Accepted: June 15, 2022
- Published: June 22, 2022
2. 信阳农林学院 水产学院, 河南 信阳 464000;
3. 广东省水产经济动物病原生物学及流行病学重点实验室, 广东 湛江 524088
2. Fisheries College of Xinyang Agriculture and Forestry University, Xinyang 464000, Henan, China;
3. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088, Guangdong, China
溶藻弧菌(Vibrio alginolyticus) 隶属于弧菌科弧菌属,是一种兼性厌氧的革兰氏阴性嗜盐嗜温短杆菌,广泛分布于海洋、河口、海水养殖池等水体环境中,对鱼、虾、蟹、贝等水产动物都有广泛的致病性[1],是导致海水养殖经济动物细菌性疾病的主要病原菌之一。近年来,随着海水养殖业的快速发展,溶藻弧菌引起的传染病暴发呈上升趋势[2],给水产养殖业造成巨大的经济损失。该菌还是一种水生动物和人共感染菌,可导致人类腹泻、中耳炎及败血症等多种疾病[3]。由于宿主广且可对人类健康和水产养殖业造成较大危害,因此溶藻弧菌感染引起了国内外学者的广泛关注,对该菌的病理特征、分离鉴定、耐药性、抗逆性及疫苗研发等方面进行了相关研究[4-8],研究结果对溶藻弧菌引起的病害防治起到了积极的作用。目前,抗生素仍是防治溶藻弧菌感染的主要药物,而长期使用抗生素,易造成细菌耐药性提高、食品安全以及环境污染等问题。因此,亟需对溶藻弧菌的毒力因子和致病机理进行深入研究,以开发更为绿色安全新型防治方法。
对溶藻弧菌的研究表明,Ⅲ型分泌系统(type Ⅲ secretion system, T3SS) 是其重要的致病系统[9]。T3SS为革兰氏阴性致病菌保守存在的注射装置,其依靠接触宿主细胞激活分泌通路,把毒力蛋白分泌至细胞外或宿主细胞表面,或者直接注射进宿主细胞内,影响宿主新陈代谢及功能,引起宿主免疫功能紊乱或细胞骨架重组,最终导致宿主细胞死亡[10]。对铜绿假单胞菌的研究发现,T3SS致病中其针尖的3个转位子蛋白(PopB、PopD、PcrV) 发挥着重要作用,疏水性成孔蛋白PopB和PopD负责在宿主细胞膜上打孔,亲水性蛋白PcrV负责针尖孔道的开关,控制毒力蛋白的转运[11]。3个转位子蛋白相互协助不仅在宿主细胞膜上成孔并控制毒素的转运,疏水性成孔蛋白PopB和PopD还可以独立插入细胞膜成孔,破坏膜内外离子平衡,改变宿主细胞组蛋白的磷酸化、乙酰化和甲基化等表观遗传[12]。VcrV是位于溶藻弧菌T3SS针尖部位的3个转位子蛋白(VcrV、VopB、VopD) 之一,控制毒素通过成孔蛋白VopB和VopD形成的孔道向宿主细胞内转运。铜绿假单胞菌的同源基因PcrV研究表明,该蛋白基因的缺失将导致毒力蛋白分子的释放被破坏,细菌的致病性显著降低[13],PcrV已成为抗铜绿假单胞菌感染的药物研发靶点[14]。耶尔森氏菌的同源基因LcrV也被证明是重要的保护性抗原[15]。但溶藻弧菌的转位子基因VcrV在致病中的作用尚不清晰,为探讨该基因的功能,本研究构建了溶藻弧菌VcrV基因的缺失株,并对其生物学特性进行研究,以期为溶藻弧菌的致病机制研究提供参考。
1 材料与方法 1.1 材料溶藻弧菌野生强毒株HY9901、大肠杆菌DH5α、大肠杆菌β2163和pLP12均由广东省水产经济动物病原生物学及流行病学重点实验室保存;Primer STAR Max DNA Polymerase购自宝生物工程(大连) 有限公司(TaKaRa);细菌DNA提取试剂盒、PCR产物纯化试剂盒、质粒提取试剂盒和琼脂凝胶回收试剂盒均购自北京全式金生物技术有限公司;ClonExpressTM快速克隆试剂盒购自南京诺唯赞生物科技有限公司;抗菌药物药敏纸片购自杭州微生物试剂有限公司。活性氧(reactive oxygen species, ROS)、脯氨酸(Pro)、肽聚糖(peptidoglycan, PG)、β-内酰胺酶(β-lactamase)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)、过氧化氢酶(catalase, CAT) 检测试剂盒购自江苏酶免实业有限公司。氯化钠、酵母提取物、胰蛋白胨、大豆蛋白胨、琼脂、二氨基庚二酸、ʟ-阿拉伯糖等培养基成分及其他试剂购于生工生物工程(上海) 股份有限公司。
1.2 方法 1.2.1 引物设计与合成根据GenBank中公布的溶藻弧菌HY9901菌株的VcrV基因序列(登录号:MG907044.1),利用Primer Premier 5.0软件分别设计VcrV基因上、下游同源臂及检测引物(表 1)。引物由生工生物工程(上海) 股份有限公司合成。
| Primers | Primer sequences (5′→3′) | Usages |
| VcrV-UF | GGAATCTAGACCTTGAGTCGACATGAGCAGCCAGCGATTG | Amplify the upstream homology arm of VcrV |
| VcrV-UR | TTCATCGCTTCAACGGTCGATCCTGTCGTAGAGCCAGTCGTTT | Amplify the upstream homology arm of VcrV |
| VcrV-DF | AAACGACTGGCTCTACGACAGGATCGACCGTTGAAGCGATGAA | Amplify the down stream homology arm of VcrV |
| VcrV-DR | ACAGCTAGCGACGATATGTCGCTTCTAACATGATGCCTGCAC | Amplify the down stream homology arm of VcrV |
| VcrV-AF | CCGGAATTCATGACGAATATGAAAACGACTGGC | Detect the wild type strain |
| VcrV-AR | CCGCTCGAGAATGGCTCGTAGGATTTCTTGT | Detect the wild type strain |
| VcrV-TF | ATGCCATTCAACTTTATCCCTCC | Detect the mutant strain |
| VcrV-TR | ATAAACCTGTGTCTGGATGCGG | Detect the mutant strain |
| pLP-UF | GACACAGTTGTAACTGGTCCA | Detect the recombinant vector |
| pLP-UR | CAGGAACACTTAACGGCTGAC | Detect the recombinant vector |
以溶藻弧菌野生株HY9901基因组DNA为模板,用引物VcrV-UF/VcrV-UR和VcrV-DF/ VcrV-DR扩增VcrV基因上、下游同源臂片段。以VcrV基因上、下游同源臂片段为模板,用引物VcrV-UF/VcrV-DR进行重叠(Overlap) PCR扩增VcrV基因上、下游同源臂的融合片段。用重组酶Exnase Ⅱ将融合片段与自杀载体pLP12连接,然后转入大肠杆菌DH5α感受态细胞,转化的细胞涂布于氯霉素LB平板进行培养。以pLP-UF/pLP-UR为引物筛选转入自杀载体pLP12的阳性克隆株,阳性克隆纯化后扩大培养并提取质粒pLP12-VcrV。将pLP12-VcrV转入大肠杆菌β2163感受态细胞,转化产物涂布于含有氯霉素的0.3% DAP-LB平板(二氨基庚二酸,DAP),挑取阳性克隆并纯化培养,命名为pLP12-VcrV-β2163。将pLP12-VcrV-β2163与野生株HY9901分别过夜培养,各取200 μL混合,离心弃上清,用LB洗涤1次后加入10 μL LB重悬,涂布于DAP-LB平板。用1 mL LB洗板,取洗板菌液涂布于氯霉素LB平板,挑取平板上单克隆菌体,用引物VcrV-UF/VcrV-DR进行菌落PCR检测,阳性菌株即为插入突变株。取若干插入突变克隆,划线于LB平板(0.4% ʟ-阿拉伯糖),28 ℃过夜培养,挑取平板上的克隆,以引物VcrV-TF/VcrV-TR进行检测,野生株为对照。克隆纯化后,再次扩增验证,并将PCR产物测序验证VcrV缺失突变株是否构建成功。步骤如图 1所示。
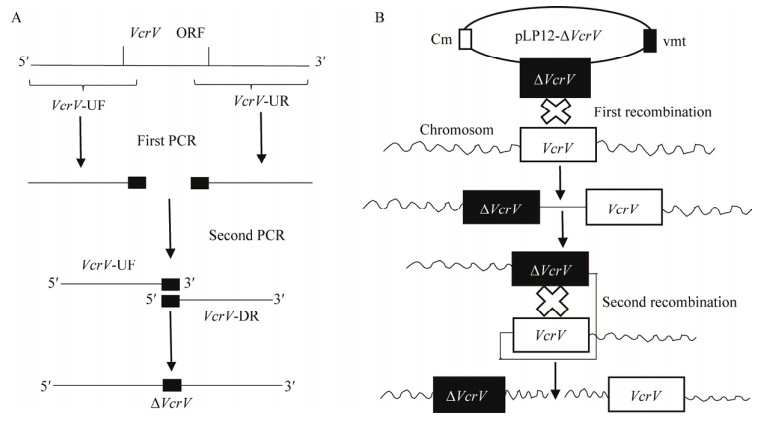
|
| 图 1 ΔVcrV突变株构建示意图 Fig. 1 Schematic diagram for construction of the ΔVcrV mutant. (A) Fragments missing VcrV were obtained by overlap PCR. (B) A two-step method was used to screen ΔVcrV mutant by pLP12-mediated suicide plasmid and homologous recombination. |
| |
将缺失株ΔVcrV接种于TSB培养基中,连续传代培养30代,用VcrV-AF/VcrV-AR和VcrV-UF/VcrV-DR引物对野生株和缺失株进行PCR鉴定,确定ΔVcrV的遗传稳定性。
1.2.4 生长曲线测定分别挑取野生株HY9901、缺失株ΔVcrV单菌落接种于TSB培养基中,28 ℃摇床培养至对数生长期时,按1:100的比例接种至新鲜TSB培养基中继续培养24 h,每1 h取样一次,测定其OD600值,每个样品重复3次并绘制生长曲线。
1.2.5 生物膜检测分别取培养过夜的野生株HY9901和缺失株ΔVcrV,稀释50倍后接种于96孔板中,每孔加200 μL,TSB培养基为阴性对照,封口膜密封后于28 ℃下分别静置培养2、4、6、12、24、36 h。培养结束后将菌液吸弃,用无菌磷酸缓冲盐(phosphate-buffered saline, PBS) 250 μL洗涤3次,倒置晾干。加200 μL甲醇固定20 min,吸弃甲醇,倒置室温晾干。加200 μL结晶紫草酸铵溶液染色15 min,吸弃结晶紫染液,并用自来水轻轻冲洗后倒置晾干。每孔加入220 μL 95%酒精溶解,室温反应30 min,酶标仪测定OD570吸光度,实验重复3次。
1.2.6 细菌游动性(swimming) 和涌动性(swarming) 检测将野生株HY9901和缺失株ΔVcrV分别接种到TSB培养基中活化,28 ℃摇床培养至对数生长期时在TSA培养基上划线培养12–18 h,分别挑取单菌落用PBS将溶藻弧菌悬液调整至1.5×108 CFU/mL,OD625为0.08。
游动性检测:用接种环前端金属丝的直线端,烧红消毒,蘸取菌悬液刺入(约0.5 mm) 半固体TSA培养基(0.3%琼脂) 中,然后将平板正置(平板强度低,不能倒置) 放在28 ℃生化培养箱中培养12 h后,观察并记录各菌体游动圈大小。实验重复3次。
涌动性检测:用移液枪分别吸取菌悬液点到半固体TSA培养基(0.6%琼脂) 中,将平板正置(平板强度低,不能倒置) 放在28 ℃生化培养箱中培养10 h,观察并记录各菌体涌动圈大小。实验重复3次。
1.2.7 细胞粘附试验大黄鱼内皮前体细胞(endothelial precursor cell, EPC) 细胞接种于24孔细胞培养板中贴底生长满并计数,同时将生长对数期的野生株HY9901和缺失株ΔVcrV 7 000 r/min离心5 min,PBS洗涤3次,调整菌悬液浓度为1×108 CFU/mL。每个细胞感染剂量(multiplicity of infection) MOI为100,每个样品设3个平行。细胞放入5%的CO2培养箱中,28 ℃孵育2 h,吸去培养液,用0.22 μm滤膜过滤除菌的PBS清洗细胞3次除去未粘附的细菌。每孔中加入200 μL 1%的Triton X-100裂解细胞10 min,适度稀释裂解液后取50 μL涂布于TSA平板上,28 ℃倒置培养并进行细菌计数。
1.2.8 耐受性测定为检测缺失株ΔVcrV对H2O2的敏感性,在TSB培养基中分别培养野生株HY9901、缺失株ΔVcrV,在细菌生长到OD600值为0.2时,分别加入H2O2,使H2O2浓度分别达到0.4 mmol/ L和1 mmol/ L,然后继续在28 ℃培养24 h,每1 h测定OD600的值,实验重复3次。
将野生株HY9901和缺失株ΔVcrV分别接种到TSB培养基中,28 ℃摇床培养至对数生长期,调整OD600为0.1,取2 μL菌液分别点在含有40、60 g/L NaCl和100、300 μmol/L CuSO4的TSA平板上,28 ℃生化培养箱培养,记录菌落生长状况,测量直径并拍照,实验重复3次。
1.2.9 细菌自凝集能力检测将野生株HY9901和缺失株ΔVcrV分别接种于TSB中培养到对数生长期,取部分菌液4 000 r/min离心10 min,弃掉上清液,收集细菌,用PBS重悬浮清洗,4 000 r/min离心10 min,弃上清液,将收集到的细菌用PBS悬浮,调节OD600为1.0。以PBS为空白对照,吸取2 mL菌液于灭菌的离心管中,室温静置,分别在静置2、4、6、8、10、12、14、16、18、24 h后吸取上清溶液0.5 mL,混匀后在OD600下测吸光度值,每个时间点做3个平行。
1.2.10 药敏试验采用K-B纸片扩散法进行药敏实验。将野生株HY9901和缺失株ΔVcrV菌液浓度分别调整至1.5×108 CFU/mL,取100 μL涂布于MH固体培养基上,待培养基上水分干后用无菌镊子贴上药敏纸片,每个平板均匀贴3张药敏纸片,28 ℃倒置培养24 h后测定抑菌圈直径。
1.2.11 半致死剂量(LD50) 测定在TSB培养基中分别培养野生株HY9901和缺失株ΔVcrV,28 ℃摇床培养至对数生长期,OD600为0.4−0.6,2 500×g离心15 min弃上清,PBS清洗并重悬浮,用无菌PBS调整OD600为1。调整野生株HY9901和缺失株ΔVcrV的浓度梯度分别为104、105、106、107和108 CFU/mL。然后分别对暂养1周的斑马鱼(Barchydanio rerio var) 进行背部肌肉注射,每尾斑马鱼注射菌液10 µL,每组注射斑马鱼20尾,对照组注射10 µL PBS。每组3个重复。注射后的斑马鱼在25 ℃水温下养殖14 d,定期投喂、换水和清污,每天记录死亡鱼数,直至死亡稳定。养殖结束后用改良寇氏法计算各株的半致死剂量(LD50)。
1.2.12 生化特性及酶活检测将野生株HY9901和缺失株ΔVcrV分别接种于TSB中培养到对数生长期,取部分菌液4 000 r/min离心10 min,弃清液,PBS洗涤菌体3次,收集细菌。活性氧(ROS) 检测按照检测试剂盒(HR9066) 说明书进行。
将收集的菌体按500万细菌加入1 mL蒸馏水的比例稀释,超声波破碎细菌(冰浴,功率200 W,超声3 s,间隔10 s,重复30次),8 000×g、25 ℃离心10 min,取上清液检测备用。其中脯氨酸检测时,超声破碎菌液需置沸水浴中煮沸10 min (加盖,防止水分散失),冷却后再离心制备上清液。脯氨酸(Pro)、肽聚糖(PG)、β-内酰胺酶(β-lactamase)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、过氧化氢酶(CAT) 检测分别按照其检测试剂盒说明书进行。
1.2.13 数据统计与分析数据采用SPSS 18.0软件进行单因素方差分析,结果用平均数±标准差(x±s) 表示,**: P < 0.01为差异极显著。
2 结果与分析 2.1 缺失株ΔVcrV的构建以VcrV-TF/VcrV-TR为引物,以野生株为对照,对构建缺失株进行检测,扩增结果如图 2所示,缺失突变株获得1 204 bp片段,野生株扩增片段长2 917 bp,pLP12-VcrV-β2163株没有扩增片段。对缺失株克隆纯化后再次扩增,并对PCR产物进行测序,测序结果证实缺失株ΔVcrV构建成功。
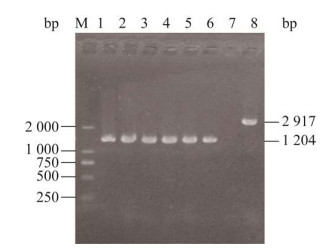
|
| 图 2 缺失株ΔVcrV的构建 Fig. 2 Construction of ΔVcrV mutant. Band 1 to 6 were PCR products of ΔVcrV mutant, and M stands for DNA marker. Band 7 to 8 were PCR products of pLP12-VcrV-β2163 and HY9901, respectively. |
| |
用VcrV-AF/VcrV-AR和VcrV-UF/VcrV-DR引物分别对连续传代30代野生株和缺失株进行PCR鉴定,野生株可检测到1 824 bp的片段,缺失株ΔVcrV得到1 204 bp的片段(图 3),说明缺失株ΔVcrV能够稳定遗传。
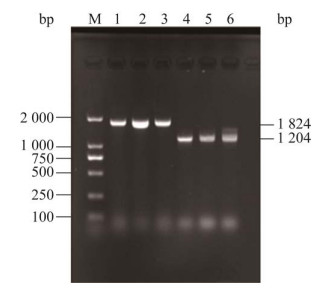
|
| 图 3 缺失株ΔVcrV的遗传稳定性分析 Fig. 3 Genetic stability analysis of ΔVcrV mutant. Band 1 to 3 were PCR products of HY9901, and M stands for DNA marker. Band 4 to 6 were PCR products of the mutant strain ΔVcrV. |
| |
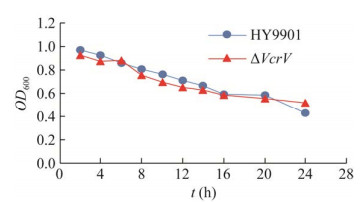
缺失株ΔVcrV与野生株HY9901生长曲线如图 4所示,接种2 h后两菌株均进入对数生长期,11 h后进入平台期,但缺失株的生长速度略微慢于野生株,12 h后二者生长速度达到一致,说明VcrV基因缺失基本不影响菌株生长。
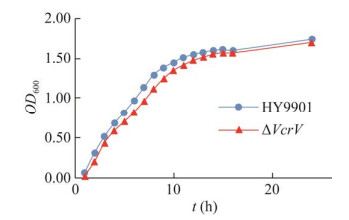
|
| 图 4 野生株HY9901与缺失株ΔVcrV的生长曲线 Fig. 4 Growth curves of wild type strain HY9901 and mutant strain ΔVcrV. |
| |
由图 5可知,在4–12 h内,野生株HY9901和缺失株ΔVcrV的生物膜形成能力均是先升高后降低,在6 h时都达到最大值,但缺失株生物膜的形成能力明显低于野生株;在12–36 h内,二者生物膜形成能力均下降到基本一致水平。表明VcrV基因的缺失对溶藻弧菌前期生物膜的形成影响较大。
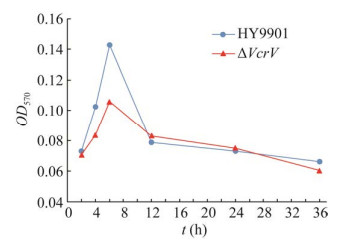
|
| 图 5 野生株HY9901与缺失株ΔVcrV的生物膜 Fig. 5 Biofilm of wild type strain HY9901 and mutant strain ΔVcrV. |
| |
比较野生株HY9901和缺失株ΔVcrV的游动性和涌动性发现,VcrV基因敲除后,缺失株的游动能力和涌动能力均增强,与野生株相比,均有极显著性差异(P < 0.01) (图 6)。
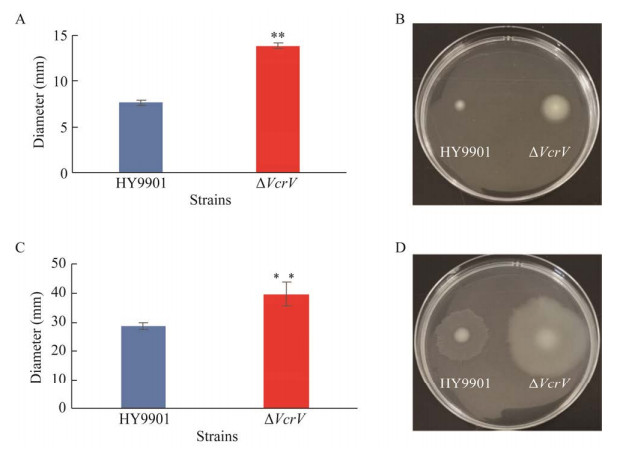
|
| 图 6 野生株HY9901和缺失株ΔVcrV的游动和涌动能力 Fig. 6 Swimming and swarming motility of wild type strain HY9901 and mutant strain ΔVcrV. (A/B) Swimming motility. (C/D) Swarming motility. **: P < 0.01. |
| |
对大黄鱼EPC细胞的粘附结果表明,缺失VcrV基因显著降低了溶藻弧菌对大黄鱼EPC细胞的粘附能力,与野生株相比,降低幅度达到极显著性差异(P < 0.01) (图 7)。
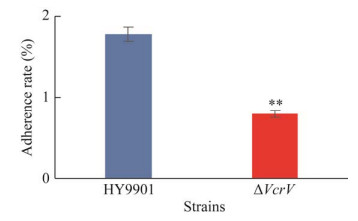
|
| 图 7 野生株HY9901和缺失株ΔVcrV与细胞粘附作用 Fig. 7 Adhesion to cells of wild type strain HY9901 and mutant strain ΔVcrV. **: P < 0.01. |
| |
通过比较野生株HY9901和缺失株ΔVcrV对不同浓度的H2O2、NaCl和CuSO4耐受性发现,在含0.4 mmol/L H2O2的TSB培养基中,野生株和缺失株的生长速度没有明显差异(图 8A),当H2O2增加到1 mmol/L时,在指数生长期缺失株的生长速度降低,进入平台期较滞后(图 8B);在含40 g/L NaCl的TSA上,野生株和缺失株的生长速度没有明显差异,当NaCl增加到60 g/L时,缺失株ΔVcrV的生长速度降低,与野生株相比,具有极显著性差异(P < 0.01) (图 8C、8D);在含100 μmol/L和300 μmol/L CuSO4的TSA平板上,野生株和缺失株ΔVcrV的生长速度均没有明显差异,而当CuSO4增加到400 μmol/L时,两菌株均不能生长(图 8E)。表明缺失的VcrV基因参与了溶藻弧菌的抗氧化作用,并降低了对NaCl的耐受性,但对CuSO4的耐受性不受影响。
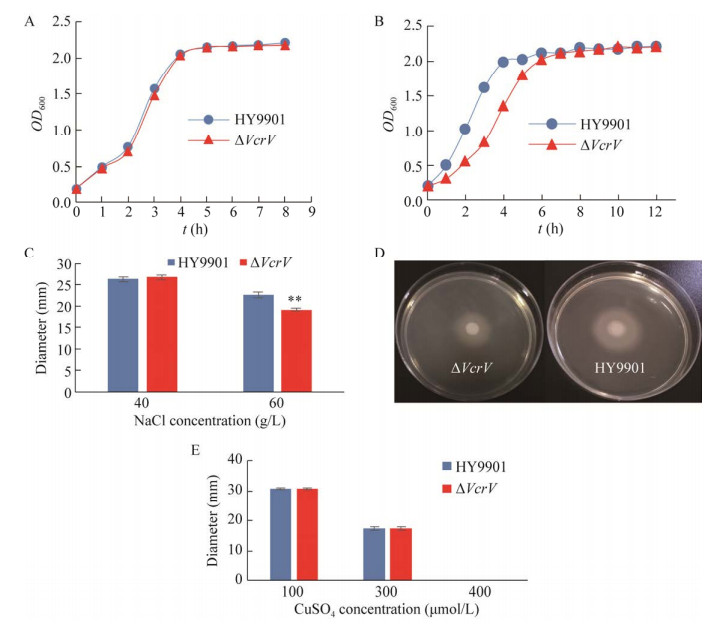
|
| 图 8 野生株HY9901和缺失株ΔVcrV的耐受性 Fig. 8 Tolerance of wild type strain HY9901 and mutant strain ΔVcrV. (A/B) Tolerances to 0.4 mmol/L and 1 mmol/L H2O2. (C/D) Tolerances to NaCl. (E) Tolerances to CuSO4. **: P < 0.01. |
| |
缺失株ΔVcrV与野生株HY9901自凝集能力如图 9所示,二者没有明显差别,表明VcrV基因缺失基本不影响菌株的自凝集能力。
|
| 图 9 野生株HY9901和缺失株ΔVcrV自凝集能力 Fig. 9 The autoagglutination of wild type strain HY9901 and mutant strain ΔVcrV. |
| |
由表 2可知,野生株HY9901和缺失株ΔVcrV对青霉素类抗生素均产生较强的耐药性。缺失株对头孢菌素类抗生素头孢氨苄、头孢他啶、头孢呋辛和头孢曲松的敏感性增强;对喹诺酮类抗生素诺氟沙星、氧氟沙星和环丙沙星虽然敏感度(S) 不变,但抑菌圈直径则明显减小;对氨基糖苷类的丁胺卡那和多肽类的多粘菌素B抗生素敏感性均减弱,而大环内酯类的麦迪霉素和林克胺类的克林霉素抗生素敏感性增强;对磺胺类药物复方新诺明的敏感度(S) 不变,但抑菌圈直径减小。
| Drugs | Dose | Standard diameters of inhibited zone (mm) | Diameters of inhibited zone (mm) | ||||
| R | I | S | HY9901 | ΔVcrV | |||
| Penicillin G | 10 U | ≤28 | ‒ | ≥29 | 0 (R) | 0 (R) | |
| Oxacillin | 1 µg | ≤10 | 11−12 | ≥13 | 0 (R) | 0 (R) | |
| Ampicillin | 10 µg | ≤11 | 12−14 | ≥15 | 0 (R) | 0 (R) | |
| Carbenicillin | 100 µg | ≤19 | 20−22 | ≥23 | 0 (R) | 11 (R) | |
| Piperacillin | 100 µg | ≤17 | 18−20 | ≥21 | 12 (R) | 15 (R) | |
| Cephradine | 30 µg | ≤14 | 15−17 | ≥18 | 16 (I) | 16 (I) | |
| Cefazolin | 30 µg | ≤14 | 15−17 | ≥18 | 20 (S) | 18 (S) | |
| Cefoperazone | 75 µg | ≤15 | 16−20 | ≥21 | 21 (S) | 21 (S) | |
| Cephalexin | 30 µg | ≤14 | 15−17 | ≥18 | 12 (R) | 18 (S)* | |
| Ceftazidime | 30 µg | ≤14 | 15−17 | ≥18 | 21 (S) | 26 (S)* | |
| Cefuroxime | 30 µg | ≤14 | 15−17 | ≥18 | 15 (I) | 24 (S)* | |
| Ceftriaxone | 30 µg | ≤13 | 14−20 | ≥21 | 30 (S) | 37 (S)* | |
| Norfloxacin | 10 µg | ≤12 | 13−16 | ≥17 | 33 (S) | 25 (S)Δ | |
| Ofloxacin | 5 µg | ≤12 | 13−15 | ≥16 | 35 (S) | 27 (S)Δ | |
| Ciprofloxacin | 5 µg | ≤15 | 16−20 | ≥21 | 33 (S) | 28 (S)Δ | |
| Tetracycline | 30 µg | ≤14 | 15−18 | ≥19 | 23 (S) | 22 (S) | |
| Doxycycline | 30 µg | ≤12 | 13−15 | ≥16 | 21 (S) | 22 (S) | |
| Minocyline | 30 µg | ≤14 | 15−18 | ≥19 | 25 (S) | 25 (S) | |
| Gentamicin | 10 µg | ≤12 | 13−14 | ≥15 | 21 (S) | 22 (S) | |
| Kanamycin | 30 µg | ≤13 | 14−17 | ≥18 | 21 (S) | 23 (S) | |
| Neomycin | 30 µg | ≤12 | 13−16 | ≥17 | 23 (S) | 21 (S) | |
| Amikacin | 30 µg | ≤14 | 15−16 | ≥17 | 22 (S) | 16 (I)Δ | |
| Erythromycin | 15 µg | ≤13 | 14−22 | ≥23 | 20 (I) | 22 (I) | |
| Medimycin | 30 µg | ≤13 | 14−17 | ≥18 | 11 (R) | 15 (I)* | |
| Vancomycin | 30 µg | ≤14 | 15−16 | ≥17 | 11 (R) | 12 (R) | |
| PolymxinB | 300 IU | ≤8 | 9−11 | ≥12 | 15 (S) | 11 (I)Δ | |
| Furazolidone | 300 µg | ≤14 | 15−16 | ≥17 | 15 (I) | 16 (I) | |
| Chloramphenicol | 30 µg | ≤12 | 13−17 | ≥18 | 31 (S) | 28 (S) | |
| Clindamycin | 2 µg | ≤14 | 15−20 | ≥21 | 10 (R) | 15 (I)* | |
| SMZ/TMP | 23.75 μg/1.25 μg | ≤10 | 11−15 | ≥16 | 24 (S) | 17 (S)Δ | |
| S: susceptible; I: intermediate; R: resistant. *: the sensitivity of the mutant strain to antibiotics increased; Δ: the sensitivity of the mutant strain to antibiotics decreased. | |||||||
比较野生株HY9901和缺失株ΔVcrV对斑马鱼的半致死剂量发现,缺失株的半致死量升高,是野生株的16.5倍(表 3)。说明VcrV基因缺失影响了溶藻弧菌的致病性,导致毒力降低。
| Strains | Microbial concentration (CFU/mL) | Experiment number | Mortality number | Mortality rate (%) | LD50 (CFU/mL) |
| HY9901 | 1.0×108 | 20 | 20 | 100 | 3.49×106 |
| 1.0×107 | 20 | 12 | 60 | ||
| 1.0×106 | 20 | 8 | 40 | ||
| 1.0×105 | 20 | 6 | 30 | ||
| 1.0×104 | 20 | 3 | 15 | ||
| ΔVcrV | 1.0×108 | 20 | 12 | 60 | 5.75×107 |
| 1.0×107 | 20 | 5 | 25 | ||
| 1.0×106 | 20 | 4 | 20 | ||
| 1.0×105 | 20 | 4 | 20 | ||
| 1.0×104 | 20 | 2 | 10 |
比较野生株HY9901和缺失株ΔVcrV的生化特性及酶活,结果如表 4所示,二者生化特性及酶活均有极显著性差异(P < 0.01),其中除野生株的活性氧生化指标比缺失株显著升高外,野生株的脯氨酸、肽聚糖、β-内酰胺酶、过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶指标均比缺失株显著降低。表明VcrV基因参与了溶藻弧菌的氧化和抗氧化作用及脯氨酸、肽聚糖、β-内酰胺酶的生成,具有多种生理功能。
| Detection indexes | HY9901 | ΔVcrV |
| ROS (pg/mL) | 1 797.26±9.13 | 1 609.96±17.26** |
| Pro (μmol/L) | 250.73±1.99 | 312.97±4.15** |
| PG (ng/mL) | 5.27±0.06 | 6.01±0.07** |
| β-lactamase (U/L) | 32.86±0.51 | 37.21±0.38** |
| CAT (U/L) | 14.17±0.32 | 16.68±0.28** |
| SOD (U/L) | 12.81±0.11 | 13.61±0.03** |
| GPX (U/L) | 80.89±1.53 | 107.55±1.74** |
| **: P<0.01. | ||
溶藻弧菌T3SS是其重要的致病装置,VcrV作为T3SS转位子蛋白之一,介导转位子蛋白VopB和VopD插入宿主细胞膜并形成毒力蛋白进入宿主细胞的孔道,在溶藻弧菌的致病中发挥着重要作用。为探讨VcrV基因的功能,本研究利用同源重组方法构建了溶藻弧菌VcrV基因的缺失株ΔVcrV,并分析其生物学特性,以期为溶藻弧菌的致病机制研究提供参考。本研究发现,VcrV基因的缺失,除对溶藻弧菌的生长和自凝集能力无明显影响外,对其生物膜形成、细胞粘附、耐受性、抗药性、游动性和涌动性、半致死剂量、生化及酶活指标等生物学特性均具有明显影响,表明VcrV基因参与溶藻弧菌T3SS的致病性和多种生理功能,具有重要的生物学意义。
生物膜是细菌为适应环境由菌体和自身分泌的多糖、纤维蛋白、脂蛋白等包裹而成,涉及粘附、群体感应、代谢和应激反应等多个因素[16],不仅有助病原菌抵抗宿主免疫清除和外界酸碱、氧化、高渗等不良环境,也与其粘附能力和抗药性密切相关,是病原菌的毒力因子之一[17-18]。与野生株相比,缺失株ΔVcrV前期生物膜的形成能力明显偏低,同时缺失株抵抗H2O2氧化、NaCl高渗不良环境和细胞粘附能力较野生株也明显减弱,说明缺失株抵抗不良环境的应激能力和粘附能力降低与溶藻弧菌生物膜的形成能力减弱有关,VcrV基因参与或调控了溶藻弧菌生物膜的形成。但缺失株ΔVcrV对CuSO4重金属的耐受性没有明显影响,具体原因还有待进一步研究。缺失株ΔVcrV生物膜形成能力虽然降低,但并不仅仅减弱抗生素的耐药性,而是对不同类型抗生素的耐药性有增强和减弱差异。药敏试验显示,缺失株ΔVcrV对青霉素类抗生素产生较强的耐药性,敏感性几乎不变;对头孢菌素类(头孢氨苄、头孢他啶、头孢呋辛、头孢曲松)、大环内酯类(麦迪霉素)、林克胺类(克林霉素) 抗生素耐药性减弱;而对氨基糖苷类(丁胺卡那) 和多肽类(多粘菌素B) 抗生素耐药性增强;对喹诺酮类(诺氟沙星、氧氟沙星、环丙沙星) 和磺胺类(复方新诺明) 抗生素虽然敏感性不变,但抑菌圈均明显减小。表明缺失株ΔVcrV的耐药性不仅受生物膜的影响,还有其他因素影响。研究发现,溶藻弧菌还携带strA、strB、drfA27、floR、arr-2、qnrvC和cat等多种耐药基因[19]。推测VcrV基因不仅影响溶藻弧菌生物膜的形成,还可能参与调控其相关耐药基因的表达。
细菌的运动性与其生存、致病性、粘附性、趋化性、生物膜形成等密切相关,端生鞭毛和周生鞭毛是细菌运动的驱动力,细菌的运动能力直接受鞭毛调控蛋白的影响[20]。溶藻弧菌的运动有端生鞭毛驱动。研究发现,溶藻弧菌的鞭毛受多个基因的调控,tssJ基因可促进溶藻弧菌鞭毛的生成,增强其运动性[21],exsD基因则具有相反的作用[4]。本研究中,VcrV基因敲除后缺失株的游动能力和涌动能力均增强,与野生株相比均有极显著性差异(P < 0.01),表明VcrV基因对溶藻弧菌鞭毛的生成及运动性具有负调控作用。该结果与铜绿假单胞菌鞭毛的生成和运动不利于其聚集和形成生物膜一致[22]。
本研究用斑马鱼进行溶藻弧菌攻毒实验,缺失株ΔVcrV的毒力较野生株下降16.5倍。其毒力下降倍数大于溶藻弧菌T3SS的装置蛋白缺失基因VscQ的4.6倍[23],小于效应蛋白基因Va1686的54.3倍[24]。而溶藻弧菌T3SS的调控蛋白基因TyeA缺失,其毒力则下降40倍[25]。表明溶藻弧菌T3SS的致病性受多种基因的复杂调控,不同类型的基因对致病性差异较大,甚至起相反的作用。转位子蛋白基因VcrV缺失可降低溶藻弧菌的致病性,具有进一步开发减毒活疫苗的潜力。
活性氧(ROS) 是好氧菌能量代谢产生的含氧的、化学活性极强的物质。少量的ROS是细菌正常生理代谢必需物质,过量则会带来氧化压力,造成氧化损伤[26]。与野生株HY9901相比,缺失株ΔVcrV的ROS含量显著减少(P < 0.01),而抗氧化酶系统的过氧化氢酶(CAT)、超氧化物歧化酶(SOD) 和谷胱甘肽过氧化物酶(GPX) 的活性则显著增强(P < 0.01),同时抗氧化非酶系统的脯氨酸的含量也显著增加(P < 0.01)。缺失株抗氧化能力的增强,推测由于VcrV基因缺失引起溶藻弧菌应激反应,诱导其抗氧化酶系统和非酶系统高表达,清除体内大量ROS所致。这与细菌中ROS水平减少伴随体内抗氧化系统活力增强的结果相一致[27]。肽聚糖是细菌细胞壁的重要结构组分,在维持细菌细胞形态、结构和功能完整性方面起着重要作用。肽聚糖的合成需要青霉素结合蛋白(PBP) 转肽酶的催化,转肽酶常成为青霉素类抗生素的靶标。青霉素类抗生素通过β-内酰胺环结构与转肽酶共价结合阻止肽聚糖的合成,从而使细菌细胞壁缺损,菌体膨胀裂解来发挥抗菌作用[28-29]。研究表明,青霉素类抗生素本身是β-内酰胺酶良好的诱导剂,β-内酰胺酶的诱导和肽聚糖循环与细菌耐药性关系极为密切[30]。本研究中,缺失株ΔVcrV的肽聚糖含量和β-内酰胺酶活性均比野生株显著增强(P < 0.01),推测缺失株对青霉素类抗生素耐药性有较强的耐药性,这与本文药敏实验相一致。但缺失株对部分β-内酰胺类抗生素(头孢菌素类) (表 2) 的耐药性降低,可能受其他因素影响,因β-内酰胺类抗生素的耐药性除受β-内酰胺酶和肽聚糖影响外,还与外排泵的表达、生物膜的形成和抗生素靶蛋白的修饰等因素可能有关,具体原因还有待进一步研究。
| [1] |
Xia MJ, Pei F, Mu CK, et al. Disruption of bacterial balance in the gut of Portunus trituberculatus induced by Vibrio alginolyticus infection. J Oceanol Limnol, 2018, 36(5): 1891-1898. DOI:10.1007/s00343-018-7121-x
|
| [2] |
Kokkari C, Sarropoulou E, Bastias R, et al. Isolation and characterization of a novel bacteriophage infecting Vibrio alginolyticus. Arch Microbiol, 2018, 200(5): 707-718. DOI:10.1007/s00203-018-1480-8
|
| [3] |
周柯, 孙菲, 查定军, 等. 慢性外耳道炎患者分离溶藻弧菌的鉴定及生物学特性分析. 中国病原生物学杂志, 2020, 15(2): 146-151. Zhou K, Sun F, Zha DJ, et al. Biological characteristics of a Vibrio alginolyticus strain isolated from a patient with chronic otitis externa. J Pathog Biol, 2020, 15(2): 146-151 (in Chinese). |
| [4] |
王俊霖, 招茵, 苏茵茵, 等. 溶藻弧菌T3SS exsD基因敲除突变株构建及其表型特征. 广东海洋大学学报, 2021, 41(5): 35-43. Wang JL, Zhao Y, Su YY, et al. Construction and characterization of gene exsDKnock-out mutant of Vibrio alginolyticus type Ⅲ secretion system. J Guangdong Ocean Univ, 2021, 41(5): 35-43 (in Chinese). DOI:10.3969/j.issn.1673-9159.2021.05.005 |
| [5] |
Chen YY, Wu FL, Pang HY, et al. Superoxide dismutase B (sodB), an important virulence factor of Vibrio alginolyticus, contributes to antioxidative stress and its potential application for live attenuated vaccine. Fish Shellfish Immunol, 2019, 89: 354-360. DOI:10.1016/j.fsi.2019.03.061
|
| [6] |
Zhou SH, Tu XT, Pang HY, et al. A T3SS regulator mutant of Vibrio alginolyticus affects antibiotic susceptibilities and provides significant protection to Danio rerio as a live attenuated vaccine. Front Cell Infect Microbiol, 2020, 10: 183. DOI:10.3389/fcimb.2020.00183
|
| [7] |
Li L, Su YB, Peng B, et al. Metabolic mechanism of colistin resistance and its reverting in Vibrio alginolyticus. Environ Microbiol, 2020, 22(10): 4295-4313. DOI:10.1111/1462-2920.15021
|
| [8] |
He RC, Zuo YF, Zhao LM, et al. Copper stress by nutritional immunity activates the CusS-CusR two-component system that contributes to Vibrio alginolyticus anti-host response but affects virulence-related properties. Aquaculture, 2021, 532: 736012. DOI:10.1016/j.aquaculture.2020.736012
|
| [9] |
Zhao Z, Chen C, Hu CQ, et al. The type Ⅲ secretion system of Vibrio alginolyticus induces rapid apoptosis, cell rounding and osmotic lysis of fish cells. Microbiology (Reading), 2010, 156(Pt 9): 2864-2872.
|
| [10] |
Zhao Z, Liu JX, Deng YQ, et al. The Vibrio alginolyticus T3SS effectors, Val1686 and Val1680, induce cell rounding, apoptosis and lysis of fish epithelial cells. Virulence, 2018, 9(1): 318-330. DOI:10.1080/21505594.2017.1414134
|
| [11] |
Marenne MN, Journet L, Mota LJ, et al. Genetic analysis of the formation of the Ysc-Yop translocation pore in macrophages by Yersinia enterocolitica: role of LcrV, YscF and YopN. Microb Pathog, 2003, 35(6): 243-258. DOI:10.1016/S0882-4010(03)00154-2
|
| [12] |
Dortet L, Lombardi C, Cretin F, et al. Pore-forming activity of the Pseudomonas aeruginosa type Ⅲ secretion system translocon alters the host epigenome. Nat Microbiol, 2018, 3(3): 378-386. DOI:10.1038/s41564-018-0109-7
|
| [13] |
Audia JP, Lindsey AS, Housley NA, et al. In the absence of effector proteins, the Pseudomonas aeruginosa type three secretion system needle tip complex contributes to lung injury and systemic inflammatory responses. PLoS One, 2013, 8(11): e81792. DOI:10.1371/journal.pone.0081792
|
| [14] |
何爱琳, 李文桂. 铜绿假单胞菌PcrV疫苗研制现状. 中国病原生物学杂志, 2020, 15(6): 737-741. He AL, Li WG. The current status of a PcrV vaccine against Pseudomonas aeruginosa. J Pathog Biol, 2020, 15(6): 737-741 (in Chinese). |
| [15] |
Feodorova VA, Lyapina AM, Khizhnyakova MA, et al. Yersinia pestis antigen F1 but not LcrV induced humoral and cellular immune responses in humans immunized with live plague vaccine-comparison of immunoinformatic and immunological approaches. Vaccines, 2020, 8(4): 698. DOI:10.3390/vaccines8040698
|
| [16] |
Lamas A, Miranda JM, Vázquez B, et al. Biofilm formation, phenotypic production of cellulose and gene expression in Salmonella enterica decrease under anaerobic conditions. Int J Food Microbiol, 2016, 238: 63-67. DOI:10.1016/j.ijfoodmicro.2016.08.043
|
| [17] |
Lamas A, Fernandez-No IC, Miranda JM, et al. Biofilm formation and morphotypes of Salmonella enterica subsp. arizonae differs from those of other Salmonella enterica sub species in isolates from poultry houses. J Food Prot, 2016, 79(7): 1127-1134. DOI:10.4315/0362-028X.JFP-15-568
|
| [18] |
González JF, Alberts H, Lee J, et al. Biofilm formation protects Salmonella from the antibiotic ciprofloxacin in vitro and in vivo in the mouse model of chronic carriage. Sci Rep, 2018, 8(1): 222. DOI:10.1038/s41598-017-18516-2
|
| [19] |
胡梦华, 马立才, 赵姝, 等. 一株致病性溶藻弧菌的多重耐药与毒力基因分子分析. 海洋渔业, 2015, 37(6): 557-564. Hu MH, Ma LC, Zhao S, et al. Molecular analysis of multi-drug resistance and virulence genes in a pathogenic Vibrio alginolyticus. Mar Fish, 2015, 37(6): 557-564 (in Chinese). DOI:10.3969/j.issn.1004-2490.2015.06.011 |
| [20] |
许绵, 周明旭, 朱国强. 细菌鞭毛运动、黏附和免疫逃逸机制的研究进展. 中国兽医学报, 2017, 37(2): 369-375, 380. Xu M, Zhou MX, Zhu GQ. Progress in the mechanism of bacterial flagellum motility, adhesion and immune escape. Chin J Vet Sci, 2017, 37(2): 369-375, 380 (in Chinese). |
| [21] |
刘文竹. tssJ基因对溶藻弧菌运动性和生物膜形成的影响[D]. 海口: 海南大学, 2015. Liu WZ. Influences of tssJ gene on motility and biofilm formation of Vibrio alginolyticus[D]. Haikou: Hainan University, 2015 (in Chinese). |
| [22] |
杜邦. 环境压力胁迫下细菌运动对生物膜形成的影响. 合肥: 合肥工业大学, 2019. Du B. Effects of bacterial motility on biofilm formation under environmental stresses. Hefei: Hefei University of Technology, 2019 (in Chinese). |
| [23] |
武沛文. 溶藻弧菌T3SS C-环组分VscQ的功能研究[D]. 湛江: 广东海洋大学, 2020. Wu PW. Functional study on T3SS C-ring component VscQ of Vibrio alginolytic[D]. Zhanjiang: Guangdong Ocean University, 2020 (in Chinese). |
| [24] |
宋大伟. 溶藻弧菌T3SS效应蛋白Va1686基因克隆及其生物学功能研究[D]. 湛江: 广东海洋大学, 2018. Song DW. Cloning and biological function of Vibrio alginolytic HY9901 type Ⅲ secretion system effector protein Va1686[D]. Zhanjiang: Guangdong Ocean University, 2018 (in Chinese). |
| [25] |
周诗慧. 溶藻弧菌Ⅲ型分泌系统调控蛋白TyeA的功能研究[D]. 湛江: 广东海洋大学, 2021. Zhou SH. Characterization of the regulatory protein TyeA involved in type Ⅲ secretion system in marine fish pathogen Vibrio alginolyticus[D]. Zhanjiang: Guangdong Ocean University, 2021 (in Chinese). |
| [26] |
王建波. 谷氨酸棒状杆菌中Ohr抗有机氧化物胁迫的功能研究[D]. 杨凌: 西北农林科技大学, 2015. Wang JB. Ohr protects Corynebacterium glutamicum against organic hydroperoxide induced oxidative stress[D]. Yangling: Northwest A & F University, 2015 (in Chinese). |
| [27] |
刘武康, 吴淑燕, 陈国薇, 等. 细菌产生的活性氧及其功能. 微生物学杂志, 2016, 36(1): 89-95. Liu WK, Wu SY, Chen GW, et al. The reactive oxygen species generated by bacteria and its functions. J Microbiol, 2016, 36(1): 89-95 (in Chinese). DOI:10.3969/j.issn.1005-7021.2016.01.015 |
| [28] |
吴根福, 音建华. 肽聚糖循环及细菌对β-内酰胺类抗生素的耐受性. 中国药学杂志, 2017, 52(3): 180-184. Wu GF, Yin JH. Peptidoglycan recycling and bacterial resistance to β-lactams. Chin Pharm J, 2017, 52(3): 180-184 (in Chinese). |
| [29] |
Kocaoglu O, Carlson EE. Profiling of β-lactam selectivity for penicillin-binding proteins in Escherichia coli strain DC2. Antimicrob Agents Chemother, 2015, 59(5): 2785-2790. DOI:10.1128/AAC.04552-14
|
| [30] |
Zeng XM, Lin J. Beta-lactamase induction and cell wall metabolism in Gram-negative bacteria. Front Microbiol, 2013, 4: 128.
|
 2022, Vol. 38
2022, Vol. 38




