嗜神经性疱疹病毒:神经科学研究的有力工具
李明智
,
潘力
,
吴红霞
,
仇华吉
,
王异民
,
孙元
生物工程学报  2023, Vol. 39 2023, Vol. 39 Issue (1): 7-18 Issue (1): 7-18 |

嗜神经性疱疹病毒发现较早,可在感染的神经元胞体中潜伏,一定条件下潜伏的病毒能够再激活从而导致机体出现复发性感染。嗜神经性疱疹病毒引起的疾病在世界范围内流行和传播,对人类和多种哺乳动物造成了严重的危害[1]。随着对嗜神经性疱疹病毒感染机制的深入研究,此类病毒逐渐被改造为疾病治疗和科学研究的重要工具。嗜神经性疱疹病毒一方面给人类和其他哺乳动物以及畜牧养殖行业造成了严重的危害,另一方面也因其具有嗜神经性以及在神经细胞中传导的特性而应用在神经科学研究及神经性疾病的治疗当中。
1 嗜神经性疱疹病毒的分类及特性疱疹病毒是一类有囊膜的双链DNA病毒,基因组长为125−240 kb,病毒粒子直径大小为200−250 nm,由核芯、衣壳、被膜及囊膜4个部分组成[2]。核芯含有双股DNA,缠绕成纤丝卷轴。衣壳呈对称的二十面体结构,由162个壳微粒组成,囊膜由脂质双层组成,并且囊膜表面含有大约11种病毒糖蛋白,其中gB、gD、gH和gL是病毒侵入细胞所必需的蛋白[3]。目前已知疱疹病毒家族有140余个成员,感染宿主范围广,几乎能感染所有哺乳动物[4],主要侵害皮肤、黏膜以及神经组织。病毒感染可表现为原发性、潜伏性及复发性感染,引起多种多样的疾病,是一类十分常见并严重危害人类及其他动物生命健康的病毒。
根据疱疹病毒的基因组结构、组织嗜性、潜伏感染部位、发病机制及临床表现,国际病毒分类委员会将疱疹病毒分为α疱疹病毒、β疱疹病毒、γ疱疹病毒以及其他疱疹病毒[5]。其中多种α疱疹病毒是嗜神经性疱疹病毒[6]。当前,已对包括人类单纯疱疹病毒1型(herpes simplex virus type 1, HSV-1)和2型(HSV-2)、水痘带状疱疹病毒(varicella-zoster virus, VZV)、伪狂犬病病毒(pseudorabies virus, PRV)、禽传染性喉气管炎病毒(infectious laryngotracheitis virus, ILTV)、马立克氏病病毒(Marek’s disease virus, MDV)、牛疱疹病毒1型(bovine herpesviruses type 1, BHV-1)和5型(BHV-5)以及马疱疹病毒1型(equine herpesviruses type 1, EHV-1)和4型(EHV-4)等40多种疱疹病毒进行了深入研究,其中具有代表性的HSV-1、PRV等常作为嗜神经性疱疹病毒研究的模式病毒。
2 神经系统的示踪工具神经网络由近千亿个神经元构成,不同的神经元之间存在形态及功能上的差异,神经元通过突触连接形成神经环路系统来进行信息的加工和传递[7]。神经系统分为中枢神经系统(central nervous system, CNS)和外周神经系统(peripheral nervous system, PNS)两大部分。中枢神经系统又包括脑和脊髓,外周神经系统包括脑神经和脊神经。神经系统错综复杂,控制着学习、记忆等一系列行为[8]。揭示脑神经环路是了解脑神经网络运作机制的基础,对脑神经环路清晰准确的认知有助于探索多种神经性疾病的致病机制,可为神经性疾病的诊断、治疗及预防和其他神经科学方面的研究提供有力的理论依据[9]。在过去的几十年里已经有许多方法和技术可以用来探索神经网络,包括放射性标记的氨基酸、2-脱氧葡萄糖、辣根过氧化物酶(horseradish peroxidase, HRP)以及生物素化的葡聚糖胺(biotinylated dextran amines, BDAs)等多种可以将大量神经连接可视化的非生物示踪剂。但是这些示踪方法具有明显的局限性,仅仅可以将神经元的全脑投射连接可视化,不能具体观察到投射的细胞类型以及突触之间的连接方式。随后多种生物示踪剂被发掘并利用[10]。随着基因工程及反向遗传操作技术的不断发展,改造后的嗜神经性病毒便是最强大的神经示踪工具之一[11]。嗜神经性病毒感染机体后入侵神经元并在神经元间沿特定方向跨突触传播(图 1)。与传统的示踪剂相比,嗜神经性病毒具有可以通过突触传播、传播方向明确和病毒的复制避免了标记信号减弱等优点[12]。不同的嗜神经性病毒之间也存在差异,主要体现在病毒的结构、基因组、受体蛋白和复制过程等[13]。嗜神经性病毒通过识别并结合相应的受体蛋白侵入神经系统并完成病毒的复制和释放[14]。疱疹病毒是最早用于神经环路示踪研究的病毒,其中α疱疹病毒属的HSV-1[15]和PRV[16]比疱疹病毒家族其他成员的宿主范围更广,是目前比较理想的用于神经示踪研究的模式病毒。
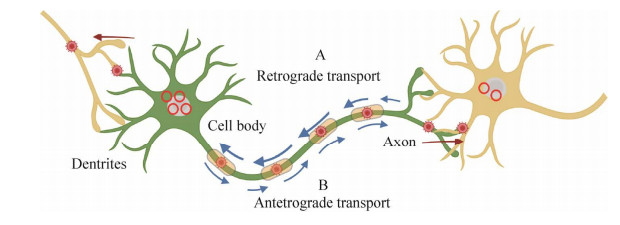
|
| 图 1 病毒跨突触传播过程 Fig. 1 Virus transsynaptic spread process. A:病毒侵入感觉神经元后,在胞体内复制并建立潜伏,再激活后沿树突跨突触运行并感染上一级神经元. B:病毒在胞体中复制并建立潜伏,再激活后从胞体沿轴突运输并跨突触返回到下一级神经元 A: the virus invades sensory neurons, replicates in the cell body and establishes latency, runs along dendrites across synapses and infects upper-level neurons upon reactivation. B: the virus replicates in the soma and establishes latency, and is transported from the soma along the axon and back across the synapse to the next-level neuron upon reactivation. |
| |
当病毒进入感觉神经元的胞体后,病毒的基因组会进入细胞核进行复制并建立潜伏感染。适当条件下,潜伏的病毒可以再激活,病毒粒子会从神经元细胞的胞体沿轴突运输到突触并返回到上皮组织,这一过程就是病毒的顺行传导[17]。
HSV-1及血清型1型腺相关病毒(adeno-associated virus 1, AAV1)是当前应用较为广泛的顺神经轴突示踪工具。HSV-1-129株(H129)与大多数双向传播的HSV-1毒株不同,H129在神经环路中顺向跨突触传播,通过感染位点的胞体,顺向运输至神经末梢,进而感染下一级神经元的胞体,基于这种传播方式,H129被用来揭示和研究输出神经环路[18]。在早期的研究中,由于用于观察病毒传播的技术十分复杂并且对大基因组的单纯疱疹病毒的改造十分困难,H129在解析神经系统方面的研究进展十分缓慢,但近些年随着分子生物学技术的不断发展和增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)的发现,大量基于H129衍生的病毒工具开始得到广泛的应用[19-20]。自2011年,开发出源于H129的顺行跨突触示踪剂[21],该示踪剂是利用同源重组法将HSV在神经元等非有丝分裂细胞中复制和传播所必需的内源性TK基因用Cre-loxP系统控制的密码子优化的TK基因和红色荧光蛋白基因tdtomato所替换,并将其命名为H129ΔTK-TT[22]。这种重组病毒无法在正常的神经元中复制,只有当其感染具有特异性表达的Cre重组酶的神经元时tdtomato和TK才会表达。Cre-loxP系统促进H129在解析PNS和CNS之间的连接以及标记脑内特定区域的神经元中发挥了强大的作用[23]。有研究报道,AAV1也可以顺行跨单级突触传递,通过在Ai14小鼠大脑初级视皮层注射高滴度的AAV1-Cre后,可以观察到在下游多个脑区的神经元中表达环化重组酶蛋白(cyclization recombination enzyme, Cre)。而后又进行了在Ai14小鼠的视网膜注射AAV1-Syn-Cre试验,发现在视网膜神经节细胞投射的脑区也可以观察到表达Cre蛋白的神经元,而这些脑区均无输出神经元投射到视网膜。但是AVV1相较于HSV-1跨突触效率更低,并且在一般情况下仅适用于在下游神经元表达Cre等重组酶蛋白,无法有效表达荧光蛋白[24]。
2.2 逆神经轴突示踪工具嗜神经性疱疹病毒在上皮组织复制的过程中,病毒会进入感觉神经元的轴突,在病毒与细胞膜融合时将衣壳释放到轴浆中,病毒衣壳附着在动力蛋白上面。随后进入感觉神经节中的神经元细胞的胞体,这一过程称为病毒逆行轴突传导[25]。
目前应用较多的逆神经轴突示踪工具有狂犬病病毒(rabies virus, RV)和PRV。RV的优势在于其感染神经系统后,主要标记神经元,对胶质细胞几乎不标记,并且不感染没有突触连接的过路神经纤维。目前构建的缺陷型重组RV也具有较高的安全性,感染后对神经元的毒性较低。相较于前者,PRV作为逆神经轴突示踪工具具有更为鲜明的特点及优势[26]。PRV Bartha-K61株能够沿神经轴逆行跨突触传播,病毒通过感染神经末梢,沿轴突逆向运行至胞体[27],进而感染与之连接的上一级神经元,用于揭示和研究输入神经环路,这在对于中枢神经系统及其外周神经系统的研究中发挥了十分重要的作用[28]。PRV Bartha-K61株是一种减毒活疫苗株,通过直接注射脑实质或外周神经后跨突触感染中枢神经系统[29]。在之前的研究中,使用免疫细胞化学标记法来检测PRV感染的神经元,利用这种技术获得了良好的标记效果,不仅非特异性染色水平很低,而且可以利用电子显微镜进行观察和分析。但这种技术还不够完善,因为只有在对组织进行固定和切片,并经过免疫细胞在化学处理后,才能够准确地识别PRV感染的神经元,耗时耗力。为了能够减少免疫细胞化学组织处理时的大量消耗,构建了表达EGFP的PRV重组病毒[30]。EGFP蛋白可以在重组PRV感染的神经元中大量表达,通过荧光显微镜可以清楚、准确地获得标记信号,可以节省在组织处理上花费的精力[31]。而后构建的包括表达红色荧光蛋白的重组PRV等多种重组PRV都应用到神经环路的研究中[32]。这种效果极佳且廉价的方式对解析CNS和PNS环路、推进神经网络的研究起到了至关重要的作用。
以上研究将为进一步解析疱疹病毒的潜伏感染机制,阻断疱疹病毒潜伏感染,清除已潜伏的病毒和利用疱疹病毒潜伏感染的特性研发保护力持久的新型疫苗提供了新思路。
3 用于治疗神经性疾病的疱疹病毒载体病毒载体对基因和药物的递送以及对应靶细胞中基因的表达是治疗神经性疾病的关键。病毒载体的感染与天然病毒受体的分布相关,而所需的靶细胞上可能不存在相对应的病毒受体[33],这使基因和药物的靶向传递受到限制。大多数病毒的宿主细胞选择有限,而对于嗜神经性疱疹病毒,以HSV-1为例,几乎可以感染人体内的每一种细胞[34]。通过改造HSV-1可使其定向感染,从而使其作为具有特殊用途的基因递送载体应用于神经科学研究[35]。HSV-1载体利用其天然嗜性可使基因在神经元中运输[36]。
当前,神经性疾病十分普遍且治疗效果不佳,治疗神经性疾病的一个主要障碍是血脑屏障的存在。血脑屏障是一种高度选择性的半透膜,它将循环血液与脑组织分隔开,是由毛细血管壁的内皮细胞、包裹毛细血管的星形胶质细胞的伪足末端和嵌入毛细血管基底膜的周细胞所组成[37]。当有害物质想要进入大脑,血脑屏障就会起到防御作用,但血脑屏障在阻断有害物质进入大脑的同时也阻断了用于治疗脑部神经疾病药物的递送[38]。为了实现跨血脑屏障的药物递送,可以将药物与改造后的嗜神经性疱疹病毒载体进行偶联,由于神经可以通过血脑屏障,而嗜神经性疱疹病毒可以携带药物沿神经进入脑内[39]。药物通过穿过血脑屏障递送,到达脑内只是第一步,还应考虑如何将药物准确递送至发病部位。不同的病毒由于其特殊的神经嗜性,可以进入到脑内的特定区域。例如,有研究发现在小鼠淋巴结处注射重组病毒PRV-152,病毒可以感染小鼠下丘脑室旁核以及脑干,但其他脑内区域没有被病毒感染[40]。本团队利用荧光蛋白标记的病毒开展了PRV沿神经轴突逆向传导的相关研究,获得了相似结果[41]。这更进一步证明嗜神经性疱疹病毒是脑内药物递送的高效载体[42]。然而,目前对多数神经疾病发病机制还未完全了解,对所有病毒载体的毒性控制也在不断研究,所以病毒载体携带药物治疗神经性疾病的疗效、稳定性和安全性还需要进行更深入的研究。
阿尔茨海默病(Alzheimer’s disease, AD)是一种研究最多的神经性疾病,也是一种十分常见的老年痴呆症。AD是一种炎症性神经退行性疾病,是由多种因素造成。当前研究中对AD的具体病因还尚不清楚[43]。AD患者会出现认知能力下降和智力受损,从而导致工作能力和日常生活活动能力的丧失[44]。最新研究表明神经细胞内溶酶体的酸化障碍会引起β样淀粉蛋白(amyloid-β, Aβ)释放进入组织环境,而Aβ可以导致脑内老年斑的形成和神经细胞的凋亡,进而导致阿尔茨海默病[45]。有研究表明,在小鼠中使用HSV-1扩增子载体接种Aβ疫苗,通过预防Aβ纤维形成和清除实质淀粉样蛋白的沉积来治疗AD。HSV-1扩增子载体具有基因组容量大、操作简单、缺乏免疫抑制病毒基因、能够有效递呈抗原细胞等优点,是作为构建Aβ疫苗的良好病毒载体[46]。基于HSV构建的Aβ的扩增子载体疫苗(HSVIEAβCMVIL-4)[47]介导的三重转基因AD (3xTg-AD)小鼠的AD相关病症得到了抑制,并伴随着学习和记忆功能的改善。
除AD外,帕金森病(Parkinson’s disease, PD)也是一种具有代表性的神经退行性疾病,PD的发病机制与表达多巴胺神经递质的中脑黑质神经元选择性的丢失之间存在联系[48]。多巴胺神经递质的减少会导致机体出现一系列的运动障碍[49]。当前改善PD症状的较为有效的方法是通过外源性给予左旋多巴。然而,对左旋多巴的长时间使用会使药效逐渐下降甚至丧失。因此,通过基因治疗方法来恢复受损的细胞功能成为一种治疗PD的重要手段[50]。目前,HSV-1扩增子载体已经被用来携带包括与多巴胺合成有关的内源性功能酶和对神经细胞具有保护作用的治疗基因来恢复受损细胞的功能。已有研究证实,HSV-1扩增子载体可以在携带大量基因的基础上,将与多巴胺生物合成和运输有关的4种基因,酪氨酸羟化酶(tyrosine hydroxylase, TH)、氨基酸脱羧酶(amino acid decarboxylase, AADC)、三磷酸鸟苷-环化水解酶1 (guanosine triphosphate cyclohydrolase-1, GCH1)和囊泡单胺转运体1 (vesicular monoamine teansporter 1, VMAT1)基因在神经组织特异启动子的启动下插入到HSV-1扩增子载体上,通过无辅助病毒污染的包装系统对该扩增子载体进行包装,并将其感染至由6-羟基多巴所致的PD动物模型上,实验结果显示PD动物模型体内的多巴胺含量明显增加[51]。
通过病毒载体携带治疗基因或药物是当前治疗神经性疾病的一种有效且十分有潜力的治疗手段。除上述案例外,已有多项研究已经在动物模型上利用嗜神经性疱疹病毒、腺病毒、狂犬病病毒等嗜神经性病毒载体携带基因对亨廷顿病(Huntington’s disease, HD)、肌萎缩性侧索硬化(amyotrophic lateral sclerosis, ALS)等神经性疾病进行治疗并取得了良好的效果[52]。其中,HSV-1作为嗜神经性疱疹病毒相对于其他嗜神经性病毒,更是展现了其装载容量大、宿主范围广且不含编码病毒蛋白等优势[53]。HSV-1对神经系统突出的适应性特别适合作为将基因输送到CNS和PNS的载体,但使用HSV-1作为载体依然存在一定的局限性。在接下来的对HSV-1扩增子载体的扩增片段对神经系统不同区域的靶向性以及开发组合载体是主要研究方向,对HSV-1载体的利用最终可能实现基因和药物通过病毒载体在大脑中的递送,这使神经性疾病的治疗可以完全代替手术治疗。笔者认为,解析疱疹病毒致神经损伤的重要机制,避免疱疹病毒嗜神经性而造成的持续性神经损伤,并开发出相关产品和技术用于有效清除神经细胞中的病毒将是未来研究的热点之一。
4 作为溶瘤病毒用于抗神经系统肿瘤治疗尽管当前手术切除和放化疗在抗肿瘤方面取得一定的进展,但依然不能控制更高级别的脑肿瘤导致的发病和死亡,传统治疗肿瘤的方法已经不能满足当前对肿瘤治疗的要求[54]。溶瘤病毒(oncolytic viruses, OVs)是一种新型的肿瘤治疗工具[55],其有效的溶瘤作用以及靶向性,可直接杀死肿瘤细胞并引起机体的免疫反应[56] (图 2)。应用OVs的优点是可以使病毒仅在肿瘤细胞中复制,不会对周围的正常组织造成损害[57]。然而,天然的溶瘤病毒存在一定的局限性,因此需要将新的功能性基因导入改造后的病毒载体,以增强溶瘤作用。HSV-1作为一种抗肿瘤治疗载体,广泛应用在神经胶质瘤及其他肿瘤的治疗中[58]。
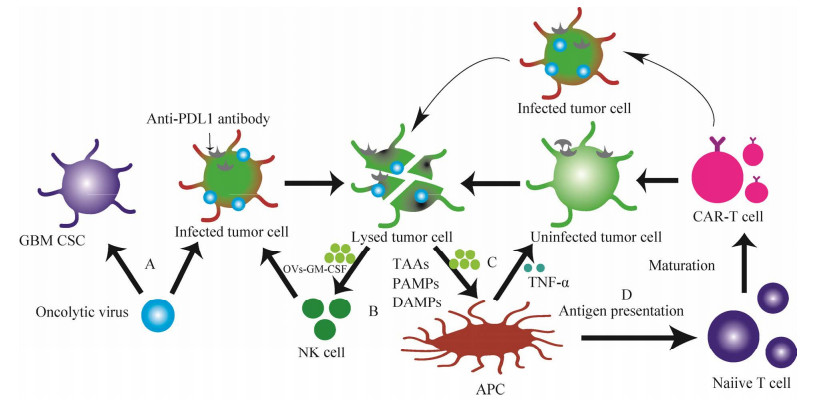
|
| 图 2 溶瘤病毒抗肿瘤作用 Fig. 2 Anti-tumor effects of oncolytic virus. A:OVs可以优先感染肿瘤细胞,诱导肿瘤细胞溶解. B:OVs感染并引起肿瘤细胞裂解导致肿瘤相关抗原(tumor-associated antigens, TAAs)、细胞源性损伤相关分子(damage associated molecular patterns, DAMPs)和病毒病原体相关分子(pathogen-associated molecular patterns, PAMPs)的释放,随后结合树突状细胞(dendritic cell, DCs)和先天淋巴样细胞(例如自然杀伤细胞),以清除病毒早期感染的细胞. C:OVs感染导致TAAs、PAMPs和DAMPS的释放,既诱导针对感染的肿瘤细胞的天然免疫反应(如TNF-α)又通过旁观者效应诱导对未感染的肿瘤细胞的天然免疫反应. D:崩解的肿瘤细胞释放TAAs、DAMPS、PAMPs、促炎细胞因子和趋化因子,可激活抗原递呈细胞(antigen-presenting cells, APCs),从而促进细胞介导的免疫反应 A: OVs preferentially infect tumor cells and induce tumor cell lysis. B: OVs infect and cause tumor cell lysis, leading to the release of tumor-associated antigens (TAAs), cell-derived damage-associated molecules (DAMPs) and viral pathogen-associated molecules (PAMPs), which subsequently bind dendritic cells (DCs) and innate lymphoid-like cells (e.g. NK cells) to clear the virus from early infected cells. C: Infection with OVs leads to the release of TAAs, PAMPs and DAMPS, inducing both innate immune responses against infected tumor cells (e.g. TNF-α) and innate immune responses against uninfected tumor cells through bystander effects. D: Disintegrating tumor cells release TAAs, DAMPS, PAMPs, pro-inflammatory cytokines and chemokines that activate antigen-presenting cells (APCs), thereby promoting cell-mediated immune responses. |
| |
HSV-1由于其基因组非常大,可以容纳40−50 kb的外源基因,是目前容量最大的病毒载体[59]。HSV-1可以感染多种类型的肿瘤细胞,在动物模型上已应用于病毒实验的临床研究[60]。虽然胶质瘤细胞可以侵入脑组织内,但目前已经鉴定出HSV-1在脑神经中致病所必需的基因,并且可以进行改造,因此HSV-1在神经胶质肿瘤的治疗中效果明显[61]。
在最早的研究中,将用于治疗胶质肿瘤的溶瘤HSV-1命名为G207[62]。随后在小鼠和灵长类动物上进行了安全评价后用于临床治疗[63],临床结果表明溶瘤HSV-1对肿瘤的治疗效果十分显著。为了在不影响安全性的前提下进一步提高肿瘤治疗效果,开发了第3代溶瘤HSV-1,并命名为G47Δ[64]。在对小鼠进行瘤内接种后发现,G47Δ对抑制肿瘤生长及有效杀死从手术切除的胶质母细胞中分离出来的癌症干细胞的效果明显优于G207[65]。由于溶瘤HSV-1的疗效不仅取决于病毒在肿瘤内的复制能力,还取决于诱导抗肿瘤免疫的程度。因此联合免疫基因治疗可以增强HSV-1的抗肿瘤免疫作用。例如,在CT26皮下肿瘤模型中,表达小鼠白细胞介素12 (interleukin-12, IL-12)的缺陷型HSV-1载体联合G207在瘤内进行接种,结果显示出比单独使用G207更好的效果[66]。
在抗肿瘤治疗中,HSV-1作为溶瘤病毒依然存在缺陷,主要缺陷是因为HSV-1是一种人类病原体,在作为溶瘤病毒时需要对其进行基因改造,以减弱其致病力,使病毒能够在肿瘤细胞中优先复制。然而,病毒毒力减弱后会降低病毒的复制能力,从而影响治疗效果[67]。因此,使用非人类病原体病毒替代HSV-1可能是一种更好的治疗肿瘤的方法。目前,发现山羊疱疹病毒1型(caprine herpesvirus 1, CpHV-1)可以杀死小鼠神经母细胞瘤细胞系,有实验用CpHV-1感染小鼠及人类癌细胞后发现,CpHV-1存在与HSV-1相似的溶瘤能力[68],这使CpHV-1成为溶瘤病毒免疫治疗的新型候选病毒。
根据临床试验结果,溶瘤HSV-1及其他动物嗜神经性疱疹病毒应用在治疗神经胶质瘤上是一种很有前途的治疗方法,同时可以通过溶瘤嗜神经性疱疹病毒开发有效的肿瘤疫苗[69]。但由于中枢神经系统肿瘤具有高度免疫抑制性,存在多种抑制性信号通路,单一治疗手段无法产生持久的效果。根据肿瘤微环境中癌细胞、溶瘤病毒和宿主免疫系统之间的相互作用,将溶瘤病毒与不同抗癌手段联合使用可以增强抗肿瘤免疫并改善治疗效果,并且这种联合治疗手段已经取得了一定的进展。鉴于PRV基因组庞大,可选择插入外源基因的位点较多,病毒宿主范围广且病毒易于体外增殖等诸多优点,本团队正在尝试以PRV为载体,构建表达免疫原性好的外源基因重组活载体疫苗用于防控常见的动物烈性传染病,该研究正在顺利开展中。
5 总结与展望嗜神经性疱疹病毒宿主范围广泛,使其造成全球性的危害。病毒感染后在神经元胞体中潜伏和再激活可以造成宿主的终身感染。目前,还没有有效手段来预防病毒的原发性感染以及潜伏感染和复发性感染。在对嗜神经性疱疹病毒感染机制研究的同时,也发现嗜神经性疱疹病毒的一些特性使其十分适合作为病毒工具应用于神经科学研究,并相较于其他嗜神经性病毒具有特定的优势。
嗜神经性疱疹病毒对神经科学的研究来说是一种重要的工具,重组病毒在神经环路的示踪以及构建递送基因和药物用于疾病的预防和治疗的病毒载体。虽然嗜神经性疱疹病毒在对神经系统的解析和神经性疾病的治疗上已经取得突出进展,但依然存在缺陷。病毒的毒性会引发一系列疾病,目前对病毒的大部分研究仍是在小鼠模型上进行,还没有在人体上开展相关试验。虽然目前的抗病毒疗法降低了急性感染的严重程度和病毒重新激活的频率,但这并不能减少或消除潜伏病毒的再激活。对重组嗜神经性疱疹病毒的改造还要从如何消除病毒的潜伏和再激活方面出发。已有实验通过使用CRISPR/Cas9与巨核酸酶的基因编辑技术可以直接对潜伏的病毒基因组进行破坏或消除,在不损伤神经元的同时可以使病毒不再激活以及预防其引发的疾病[70]。在对小鼠感觉神经元中潜伏的HSV基因组相关基因进行编辑更验证了这一想法的可行性。这对体内抗病毒基因治疗方案的优化有着重要意义,也证明基因编辑是消除嗜神经性疱疹病毒感染的有效方法。
病毒作为携带基因和药物的载体是一种有效且潜力巨大的治疗神经性疾病的工具,同时以嗜神经性疱疹病毒为载体构建的用于预防传染病的重组活载体疫苗也造福了不计其数的人和动物。由此,笔者认为对构建预防神经性疾病的重组活载体疫苗的研究可能是消除或降低神经性疾病患病率的重点方向。
在未来几十年内,嗜神经性疱疹病毒感染造成的危害会随着基因工程学和分子生物学技术的发展被逐渐解决甚至完全消失,病毒会被改造成用于预防神经性疾病以及对神经系统准确且无损伤的、安全的、高效的疫苗和基因治疗载体。随着研究的深入,将会有越来越多的嗜神经性疱疹病毒能够根据其自身的一些关键特性而应用于神经科学研究领域,造福人类。
| [1] |
CONNOLLY SA, JARDETZKY TS, LONGNECKER R. The structural basis of herpesvirus entry. Nature Reviews Microbiology, 2021, 19(2): 110-121. DOI:10.1038/s41579-020-00448-w
|
| [2] |
SINGH N, TSCHARKE DC. Herpes simplex virus latency is noisier the closer we look. Journal of Virology, 2020, 94(4): e01701-e01719.
|
| [3] |
高俊, 刘荻萩, 马月, 王晓钧. 疱疹病毒潜伏相关转录体的生物学特性. 中国预防兽医学报, 2017, 39(10): 855-860. GAO J, LIU DQ, MA Y, WANG XJ. Biological characteristics of herpes virus latent transcripts. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(10): 855-860 (in Chinese). |
| [4] |
刘占, 马宁宁, 郭子仪, 邓梦梦, 史志斌, 陈陆. 疱疹病毒治疗性疫苗研究进展. 中国人兽共患病学报, 2021, 37(2): 133-137. LIU Z, MA NN, GUO ZY, DENG MM, SHI ZB, CHEN L. Research progress in a therapeutic vaccine against herpes virus. Chinese Journal of Zoonoses, 2021, 37(2): 133-137 (in Chinese). |
| [5] |
RECHENCHOSKI DZ, FACCIN-GALHARDI LC, LINHARES REC, NOZAWA C. Herpesvirus: an underestimated virus. Folia Microbiologica, 2017, 62(2): 151-156. DOI:10.1007/s12223-016-0482-7
|
| [6] |
RATHBUN MM, SZPARA ML. A holistic perspective on Herpes simplex virus (HSV) ecology and evolution. Advances in Virus Research, 2021, 110: 27-57.
|
| [7] |
KRIEGESKORTE N, GOLAN T. Neural network models and deep learning. Current Biology, 2019, 29(7): R231-R236. DOI:10.1016/j.cub.2019.02.034
|
| [8] |
MARTÍN-DURÁN JM, HEJNOL A. A developmental perspective on the evolution of the nervous system. Developmental Biology, 2021, 475: 181-192. DOI:10.1016/j.ydbio.2019.10.003
|
| [9] |
GHOSH SK, NARAYAN RK. Anatomy of nervous system and emergence of neuroscience: a chronological journey across centuries. Morphologie, 2020, 104(347): 267-279. DOI:10.1016/j.morpho.2020.05.005
|
| [10] |
XU XM, HOLMES TC, LUO MH, BEIER KT, HORWITZ GD, ZHAO F, ZENG WB, HUI M, SEMLER BL, SANDRI-GOLDIN RM. Viral vectors for neural circuit mapping and recent advances in trans-synaptic anterograde tracers. Neuron, 2020, 107(6): 1029-1047. DOI:10.1016/j.neuron.2020.07.010
|
| [11] |
CHEN SH, HAAM J, WALKER M, SCAPPINI E, NAUGHTON J, MARTIN NP. Recombinant viral vectors as neuroscience tools. Current Protocols in Neuroscience, 2019, 87(1): e67. DOI:10.1002/cpns.67
|
| [12] |
LI JM, LIU TA, DONG Y, KONDOH K, LU ZH. Trans-synaptic neural circuit-tracing with neurotropic viruses. Neuroscience Bulletin, 2019, 35(5): 909-920. DOI:10.1007/s12264-019-00374-9
|
| [13] |
UGOLINI G. Advances in viral transneuronal tracing. Journal of Neuroscience Methods, 2010, 194(1): 2-20. DOI:10.1016/j.jneumeth.2009.12.001
|
| [14] |
ABDULLAHI AM, SARMAST ST, SINGH R. Molecular biology and epidemiology of neurotropic viruses. Cureus, 2020, 12(8): e9674.
|
| [15] |
李碧, 朱玲, 周远成, 郭万柱, 徐志文. 伪狂犬病毒神经传导研究. 病毒学报, 2014, 30(3): 333-337. LI B, ZHU L, ZHOU YC, GUO WZ, XU ZW. Studies on neuronal tracing with pseudorabies virus. Chinese Journal of Virology, 2014, 30(3): 333-337 (in Chinese). DOI:10.13242/j.cnki.bingduxuebao.002486 |
| [16] |
ZHANG GR, ZHAO H, ABDUL-MUNEER PM, CAO HY, LI X, GELLER AI. Neurons can be labeled with unique hues by helper virus-free HSV-1 vectors expressing Brainbow. Journal of Neuroscience Methods, 2015, 240: 77-88. DOI:10.1016/j.jneumeth.2014.11.009
|
| [17] |
DONG X, ZHOU J, QIN HB, XIN B, HUANG ZL, LI YY, XU XM, ZHAO F, ZHAO CJ, LIU JJ, LUO MH, ZENG WB. Anterograde viral tracer Herpes simplex virus 1 strain H129 transports primarily as capsids in cortical neuron axons. Journal of Virology, 2020, 94(8): e01957-19.
|
| [18] |
YANG H, XIONG F, QIN HB, YU QT, SUN JY, ZHAO HW, LI D, ZHOU YT, ZHANG FK, ZHU XW, WU T, JIANG M, XU XM, LU YM, SHEN HJ, ZENG WB, ZHAO F, LUO MH. A novel H129-based anterograde monosynaptic tracer exhibits features of strong labeling intensity, high tracing efficiency, and reduced retrograde labeling. Molecular Neurodegeneration, 2022, 17(1): 6. DOI:10.1186/s13024-021-00508-6
|
| [19] |
WOJACZYNSKI GJ, ENGEL EA, STEREN KE, ENQUIST LW, CARD JP. The neuroinvasive profiles of H129 (Herpes simplex virus type 1) recombinants with putative anterograde-only transneuronal spread properties. Brain Structure and Function, 2015, 220(3): 1395-1420. DOI:10.1007/s00429-014-0733-9
|
| [20] |
MCGOVERN AE, DRIESSEN AK, SIMMONS DG, POWELL J, DAVIS-POYNTER N, FARRELL MJ, MAZZONE SB. Distinct brainstem and forebrain circuits receiving tracheal sensory neuron inputs revealed using a novel conditional anterograde transsynaptic viral tracing system. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2015, 35(18): 7041-7055. DOI:10.1523/JNEUROSCI.5128-14.2015
|
| [21] |
LO L, ANDERSON DJ. A cre-dependent, anterograde transsynaptic viral tracer for mapping output pathways of genetically marked neurons. Neuron, 2011, 72(6): 938-950. DOI:10.1016/j.neuron.2011.12.002
|
| [22] |
YANG H, XIONG F, SONG YG, JIANG HF, QIN HB, ZHOU J, LU S, GRIECO SF, XU XM, ZENG WB, ZHAO F, LUO MH. HSV-1 H129-derived anterograde neural circuit tracers: improvements, production, and applications. Neuroscience Bulletin, 2021, 37(5): 701-719. DOI:10.1007/s12264-020-00614-3
|
| [23] |
SZPARA ML, GATHERER D, OCHOA A, GREENBAUM B, DOLAN A, BOWDEN RJ, ENQUIST LW, LEGENDRE M, DAVISON AJ. Evolution and diversity in human Herpes simplex virus genomes. Journal of Virology, 2014, 88(2): 1209-1227. DOI:10.1128/JVI.01987-13
|
| [24] |
ZINGG B, CHOU XL, ZHANG ZG, MESIK L, LIANG FX, TAO HW, ZHANG LI. AAV-mediated anterograde transsynaptic tagging: mapping corticocollicular input-defined neural pathways for defense behaviors. Neuron, 2017, 93(1): 33-47. DOI:10.1016/j.neuron.2016.11.045
|
| [25] |
VANDEWEERD JM, HONTOIR F, de KNOOP A, DE SWERT K, NICAISE C. Retrograde neuroanatomical tracing of phrenic motor neurons in mice. Journal of Visualized Experiments: JoVE, 2018(132): 56758.
|
| [26] |
WICKERSHAM IR, FINKE S, CONZELMANN KK, CALLAWAY EM. Retrograde neuronal tracing with a deletion-mutant rabies virus. Nature Methods, 2007, 4(1): 47-49. DOI:10.1038/nmeth999
|
| [27] |
JIN H, ZHANG YT, YANG Y, WEN LY, WANG JH, XU HY, LAI BQ, FENG B, CHE MT, QIU XC, LI ZL, WANG LJ, RUAN JW, JIANG B, ZENG X, DENG QW, LI G, DING Y, ZENG YS. Electroacupuncture facilitates the integration of neural stem cell-derived neural network with transected rat spinal cord. Stem Cell Reports, 2019, 12(2): 274-289. DOI:10.1016/j.stemcr.2018.12.015
|
| [28] |
KRAMER T, ENQUIST LW. Directional spread of alphaherpesviruses in the nervous system. Viruses, 2013, 5(2): 678-707. DOI:10.3390/v5020678
|
| [29] |
JIA F, LV P, MIAO H, SHI XW, MEI HJ, LI L, XU XQ, TAO SJ, XU FQ. Optimization of the fluorescent protein expression level based on pseudorabies virus bartha strain for neural circuit tracing. Frontiers in Neuroanatomy, 2019, 13: 63. DOI:10.3389/fnana.2019.00063
|
| [30] |
PICKARD GE, SMERASKI CA, TOMLINSON CC, BANFIELD BW, KAUFMAN J, WILCOX CL, ENQUIST LW, SOLLARS PJ. Intravitreal injection of the attenuated pseudorabies virus PRV Bartha results in infection of the hamster suprachiasmatic nucleus only by retrograde transsynaptic transport via autonomic circuits. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2002, 22(7): 2701-2710. DOI:10.1523/JNEUROSCI.22-07-02701.2002
|
| [31] |
KRISKY DM, WOLFE D, GOINS WF, MARCONI PC, RAMAKRISHNAN R, MATA M, ROUSE RJ, FINK DJ, GLORIOSO JC. Deletion of multiple immediate-early genes from Herpes simplex virus reduces cytotoxicity and permits long-term gene expression in neurons. Gene Therapy, 1998, 5(12): 1593-1603. DOI:10.1038/sj.gt.3300766
|
| [32] |
HE ZG, WANG Q, XIE RS, LI YS, HONG QX, XIANG HB. Neuroanatomical autonomic substrates of brainstem-gut circuitry identified using transsynaptic tract-tracing with pseudorabies virus recombinants. American Journal of Clinical and Experimental Immunology, 2018, 7(2): 16-24.
|
| [33] |
HUMPHREYS IR, SEBASTIAN S. Novel viral vectors in infectious diseases. Immunology, 2018, 153(1): 1-9. DOI:10.1111/imm.12829
|
| [34] |
GOINS WF, HALL B, COHEN JB, GLORIOSO JC. Retargeting of Herpes simplex virus (HSV) vectors. Current Opinion in Virology, 2016, 21: 93-101. DOI:10.1016/j.coviro.2016.08.007
|
| [35] |
FRAMPTON AR, GOINS WF, NAKANO K, BURTON EA, GLORIOSO JC. HSV trafficking and development of gene therapy vectors with applications in the nervous system. Gene Therapy, 2005, 12(11): 891-901. DOI:10.1038/sj.gt.3302545
|
| [36] |
GOINS WF, HUANG SH, HALL B, MARZULLI M, COHEN JB, GLORIOSO JC. Engineering HSV-1 vectors for gene therapy. Methods in Molecular Biology: Clifton, N J, 2020, 2060, 73-90.
|
| [37] |
DANEMAN R, PRAT A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology, 2015, 7(1): a020412. DOI:10.1101/cshperspect.a020412
|
| [38] |
ZHENG M, TAO W, ZOU Y, FAROKHZAD OC, SHI BY. Nanotechnology-based strategies for siRNA brain delivery for disease therapy. Trends in Biotechnology, 2018, 36(5): 562-575. DOI:10.1016/j.tibtech.2018.01.006
|
| [39] |
PATEL MM, PATEL BM. Crossing the blood–brain barrier: recent advances in drug delivery to the brain. CNS Drugs, 2017, 31(2): 109-133. DOI:10.1007/s40263-016-0405-9
|
| [40] |
SUN LQ, TANG YJ, YAN KJ, YU JS, ZOU YY, XU WZ, XIAO K, ZHANG ZH, LI WM, WU BL, HU Z, CHEN KN, FU ZF, DAI JX, CAO G. Differences in neurotropism and neurotoxicity among retrograde viral tracers. Molecular Neurodegeneration, 2019, 14(1): 8. DOI:10.1186/s13024-019-0308-6
|
| [41] |
QI HS, WU HX, ABID M, QIU HJ, SUN Y. Establishment of a fosmid library for pseudorabies virus SC strain and application in viral neuronal tracing. Frontiers in Microbiology, 2020, 11: 1168. DOI:10.3389/fmicb.2020.01168
|
| [42] |
ALLEN TM, CULLIS PR. Drug delivery systems: entering the mainstream. Science, 2004, 303(5665): 1818-1822. DOI:10.1126/science.1095833
|
| [43] |
SCHELTENS P, BLENNOW K, BRETELER MMB, de STROOPER B, FRISONI GB, SALLOWAY S, van der FLIER WM. Alzheimer's disease. The Lancet, 2016, 388(10043): 505-517. DOI:10.1016/S0140-6736(15)01124-1
|
| [44] |
MCKHANN GM, KNOPMAN DS, CHERTKOW H, HYMAN BT, JACK CR Jr, KAWAS CH, KLUNK WE, KOROSHETZ WJ, MANLY JJ, MAYEUX R, MOHS RC, MORRIS JC, ROSSOR MN, SCHELTENS P, CARRILLO MC, THIES B, WEINTRAUB S, PHELPS CH. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer's & Dementia, 2011, 7(3): 263-269.
|
| [45] |
LEE JH, YANG DS, GOULBOURNE CN, IM E, STAVRIDES P, PENSALFINI A, CHAN H, BOUCHET-MARQUIS C, BLEIWAS C, BERG MJ, HUO CF, PEDDY J, PAWLIK M, LEVY E, RAO ML, STAUFENBIEL M, NIXON RA. Faulty autolysosome acidification in Alzheimer's disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques. Nature Neuroscience, 2022, 25(6): 688-701. DOI:10.1038/s41593-022-01084-8
|
| [46] |
REISS AB, ARAIN HA, STECKER MM, SIEGART NM, KASSELMAN LJ. Amyloid toxicity in Alzheimerʼs disease. Reviews in the Neurosciences, 2018, 29(6): 613-627. DOI:10.1515/revneuro-2017-0063
|
| [47] |
张桦, 史巧娣. HSV-1扩增子载体对神经系统疾病治疗作用的研究进展. 实用医药杂志, 2012, 29(11): 1040-1042. ZHANG H, SHI QD. Research progress of HSV-1 amplicon vector in the treatment of nervous system diseases. Practical Journal of Medicine & Pharmacy, 2012, 29(11): 1040-1042 (in Chinese). DOI:10.14172/j.cnki.issn1671-4008.2012.11.057 |
| [48] |
JANKOVIC J, TAN EK. Parkinson's disease: etiopathogenesis and treatment. Journal of Neurology, Neurosurgery & Psychiatry, 2020, 91(8): 795-808.
|
| [49] |
MASATO A, PLOTEGHER N, BOASSA D, BUBACCO L. Impaired dopamine metabolism in Parkinson's disease pathogenesis. Molecular Neurodegeneration, 2019, 14(1): 35. DOI:10.1186/s13024-019-0332-6
|
| [50] |
LATCHMAN DS. Herpes simplex virus vectors for gene therapy in Parkinsonʼs disease and other diseases of the nervous system. Journal of the Royal Society of Medicine, 1999, 92(11): 566-70. DOI:10.1177/014107689909201107
|
| [51] |
SUN M, KONG LX, WANG XD, LU XG, GAO QS, GELLER AI. Comparison of the capability of GDNF, BDNF, or both, to protect nigrostriatal neurons in a rat model of Parkinson's disease. Brain Research, 2005, 1052(2): 119-129.
|
| [52] |
SO KH, CHOI JH, ISLAM J, KC E, MOON HC, WON SY, KIM HK, KIM S, HYUN SH, PARK YS. An optimization of AAV-82Q-delivered rat model of Huntington's disease. Journal of Korean Neurosurgical Society, 2020, 63(5): 579-589. DOI:10.3340/jkns.2019.0182
|
| [53] |
JERUSALINSKY D, BAEZ MV, EPSTEIN AL. Herpes simplex virus type 1-based amplicon vectors for fundamental research in neurosciences and gene therapy of neurological diseases. Journal of Physiology-Paris, 2012, 106(1/2): 2-11.
|
| [54] |
BERNSTOCK JD, HOFFMAN SE, CHEN JA, GUPTA S, KAPPEL AD, SMITH TR, CHIOCCA EA. The Current landscape of oncolytic Herpes simplex viruses as novel therapies for brain malignancies. Viruses, 2021, 13(6): 1158. DOI:10.3390/v13061158
|
| [55] |
MONDAL M, GUO JG, HE P, ZHOU DM. Recent advances of oncolytic virus in cancer therapy. Human Vaccines & Immunotherapeutics, 2020, 16(10): 2389-2402.
|
| [56] |
FOREMAN PM, FRIEDMAN GK, CASSADY KA, MARKERT JM. Oncolytic Virotherapy for the Treatment of Malignant Glioma. Neurotherapeutics, 2017, 14(2): 333-344. DOI:10.1007/s13311-017-0516-0
|
| [57] |
RAJA J, LUDWIG JM, GETTINGER SN, SCHALPER KA, KIM HS. Oncolytic virus immunotherapy: future prospects for oncology. Journal for Immunotherapy of Cancer, 2018, 6(1): 140. DOI:10.1186/s40425-018-0458-z
|
| [58] |
ODDO S, CACCAMO A, SHEPHERD JD, MURPHY MP, GOLDE TE, KAYED R, METHERATE R, MATTSON MP, AKBARI Y, LAFERLA FM. Triple-transgenic model of Alzheimerʼs disease with plaques and tangles. Neuron, 2003, 39(3): 409-421. DOI:10.1016/S0896-6273(03)00434-3
|
| [59] |
GERSHON AA, BREUER J, COHEN JI, COHRS RJ, GERSHON MD, GILDEN D, GROSE C, HAMBLETON S, KENNEDY PGE, OXMAN MN, SEWARD JF, YAMANISHI K. Varicella zoster virus infection. Nature Reviews Disease Primers, 2015, 1: 15016. DOI:10.1038/nrdp.2015.16
|
| [60] |
MA WQ, HE HB, WANG HM. Oncolytic Herpes simplex virus and immunotherapy. BMC Immunology, 2018, 19(1): 40. DOI:10.1186/s12865-018-0281-9
|
| [61] |
ISHINO R, KAWASE Y, KITAWAKI T, SUGIMOTO N, OKU M, UCHIDA S, IMATAKI O, MATSUOKA A, TAOKA T, KAWAKAMI K, van KUPPEVELT TH, TODO T, TAKAORI-KONDO A, KADOWAKI N. Oncolytic virus therapy with HSV-1 for hematological malignancies. Molecular Therapy, 2021, 29(2): 762-774. DOI:10.1016/j.ymthe.2020.09.041
|
| [62] |
BERNSTOCK JD, VICARIO N, LI R, NAN L, TOTSCH SK, SCHLAPPI C, GESSLER F, HAN XS, PARENTI R, BEIERLE EA, WHITLEY RJ, ABAN I, GILLESPIE GY, MARKERT JM, FRIEDMAN GK. Safety and efficacy of oncolytic HSV-1 G207 inoculated into the cerebellum of mice. Cancer Gene Therapy, 2020, 27(3): 246-255.
|
| [63] |
FRIEDMAN GK, JOHNSTON JM, BAG AK, BERNSTOCK JD, LI R, ABAN I, KACHURAK K, NAN L, KANG KD, TOTSCH S, SCHLAPPI C, MARTIN AM, PASTAKIA D, MCNALL-KNAPP R, SAIT SF, KHAKOO Y, KARAJANNIS MA, WOODLING K, PALMER JD, OSORIO DS, et al. Oncolytic HSV-1 G207 immunovirotherapy for pediatric high-grade gliomas. The New England Journal of Medicine, 2021, 384(17): 1613-1622. DOI:10.1056/NEJMoa2024947
|
| [64] |
ZENG JY, LI XX, SANDER M, ZHANG HP, YAN GM, LIN Y. Oncolytic viro-immunotherapy: an emerging option in the treatment of gliomas. Frontiers in Immunology, 2021, 12: 721830. DOI:10.3389/fimmu.2021.721830
|
| [65] |
FUKUHARA H, INO Y, TODO T. Oncolytic virus therapy: a new era of cancer treatment at dawn. Cancer Science, 2016, 107(10): 1373-1379. DOI:10.1111/cas.13027
|
| [66] |
MARKERT JM, CODY JJ, PARKER JN, COLEMAN JM, PRICE KH, KERN ER, QUENELLE DC, LAKEMAN AD, SCHOEB TR, PALMER CA, CARTNER SC, GILLESPIE GY, WHITLEY RJ. Preclinical evaluation of a genetically engineered Herpes simplex virus expressing interleukin-12. Journal of Virology, 2012, 86(9): 5304-5313. DOI:10.1128/JVI.06998-11
|
| [67] |
CARDOSO TC, ROSA ACG, FERREIRA HL, OKAMURA LH, OLIVEIRA BRSM, VIEIRA FV, SILVA-FRADE C, GAMEIRO R, FLORES EF. Bovine herpesviruses induce different cell death forms in neuronal and glial-derived tumor cell cultures. Journal of NeuroVirology, 2016, 22(6): 725-735. DOI:10.1007/s13365-016-0444-5
|
| [68] |
MONTAGNARO S, DAMIANO S, CIARCIA R, PUZIO MV, FERRARA G, IOVANE V, FORTE IM, GIORDANO A, PAGNINI U. Caprine herpesvirus 1 (CpHV-1) as a potential candidate for oncolytic virotherapy. Cancer Biology & Therapy, 2019, 20(1): 42-51.
|
| [69] |
KOCH MS, LAWLER SE, CHIOCCA EA. HSV-1 oncolytic viruses from bench to bedside: an overview of current clinical trials. Cancers, 2020, 12(12): 3514. DOI:10.3390/cancers12123514
|
| [70] |
AUBERT M, STRONGIN DE, ROYCHOUDHURY P, LOPRIENO MA, HAICK AK, KLOUSER LM, STENSLAND L, HUANG ML, MAKHSOUS N, TAIT A, de SILVA FEELIXGE HS, GALETTO R, DUCHATEAU P, GRENINGER AL, STONE D, JEROME KR. Gene editing and elimination of latent Herpes simplex virus in vivo. Nature Communications, 2020, 11: 4148. DOI:10.1038/s41467-020-17936-5
|