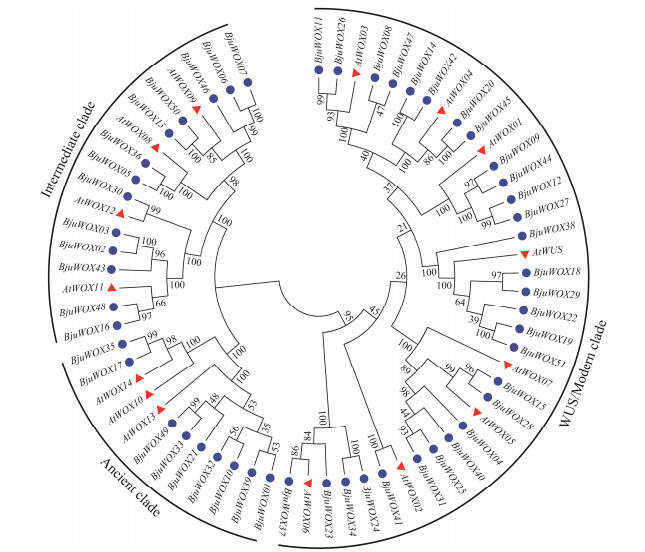
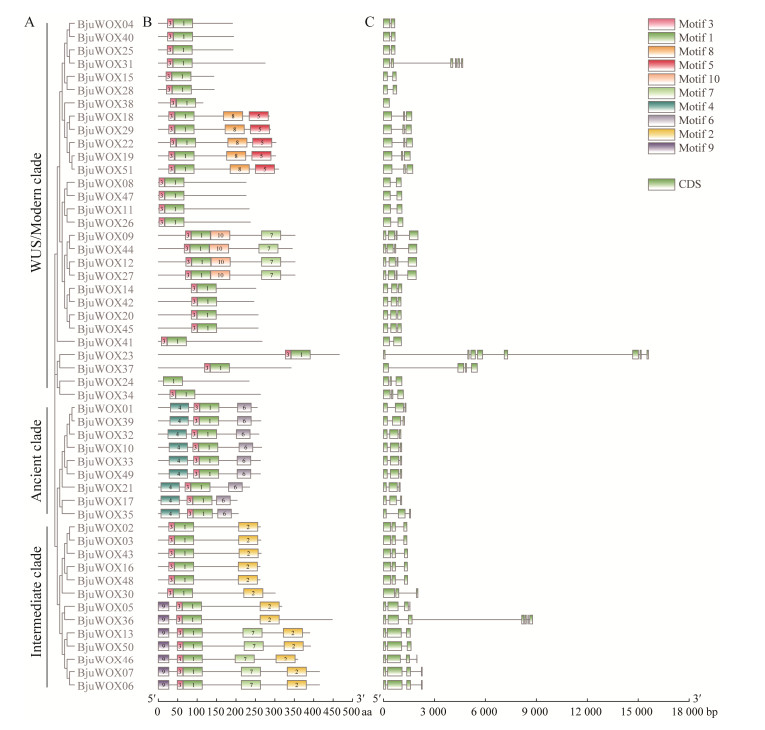
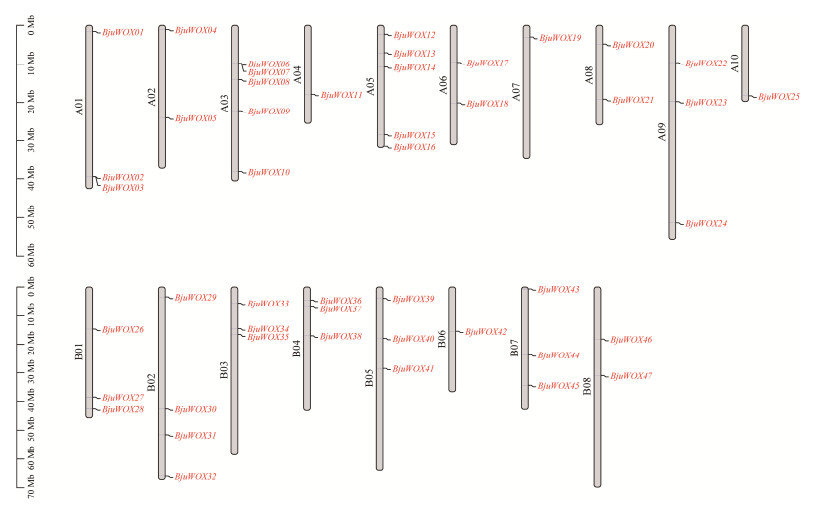
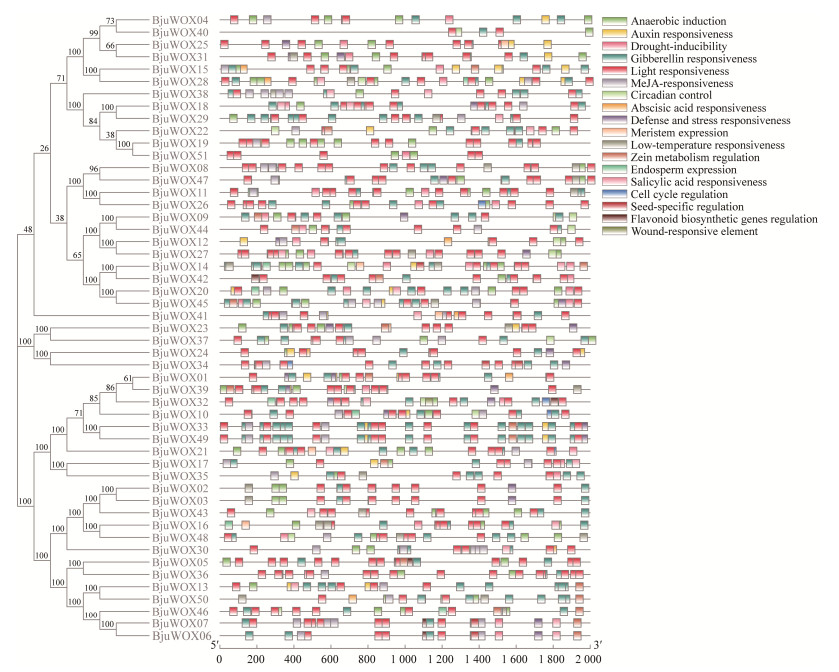
| [1] |
van der GRAAFF E, LAUX T, RENSING SA. The WUS homeobox-containing (WOX) protein family. Genome Biology, 2009, 10(12): 248. DOI:10.1186/gb-2009-10-12-248
|
|
| [2] |
LAUX T, MAYER KF, BERGER J, JÜRGENS G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development: Cambridge, England, 1996, 122(1): 87-96. DOI:10.1242/dev.122.1.87
|
|
| [3] |
KAMIYA N, NAGASAKI H, MORIKAMI A, SATO Y, MATSUOKA M. Isolation and characterization of a rice WUSCHEL-type homeobox gene that is specifically expressed in the central cells of a quiescent center in the root apical meristem. The Plant Journal: for Cell and Molecular Biology, 2003, 35(4): 429-441. DOI:10.1046/j.1365-313X.2003.01816.x
|
|
| [4] |
MUKHERJEE K, BROCCHIERI L, BÜRGLIN TR. A comprehensive classification and evolutionary analysis of plant homeobox genes. Molecular Biology and Evolution, 2009, 26(12): 2775-2794. DOI:10.1093/molbev/msp201
|
|
| [5] |
HAECKER A, GROSS-HARDT R, GEIGES B, SARKAR A, BREUNINGER H, HERRMANN M, LAUX T. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana. Development: Cambridge, England, 2004, 131(3): 657-668. DOI:10.1242/dev.00963
|
|
| [6] |
LIAN GB, DING ZW, WANG Q, ZHANG DB, XU J. Origins and evolution of WUSCHEL-related homeobox protein family in plant kingdom. The Scientific World Journal, 2014, 2014, 534140.
|
|
| [7] |
IKEDA M, MITSUDA N, OHME-TAKAGI M. Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patterning. The Plant Cell, 2009, 21(11): 3493-3505. DOI:10.1105/tpc.109.069997
|
|
| [8] |
王俞程, 何瑞萍, 彭献军, 沈世华. WOX转录因子家族研究进展. 草业科学, 2015, 32(5): 760-769. WANG YC, HE RP, PENG XJ, SHEN SH. The research progress of WOX transcription factor family. Pratacultural Science, 2015, 32(5): 760-769 (in Chinese).
|
|
| [9] |
李晓旭, 刘成, 李伟, 张增林, 高晓明, 周慧, 郭永峰. 番茄WOX转录因子家族的鉴定及其进化、表达分析. 遗传, 2016, 38(5): 444-460. LI XX, LIU C, LI W, ZHANG ZL, GAO XM, ZHOU H, GUO YF. Genome-wide identification, phylogenetic analysis and expression profiling of the WOX family genes in Solanum lycopersicum. Hereditas, 2016, 38(5): 444-460 (in Chinese). DOI:10.16288/j.yczz.15-499
|
|
| [10] |
ZHANG X, ZONG J, LIU JH, YIN JY, ZHANG DB. Genome-wide analysis of WOX gene family in rice, sorghum, maize, Arabidopsis and poplar. Journal of Integrative Plant Biology, 2010, 52(11): 1016-1026. DOI:10.1111/j.1744-7909.2010.00982.x
|
|
| [11] |
武强强, 张凤洁, 董浩欢, 卢平, 樊婕, 李雪垠, 王爱萍, 董琦. 小麦WOX转录因子基因的全基因组鉴定与分析. 激光生物学报, 2021, 30(1): 67-74. WU QQ, ZHANG FJ, DONG HH, LU P, FAN J, LI XY, WANG AP, DONG Q. Genome-wide identification and analyses of WOX transcription factor genes in wheat. Acta Laser Biology Sinica, 2021, 30(1): 67-74 (in Chinese). DOI:10.3969/j.issn.1007-7146.2021.01.009
|
|
| [12] |
RATHOUR M, SHARMA A, KAUR A, UPADHYAY SK. Genome-wide characterization and expression and co-expression analysis suggested diverse functions of WOX genes in bread wheat. Heliyon, 2020, 6(12): e05762. DOI:10.1016/j.heliyon.2020.e05762
|
|
| [13] |
WANG MM, LIU MM, RAN F, GUO PC, KE YZ, WU YW, WEN J, LI PF, LI JN, DU H. Global analysis of WOX transcription factor gene family in Brassica napus reveals their stress- and hormone-responsive patterns. International Journal of Molecular Sciences, 2018, 19(11): 3470. DOI:10.3390/ijms19113470
|
|
| [14] |
HE P, ZHANG YZ, LIU H, YUAN Y, WANG C, YU JN, XIAO GH. Comprehensive analysis of WOX genes uncovers that WOX13 is involved in phytohormone-mediated fiber development in cotton. BMC Plant Biology, 2019, 19(1): 312. DOI:10.1186/s12870-019-1892-x
|
|
| [15] |
HAO QN, ZHANG L, YANG YY, SHAN ZH, ZHOU XN. Genome-wide analysis of the WOX gene family and function exploration of GmWOX18 in soybean. Plants: Basel, Switzerland, 2019, 8(7): 215.
|
|
| [16] |
AKBULUT SE, OKAY A, AKSOY T, ARAS ES, BÜYÜK İ. The genome-wide characterization of WOX gene family in Phaseolus vulgaris L. during salt stress. Physiology and Molecular Biology of Plants, 2022, 28(6): 1297-1309. DOI:10.1007/s12298-022-01208-1
|
|
| [17] |
HAN N, TANG R, CHEN XQ, XU ZX, REN ZH, WANG LN. Genome-wide identification and characterization of WOX genes in Cucumis sativus. Genome, 2021, 64(8): 761-776. DOI:10.1139/gen-2020-0029
|
|
| [18] |
董新玉, 邓浪, 张亚春, 陈国发, 李树锋. 大蒜全基因组WOX基因家族鉴定及密码子使用偏性分析. 西南农业学报, 2022, 35(2): 285-293. DONG XY, DENG L, ZHANG YC, CHEN GF, LI SF. Identification of WOX genes family and analysis of codon usage bias in garlic genome. Southwest China Journal of Agricultural Sciences, 2022, 35(2): 285-293 (in Chinese).
|
|
| [19] |
SARKAR AK, LUIJTEN M, MIYASHIMA S, LENHARD M, HASHIMOTO T, NAKAJIMA K, SCHERES B, HEIDSTRA R, LAUX T. Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers. Nature, 2007, 446(7137): 811-814. DOI:10.1038/nature05703
|
|
| [20] |
NAIR R, ROST B. LOCnet and LOCtarget: sub-cellular localization for structural genomics targets. Nucleic Acids Research, 2004, 32(suppl_2): W517-W521.
|
|
| [21] |
BREUNINGER H, RIKIRSCH E, HERMANN M, UEDA M, LAUX T. Differential expression of WOX genes mediates apical-basal axis formation in the Arabidopsis embryo. Developmental Cell, 2008, 14(6): 867-876. DOI:10.1016/j.devcel.2008.03.008
|
|
| [22] |
SHIMIZU R, JIJB, KELSEY E, OHTSU K, SCHNABLE PS, SCANLON MJ. Tissue specificity and evolution of meristematic WOX3 function. Plant Physiology, 2009, 149(2): 841-850. DOI:10.1104/pp.108.130765
|
|
| [23] |
JIJB, STRABLE J, SHIMIZU R, KOENIG D, SINHA N, SCANLON MJ. WOX4 promotes procambial development. Plant Physiology, 2010, 152(3): 1346-1356. DOI:10.1104/pp.109.149641
|
|
| [24] |
PARK SO, ZHENG ZG, OPPENHEIMER DG, HAUSER BA. The PRETTY FEW SEEDS2 gene encodes an Arabidopsis homeodomain protein that regulates ovule development. Development: Cambridge, England, 2005, 132(4): 841-849. DOI:10.1242/dev.01654
|
|
| [25] |
ZHU JH, SHI HZ, LEE BH, DAMSZ B, CHENG SE, STIRM V, ZHU JK, HASEGAWA PM, BRESSAN RA. An Arabidopsis homeodomain transcription factor gene, HOS9, mediates cold tolerance through a CBF-independent pathway. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(26): 9873-9878. DOI:10.1073/pnas.0403166101
|
|
| [26] |
DEVEAUX Y, TOFFANO-NIOCHE C, CLAISSE G, THAREAU V, MORIN H, LAUFS P, MOREAU H, KREIS M, LECHARNY A. Genes of the most conserved WOX clade in plants affect root and flower development in Arabidopsis. BMC Evolutionary Biology, 2008, 8: 291. DOI:10.1186/1471-2148-8-291
|
|
| [27] |
CHENG SF, HUANG YL, ZHU N, ZHAO Y. The rice WUSCHEL-related homeobox genes are involved in reproductive organ development, hormone signaling and abiotic stress response. Gene, 2014, 549(2): 266-274. DOI:10.1016/j.gene.2014.08.003
|
|
| [28] |
YANG ZE, GONG Q, QIN WQ, YANG ZR, CHENG Y, LU LL, GE XY, ZHANG CJ, WU ZX, LI FG. Genome-wide analysis of WOX genes in upland cotton and their expression pattern under different stresses. BMC Plant Biology, 2017, 17(1): 113. DOI:10.1186/s12870-017-1065-8
|
|
| [29] |
BHARDWAJ AR, JOSHI G, KUKREJA B, MALIK V, ARORA P, PANDEY R, SHUKLA RN, BANKAR KG, KATIYAR-AGARWAL S, GOEL S, JAGANNATH A, KUMAR A, AGARWAL M. Global insights into high temperature and drought stress regulated genes by RNA-Seq in economically important oilseed crop Brassica juncea. BMC Plant Biology, 2015, 15: 9. DOI:10.1186/s12870-014-0405-1
|
|
| [30] |
LI MD, WANG RH, LIU ZY, WU XM, WANG JB. Genome-wide identification and analysis of the WUSCHEL-related homeobox ( WOX) gene family in allotetraploid Brassica napus reveals changes in WOX genes during polyploidization. BMC Genomics, 2019, 20(1): 317. DOI:10.1186/s12864-019-5684-3
|
|
| [31] |
ETCHELLS JP, PROVOST CM, MISHRA L, TURNER SR. WOX4 and WOX14 act downstream of the PXY receptor kinase to regulate plant vascular proliferation independently of any role in vascular organisation. Development: Cambridge, England, 2013, 140(10): 2224-2234. DOI:10.1242/dev.091314
|
|
| [32] |
ZHAO Y, HU YF, DAI MQ, HUANG LM, ZHOU DX. The WUSCHEL-related homeobox gene WOX11 is required to activate shoot-borne crown root development in rice. The Plant Cell, 2009, 21(3): 736-748. DOI:10.1105/tpc.108.061655
|
|
| [33] |
ROMERA-BRANCHAT M, RIPOLL JJ, YANOFSKY MF, PELAZ S. The WOX13 homeobox gene promotes replum formation in the Arabidopsis thaliana fruit. The Plant Journal: for Cell and Molecular Biology, 2013, 73(1): 37-49. DOI:10.1111/tpj.12010
|
|
 2023, Vol. 39
2023, Vol. 39